LN在不同繁殖期蓝狐睾丸组织分布比较
2019-09-18梁晶晶袁莉刚李琪
梁晶晶,袁莉刚,李琪
(甘肃农业大学动物医学院,甘肃 兰州 730070)
睾丸细胞外基质(extracellular matrix,ECM)由将不同细胞紧密联系在一起的多糖和蛋白质网构成,包括生精小管基膜和管周细胞间基质,多种分子通过细胞骨架传递细胞间信息从而控制细胞分化、粘附、增殖及基因表达[1].LN是基膜的主要成分之一,由位于基膜的上皮细胞和内皮细胞合成[2];且LN在肿瘤转移及信息传递等发挥重要功能.LN为粘连糖蛋白家族的细胞粘附分子,在生精小管大量表达,参与精子发生过程中的紧密连接重构作用和暂时性连接的形成[3].免疫组化显示,LN在黑背豺基底膜显示强烈的免疫染色,表明其可能与间质细胞、小叶周肌样细胞和血管平滑肌细胞的形成有关[4];LN在正常人睾丸的间质和生精小管基底膜亦有表达[5].LN在双峰驼生精小管基膜下毛细血管较强阳性表达,在支持细胞、间质细胞及管周肌样细胞均有阳性表达[6].研究表明,LN在老龄牦牛睾丸Sertoli细胞和肌样细胞表达与青年牦牛相似,有助于老龄牦牛精子生成[7].因此,LN作为睾丸ECM的重要成分,在生精过程及间质细胞发育等多方面发挥功能.
蓝狐(Alopexlagopus),犬科北极狐属,典型的季节性繁殖经济动物,主要分布于北冰洋沿岸各国,具有很高的经济价值和研究价值,其在10月龄时进入性成熟,保持高繁殖能力7 a.季节变化引起动物睾丸形态和精子发生改变,长日照可促进生精细胞的产生,北极狐群的交配季节取决于气候条件,通常从二月中旬至四月下旬,一年发情一次[8].Madekurozwa等[4]应用免疫组织化学研究表明,黑背豺睾丸组织中LN和细胞骨架蛋白随繁殖季节变化明显.袁莉刚等[18]发现LN合成与不同繁殖季节牦牛睾丸间质细胞分泌功能变化相关;本研究通过H.E染色、免疫组织化学SP(streptavidin-perosidase)法及免疫荧光法比较不同繁殖期蓝狐睾丸LN定位及分布特征,揭示睾丸LN与生精细胞发育微环境、季节性繁殖之间的相互关系,旨在为蓝狐的生殖研究提供参考,进一步认识层连粘蛋白在调节细胞粘着、转移、生长及运动方面的功能及其生理意义.
1 材料与方法
1.1 试验材料
2017年3月中旬于张掖市蓝狐养殖场经睾丸摘除手术采集发情期蓝狐睾丸3对,又于当年11月用此法采集休情期蓝狐睾丸3对.
1.2 试验方法
1.2.1 主要药品试剂 H.E染液;LN兔抗羊多克隆抗体由北京博奥森生物制品有限公司提供;免疫组化试剂盒(sp-0023)由美国ZYMED公司生产,北京博奥森生物制品有限公司提供;DAB显色试剂盒(ZLI-9018)和APES防脱片(ZLI-9502)由北京中杉金桥生物技术有限公司提供.
1.2.2 样品固定与切片制备 新鲜组织用10%福尔马林固定液固定,切成0.1 cm×0.1 cm×0.1 cm小块,流水冲洗48 h后经不同梯度酒精脱水,二甲苯透明,组织浸蜡后常规石蜡切片包埋,LKB8800型超薄切片机切片(4 μm)制备切片,H.E常规染色,中性树胶固封.
1.2.3 免疫组织化学法 石蜡切片常规脱蜡,酒精梯度分化;30 g/L H2O2水溶液封闭过氧化物酶10 min,正常山羊血清白蛋白孵育15 min后;每张切片滴加50 μL兔多克隆抗鼠LN-IgG (稀释度1∶400),37 ℃孵育4 h,PBS振洗后每张切片滴加50 μL生物素标记山羊抗兔IgG工作液,后加50 μL辣根酶标记链霉卵白素工作液,37 ℃孵育滴加新鲜配制DAB显色液,常规脱水透明、封片.
1.3 数据统计
切片在NIKON ECLIPSE 80i显微摄像系统进行照相,免疫组织化学染色随机选取5张切片,每张切片随机选取6张不重复视野(400×)采用半定量的形式对染色结果的分布密度进行描述-:无阳性表达;+/-:偶有阳性表达;+:阳性表达;++:中等强度阳性表达;+++:强阳性表达;++++:高密度强阳性.
2 结果与分析
2.1 不同繁殖季节蓝狐睾丸组织结构特点
光镜下由H.E染色可见,繁殖期蓝狐睾丸生精上皮为6~8层细胞构成,腔内游离面可见大量成熟精子,生精小管外周偶见小血管(图1-A).繁殖间期生精小管由3~5层生精细胞构成,管腔内无精子,生精小管固外周有梭形管周肌样细胞围绕(图1-B).统计结果表明(图2),繁殖期蓝狐生精小管支持细胞数量平均为(26.5±4.2)个,生精小管平均直径为( 62.857±5.95)μm,间质细胞数目为(54±2.1)个.繁殖间期生精小管内支持细胞平均数为(11.9±2.2)个,生精小管平均直径为(84.820±2.81)μm;间质细胞数目为(36±1.1)个.二者相比较,繁殖期蓝狐生精小管直径较繁殖间期显著增大(P<0.05),而繁殖期支持细胞数量及间质细胞数量亦明显多于繁殖间期,差异极显著.
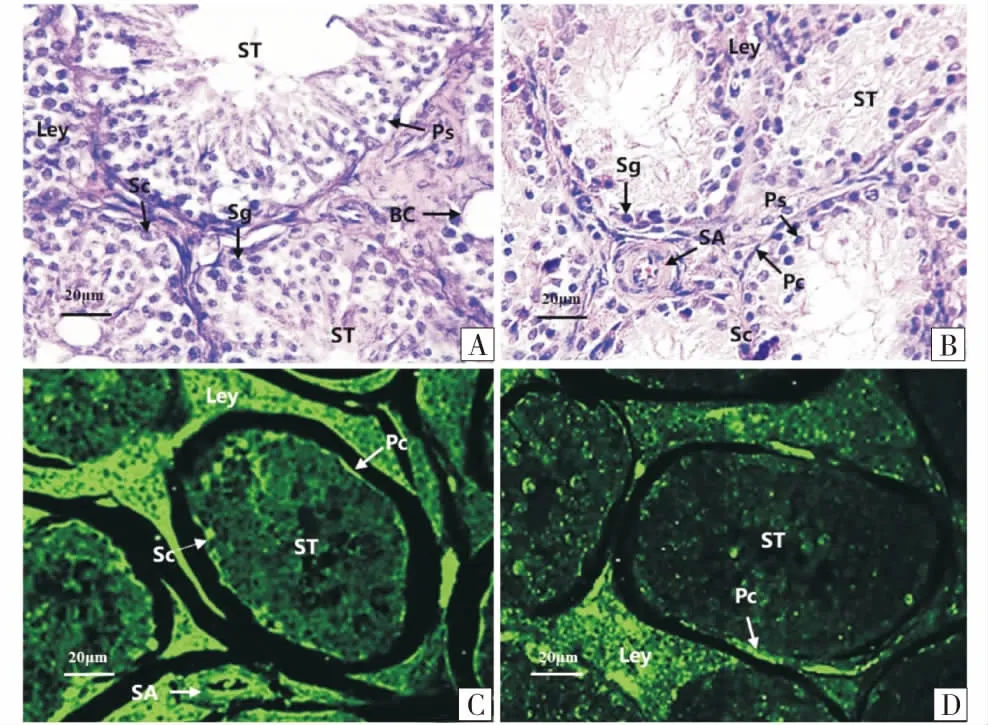
A、C:繁殖期蓝狐睾丸组织;A:H.E染色,标尺示20 μm;C:LN免疫荧光染色,标尺示20 μm;B、D:繁殖间期蓝狐睾丸组织;B:H.E染色,标尺示20 μm;D:LN免疫荧光染色,标尺示20 μm;Pc:管周肌样细胞;Ps:初级精母细胞;SA:小动脉;Sc:Sertoil细胞;Sg:精原细胞;ST:生精小管;Ley:睾丸间质细胞;BC:毛细血管.A、C:The structure of Alopex lagopus testicle in breeding season;A:The hematoxylin-eosin staining,bar=20 μm;C:The LN immunofluorescent staining,bar=20 μm;B、D:The structure of Alopex lagopus testicle in non-breeding season;B:The hematoxylin-eosin staining,bar=20 μm;D:The LN immunofluorescent staining,bar=20 μm;Pc:Peritublar Myoid cells;Ps:Primary spermatcyte;SA:Small artery;SC:Sertoli's cells;Sg:Spermatophore;ST:Spermatogenic tubule;Ley:Leydig cells;BC:Blood capillary.图1 不同繁殖季节蓝狐睾丸H.E及免疫荧光染色Figure 1 The hematoxylin-eosin staining and immunofluorescence staining of Alopex lagopus testicles in different breeding seasons
免疫荧光结果表明(图1-C、1-D,表1),LN在繁殖期蓝狐睾丸间质细胞、生精小管基膜、管周肌样细胞呈强阳性表达,支持细胞弱阳性表达(图1-C),繁殖间期LN仅在管周肌样细胞及小血管壁呈阳性表达,间质细胞表达减弱(图1-D).
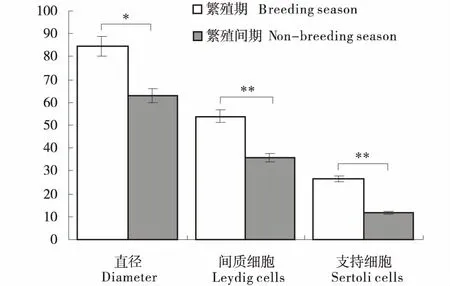
*同一数据间差异显著(P<0.05);**同一数据间差异极显著(P<0.01).* means significant difference between groups(P<0.05);** means extreme significant difference between groups(P<0.01).图2 不同繁殖季节蓝狐睾丸生精小管直径及间质细胞和生精小管内支持细胞平均个数统计Figure 2 Statistical map of the average number of leydig cells and sertoli cells in the seminiferous tubules of Alopex lagopus and the diameter of spermatogenic tubules in the Alopex lagopus testicles in different breeding seasons
2.2 LN在不同繁殖季节蓝狐睾丸组织分布特点
免疫组化显示,LN在繁殖期蓝狐睾丸生精小管基膜,支持细胞及各级生精细胞阳性表达明显,间质细胞及小血管为强阳性表达(图3-A,3-B),繁殖期阴性对照无表达(图3-C).繁殖间期LN在生精上皮基本无表达,肌样细胞阳性表达明显,小血管管壁为强阳性表达,间质细胞表达减弱(图3-D,3-E),繁殖间期阴性对照无表达(图3-F).
2.3 LN在不同繁殖期蓝狐睾丸免疫组织化学检测结果对比分析
免疫组织化学平均吸光度统计结果显示,繁殖期蓝狐睾丸显著高于繁殖间期,统计学差异极显著(图4).
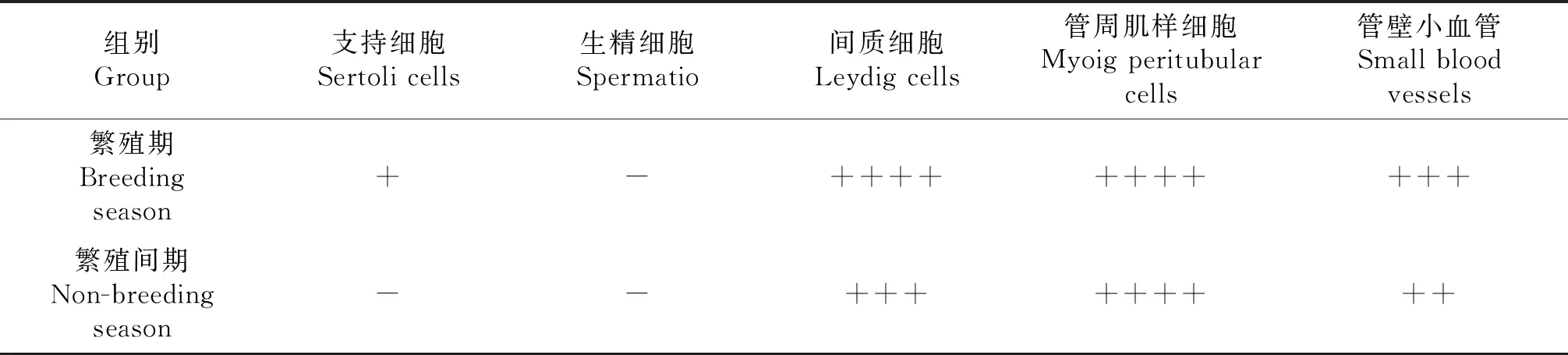
表1 LN在不同繁殖季节蓝狐睾丸组织的表达特点
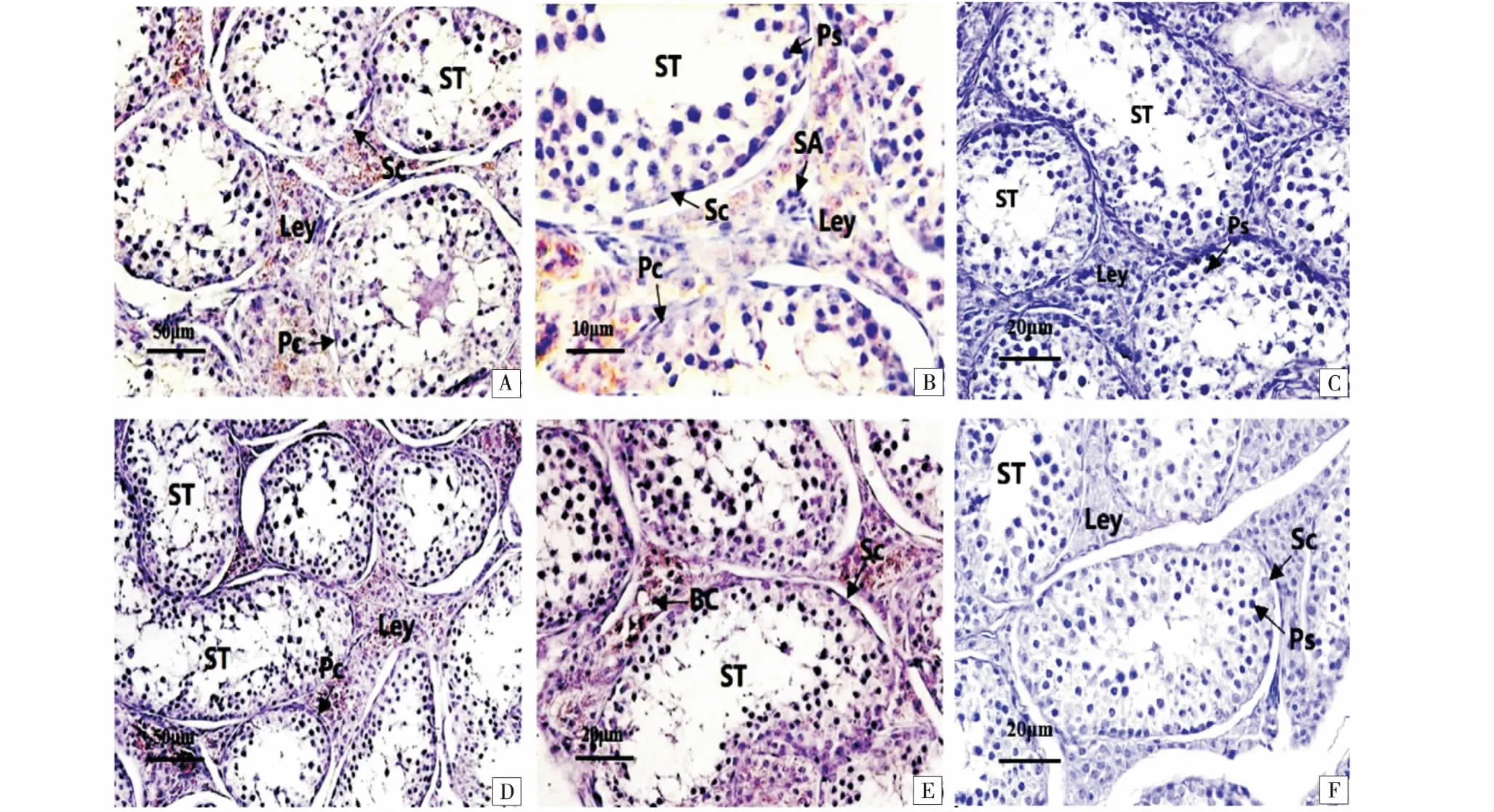
A~C:繁殖期蓝狐睾丸组织;A:LN免疫组化染色,标尺示50 μm;B:LN免疫组化染色,标尺示10 μm;C:免疫组化阴性对照,标尺示20 μm;D ~F:繁殖间期蓝狐睾丸组织;D:LN免疫组化染色,标尺示50μm;E:LN免疫组化染色,标尺示20 μm;F:免疫组化阴性对照,标尺示20 μm;Pc:管周肌样细胞;Ps:初级精母细胞;SA:小动脉;Sc:Sertoil细胞;Sg:精原细胞;ST:生精小管;Ley:睾丸间质细胞;BC:毛细血管.A~C:The structure of Alopex lagopus testicle in breeding season;A:The LN immunohistochemical staining,bar=50 μm;B:The LN immunohistochemical staining,bar=10 μm;C:The immunohistochemical staining negative control,bar=20 μm;D~F:The structure of Alopex lagopus testicle in non-breeding season;D:The LN immunohistochemical staining,bar=50 μm;E:The LN immunohistochemical staining,bar=20 μm;F:The immunohistochemical staining negative control,bar=20 μm;Pc:peritublar myoid cells;Ps:primary spermatcyte;SA:small artery;SC:sertoli's cells;Sg:spermatophore;ST:spermatogenic tubule;ley:leydig cells;BC:blood capillary.图3 LN在不同繁殖季节蓝狐睾丸免疫组化染色Figure 3 Immunohistochemistry of Alopex lagopus testicles in different breeding seasons
3 讨论与结论
季节性繁殖是动物适应自然选择而形成只在特定季节繁殖的现象,受生存环境的限制而具有了季节性繁殖的特征[9].日本田鼠在繁殖间期生精小管由支持细胞、精原细胞、精母细胞和退化脱落的圆形精子组成;恢复期开始有精子发生;至活跃期生精小管管腔直径最大,内部有大量精子[10].性成熟恒河猴睾丸生精上皮细胞在繁殖期较非繁殖期丰富[11].作为典型季节性繁殖的鱼类,巴西条带兔脂鲤在生殖季节(12月/ 1月和2月/ 3月)性腺指数和生精小管直径较大,回归和休眠期(4月/5月和6月/7月)显著降低[12].研究表明,蓝狐睾丸质量和体积的变化都与季节性有关,休情期蓝狐睾丸生精小管排列较为疏松间距较大,生精上皮细胞较发情期松散.不同繁殖期睾丸生殖上皮季节性发育主要变化是1倍体细胞(主要是精细胞和成熟的精子)的比率从3月的90%急剧下降到了12月的78%以下[13].澳大利亚鸸鹋在繁殖期生精上皮大量增生,细胞层次多,管腔渐大,有大量精子分布,而在非繁殖期生精上皮细胞排列紧密,管直径小,未见成熟精子[14];与此相一致,本研究中繁殖期蓝狐睾丸生精小管与繁殖间期相比,生精上皮细胞层数变化显著,生精小管平均直径显著增加,表明生精小管的大小及生精上皮的发育随季节性繁殖变化明显;季节性繁殖动物睾丸在繁殖期与间期的膨大和缩小亦可能是普遍存在的现象.
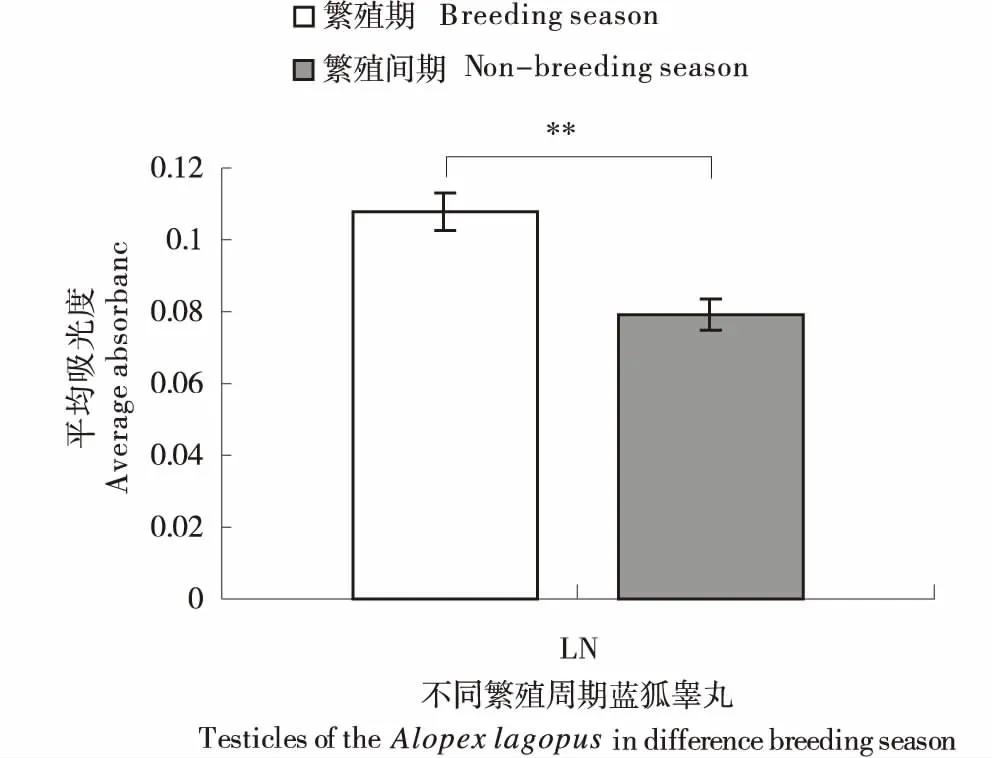
*同一数据间差异显著(P<0.05);**同一数据间差异极显著(P<0.01).* means significant difference between groups(P<0.05);** means extreme significant difference between groups(P<0.01).图4 不同繁殖季节成年蓝狐睾丸LN表达统计比较Figure 4 The comparison of LN expression in the testicle of adult Alopex lagopus between breeding and non-breeding seasons
睾丸细胞外基质(extracellular matrix,ECM)包括生精小管基膜和管周细胞间基质部分,主要包括Ⅰ型和Ⅳ型胶原、层粘连蛋白、制动素和蛋白多糖等多种蛋白和因子,在精原细胞自我更新及精子发生等方面发挥着重要作用[15].不同种属哺乳动物睾丸基膜中的LN在管周肌样细胞发育时出现,并参与基膜及血管壁构成,在支持细胞构成血睾屏障过程及生精细胞的各个阶段发挥功能[16].Gao等[17]研究发现LN在鸡、鸭、鸽子和兔定位于生精小管基底膜和管周肌样细胞,且在血管强表达.与此相一致,本研究中LN在繁殖期与繁殖间期在生精小管基底膜均呈现强阳性反应,表明LN可能通过基膜和血管发挥作用.免疫组化研究表明,不同繁殖季节南非黑背豺睾丸LN均主要表达于生精小管基膜,血管平滑肌细胞以及间质细胞[4].本研究中,繁殖期及繁殖间期蓝狐睾丸LN在管周肌样细胞及血管壁细胞为强阳性表达,提示不同繁殖期LN在蓝狐生精小管基膜的表达变化不明显.
支持细胞调节睾丸的分化和发育,是维持成年睾丸功能的关键.不同种属动物睾丸基膜中的LN及COIV在管周肌样细胞发育时出现,且在支持细胞分化以及维持分化的各个阶段发挥功能.LN的存在促进了支持细胞的粘附和转移[18];体外研究表明,大鼠支持细胞能够合成层粘连蛋白和IV型胶原[5].免疫组化显示,LN在不同繁殖期牦牛睾丸的支持细胞均为阳性表达[19].睾丸内的支持细胞可以分泌雄激素结合蛋白,并与间质细胞分泌的睾丸酮结合,维持精子的发育,亦可决定成年小鼠睾丸的生殖细胞和间质细胞数量[20].本研究中繁殖期生精小管内支持细胞平均数量较繁殖间期显著增加,LN在繁殖期支持细胞阳性表达,而在繁殖间期表达不明显,提示LN在不同繁殖期的表达变化与繁殖间期支持细胞数量变化有关,亦可能参与调解繁殖间期睾酮的分泌.
研究表明睾丸组织LN合成与不同繁殖季节间质细胞分泌功能变化相关[18].体外研究证实间质细胞通过调节LN等ECM成分的合成以应对其激素合成的变化[21].LN在繁殖季节黑背豺的睾丸细胞间质为免疫组化强表达.季节性繁殖雄性动物,睾丸酮在非繁殖季节减少,野生浣熊犬睾丸3bHSD、P450c17免疫定位及染色强度随季节变化局部粘附分子的表达降低,同时诱导生殖细胞生成减少[22].LN在繁殖期牦牛睾丸表达强于繁殖间期,与高寒低氧环境中牦牛间质细胞分泌功能变化相关[18].与本研究中LN在睾丸间质的表达及生殖细胞的变化相一致,且繁殖间期间质细胞数量极显著低于繁殖期,提示LN可能与睾丸间质细胞数量及睾酮的分泌有关.
综上所述,不同繁殖期蓝狐睾丸生精小管结构差异明显,季节性变化显著.LN在生精小管基膜表达受动物季节性繁殖的影响不明显,蓝狐睾丸LN表达变化与支持细胞和间质细胞数量变化相一致,LN表达强弱可能与不同繁殖季节间质细胞及支持细胞发育及功能变化相关,有待于进一步分析.
