凹凸棒石负载锌钴层状双氧化物抗菌材料的制备及性能
2019-09-18张明明刘欣跃牟斌王爱勤
张明明,刘欣跃,牟斌,王爱勤
(1.兰州大学第二医院检验医学中心,甘肃 兰州 730030;2.甘肃省粘土矿物应用研究重点实验室,中国科学院兰州化学物理研究所生态材料与绿色化学中心,甘肃 兰州 730000)
近年来,由于对抗生素的滥用和不合理使用,导致耐药菌株大量出现出现,严重威胁人类健康,因此急需研发新型抗生素[1-3].但是,新型抗生素的研发速度远远慢于细菌耐药的发生速度.因此,研发具有高效抗菌活性的抗菌材料受到广泛关注和研究.
目前,常见的抗菌材料研究仍以无机金属类化合物为主,如银、锌、铜等[4-6].其中,银价格高昂,且易于氧化变色;铜作为重金属具有广泛的细胞毒性作用;而锌则兼具抗菌谱广和细胞毒性相对较低的的优势.因此,以锌为原材料合成抗菌材料受到了生物材料、医学等领域的广泛关注[7-10].其中,锌/黏土矿物复合材料由于具有低成本和绿色环保等优势,近年来受到广泛研究[11].研究发现,黏土矿物的引入可以通过控制锌基化合物的粒径和形貌,从而提高复合材料的抗菌性能[12-13].凹凸棒石(attapulgite,APT)是一种层状含水富镁铝的硅酸盐黏土矿物,理论化学式可表示为(Al2Mg2)Si8O20(OH)2(OH2)4·4H2O[14].其具有独特的一维纳米棒状结构、永久表面负电荷以及大量规整孔道结构和表面硅羟基,拥有较大的比表面积、优异的吸附性能[15]、表面易修饰等优点,因此被广泛用于各类微纳米复合材料的制备[16].层状双氧化物(layer double oxides,LDO)是由具有水滑石结构的层状双氢氧化物(layer double hydroxides,LDH)高温煅烧而来.研究表明,在温度不太高时(一般不超过550 ℃),LDO化合物与LDH化合物具有相似的结构,将LDO化合物放置于溶液中,此时可重新得到结构完整的LDH[17-18].在LDH化合物中,每个单层是由类水镁石结构的八面体相互连接组成,在层的形成过程中,八面体中心的二价金属阳离子可被三价金属阳离子取代,因而使得单层LDH带正电荷.为了保持整体结构呈电中性,层间就会相应地填充大量阴离子(如NO3-、CO32-、Cl-),这些层间阴离子和水分子通过氢键和静电引力与每个LDH单层进行相互作用,从而构成完整的LDH化合物[19].此外,由于LDH化合物的主体层板阳离子具有较大的普适性以及层间阴离子较好的离子交换性,使得该化合物可在吸附[20]、催化[21-22]、电极材料[23]、抗菌以及药物缓释[24-25]等领域均能发挥重大潜力.同时,钴作为钴胺类辅酶中的活性中心(例如在维生素B12中),与人体具有较好的生物相容性.因此,本研究拟通过引入钴元素与锌元素合成锌钴层状双氧化物,并将其负载在凹凸棒石上,期望可以合成抗菌性能良好且生物相容性优异的抗菌材料.
基于此,为进一步改善锌基抗菌材料的抗菌活性和生物相容性,降低其生产制作成本.本文以凹凸棒石、氯化锌和六水合氯化钴为原料,联合共沉淀和煅烧法制备了复合材料凹凸棒石负载的层状双氧化物(APT/CoZn LDO).系统地评价了不同凹凸棒石添加量以及不同锌钴摩尔比等因素对材料抗菌性能和细胞毒性的影响.同时,对制备的复合材料其结构、理化性能和生物相容性等进行了表征和分析.
1 材料与方法
1.1 试验材料
凹凸棒石(attapulgite,APT),产自安徽省明光矿,根据X-射线荧光光谱测试(XRF),其主要成分为:Al2O39.69%、MgO 10.94%、SiO251.75%、CaO 1.29%、Na2O 0.48%、K2O 0.99%和Fe2O35.04%.氯化锌(ZnCl2)、六水合氯化钴(CoCl2·6H2O),分析纯,购自中国广东省汕头市西陇化工有限公司.六亚甲基四胺(HMT),分析纯,购自中国上海市鑫达化工有限公司.水解酪蛋白(MH)琼脂培养基、L-B肉汤培养基购自中国青岛高科园海博生物技术有限公司.日本同仁CCK-8试剂盒,上海经科化学科技有限公司.活/死细菌活力试剂盒(L 7012),美国Invitrogen公司.标准菌株金黄色葡萄球菌(ATCC 25923),大肠埃希菌(ATCC 25922),来自兰州大学第二医院检验医学中心.Hela细胞株,中国科学院近代物理研究所购自江苏省江阴齐式生物科技有限公司.所有化学试剂均未进行进一步纯化,如无特殊说明,所有溶液均使用去离子水配制.
1.2 样品的制备
将8 mmol ZnCl2和1 mmol CoCl2·6H2O溶解于100 mL去离子水中,并将称量好的40 wt.% APT加入上述溶液中并搅拌均匀.得到的溶液在超声细胞破碎仪中超声30 min后,在100 ℃油浴下剧烈搅拌,逐滴滴加含48 mmol的HMT溶液并继续搅拌反应12 h.待反应结束后,将沉淀物进行多次离心洗涤至pH中性,并于60 ℃烘箱中干燥.得到的固体产物经研磨粉碎、过200目筛,备用.将上述合成的化合物在马弗炉中分别经300、400、500、600、700和800 ℃煅烧4 h后,经研磨过筛得到系列产物.为了考察煅烧温度对复合材料抗菌性能的影响,将上述系列产物分别进行抗菌性能测试,根据抗菌性能的优劣判断最佳煅烧温度.同理,考察系列不同锌钴摩尔比例和凹凸棒石添加量样品的抗菌性能,找到最优凹凸棒石添加量和锌钴摩尔比.同时,将不添加CoCl2·6H2O制备的产物APT/ZnO标记为对照组.具体的样本制备条件见表1.

表1 样本的制备条件和编号
1.3 样品表征
采用扫描电子显微镜(SEM,JSM-6701F型JEOL,日本),用于观察样品的形貌,测试前样品经喷金处理;透射电子显微镜(TEM,F-30型 Tecnai,荷兰),测试前将样品分散于无水乙醇中,滴在碳膜铜网上晾干;傅里叶红外光谱仪(Fourier Transform Infrared Spectroscopy,FTIR):Nicolet NEXUS型(Thermo,美国),在扫描波长4 000~400 cm-1的范围内分析样品组成,样品经KBr压片法制备;多晶X射线衍射(X-ray diffraction,XRD):X′Pert型(PANnalytical,荷兰),测试条件:连续记谱扫描,Cu-Kα 辐射,狭缝宽度0.5°,扫描速度0.05°/s,电压40 kV,电流强度30 mA,扫描范围2θ=3°~80°;X-射线荧光光谱仪(X Ray Fluorescence,XRF):由MiniPal 4台式能量色散(Panalytical 荷兰)获得.
1.4 体外抗菌试验
采用琼脂稀释法评价抗菌材料的抗菌性能[26],通过最低抑菌浓度值(MIC)评价样品的抗菌活性,MIC为抗菌材料抑制细菌生长的最低浓度.以水解酪蛋白(MH)琼脂为培养基,分别对革兰氏阳性菌(金黄色葡萄球菌)和革兰氏阴性菌(大肠埃希菌)两种细菌进行测试.取-80 ℃保存的标准菌种金黄色葡萄球菌(ATCC 25923)和大肠埃希菌(ATCC 25922),将其接种至L-B肉汤中进行复活,当细菌传代进入对数期时,制备标准菌株菌悬液.调整菌悬液至0.5 McFarland标准浊度,含菌量约1×108CFU/mL,再稀释浓度至1×107CFU/mL后备用.然后,制备浓度分别为2.0、1.0、0.5、0.25、0.125和0.062 5 mg/mL的含抗菌材料的琼脂平板.最后,用加样枪吸取1 μL上述菌悬液(含菌量约为1×104CFU/μL),点种于含抗菌材料的平皿内.每个平皿分别点种在3个不同的位置,并进行2次重复试验.将所有平板移至二氧化碳孵育箱中培养,在37 ℃下培养24 h后,观察细菌生长情况.同时设置阳性对照组,为不含抗菌材料,但接种细菌的MH琼脂培养基;阴性对照组,不含抗菌材料且未接种细菌的MH琼脂培养基.
1.5 细菌活力试验
采用活/死细菌活力试剂盒来测定金黄色葡萄球菌和大肠埃希菌在APT/ZnCo LDO-1中的细菌活性.将金黄色葡萄球菌和大肠埃希菌用0.9% NaCl配制成浓度为1×108CFU/mL的菌悬液,并与APT/ZnCo LDO-1在37 ℃下共培养12 h.然后,以10 000 r/min离心10 min后弃上清并重悬沉淀,在室温黑暗的环境中荧光染色15 min.采用倒置荧光显微镜(EVOS,Thermo,USA)对细菌的荧光染色结果进行成像和观察.膜受损的死细菌被PI染液染成红色荧光,而膜完好无损的活细菌被SYTO 9染成绿色荧光[27].
1.6 生物相容性试验
1.6.1 细胞培养 Hela细胞的培养条件,DMEM高葡萄糖培养基中含10%胎牛血清、100单位/mL的青霉素和链霉素,在含5% CO2的37 ℃温箱中培养.
1.6.2 细胞相对增值率试验 采用CCK-8法测试复合材料的细胞生物相容性.CCK-8法是细胞增殖或毒性试验中测定活细胞数量的一种高灵敏度、非放射性比色法试验.活细胞内的脱氢酶还原WST-8并产生可溶解于培养基的橙黄色产物福尔马臜染料,细胞中脱氢酶生成的福尔马臜染料的数量与活细胞的数量成正比[28].将100 μL的Hela细胞悬液接种于96孔板中的每个孔中,细胞密度为1(104细胞/孔,37 ℃孵育24 h.待细胞贴壁后分别加入100 μL含有不同浓度(0.5、0.25、0.125、0.062 5 mg/mL)复合材料的新鲜培养基后继续孵育24、48、72 h.并在加入抗菌材料后的第24、48、72 h 时,向每孔中加入10 μL的CCK-8试剂,显色孵育3 h后,测定其吸光度值(λ=450 nm).试验对照组为不添加抗菌材料的Hela细胞.每个样品的细胞增值率是3次重复试验的平均值.
2 结果与分析
2.1 体外性能试验
表2为制得的系列复合材料APT/ZnCo LDO对金黄色葡萄球菌和大肠埃希菌的抗菌结果.从表2中可以发现,材料在经过300 ℃和400 ℃煅烧后,其对金黄色葡萄球菌和大肠埃希菌的MIC分别为0.25 mg/mL和1.0 mg/mL.然而,在经500 ℃煅烧后,其抗菌性能有了明显提高,对金黄色葡萄球菌和大肠埃希菌的MIC值分别达到0.125 mg/mL和0.5 mg/mL.之后,随着煅烧温度的进一步提高,复合物的抗菌效果反而下降.当煅烧温度达到800 ℃时,其对金黄色葡萄球菌和大肠埃希菌的MIC分别降为>1.0 mg/mL和>2.0 mg/mL.上述结果表明制备抗菌材料的最佳煅烧温度为500 ℃.
随后,考察APT添加量为40 wt.%,煅烧温度为500 ℃的条件下,不同锌钴摩尔比的系列样品的抗菌性能.结果发现,锌钴摩尔比为8∶1的产物APT/ZnCo LDO-1与不添加Co的对照样品APT/ZnO拥有相同且最佳的抗菌效果,其对金黄色葡萄球菌和大肠埃希菌的MIC分别为0.125 mg/mL和0.5 mg/mL.
最后,评价锌钴摩尔比为8∶1,煅烧温度为500 ℃,不同凹凸棒石添加量的系列样品的抗菌性能.从表2的结果可以发现,随着APT的添加量从0增加到40 wt.%,复合材料对金黄色葡萄球菌和大肠埃希菌的抗菌效果并无改变.但是,凹凸棒石的添加量增加,会明显减少复合材料锌钴的相对添加量,这表明引入凹凸棒石提高了锌钴双氧化物的抗菌活性.
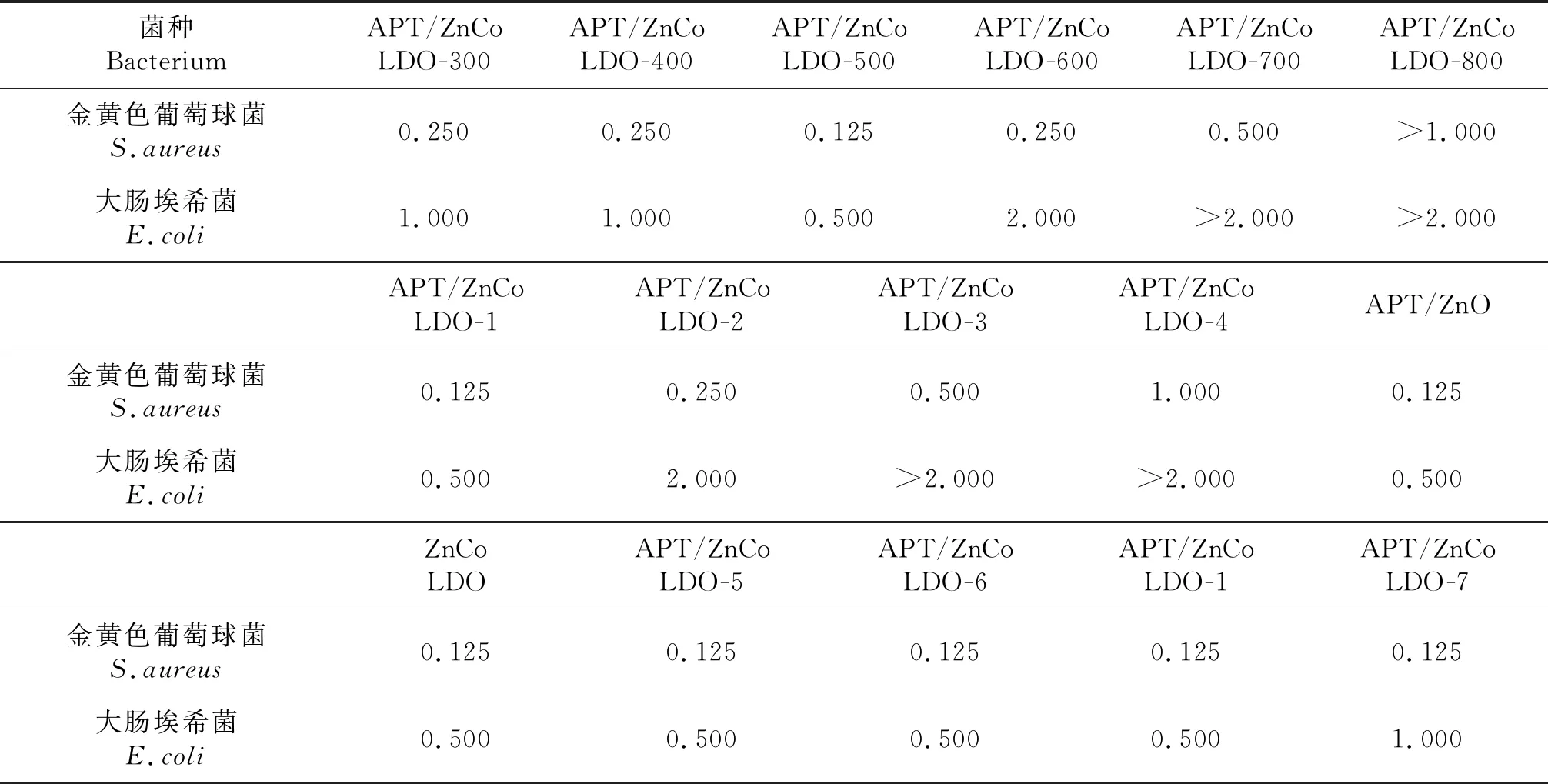
表2 样品对金黄色葡萄球菌和大肠埃希菌的MIC
2.2 材料表征
2.2.1 形貌分析 所制备的复合材料煅烧前后的形貌如图1和图2所示.从图1-A和1-B中可以发现,复合材料是由一维棒状结构APT和二维层状的LDO所组成的化合物.图1-C为复合材料煅烧前的形貌,是由一维棒状结构的APT和二维六边形的LDH结构组成.对比煅烧前后材料的表面微观形貌,发现LDH表面相对光滑的片状结构在经500 ℃煅烧后变得粗糙,并有部分区域出现颗粒团聚现象.这归咎于煅烧使得LDH主体层板上的结构羟基以及层间阴离子、层间水的脱除[18].

A、B:APT/ZnCo LDO-1;C:APT/ZnCo LDH.A and B:APT/ZnCo LDO-1;C:APT/ZnCo LDH.图1 样品煅烧前后的SEMFigure 1 SEM images of APT/ZnCo LDO-1
图2-A是抗菌材料APT/ZnCo LDO-1在透射电子显微镜下的微观形貌,图2-B是其煅烧前的形貌结构.从图2-A中清晰地发现材料是由一维棒状APT与二维层状LDO组成的混维结构,并且它们之间接触紧密,可能存在一定的物理或化学作用.与SEM结果一致,观察到六边形的LDO结构,与煅烧前的结构相比,复合物在煅烧后出现颗粒团聚的现象.图2-C~F展示了细菌与抗菌材料APT/ZnCo LDO-1接触前后的形貌变化.其中,图2-C和2-E分别为金黄色葡萄球菌和大肠埃希菌的形貌图,观察到金黄色葡萄球菌呈圆球状,大肠埃希菌呈长杆状,菌体表面光滑、边缘整齐且细胞结构完整.图2-D和2-F分别展示金黄色葡萄球菌和大肠埃希菌与抗菌材料接触12 h后的形貌变化.图2-D中3个金黄色葡萄球菌被抗菌材料成功“捕获”,且菌体形态变为不规则状,边缘不再完整,细菌结构遭到破坏.图2-F中同样发现,大肠埃希菌菌体表面变得粗糙,形态结构被破坏呈不规则状.

A:APT/ZnCo LDO-1;B:APT/ZnCo LDH;C、E:分别为金黄色葡萄球菌和大肠埃希菌;D:金黄色葡萄球菌与APT/ZnCo LDO-1接触12 h后;F:大肠埃希菌与APT/ZnCo LDO-1接触12 h后.A:APT/ZnCo LDO-1;B:APT/ZnCo LDH;C and E:S.aureus and E.coli,respectively;D and F:The bacteria of S.aureus and E.coli exposure to APT/ZnCo LDO-1 for 12 h,respectively.图2 APT/ZnCo LDO-1和细菌的透射电子显微镜图片Figure 2 TEM images of APT/ZnCo LDO-1 and the bacteria
2.2.2 FTIR分析 图3-A为不同煅烧温度下的系列材料APT/ZnCo LDO的傅里叶变换红外光谱图.如图所示,在437 cm-1附近处出现的吸收带,随着煅烧温度的升高,逐渐变窄,并伴有位移和振动强度的降低,吸收带位于428、438、439、448、464 cm-1处,分别归属于Zn-O和Co-O键的振动[29-30].在3 442和3 550 cm-1处的振动带分别与Si-OH和Mg-OH中的羟基拉伸振动有关[31].随着煅烧温度的增加,3 550 cm-1处的羟基振动带强度降低,直到800 ℃时完全消失,并形成以3 450 cm-1为中心的宽带.这些峰位置的迁移,主要归因于APT的结构变化,包括沸石水和结构水的损失、晶体结构的坍塌和晶相相变.1 655 cm-1处的频带是由吸附在APT和LDO上的水分子弯曲振动造成,从图中观察到,随着煅烧温度的增加,振动带的强度减弱.984、1 031 cm-1处出现的特征吸收带,可能与APT框架中的Si-O-Si键或层内Si-O-Si键的的弯曲振动有关[32].此外,1 031 cm-1处的谱带在随着煅烧温度增加到700 ℃时,右移到了950 cm-1处,与煅烧温度600 ℃相比,峰的强度明显增加,然后随着煅烧温度的进一步升高而升高,这说明在高温煅烧下,APT骨架结构中Si-O-Si或Mg(Si)-OH基团振动强度发生了改变.

图3 不同煅烧温度下的APT/ZnCo LDO的红外光谱图(A)和XRD谱图(B)Figure 3 FTIR spectra (A) and XRD patterns (B) of APT/ZnCo LDO at different calcination temperatures
2.2.3 XRD分析 为了更好地研究样品的结构变化,图3b展示了不同煅烧温度下的APT/ZnCo LDO的XRD结果.在复合材料APT/ZnCo LDO的XRD谱图中,位于2θ=8.5°、19.8°、25.5°和28.1°处出现了APT的特征衍射峰,分别归属于(110)、(040)、(231)和(400)晶面(PDF# No.29-0855)[33].且随着煅烧温度的升高,这些衍射峰的强度显著降低或者消失.在300 ℃煅烧时,尚未观察到明显变化,但当煅烧温度升高到400 ℃时,2θ=28.1°处的衍射峰强度变弱,且随着温度的继续升高最终消失.当煅烧温度达到600 ℃时,2θ=8.49°处出现的衍射峰消失.材料经700 ℃煅烧后,位于2θ=19.8°处的衍射峰也随之消失.以上结果表明APT框架内的Si-O或Si-O-Si基团在煅烧过程中发生了变化.此外,在APT/ZnCo LDO-800上观察到2θ=39.4°处出现的弱衍射峰,这表明在一定程度上,由于APT结构内失去镁羟基,导致APT碱度降低,可能会产生石英相的SiO2[34].此外,在2θ=31.8°、34.4°、36.3°、47.5°、56.6°、62.9°、68.0°和69.1°处出现的衍射峰可归属于六方ZnO纤锌矿结构(PDF# No.36-1451),其对应的晶面分别为(100)、(020)、(101)、(110)、(103)、(112)和(201)[34].从图中发现,APT/ZnCo LDO复合材料的XRD谱图中均发现了ZnO的特征衍射峰,但其衍射峰的强度和位置略有不同.随着煅烧温度的升高,衍射峰逐渐变得更加尖锐,同时峰的强度也增大,表明复合物的结晶度得到了一定提升.在2θ=38.5°、44.8°、55.7°和59.4°出现的衍射峰分别对应于CoO (222)、(400)、(422)和(511)的晶面(PDF# No.42-1467)[30].与ZnO的衍射峰相似,CoO的衍射峰也会随着温度的升高而强度增加.总体来说,随着煅烧温度的升高,复合物的XRD衍射峰将逐渐锐化,这可归咎于晶粒的尺寸增大或晶格应变的减小[35].
2.3 细菌活力试验
图4为金黄色葡萄球菌和大肠埃希菌与APT/ZnCo LDO-1接触前后的细菌活力变化图.图4-A和4-D分别为金黄色葡萄球菌和大肠埃希菌与抗菌材料APT/ZnCo LDO-1接触前的荧光染色照片.发现其均被荧光染液SYTO 9染为绿色荧光,说明细菌菌体结构完好,细胞活力良好.细菌和抗菌材料接触12 h后,可以发现细菌菌体均被染为红色荧光(图4-B和4-E),说明细菌菌体结构遭到破坏,细胞壁不再完整,红色荧光染液PI进入细菌内部.值得一提的是,图4-C和4-F展现细菌和抗菌材料接触12 h后,在荧光显微镜下的复合图片,发现被染为红色荧光的死细菌主要黏附在抗菌材料表面.
2.4 生物相容性试验
通过CCK-8试验评价凹凸棒石和钴的添加量抗菌材料的生物相容性的影响.在CCK-8试验中,如果材料和细胞经过一定时间的共培养后,若细胞相对增殖率仍大于或等于75%,则该复合材料被认为无细胞毒性作用.图5-A~C和图5-D~F分别为不同锌钴摩尔比例和不同凹凸棒石添加量APT/ZnCo LDH分别在在0.5、0.25、0.125和0.062 5 mg/mL的浓度下与Hela细胞共同孵育24、48、72 h后的细胞相对增值率.由图5-A发现,所有材料在经过24 h的孵育后,细胞相对增值率均大于75%,说明此时材料均未表现出细胞毒性.但当APT/ZnO与Hela细胞共孵育48 h后(图5-B),在0.5 mg/mL浓度下,其细胞相对增值率<75%;且当孵育时间延长到72 h时 (图5-C),APT/ZnO在浓度为0.5和0.25 mg/mL时,细胞相对增值率均<75%,表明其细胞毒性随时间延长而增强.然而,APT/ZnCo LDO-1、APT/ZnCo LDO-2、APT/ZnCo LDO-3、APT/ZnCo LDO-4在不同浓度下,经过24、48、72 h孵育后,其细胞相对增值率均>75%.与未添加Co的对照组APT/ZnO相比,抗菌材料在引入Co后其细胞毒性作用减弱;同时,随着材料中钴添加量的增加,细胞的相对增值率不断提高,说明Co的引入减少材料中锌的添加量,从而降低了细胞毒性.从图5d,e和f中,观察到抗菌材料在添加不同比例的凹凸棒石后,其生物相容性发生了变化.图5-A中当凹凸棒石添加量为0和10 wt.%时,在0.5 mg/mL和0.25 mg/mL的浓度下表现出细胞毒性;当凹凸棒石添加量≥20 wt.%时,其细胞毒性作用减弱,细胞相对增值率均>75%,并且随着与细胞共同孵育时间的延长(图5-B~C),依然表现出良好的生物相容性.
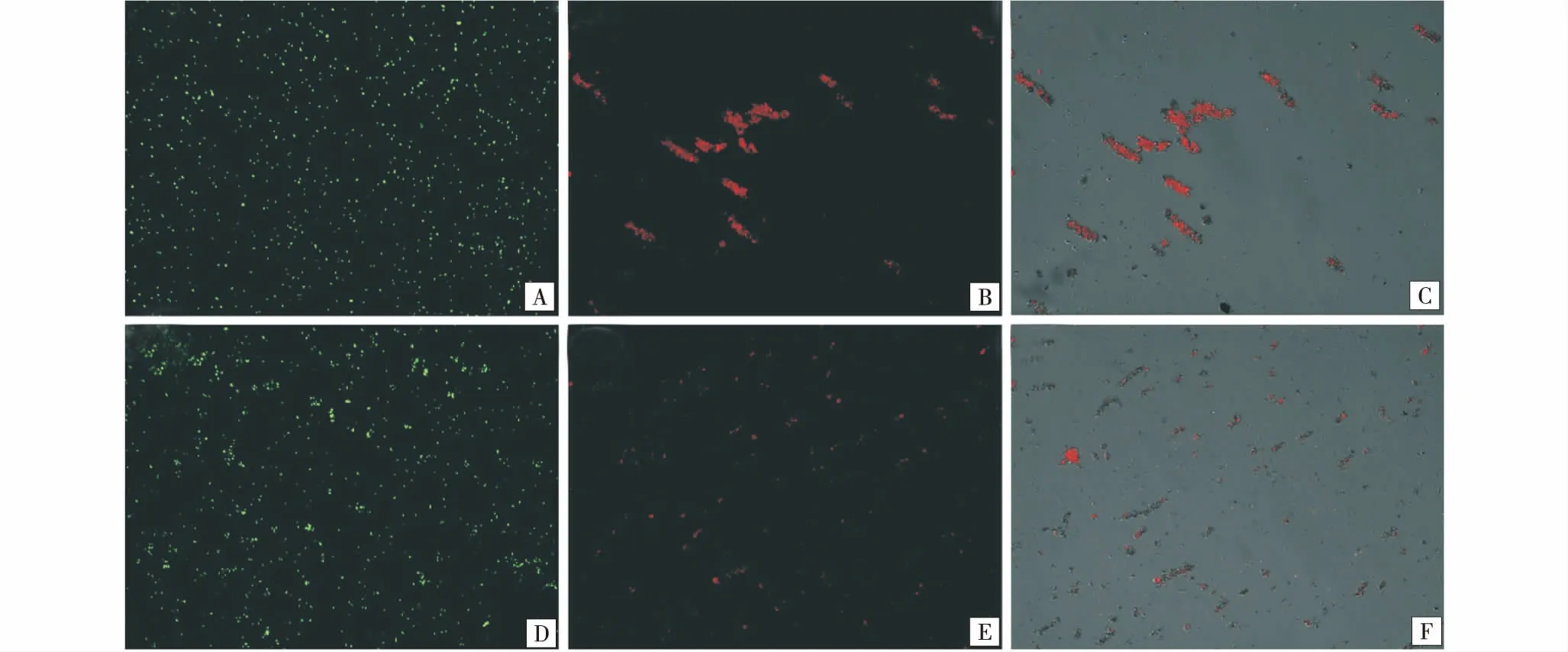
A、D:金黄色葡萄球菌和大肠埃希菌;B:为金黄色葡萄球菌与APT/ZnCo LDO-1培养12 h后;E:为大肠埃希菌与APT/ZnCo LDO培养12 h后;C:为金黄色葡萄球菌与APT/ZnCo LDO-1培养12 h后APT/ZnCo LDO-1和细菌的复合图;F:大肠埃希菌与APT/ZnCo LDO-1培养12 h后APT/ZnCo LDO和细菌的复合图.A and D:The images of S.aureus and E.coli;B and E:The images of S.aureus and E.coli after cultured with APT/ZnCo LDO-1 for 12 h,respectively;C and F:The images of S.aureus and E.coli with APT/ZnCo LDO-1,after incubation for 12 h.图4 细菌与APT/ZnCo LDO-1接触前后的细菌活力荧光染色结果Figure 4 LIVE/DEAD bacterial viability assay of S.aureus and E.coli
3 讨论
复合材料的抗菌性能试验结果表明,锌钴摩尔比为8∶1,经过500 ℃煅烧后的抗菌材料APT/ZnCo LDO-1与不添加Co的对照组APT/ZnO表现出相同的抗菌性能;这说明复合材料中发挥抗菌作用的主要成分是锌,而将钴引入复合材料后,减少了材料中锌源的使用量,但材料依然展现出良好的抗菌性能.同时,APT的添加量为40 wt.%的抗菌材料APT/ZnCo LDO-1与不添加APT的对照组ZnCo LDO相比,表现出相同的抗菌活性;而随着抗菌材料中APT添加量的增加,相同浓度下的抗菌材料中锌钴的质量却显著降低,但材料依然维持良好的抗菌性能.这表明在抗菌材料中引入价廉的天然粘土矿物APT后,在提高锌钴双氧化物抗菌活性的同时,还大大降低了抗菌材料的生产成本.抗菌材料在引入钴和凹凸棒石后,抗菌性能的改善可能归因于试验中钴和锌合成的双氧化物LDO结构和APT具有良好的物理和化学吸附能力,能提高抗菌材料对细菌的吸附网罗能力,将细菌牢固吸附在抗菌材料表面;此外,APT具有较大的比表面积,能有效提高锌钴双氧化物的分散性能,并减少金属氧化物团聚现象的发生.综上,在引入钴和凹凸棒石后,抗菌材料的抗菌性能得了显著改善.复合材料的最佳制备条件为锌钴摩尔比为8∶1,凹凸棒石添加量为40 wt.%,煅烧温度为500 ℃,即APT/ZnCo LDO-1.其对金黄色葡萄球菌和大肠埃希菌的MIC值分别为0.125 mg/mL和0.5 mg/mL.
通过分析抗菌材料的抗菌性能,发现样品在经过300~800 ℃煅烧的过程中,拥有最佳抗菌性能的煅烧温度为500 ℃.对系列材料进行FTIR和XRD分析,抗菌材料在经过高温煅烧后,出现化合物ZnO和CoO的衍射峰,且衍射强度随着煅烧温度的升高而增强.这说明锌钴层状双氢氧化物经过高温煅烧后变为锌钴层状双氧化物,而将层状双氧化物结构置于溶液后,会恢复为原来的层状结构.这一过程需要在给定范围内才能进行重构,焙烧温度必需足够高,以消除层状双氢氧化物中间层的大多数阴离子;但是,如果煅烧温度过高,高于550 ℃时,层状双氧化物结构则无法重建[17].所以,材料在经过600 ℃及以上的高温煅烧后,会出现LDO结构的塌陷,在溶液中无法恢复片层状结构,影响其在抗菌过程中对细菌的吸附作用,从而降低材料的抗菌性能.此外,XRD结果显示,当煅烧温度达到600 ℃及以上时,材料中APT的特征衍射峰变弱和消失现象;同样地,FTIR结果发现,位于3 550和1 655 cm-1的振动带出现位移及强度减弱现象.这些现象说明抗菌材料中的APT发生了晶体结构和孔洞结构的塌陷[31],造成APT结构破坏和比表面积降低,导致APT对细菌的吸附性能降低,并影响锌钴双氧化的分散性和稳定性,降低材料的抗菌活性.

A~C:分别为APT/ZnCo LDO-1、APT/ZnCo LDO-2、APT/ZnCo LDO-3、APT/ZnCo LDO-4和APT/ZnO与Hela细胞共同孵育24 h、48 h和72 h后的细胞相对增值率;D~F:分别为ZnCo LDO、APT/ZnCo LDO-5、APT/ZnCo LDO-6、APT/ZnCo LDO-1和APT/ ZnCo LDO-7与Hela细胞共同孵育24 h、48 h和72 h后的细胞相对增值率.Various concentrations of APT/ZnCo LDO and APT/ZnO with different molar ratios of Zn/Co.A~C and ZnCo LDO with different contents of APT (D~F) after incubation for 24,48,and 72 h,respectively.The data are provided the mean standard deviation of three parallel experiments.图5 样品的细胞相对增值率Figure 5 Cell viability (CCK-8 assay) of Hela cells
通过对细菌和抗菌材料APT/ZnCo LDO-1接触前后的形貌变化进行分析(图2),发现细菌在与抗菌材料接触后,细菌菌体的形貌由规则、光滑、完整变为不规则、粗糙和破碎的状态;死亡的细菌大量黏附在抗菌材料表面(图2-D和图2-F).同样地,在细菌活力试验的结果中,同样发现被染为红色荧光的死细菌大量黏附在抗菌材料表面.死细菌大量附着在抗菌材料表面,可能与凹凸棒石拥有的物理和化学吸附性能、自身携带负电荷和表面大量的Si-OH基团有关,其与细菌细胞壁表面的正电荷和有机物结合形成化学键,从而使得细菌被固定在材料表面.细菌在被固定在材料表面后,会增大抗菌材料与细菌的有效接触面积,提高抗菌活性物质锌和钴的释放;同时破坏细菌的细胞膜屏障,消耗表面离子梯度浓度,最终引起细菌肿胀,细胞壁结构破坏,引起细胞质外泄,导致细菌死亡[36].锌钴双氧化物LDO的抗菌机理可能与材料生成活性氧(ROS)[37];金属氧化物粒子穿过细菌细胞壁,渗入到细胞内,并在细胞内进行重新聚合,产生抗菌作用有关[38].如图2-A所示,本试验制备的锌钴层状双氧化物的平均尺寸均大于200 nm.这表明抗菌材料APT/ZnCo LDO-1不太可能直接穿透细菌的细胞壁,进入细菌内部,从而引起细菌死亡.但是,金黄色葡萄球菌和大肠埃希菌在和抗菌材料接触后,确实发生了菌体的变形,细菌结构遭到破坏等形态学的改变.这说明APT/ZnCo LDO在发挥抗菌作用时,可能是氧化锌和氧化钴生成ROS发挥的作用.然而,有关ROS的生成及其抗菌作用过程仍需更进一步的研究来阐明.
系列抗菌材料的生物相容性结果表明,随着抗菌材料中钴和凹凸棒石添加量的不断增加,抗菌材料的细胞毒性呈下降趋势.说明钴和凹凸棒石的引入,改善了材料的生物相容性.这可能与钴和凹凸棒石的引入,降低了锌的相对添加量;凹凸棒石为绿色、无毒的天然纳米材料,具有良好的生物相容性有关.
4 结论
本研究联合共沉淀与煅烧法成功制备了一种混维抗菌复合材料APT/ZnCo LDO.研究表明,经过500 ℃煅烧、引入40 wt.% APT和12.5 wt.% Co(锌钴摩尔比为8∶1)之后,制备的复合材料具有优异的抗菌性能和细胞生物相容性,对金黄色葡萄球菌和大肠埃希菌的MIC值分别达到0.125 mg/mL和0.5 mg/mL.凹凸棒石和钴的引入减少了抗菌活性组分中锌的相对添加量,这不仅降低了抗菌材料的生产制备成本,还显著提升了材料的生物相容性,可作为提高锌基抗菌材料抗菌性能和生物相容性的有效策略.
