AMPK 活性对宰后牛肉糖酵解、肌肉内环境及品质的影响
2019-09-18高永芳宫玉霞杨雅媛余群力朱跃明韩广星薄文喜
高永芳,宫玉霞,杨雅媛,韩 玲,*,余群力,*,朱跃明,韩广星,薄文喜
(1.甘肃农业大学食品科学与工程学院,甘肃 兰州 730070;2.甘南藏族自治州畜牧工作站,甘肃 甘南 747000;3.张掖市万禾草畜产业科技开发有限责任公司,甘肃 张掖 734000;4.国家肉牛牦牛产业技术体系临沂站,山东 临沂 276000;5.河北福成五丰食品股份有限公司,河北 廊坊 065201)
宰后肌肉转化为肉需要经过一系列复杂的生理生化过程,其中能量代谢尤其是糖酵解是这些变化过程的重要途径[1],而糖酵解与肉色、pH值、嫩度及保水性等肉质性状密切相关,因此,能够调节宰后糖酵解进程并影响肌肉品质的单磷酸腺苷活化蛋白激酶(adenosine monophosphate-activated protein kinase,AMPK)无疑是一个有效的研究靶点。AMPK是能被AMP激活的蛋白激酶,由一个催化亚基α和两个调节亚基β、γ共同构成,编码每个亚基的基因不同,α亚基有α1和α2两种异构体,分别被PRKAA1、PRKAA2基因编码,其Thr(172)磷酸化是AMPK激活的必要条件[2]。屠宰后胴体血液循环及供氧中断,肌肉进行无氧酵解产生能量,生成的ATP含量减少,同时肌肉中ATP消耗继续导致AMP/ATP的比值增加,这种能量状态激活AMPK[3],活化后的AMPK通过抑制糖原合成代谢等途径以减少ATP的消耗,同时促进糖酵解、葡萄糖转运等途径增加ATP的产生,从而调节机体能量供求平衡,是调控能量代谢的开关。
5-氨基咪唑-4-甲酰胺核苷(5-a m i n o-4-imidazolecarboxamide,AICAR)是可透过细胞膜的AMPK专一性激活剂,可磷酸化为5-氨基-4-咪唑甲酰胺核苷酸,5-氨基-4-咪唑甲酰胺核苷酸作为AMP模拟物激活AMPK的同时提高宰后糖酵解水平[4]。然而,在牛肉宰后成熟过程中,AICAR是否通过提高AMPKα基因mRNA转录量进而提高糖酵解水平,同时对宰后肌肉内环境及肉品质造成影响的研究,国内外鲜见报道。Young等[5]研究发现,AMPK激活剂AICAR能够激活大鼠骨骼肌糖原磷酸化酶加速糖原分解;Park等[6]研究发现AICAR激活AMPK会使肌肉呈现更快速收缩,更具糖酵解性质;有研究指出AMPK活性变化与不同极限pH值牛肉的产生密切相关[7-10]。以上研究均表明AMPK活性受多种方式的调控,因此可通过调节AMPK活性,以降低动物的宰前应激反应,并进一步改善肉的品质,降低异质肉的发生率,这对牛肉品质的改善具有重要意义。
本实验以0.50 mol/L AICAR处理的西杂牛背最长肌为对象,通过测定牛肉宰后成熟过程中AMPK活性、AMPKα基因mRNA及P-AMPK表达量、糖酵解水平、肌肉内环境和品质指标的变化,研究AICAR处理对宰后肌肉AMPK的激活作用及对糖酵解、肌肉内环境及肉品质的影响,为深入研究AMPK活性与宰后肌肉糖酵解、肌肉内环境及品质的关系,进而实现调控宰后肌肉品质提供一定的理论参考。
1 材料与方法
1.1 材料与试剂
选取甘肃省张掖地区(海拔1 400 m左右)同一牧场、生长发育正常、健康无病、公母各半、体质量相近(公牛(600±50)kg、母牛(450±60)kg)、年龄2~4 岁的西杂牛(西门塔尔公牛×本地黄牛)10 头,宰前禁食16~18 h,禁水2 h,屠宰放血后立即取牛胴体中部背最长肌肉样备用。
AICAR、RNAiso Plus、Prime ScriptTMRT reagent Kit with g DNA Eraser(Perfect Real Time)、SYBR Premix ExTaqTMII、pMD®19-TVector Kit 大连宝生物工程有限公司;牛磷酸化腺苷酸活化蛋白激酶(P-AMPK)ELISA试剂盒、己糖激酶、乳酸、糖原游离葡萄糖、能量因子含量测定试剂盒 南京建成生物工程研究所。
1.2 仪器与设备
Avanti J-E型台式冷冻离心机 美国Beckman Coulter公司;CFX96TM实时定量聚合酶链式反应(polymerase chain reaction,PCR)仪、凝胶成像系统 美国Bio-Rad公司;PCR扩增仪 北京赛默飞科技有限公司;JSM-5600LV低真空扫描电子显微镜仪 英国牛津仪器公司。
1.3 方法
1.3.1 样品采集和制备
以上述背最长肌为试材,去除表面脂肪及结缔组织后,分割为每块约250 g的肉样,按照肉液比10∶1(m/V)将0.50 mol/L AICAR溶液均匀注射进肉块中,以不作任何处理的肉样为对照组,采用托盘包装,随后立即取约40 g肉样分装并投入液氮中作为0 h肉样,剩余肉样置于0~4 ℃下成熟。
在成熟时间点分别测定pH值、肉色及蒸煮损失等指标,对于肌原纤维小片化指数(myofibrillar fragmentation index,MFI)、AMPK活性等不便立即测定的指标,将肉样用铝箔纸包裹,置于-80 ℃冻藏待测。
刺杀放血后立即取背最长肌切成约100 mg的肉块,立即放入灭酶灭菌冻存管中,置于液氮中速冻后于-80 ℃冻藏,用于AMPKα基因表达量及P-AMPK免疫沉淀的测定。
1.3.2 实时荧光定量PCR实验
1.3.2.1 引物序列来源及合成
参照田万强[11]的设计方法。以β-actin为内参基因,参照GenBank收录的β-actin、PRKAA1、PRKAA2基因的mRNA序列,运用Primer 5.0软件和Oligo软件设计特异性引物,由上海生工生物技术有限公司合成(表1)。

表1 用于实时荧光定量PCR的引物序列及PCR参数Table 1 Primer sequences and parameters used for quantitative real-time PCR
1.3.2.2 总RNA的提取
依据RNAiso Plus的实验指导使用说明书提取肌肉总RNA[12]。用超微量紫外-可见分光光度计测定总RNA的浓度和纯度,用质量分数1%琼脂糖凝胶电泳检测RNA的完整性。将质量较高的RNA立即反转录成cDNA储存于-20 ℃或直接于-80 ℃保存备用。
1.3.2.3 反转录及实时荧光定量PCR扩增
总RNA采用Prime ScriptTMRT reagent Kit with g DNA Eraser(Perfect Real Time)试剂盒提取。采用SYBR Premix ExTaqTMII,pMD®19-TVector Kit试剂盒进行PCR扩增,每个样本分别用待检测基因和内参基因引物扩增,每个反应做3 个重复[13]。其中95 ℃预变性2 min;94 ℃变性20 s,60 ℃退火20 s, 72 ℃延伸30 s,40 次循环。
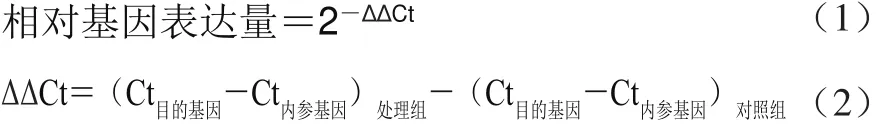
1.3.2.4 相对基因表达量的计算
采用2-∆∆Ct计算法对实时荧光定量PCR数据进行处理分析,计算方法如式(1)、(2)[14]所示。
1.3.3 蛋白免疫印迹
取肉样100 mg,按1∶10(m/V)加入预冷的匀浆缓冲液,冰浴匀浆。将匀浆液倒入1.5 mL EP管中,静置10 min。4 ℃、12 000 r/min离心10 min,取上清液,分装后存于-80 ℃保存待测。将1 mg/mL牛血清白蛋白标准蛋白分别配制为0、10、20、40、60、80、100 μg/mL,加入5 mL Bradford工作液,混匀后静置5 min,根据蛋白质量浓度确定上样体积。电泳结束后,将凝胶上的蛋白条带通过转移电泳方式转印至聚偏氟乙烯膜上(湿转),然后分别用非标记一抗及辣根过氧化物酶标记的二抗对其进行孵育、检测。显色及成像:按体积比1∶1混合增强化学发光(enhanced chemiluminescence,ECL)试剂盒中两种液体,将上述混合液均匀铺在聚偏氟乙烯膜表面,室温作用4 min。抖掉膜上液体,放入化学发光成像系统成像。
1.3.4 AMPK活性测定
参考Underwood等[15]的方法,取肉样约0.6 g,放入预冷的离心管中,按照1∶5(m/V)加入冷冻匀浆液,在3 000 r/min冰浴匀浆。然后4 ℃、12 000 r/min冷冻离心5 min,取上清液测定。具体步骤参照试剂盒说明书。
1.3.5 糖酵解指标的测定
用蒸馏水冲洗肉样表面血渍,并用滤纸吸干残留水分后将pH计的探头插入肉样,使pH计电极与肌肉充分接触,待读数稳定后记录,每个肉样随机选择3 个不同的部位重复测定3 次,取平均值。
肌糖原、乳酸、游离葡萄糖含量采用相应试剂盒进行测定,取2.0 g肉样,加入8 mL磷酸盐缓冲液(pH 7.4)匀浆后3 000 r/min离心20 min,收集上清液,之后进行加样、加酶、温育、洗涤、显色、终止等步骤,具体操作和结果计算参照各试剂盒的说明书进行。
1.3.6 能量代谢指标的测定
样品前处理方法如上述肌糖原测定步骤,参照ATP、ADP、AMP、IMP试剂盒说明书测定其含量,用双缩脲法测定样品的蛋白含量。
1.3.7 肉品质指标测定
1.3.7.1 肉色测定
使用TC-P2A全自动色差计,先将仪器预热30 min后用校正板校准。在肉样表面取3 个不同的点测定L*、a*和b*值,分别取其平均值。
1.3.7.2 蒸煮损失率测定
参考H o l m a n等[16]的方法。取体积不小于6 cm×3 cm×3 cm的肉样,去除表面脂肪,称质量(m1)后放入蒸煮袋中,置于80 ℃恒温水浴锅中加热,当肉样中心温度升至70 ℃时取出冷却至室温后称质量(m2),按公式(3)计算蒸煮损失率。
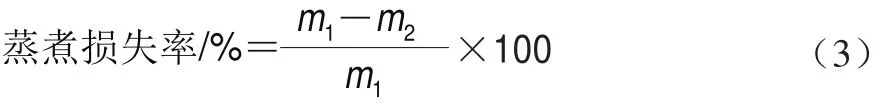
1.3.7.3 剪切力测定
将肉样沿肌纤维方向取3 个直径为1.27 cm肉柱,用C-LM4型嫩度仪垂直肌纤维方向剪切肉柱,并记录剪切力。
1.3.7.4 MFI测定
参考Wang Linlin等[17]的方法。取4.0 g肉样,加入40 mL MFI分离液(100 mmol/L KCl、20 mmol/L K3PO4、1 mmol/L乙二胺四乙酸、1 mmol/L CaCl2,pH 7.0),匀浆后4 500 r/min离心15 min,弃上清液,沉淀重复上述步骤,沉淀再用20 mL分离液溶解后用纱布过滤。将滤液的蛋白质量浓度稀释至0.5 mg/mL,立即在540 nm波长处测定其吸光度,MFI即所得吸光度乘以200。
1.3.7.5 扫描电子显微镜观察
将肉样切成0.5 cm×0.5 cm×0.3 cm的肉块,于体积分数2.5%戊二醛溶液中4 ℃固定3 d,然后用0.1 mol/L磷酸缓冲液(pH 7.3)清洗数次,然后用乙醇梯度脱水,抽真空干燥,喷金后于扫描电子显微镜观察微观结构,加速电压为20 kV,放大倍数为300。
1.3.8 数据处理与分析
每组实验重复3 次,采用Origin 9.0软件绘图,SPSS 19.0软件对数据进行单因素方差分析;采用Duncan’s法进行显著性分析和多重比较。
2 结果与分析
2.1 总RNA纯度检测
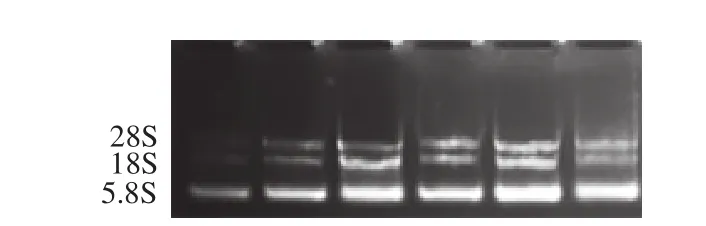
图1 肉样总RNA电泳结果Fig. 1 Electrophoresis of total RNA from meat samples
用超微量紫外-可见分光光度计检测提取的总样品RNA,OD260nm/OD280nm比值在1.8~2.0,经质量分数1%的琼脂糖凝胶检测,条带清晰,无条带弥散现象,表明提取的总RNA质量较好,可用于后期实验。
2.2 PRKAA1、PRKAA2 mRNA表达量分析结果
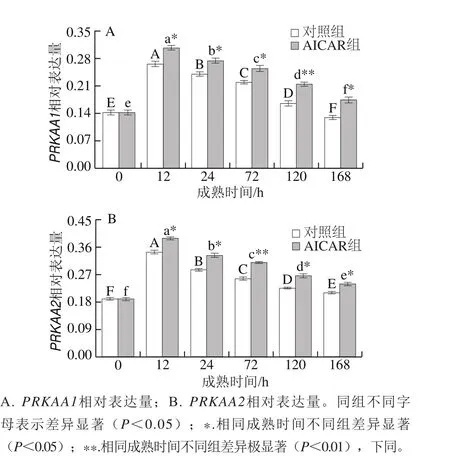
图2 PRKAA1、PRKAA2基因相对表达量Fig. 2 Relative expression levels of PRKAA1 and PRKAA2 genes
PRKAA1和PRKAA2是编码蛋白基因,能在骨骼肌细胞中表达。如图2所示,随成熟时间的延长,两组PRKAA1、PRKAA2相对表达量均呈先升后降的趋势,AICAR组显著高于对照组(P<0.05),表明AICAR提高了PRKAA1、PRKAA2表达量。Thaler等[18]研究的AICAR处理小鼠白肌纤维能够提高AMPKα2表达量(P<0.05),而AMPKα2能够磷酸化失活糖原合成酶,表明AMPK可调控肌细胞能量代谢,这与本实验结果一致;杨烨等[19]研究发现PRKAA1与快速酵解型肌纤维(IIB)表达呈显著负相关,肌肉中IIB占主导会加速糖酵解进程,导致pH值迅速下降,由此推测PRKAA1与宰后肌肉pH值也存在一定的相关性。
2.3 P-AMPK免疫印迹分析结果
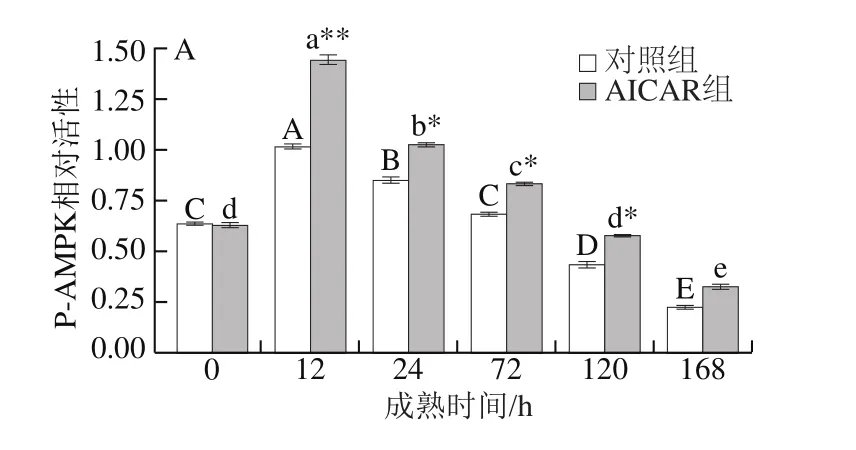
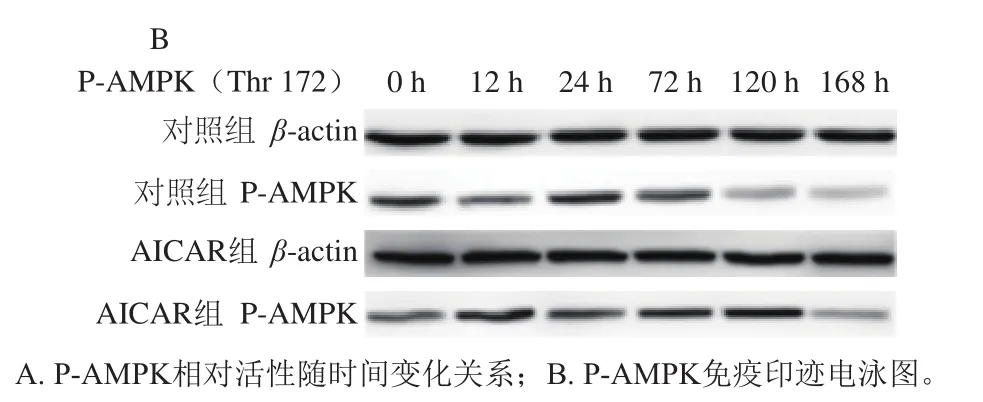
图3 宰后成熟过程中P-AMPK蛋白免疫结果Fig. 3 Western blot results of P-AMPK during postmortem aging
由图3可知,两组P-AMPK活性均呈先升后降的变化趋势,AICAR上调牛肉宰后成熟过程中P-AMPK活性(P<0.05),并在12 h检测到最高AMPK活性。成熟0~12 h过程中,对照组、AICAR组P-AMPK活性分别提高了38.2%、56.9%,表明AICAR提高了肌肉AMPK活性。
2.4 AMPK活力分析结果
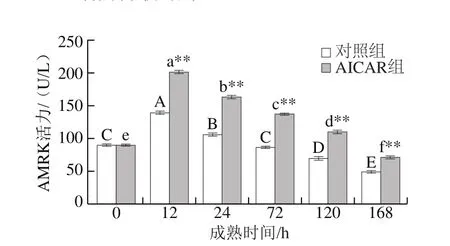
图4 宰后成熟过程中AMPK活力的变化Fig. 4 Change in AMPK activity during postmortem aging
AMPK可调节细胞能量代谢平衡,其活性高低可评判宰后糖酵解的速度和程度[20]。由图4可知,随成熟时间的延长,两组AMPK活力均呈先上升后下降的变化趋势,对照组AMPK活力极显著低于AICAR组(P<0.01)。当成熟至12 h时,对照组和AICAR组AMPK活力分别为138.19、200.69 U/L,与对照组相比,AICAR组AMPK活力提高了45.23%。成熟至168 h时,对照组和AICAR组AMPK活力分别为48.38、70.23 U/L,与对照组相比,AICAR组AMPK活力提高了45.16%,表明随成熟时间延长AICAR的激活作用逐渐下降。
2.5 肌肉糖酵解水平分析结果
pH值是评价肉质的重要指标,宰后肌肉pH值下降速度和程度影响肌肉蛋白特性进而对肉质具有重要影响[21]。袁倩等[22]研究表明AMPK活性与不同极限pH值牛肉的产生密切相关。由表2可知,随成熟时间的延长,两组pH值均呈先降后缓慢上升的趋势,成熟至72 h,对照组及AICAR组pH值均下降至最低值5.58、5.45,与对照组相比,AICAR组pH值降低了0.13,pH值下降速度较对照组快,表明AICAR加快了糖酵解进程,缩短了宰后牛肉成熟时间,这与Warriss等[23]报道的AMPK活化可促进糖酵解,进而影响肌肉pH值一致,说明AMPK活性变化能调节肌肉pH值。
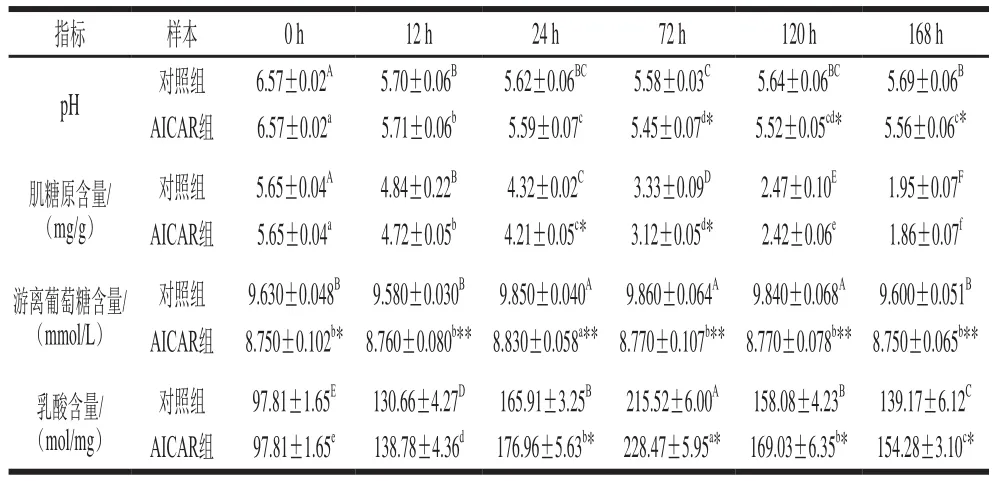
表2 宰后牛肉成熟过程中糖酵解指标变化Table 2 Changes in glycolysis indexes during postmortem aging
为进一步验证AMPK对宰后糖酵解的影响,对肌糖原、游离葡萄糖和乳酸含量进行测定。由表2可知,随成熟时间的延长,两组肌糖原含量均呈下降趋势,宰后24~72 h,AICAR组肌糖原含量显著低于对照组,120~168 h,AICAR组肌糖原含量低于对照组,但差异不显著,这与Kurth-Kraczek等[24]研究证实的激活AMPK可促进骨骼肌糖酵解、加速糖原分解基本一致;同时,宰后成熟期间两组游离葡萄糖水平差异不显著,乳酸含量均呈先升后降的变化趋势,72 h时达到最大值,其中成熟24~168 h过程中AICAR组乳酸含量显著高于对照组(P<0.05)。
2.6 肌肉内环境能量指标分析结果
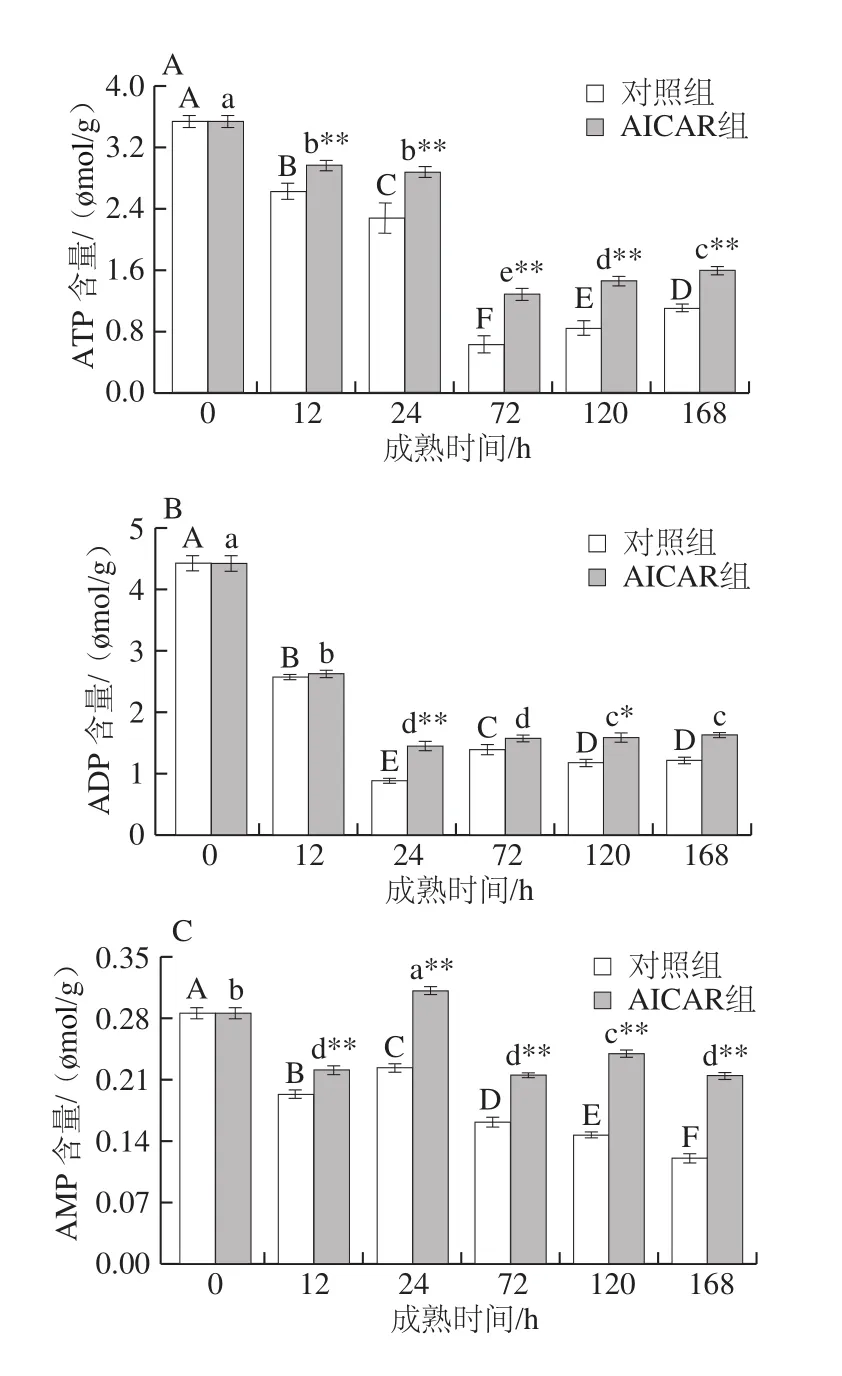
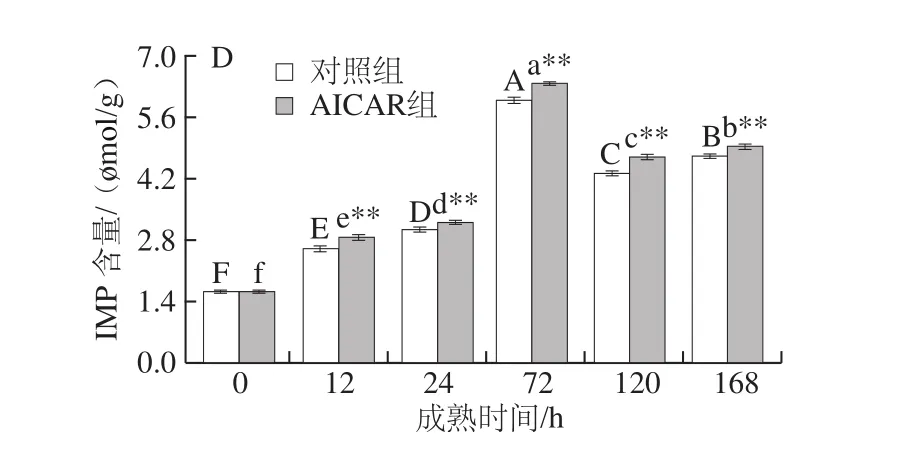
图5 宰后成熟过程中能量代谢相关指标的变化Fig. 5 Changes in energy metabolism-related indexes during postmortem aging
宰后成熟期间,ATP消耗增多,而其生成量减少,肌肉缺少能量供应,开始失控瓦解,解僵开始[25]。当ATP耗尽时,ADP会进一步释放能量,产生AMP。由图5A可知,随成熟时间的延长,对照组和AICAR组ATP含量呈先下降后缓慢上升的变化趋势,在宰后72 h分别达到最小值0.62、1.27 μmol/g,AICAR组比对照组高0.65 μmol/g,成熟72~168 h过程中ATP含量缓慢上升,可能是因为成熟后期ATP含量减少,AMPK促进葡萄糖转运再生成ATP,以维持能量平衡;由图5B可知,对照组和AICAR组ADP含量随成熟时间的延长呈下降趋势,在宰后24 h分别达到最小值0.88、1.45 μmol/g,与对照组相比AICAR组增加了0.57 μmol/g;由图5C可知,两组AMP含量总体先升后降,且AICAR组AMP含量极显著高于对照组(P<0.01),表明AMPK活性升高对肌肉能量状态有重要影响,这与贾青等[26]研究的成熟时间对牦牛肌细胞内能量因子变化的影响结果基本一致;IMP是ATP降解的中间产物,其含量增加有助于肉品风味的改善,由图5D可知,两组IMP含量呈先升后降趋势,其中AICAR组IMP含量极显著高于对照组,成熟后期IMP含量下降可能是因为此时酸性磷酸酶活化降解IMP,这与Shi Ce等[27]得到的鲢鱼宰后IMP含量变化趋势基本一致。
2.7 AICAR对西杂牛肉品质的影响
2.7.1 肉色的变化

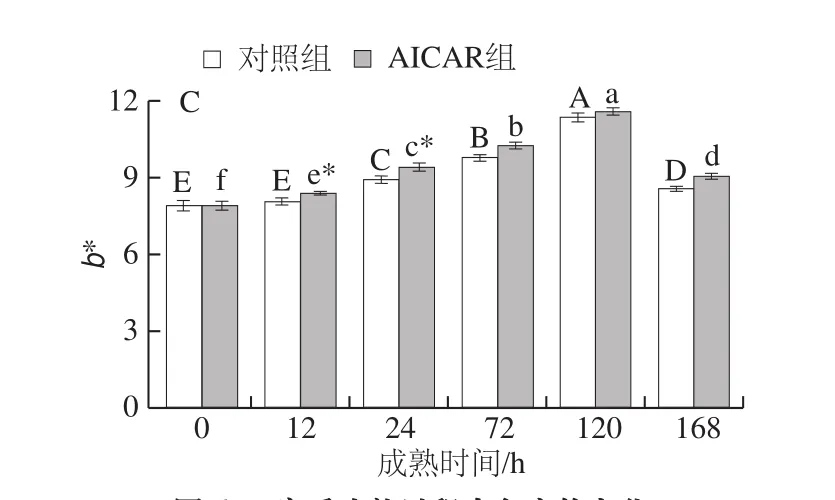
图6 宰后成熟过程中色度的变化Fig. 6 Changes in beef color during postmortem aging
肉色是评定牛肉品质的重要指标,与肌红蛋白含量和水分有很大关系[28]。由图6可知,随成熟时间的延长,两组L*值、a*值、b*值均呈先升后降的变化趋势。由图6A可知,两组L*值均在72 h达到最大值,随后逐渐下降,其中成熟24~72 h过程中,AICAR组L*值均显著高于对照组;由图6B可知,对照组和AICAR组a*值在24 h分别达到最大值22.69、20.28,AICAR组a*值除168 h外,均显著低于对照组(P<0.05),成熟后期a*值下降可能是因为肌肉中氧合肌红蛋白(oxymyoglobin,OMb)含量逐渐降低所致,这与陈景宜等[29]指出的不同部位宰后牛肉成熟期间a*值变化趋势基本一致;由图6C可知,两组b*值在120 h达到最大值之后显著下降,其中12~24 h,AICAR组b*值均显著高于对照组,这与王玮等[30]研究的猪背最长肌b*值于72 h后呈下降趋势的结果不完全一致,这可能与研究的样本及宰后成熟时间的不同有关。
2.7.2 蒸煮损失率的变化
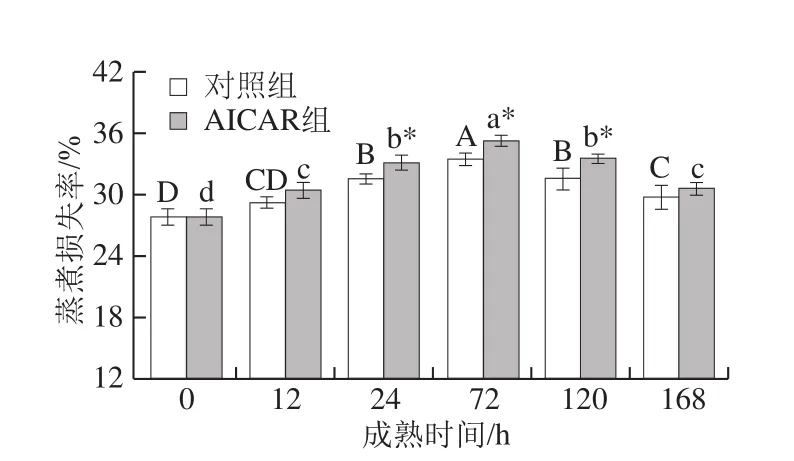
图7 宰后成熟过程中蒸煮损失的变化Fig. 7 Changes in cooking loss during postmortem aging
保水性是影响牛肉品质的关键因素,较少的蒸煮损失能一定程度上表征牛肉良好的保水性。由图7可知,两组蒸煮损失率均呈先升后降的变化趋势,宰后72 h达到最大值,这是因为此时肌肉pH值接近蛋白质的等电点,蛋白分子间斥力减少,肌肉内部空间变小,保水性降低[31]。24~120 h,AICAR组蒸煮损失率显著高于对照组(P<0.05);168 h时,两组蒸煮损失率无显著性差异(P>0.05)。
2.7.3 剪切力的变化
剪切力能够反映宰后肌肉嫩度,其值越低表示肉的嫩度越好。由图8可知,两组剪切力均呈先升后降的变化趋势,72 h后牛肉剪切力显著降低,这可能是因为宰后肌肉达到最大僵直后,肌纤维被肌肉内源酶破坏,肌肉嫩度增大所致。
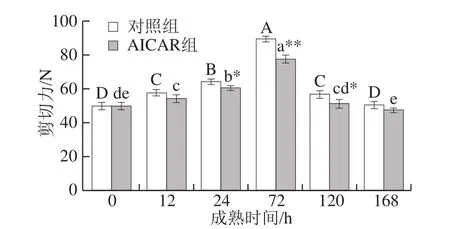
图8 宰后成熟过程中剪切力的变化Fig. 8 Changes in shear force during postmortem aging
2.7.4 MFI的变化
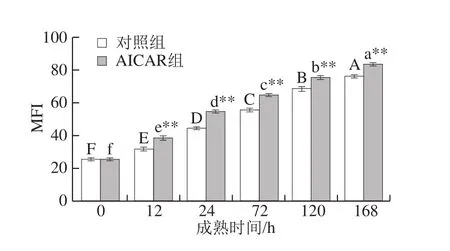
图9 宰后成熟过程中MFI的变化Fig. 9 Changes in MFI during postmortem aging
由图9可知,随成熟时间的延长,两组MFI均呈逐渐上升的趋势(P<0.05),表明肌原纤维蛋白降解程度越来越高,肌原纤维结构破坏越严重,肉的嫩度越好。成熟至12 h时,对照组与AICAR组MFI分别为31.84、38.73,AICAR组MFI值提高了21.64%,成熟至72 h,对照组与AICAR组MFI分别为55.67、64.74,AICAR组MFI值提高了14.01%。除0 h外,AICAR组的MFI均极显著高于对照组(P<0.01),可见,AICAR能够加速宰后肌肉成熟速度并提高肌肉嫩度。
2.7.5 肌肉微观结构变化

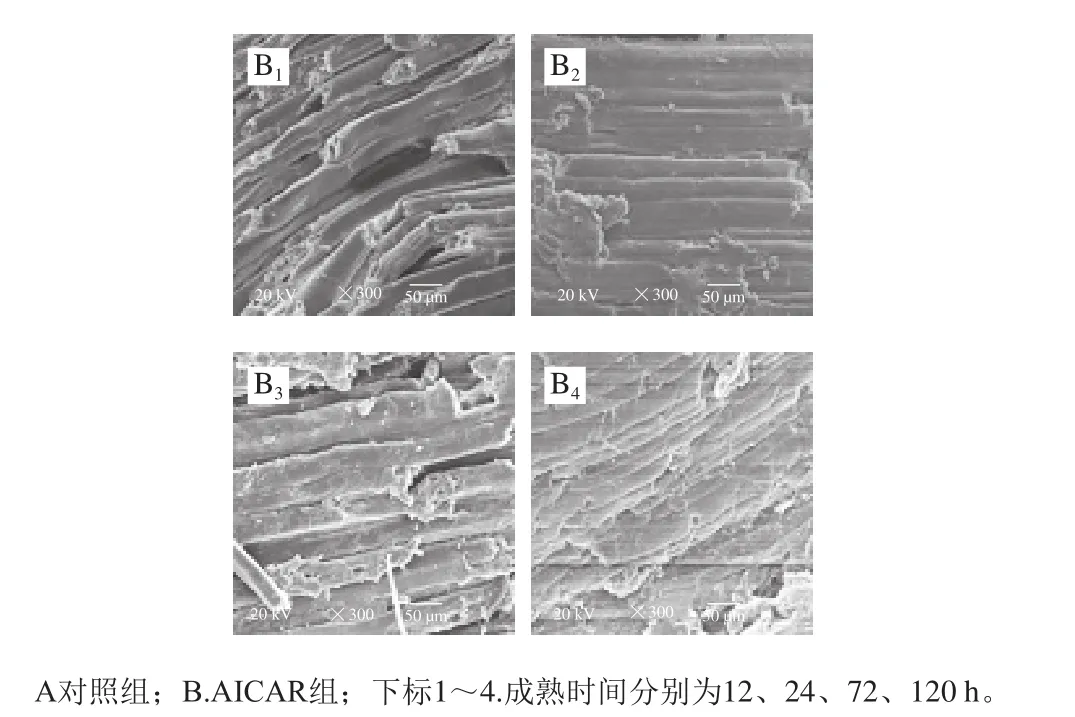
图10 宰后成熟过程中肌原纤维微观结构的变化Fig. 10 Changes in microstructure of myofibrils during postmortem aging
从图10可看出,宰后成熟期间两组肌纤维结构均发生明显变化。成熟至24 h,对照组肌纤维结构完整清晰、连接紧密、排列有序,随成熟时间的延长,肌纤维结构被破坏,宰后120 h,肌纤维大面积溶解断裂,出现大量肌原纤维小片;宰后12~120 h,AICAR组肌纤维结构破坏程度大于对照组,表明AICAR能够通过提高AMPK活性,提高肌纤维结构的破坏程度,进而加快宰后肌肉成熟进程。
3 结 论
AICAR能够提高宰后成熟过程中肌肉AMPK活性和AMPKα基因及P-AMPK表达量,显著加快肌糖原降解、pH值下降和乳酸积累的速率(P<0.05),加快宰后肌肉糖酵解进程,同时AICAR组L*值、b*值、MFI和蒸煮损失高于对照组,剪切力显著低于对照组(P<0.05),通过对AMPK活性的调控,得到AMPK调节肉质的可能机理是,AMPK活化后改变肌肉糖原含量、乳酸积累量、pH值、肌肉内环境及微观结构,使糖酵解的程度和速度发生改变,影响宰后肌肉的成熟进程,牛肉较早进入僵直完成成熟;因此AMPK及其级联效应是改善肉品品质的重要靶点,未来可通过调控AMPK活力以改善肉品品质。
