果寡糖对斜带石斑鱼免疫功能和肠道形态的影响
2019-09-18胡凌豪杨红玲叶继丹鲁康乐孙云章
胡凌豪,杨红玲,2,赵 芸,叶继丹,2,鲁康乐,2,孙云章,2,3
( 1.集美大学 水产学院,厦门市饲料检测与安全评价重点实验室,福建 厦门 361021;2.集美大学 水产学院,农业农村部东海海水健康养殖重点实验室,福建 厦门 361021;3.集美大学 水产学院,鳗鲡现代产业技术教育部工程研究中心,福建 厦门 361021 )

果寡糖又称低聚果糖,是一种由果糖单体在蔗糖上以β-1,2糖苷键连接而成的碳水化合物[3]。果寡糖能顺利通过胃和小肠而不被降解,同时能被乳酸菌、芽孢杆菌(Bacillus)等有益菌利用,从而使得有益菌得到养分后增殖,改善肠道微生态系统[4]。此外,果寡糖吸湿性低,防霉性能好,还能减少饲料发霉、变质,延长饲料贮存期[5]。果寡糖的效果已经在多种鱼类养殖中得以证实,如大菱鲆(Scophthalmusmaximus)[6]、龟壳攀鲈(Aanabastestudineus)[7]、团头鲂(Megalobramaamblycephala)[8]、黑尾重牙鲷(Diplodussargus)[9]、舌齿鲈(Dicentrarchuslabrax)[10]。本实验室前期探讨了饲料中添加果寡糖对斜带石斑鱼生长性能和消化酶活性的影响[11],发现0.05%~0.20%果寡糖能提高斜带石斑鱼的生长性能和肠道消化酶活性,笔者将进一步探讨果寡糖对斜带石斑鱼免疫功能和肠道形态的影响,以期为斜带石斑鱼养殖提供科学依据。
1 材料与方法
1.1 试验材料
果寡糖:购自江苏易实生物科技有限公司,纯度>90%。
1.2 饲料配制
试验饲料为4组等氮等能饲料,以秘鲁鱼粉、豆粕和虾粉作为蛋白源,鱼油和豆油作为脂肪源,面粉为糖源。试验分4个组:基础饲料组(对照组),及3个分别在基础饲料中添加质量分数为0.05%、0.10%以及0.20%果寡糖的试验组。基础饲料配方见表1。
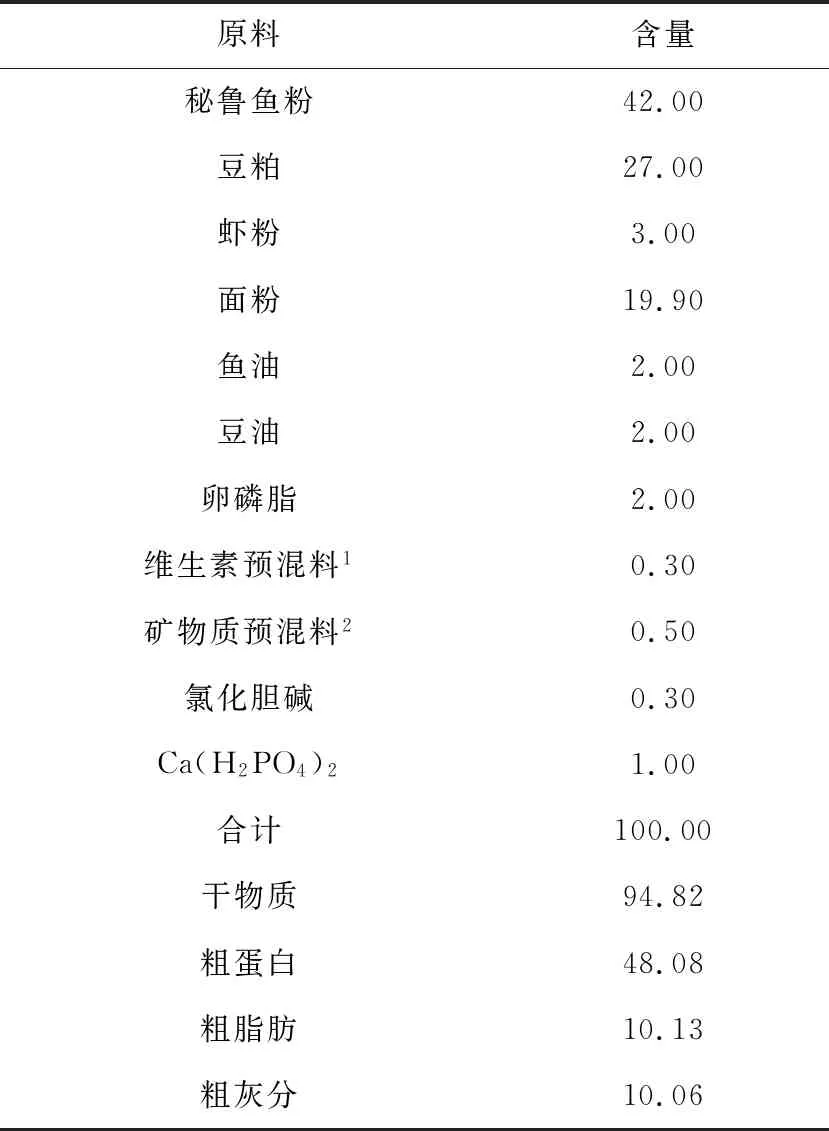
表1 基础饲料配方及营养组成 %
注:维生素预混料1和矿物质预混料2均由厦门嘉康饲料有限公司提供.
饲料原料用锤式粉碎机粉碎后过60目分析筛,添加的微量成分采用逐级扩大法混匀,混匀后加入35%~45%的水,然后用多功能催化剂成形机(双螺杆制粒机)制成半径为2.5 mm的软颗粒饲料,于室温下风干12 h后用自封袋分装,置于-20 ℃保存备用。投喂前提前从冰箱中拿出,室温下放置0.5 h。
1.3 试验鱼与饲养管理
400尾健康斜带石斑鱼幼鱼在集美大学水产试验场暂养10 d,暂养期间从商业料过渡到基础饲料,每日投喂2次。暂养结束后,选取300尾健康斜带石斑鱼幼鱼随机分为4组(对照组、0.05%试验组、0.10%试验组、0.20%试验组),每组3个平行,以每缸25尾随机投入到12个75 cm×45 cm×50 cm的玻璃水族缸中,每3个水族缸为1个试验组,每个缸按组别投喂试验饲料,饲养周期56 d。饲养期间,采用定时定量定点的原则投喂饲料,每日分别于8:30和17:30按照鱼体质量的1.5%投喂饲料(日投喂量为鱼体质量的3%),投喂前先用虹吸管吸走粪便和污物,投喂30 min后再吸掉残饵,烘干称量质量。养殖水体为一级砂滤海水,pH 8.0±0.3,盐度24~30,水温25~29 ℃。试验期间水体24 h连续充气,保证溶解氧>5 mg/L,每日换水量为40%~50%,3 d清洗1次过滤棉。
1.4 血清免疫指标的测定
养殖试验结束后,将试验鱼饥饿24 h,以丁香酚麻醉,用纱布包裹鱼体并拭干表面水分,用1 mL注射器在尾静脉取血,采集的血液置于4 ℃冰箱内静置,12 h后,4 ℃、3500 r/min离心10 min,收集其血清,将血清分装到5个1.5 mL离心管,再置于-80 ℃超低温冰箱内,用于溶菌酶、酸性磷酸酶、碱性磷酸酶、超氧化物歧化酶活性的测定,测定方法依据南京建成试剂盒说明书进行。
1.5 肠道形态指标的测定
采样前禁食24 h,分别于28 d和56 d自每个缸中随机捞取2尾鱼(每组6尾),用40 mg/L丁香酚麻醉,将鱼解剖取出肠道,用灭菌0.9% NaCl溶液将肠道冲洗干净,取约2 cm的前肠置于波恩氏液中固定12 h以上。制作切片前将其取出,按制作石蜡切片的常规法操作,乙醇逐级脱水→二甲苯透明→石蜡包埋→切片(横切,厚度为6 μm,连续切4~6个完整横切面)→苏木精—伊红染色→中性树脂封片,用光学显微镜(奥林巴斯BX80-JPA)观察并拍照,每张切片图片随机选1/4面积的绒毛,用Image-Pro Plus 6.0软件进行测量,计算肠绒毛高度、肠绒毛宽度及肌层厚度。
1.6 数据统计与分析
试验数据采用SPSS 22.0数据软件进行统计学分析,使用单因素方差分析法,Duncan法进行多重比较,数据用平均值±标准差表示,P<0.05时表示差异显著。
2 结果与分析
2.1 果寡糖对斜带石斑鱼血清免疫指标的影响
试验28 d时,0.10%试验组和0.20%试验组血清超氧化物歧化酶活性均显著高于对照组(P<0.05),试验56 d时,试验组血清超氧化物歧化酶活性均高于对照组,其中0.20%试验组超氧化物歧化酶活性显著高于对照组(P<0.05)(表2)。28 d时试验组溶菌酶活性均显著高于对照组,56 d时试验组溶菌酶活性均高于对照组,其中0.05%试验组和0.10%试验组溶菌酶活性显著高于对照组(P<0.05)。试验28 d时,各试验组血清酸性磷酸酶活性均显著高于对照组,试验56 d时,各试验组酸性磷酸酶活性均高于对照组,其中0.20%试验组酸性磷酸酶活性显著高于对照组(P<0.05)。28 d时,试验组碱性磷酸酶活性均高于对照组但差异不显著,56 d时0.05%试验组和0.20%试验组碱性磷酸酶活性高于对照组但差异不显著。
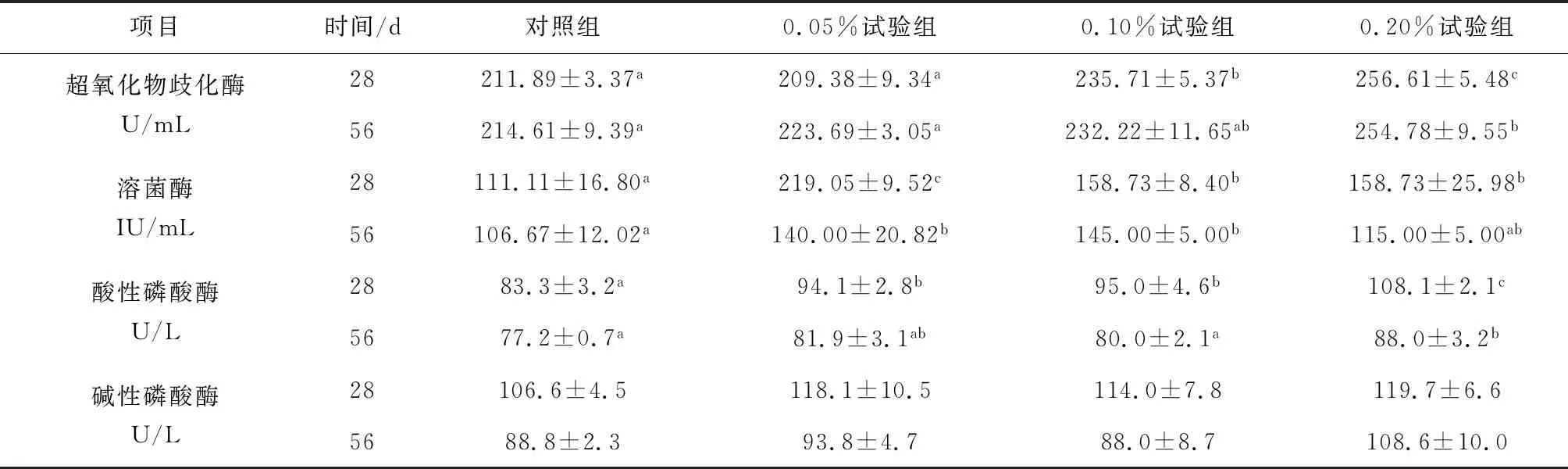
表2 果寡糖对斜带石斑鱼血清免疫指标的影响
注:数据上标字母不同表示有显著性差异(P<0.05).
2.2 果寡糖对斜带石斑鱼肠道形态的影响
各组石斑鱼肠道形态较为完整,绒毛整齐致密(图1、图2)。各试验组与对照组相比,绒毛高度与宽度均明显升高,肌层厚度也有所增加。
试验28 d和56 d时,试验组斜带石斑鱼肠绒毛高度均高于对照组,其中28 d时0.05%试验组和0.20%试验组绒毛高度显著高于对照组,56 d时0.05%试验组和0.10%试验组显著高于对照组(P<0.05)(表3)。试验28 d和56 d时,试验组斜带石斑鱼肠绒毛宽度均显著高于对照组(P<0.05),28 d时,0.05%试验组显著高于其他试验组(P<0.05)。试验28 d和56 d时,0.10%试验组肠道肌层厚度显著高于对照组(P<0.05),其余各组与对照组差异不显著。
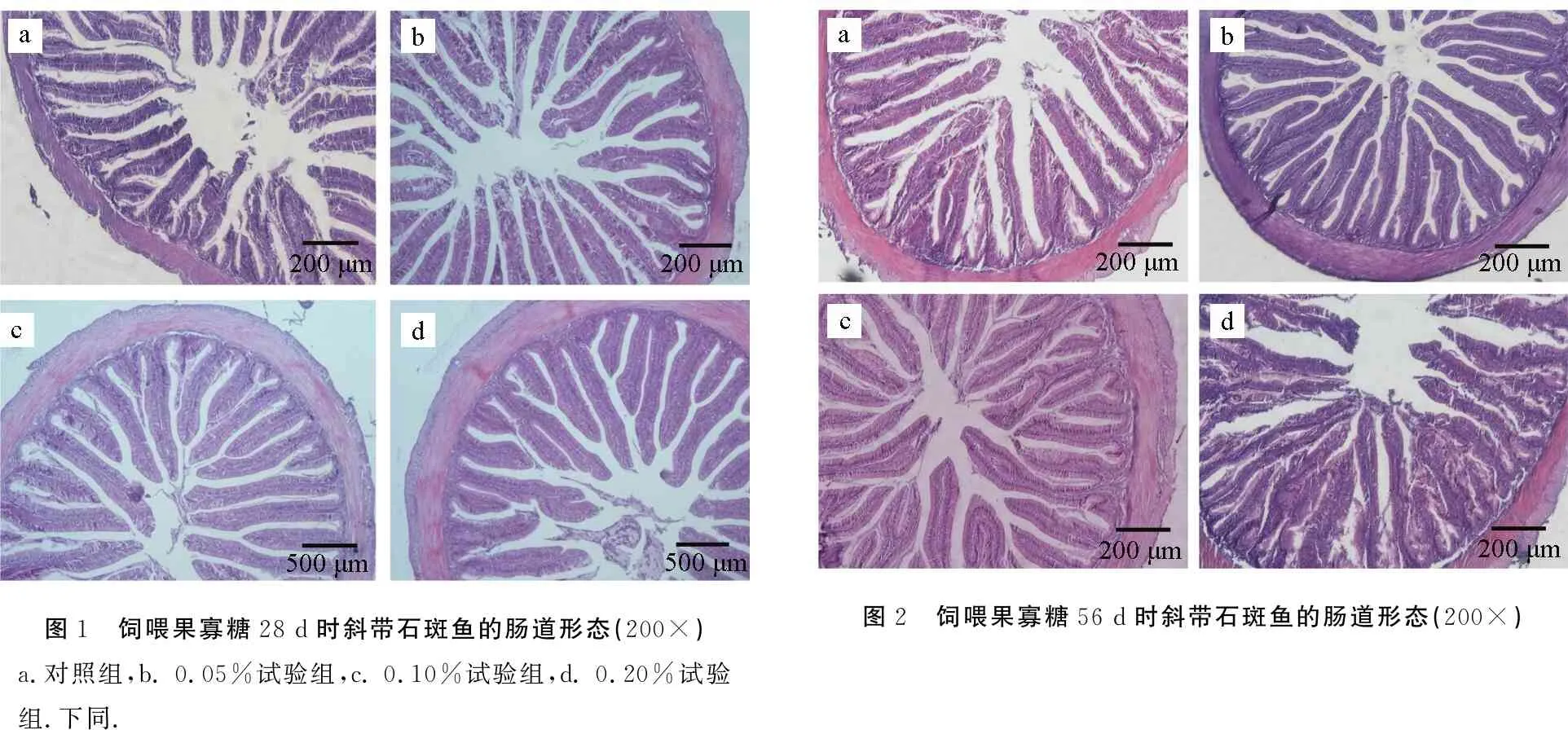
图1 饲喂果寡糖28d时斜带石斑鱼的肠道形态(200×)a.对照组,b.0.05%试验组,c.0.10%试验组,d.0.20%试验组.下同.图2 饲喂果寡糖56d时斜带石斑鱼的肠道形态(200×)
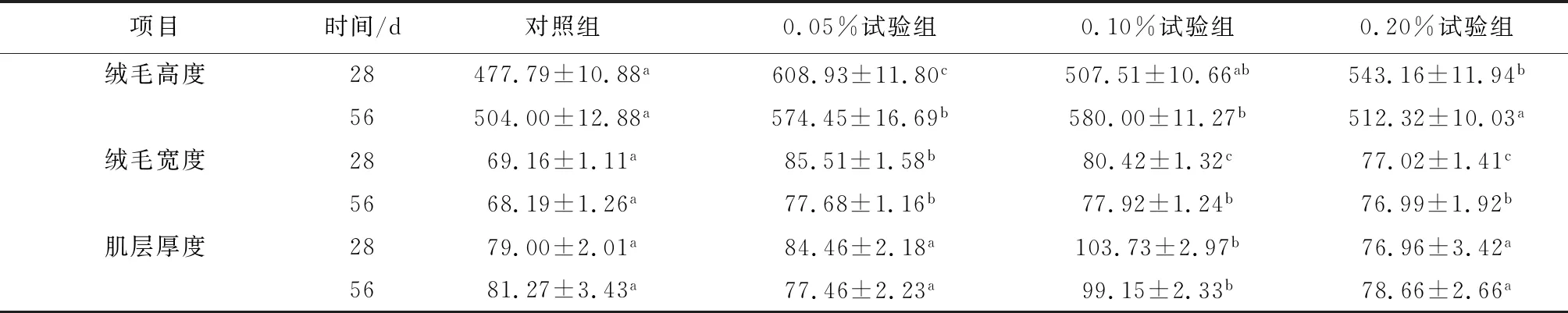
表3 果寡糖对斜带石斑鱼肠道形态的影响 μm
注:数据上标字母不同表示数据间差异显著(P<0.05).
3 讨 论
3.1 果寡糖对斜带石斑鱼免疫功能的影响
动物免疫系统包括特异性免疫与非特异性免疫,当机体受到病原体入侵时,非特异性免疫系统首先发挥功能[12]。由于特异性免疫系统的局限性,鱼类主要依赖非特异性免疫来对抗病原侵袭[13]。酸性磷酸酶作为一种机体功能调节酶,可催化磷酸基团的转移反应以及磷酸单脂的水解反应,是免疫功能以及健康机体状态的重要指标[14-15]。溶菌酶在非特异性免疫的防御机制中发挥着重要作用,主要作用于革兰氏阳性菌,通过溶解细菌细胞壁的黏多糖发挥免疫作用[16]。超氧化物歧化酶是鱼体内关键的抗氧化酶,防止体内多余自由基对机体的伤害,与免疫水平密切相关[17]。
Zhang等[18]将0.4%和0.8%的果寡糖添加到基础饲料中投喂团头鲂28 d,试验组血浆酸性磷酸酶活性显著性高于对照组,且0.4%试验组显著高于0.8%试验组;试验组超氧化物歧化酶活性均高于对照组,但只有0.4%试验组显著高于对照组。本试验中,投喂果寡糖相同时间(28 d)内,0.10%和0.20%果寡糖组的超氧化物歧化酶活性显著高于对照组,添加量为0~0.20%时,超氧化物歧化酶活性随着添加量增加而提高,这与Zhang等[18]报道的超氧化物歧化酶活性随添加量增加呈先升后降趋势有所不同。推测是由于在本试验中果寡糖的添加量相对较低(0.05%~0.20%)所致。Soleimani等[19]发现,在基础饲料中添加1%的果寡糖投喂拟鲤(Rutilusrutilus)28 d,试验组溶菌酶活性均得到提高,并且2%和3%试验组溶菌酶活性显著提高。本试验中,饲喂28 d时,试验组溶菌酶活性同样均高于对照组。卢明淼等[20]在基础饲料中添加含有0.5、2.0、4.0 g/kg的果寡糖,并将其投喂草鱼(Ctenopharyngodonidellus)8周,其中2.0 g/kg添加量的试验组溶菌酶活性显著高于对照组且达到峰值,且同一试验组28 d时溶菌酶活性均高于56 d。与该结果一致,本试验中同一试验组28 d时溶菌酶活性均高于56 d。Ai等[21]在基础饲料中添加0.2%和0.4%果寡糖饲喂大黄鱼(Pesudosciaenacrocea)10周,试验组酸性磷酸酶和溶菌酶活性均显著高于对照组,且酸性磷酸酶和溶菌酶在试验组间均无显著差异,该试验结果与本试验结果高度一致。然而,Guerreiro等[22]在15 ℃与20 ℃的水温中,在基础饲料中添加0.5%、1.0%、2.0%的果寡糖饲喂大菱鲆9周,发现试验组酸性磷酸酶、溶菌酶活性与对照组相比,差异不显著。研究表明,果寡糖对机体非特异性免疫的增强作用可能主要通过促进肠道乳酸菌等有益菌的增殖来实现的,而该水温(15 ℃与20 ℃)明显低于有益菌最适生长温度,因此果寡糖对于有益菌增殖和非特异性免疫功能的促进作用不明显[23-24]。与之相似,李富东等[25]发现,低温条件下(15~20 ℃)饲料中添加0.5%的果寡糖饲喂褐牙鲆(Paralichthysolivaceus)56 d,褐牙鲆血清中溶菌酶与对照组相比无显著差异。由上述研究可知,果寡糖对鱼类免疫功能有不同程度的促进作用,且受添加剂量、养殖水体温度等因素的影响。
3.2 果寡糖对斜带石斑鱼肠道形态的影响
肠道形态能直观地反映肠道健康,肠绒毛长度、肌层厚度与肠道的吸收能力直接相关[26]。肠黏膜结构的良好状态是养分消化吸收和动物正常生长的生理学基础,也有助于降低致病菌在肠道中的机会性感染[27]。Dimitroglou等[28]发现,在虹鳟(Oncorhynchusmykiss)幼鱼基础饲料中添加0.2%的甘露寡糖,鱼前肠和后肠区域的微绒毛长度均显著增加,且前肠微绒毛长度增加幅度高于后肠微绒毛长度。徐磊等[29]向饲料中分别添加60、120、240 mg/kg和480 mg/kg的甘露寡糖,发现肌层厚度与甘露寡糖添加量呈正相关。Abid等[30]在基础饲料中添加益生菌和果寡糖饲喂大西洋鲑(Salmosalar)63 d,发现前肠绒毛长度显著高于对照组,后肠绒毛长度高于对照组但不显著。吴阳等[8]发现,饲料中添加果寡糖能显著提升团头鲂的肠绒毛高度(P<0.05),其中0.4%果寡糖组达到峰值,但当果寡糖添加量超过0.4%时,微绒毛高度有所下降,但仍显著性高于对照组。刘爱君等[31]发现,饲料中添加甘露寡糖可以提高奥尼罗非鱼(Oreochromisniloticus×O.aureus)的肠绒毛高度、绒毛宽度以及绒毛密度,并在0.5%的添加量时达到峰值,而当添加量为0.75%时,绒毛高度、宽度和密度与0.5%添加量相比有所下降。本试验结果与吴阳等[8,31]的试验结果较为相似,果寡糖对斜带石斑鱼幼鱼肠道绒毛高度、宽度均有促进作用,且随着添加量的增加未呈现正相关的关系。由于果寡糖能特异性地被益生菌所利用,从而促进肠道微生物健康菌相的形成,而一些有害菌则会损害肠绒毛,因此,果寡糖对于肠绒毛的促进作用可能与肠道菌群结构调节有关[32-33]。
总之,饲料中添加0.05%~0.20%果寡糖能改善斜带石斑鱼的免疫功能和肠道形态,且饲料中添加0.05%果寡糖斜带石斑鱼的生长性能最佳[11]。因此,斜带石斑鱼饲料中果寡糖建议添加量为0.05%。
