杂交选育的优良猴头菌株发酵菌丝体多糖结构特征及体外免疫活性
2019-09-18宋甜甜张赫男李巧珍刘艳芳汪雯翰
宋甜甜,张赫男,吴 迪,李巧珍,刘艳芳,周 帅,汪雯翰,杨 焱*
(1上海师范大学生命科学学院,上海200234;2国家食用菌工程技术研究中心,农业部南方食用菌资源利用重点实验室,上海市农业科学院食用菌研究所,上海201403)
猴头菌[Hericium erinaceus(Bull.)Pers.]是我国珍贵的食药兼用菌[1],在中医药领域有着悠久历史[2],其多糖成分具有免疫调节[3]、抗炎、抗肿瘤、抗疲劳、抗氧化、提高机体耐缺氧能力、增加心肌血液输出量、降血糖、保肝护肝及治疗胃溃疡、胃炎的功效。猴头菌多糖作为猴头菌中的主要功效成分,其显著的免疫调节作用备受研究者和市场关注。猴头菌多糖可来源于子实体,也可来源于发酵菌丝体,液体发酵可以在较短的时间内获得大量的菌丝体及其发酵产物,生产周期短、产量高、成本低、工艺设备简单。深层发酵法还能够突破猴头菌生长的环境限制因素,提供充足的养料供生物活性物质积累,可持续满足市场对猴头菌及猴头菌多糖的需求[4]。优良的菌株是获得优质发酵菌丝体的前提,随着人们对食用菌营养价值和药用价值认识的提高,以及食用菌产业经济效益的增加,食用菌育种工作也成为研究热点。其中,杂交育种是食用菌新品种选育中使用最广泛、收效最明显的传统育种手段,杂交育种利用不同遗传类型之间的交配使遗传基因重新组合创造出兼有双亲优点的新品种[5]。本研究团队前期利用杂交育种技术选育获得了3株高产多糖的优势猴头菌株,其液体发酵生物量及菌丝体多糖含量较两亲本菌株提升率稳定,是进行猴头菌液体发酵培养的优良菌株。多糖含量提高的菌株在多糖的结构特征和活性方面有何变化值得深入研究。本试验拟对杂交选育获得的猴头菌高产多糖菌株液体发酵菌丝体胞内多糖的理化性质、基本结构特征及体外刺激巨噬细胞释放NO的活性进行系统研究,比较杂交菌株与出发菌株发酵菌丝体多糖的理化性质和活性差异,探究内在相关性,为猴头菌的育种及产品开发提供理论基础。
1 材料与方法
1.1 供试菌株
猴头菌亲本菌株0605和刺长,以及杂交育种选育出的高产多糖菌株15、91、611,均由上海市农业科学院食用菌研究所提供。
1.2 试剂与仪器设备
马铃薯葡萄糖肉汤(购自美国BD公司);酵母自溶粉(购自安琪酵母股份有限公司);葡萄糖、磷酸二氢钾、七水硫酸镁、无水乙醇(均购自国药集团化学试剂有限公司);葡聚糖标准品和单糖标准品为德国Sigma-Aldrich公司产品;DMEM培养基、RPMI1640培养基、胎牛血清、胰酶为美国Gibo公司产品;青霉素、链霉素为美国Amersco公司产品;细菌脂多糖(Lipopolysaccharide,LPS)为德国Sigma公司产品。RAW 264.7细胞株(小鼠巨噬细胞株)购自中国科学院细胞库ATCC(American Type Culture Collection)。
SA-1480-2型超净无菌工作台(上海上净净化设备有限公司);高压灭菌锅SS-325型(日本TOMY公司);酶标仪Biotek-Synergy HT型(美国Bio-Tek公司);ZWY-2102双层恒温培养振荡器(上海智城分析仪器制造有限公司);Centrifuge 5810R高速冷冻离心机(德国Eppendorff公司);Waters e2695高效液相系统(美国Waters公司);八角度激光光散射仪及粘度检测器(美国Wyatt公司);ICS2500离子色谱仪(美国Dionex公司)。
1.3 培养基
PDA培养基:取39 g PDA粉末溶于1 L蒸馏水中,pH自然。
种子培养基:马铃薯葡萄糖肉汤24 g,KH2PO42 g,MgSO4·7H2O 1 g,1 L蒸馏水,于灭菌锅中121℃灭菌35 min。
发酵培养基:葡萄糖20 g,酵母自溶粉10 g,KH2PO42 g,MgSO4·7H2O 1 g,1 L蒸馏水,于灭菌锅中121℃灭菌35 min。
1.4 猴头菌的液体发酵培养
种子培养:取两亲本菌株(0605、刺长)和杂交菌株(15、91、611)的平板菌块12块(每块大小0.5 cm×0.5 cm),分别接种于种子培养基中。在26℃、150 r·min-1条件下培养10 d,即得种子液。
发酵培养:将培养好的种子液以10%(V/V)的接种量接入发酵培养基中。在26℃、150 r·min-1条件下培养8 d,纱布过滤收集菌丝体,并用蒸馏水洗涤3次,冷冻干燥,得干燥菌丝体。
1.5 发酵菌丝体多糖含量测定
各猴头菌发酵菌丝体经粉碎过20 mm孔径筛,准确称取1.000 g,置于50 mL具塞离心管内。5 mL蒸馏水浸润样品,缓慢加入20 mL无水乙醇,使乙醇终体积分数(下同)为80%,悬紧盖子,涡旋振荡混匀,超声提取30 min。提取结束后,4 000 r·min-1离心10 min,弃上清液。用10 mL 80%的乙醇洗涤沉淀,离心。用蒸馏水将沉淀转移至圆底烧瓶,加入50 mL蒸馏水,装上磨口的空气冷凝管,于沸水浴中提取2 h。冷却至室温,过滤,将上清转移至100 mL容量瓶中,残渣洗涤2—3次,洗涤液转移至容量瓶中,加水定容。此溶液为样品的多糖含量(质量比)测定液,对其进行多糖含量测定。
1.6 猴头菌发酵菌丝体多糖组分的制备
分别准确称取各猴头菌液体发酵干燥菌丝体20.00 g,按料液比1∶20(W/V)加入蒸馏水,100℃提取2 h,取上清,提取2次,合并提取液,按料液比1∶3(W/V)浓缩。上清添加无水乙醇至终体积分数达到20%,4℃冰箱中静置12 h,10 000×g离心,沉淀用20%乙醇洗多次,醇洗时剧烈振荡,直到上清清澈无色。收集沉淀,加足够多蒸馏水并加热,保证沉淀充分溶解,90℃水浴挥醇2 h,直到无乙醇气味。抽滤除去不溶杂质后减压旋蒸浓缩样品,冷冻干燥,获得的多糖按猴头菌名称0605、刺长、15、91、611依次命名为H1P20、HCP20、H15P20、H91P20、H611P20;向20%醇沉后上清中加适量无水乙醇至终体积分数为60%,获得的多糖依次命名为H1P60、HCP60、H15P60、H91P60、H611P60,共制备得到10个多糖组份样品。
1.7 多糖相对分子质量分布测定
1.7.1 样品的制备和处理
制备流动相:0.05 mol·L-1的NaH2PO4和0.15 mol·L-1的0.02%(质量比)叠氮钠(pH 7.0)。分别准确称量多糖样品5 mg,用1 mL流动相溶解,配制成质量浓度为5 mg·mL-1的溶液。12 000×g离心20 min,上清液过0.22μm的水相微孔膜,使用HPSEC-MALLS-RI联用分析。色谱分析条件:色谱柱温用柱温箱恒定在35℃;分析柱选TSK PWXL6000和TSK PWXL3000凝胶色谱柱串联分析,流速为0.5 mL·min-1;激光检测器光源波长为623.8 nm。多糖在溶液中的折光指数增量(dn/dc)按照0.146 mL·g-1计算[6]。
1.7.2 数据处理
使用Astra(version 6.1.1,Wyatt Technology,Santa Barbara,CA)数据分析软件对光散射数据进行采集和分析,计算相对分子质量[7]。
1.8 单糖组成分析
采用高效阴离子交换色谱法测定不同菌株菌丝体分级醇沉多糖组分的单糖组成:取2 mg多糖样品于耐高温的V型反应瓶中,加入3 mL浓度为2 mol·L-1的三氟乙酸(TFA),110℃油浴加热,水解4 h,冷却至室温后,40℃下氮气吹干,然后加入3 mL甲醇,吹干,重复以上操作4—5次以完全除去TFA。用超纯水将反应瓶中的样品溶解并定容至100 mL,取1 mL溶液12 000×g离心15 min,取上清,测定水解产物中的单糖组成。
标准品:D-Gal、D-Glc、D-Ara、L-Fuc、L-Rha、D-Man、D-Xyl、D-Fru、Rib、D-GluA和D-GalA混标。
色谱条件:ICS2500离子色谱仪装备CarboPac TMPA-20阴离子交换柱(150 mm×3 mm i.d.),脉冲安倍检测器,进样量25μL,流速0.45 mL·min-1,柱温30℃,流动相为超纯水和0.25 mol·L-1的NaOH[8]。
1.9 红外光谱分析
取2 mg左右的样品与KBr粉末研磨混合均匀,压片后在400—4 000 cm-1范围内进行红外光谱分析[9]。
1.10 体外刺激巨噬细胞释放NO的活性试验
称取一定量透析过(相对分子质量3 500,透析3 d)的猴头菌多糖样品于灭过菌的Eppendoff离心管中,在无菌工作台上用PBS溶液配成5 mg·mL-1的样品母液,18 000×g离心30 min,将上清转入灭菌管中,用RPMI-1640培养基将样品分别稀释至50μg·mL-1、100μg·mL-1、200μg·mL-1、500μg·mL-1,参照乔艳茹等[10]的方法测定巨噬细胞RAW 264.7的NO产量。
2 结果与分析
2.1 杂交菌株和亲本菌株发酵菌丝生物量和多糖含量
如表1所示,杂交菌株15、91和611的液体发酵生物量较出发菌株0605均有明显的提升,提升率分别为17.28%、22.62%和29.23%;杂交菌株611较亲本菌株刺长生物量的提升率为11.48%;各杂交菌株发酵菌丝体多糖含量较出发菌株0605和刺长均有明显提升,其中杂交菌株15菌丝体多糖含量较出发菌株0605提升了111.62%,较刺长提升了107.98%。结果表明,经单核体杂交育种可筛选获得猴头菌液体发酵生物量和多糖含量高的优良菌株。

表1 各菌株生物量与菌丝体多糖含量Table 1 Biomass and polysaccharide content ofmycelium of each strain
2.2 杂交选育对猴头菌发酵菌丝体多糖相对分子质量分布的影响
如图1所示,杂交菌株15、91菌丝体20%醇沉多糖组分与亲本菌株的液相指纹图谱趋势较一致,洗脱时间为32—34 min时,H611P20多糖组分液相指纹图谱与亲本菌株刺长的HCP20多糖组分有明显差异,与亲本菌株0605的H1P20多糖组分的Peak1一致,但与Peak2有明显差异。各多糖组分的相对分子质量分布情况显示(表2、表3),杂交菌株H15P20和H611P20的Peak1相对分子质量较大,可达1×107左右,与亲本菌株H1P20多糖组分相对分子质量相似,而杂交菌株H91P20与亲本菌株刺长HCP20多糖组分相对分子质量接近。杂交菌株20%醇沉多糖组分的大相对分子质量组分Peak1占比在两亲本之间;而在60%醇沉多糖组分中,杂交菌株与亲本菌株糖组分之间无明显差异。结果表明,传统杂交育种获得的杂交后代菌株多糖相对分子质量分布可能与某一亲本菌株相近或介于两亲本菌株之间。
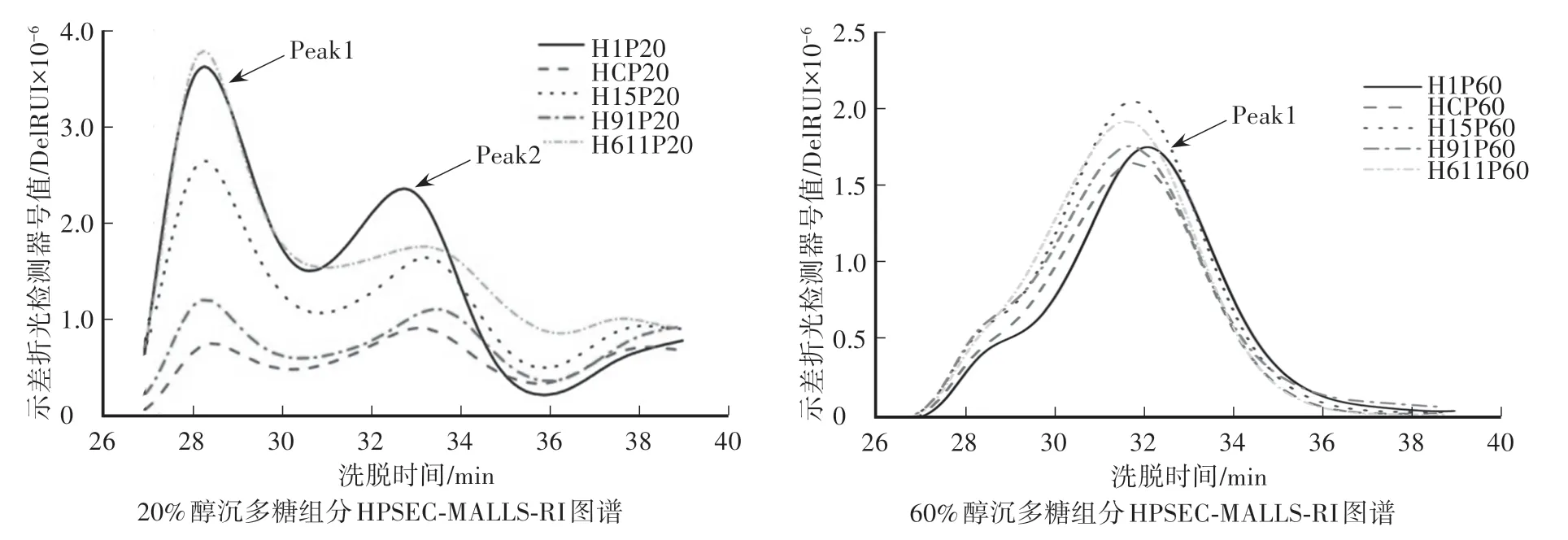
图1 猴头菌菌丝体20%、60%醇沉多糖组分HPSEC-MALLS-RI图谱Fig.1 HPSEC-MALLS-RI chromatogram s of 20%and 60%ethanol precipitated polysaccharides from Hericium erinaceus m ycelium
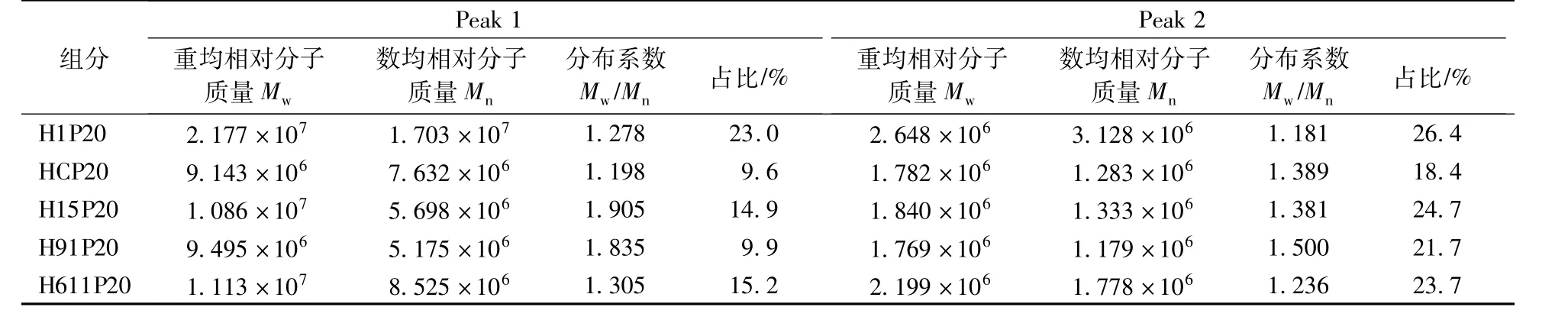
表2 亲本菌株和杂交菌株猴头菌20%醇沉多糖的相对分子质量分布范围Table 2 M olecular weight distribution of 20%ethanol precipitated polysaccharides from Hericium erinaceus mycelium of parent strains and hybrid strains

表3 亲本菌株和杂交菌株猴头菌60%醇沉多糖的相对分子质量分布范围Table 3 M olecular weight distribution of 60%ethanol precipitated polysaccharides from Hericium erinaceus mycelium of parent strains and hybrid strains
2.3 杂交育种对猴头菌发酵菌丝体多糖的单糖组成影响
由表4可见,猴头菌杂交菌株的发酵菌丝体多糖组分的单糖组成与亲本菌株基本一致,多糖组分中单糖的比例介于两亲本之间。20%醇沉多糖由半乳糖、葡萄糖和少量甘露糖构成,亲本菌株HCP20中的葡萄糖比例高于H1P20,杂交菌株多糖组分H15P20、H91P20、H611P20中葡萄糖的比列在两亲本之间;H15P20中半乳糖的比例较两亲本有所增加,H611P20中的单糖组成更接近亲本H1P20,半乳糖比例略下降,甘露糖比例略提高;60%醇沉多糖组分主要含有葡萄糖,杂交菌株H611P60相比两亲本多糖组分中的葡萄糖比例略下降,甘露糖比例提高。杂交菌株多糖组分H15P60、H91P60的葡萄糖、甘露糖比例较两亲本菌株多糖组分H1P60、HCP60均分别略降低和略提高。杂交菌株的60%醇沉糖组分的木糖比例较两亲本菌株均有提高。总体来看,杂交选育的高产多糖菌株发酵菌丝体多糖组分的单糖组成较亲本菌株变化不大。
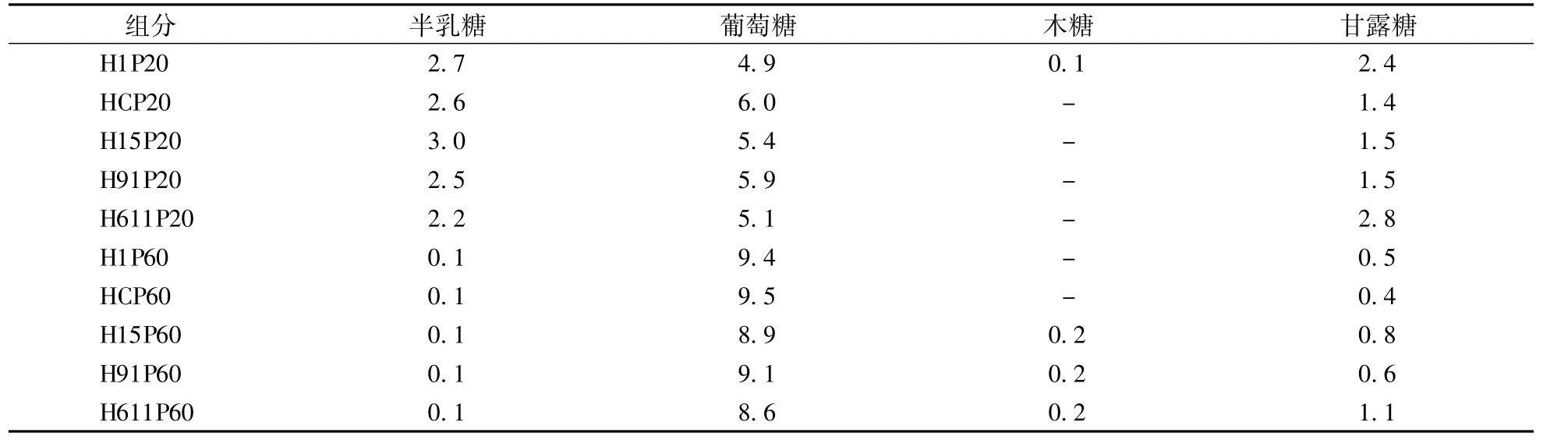
表4 各醇沉多糖组分的单糖组成Table 4 M onosaccharide com position of ethanol precipitated polysaccharides
2.4 红外光谱分析
由图2可见,猴头菌菌丝体20%、60%醇沉多糖组分在400—4 000 cm-1扫描范围具有多糖的典型吸收峰。H1P20、HCP20、H15P20、H91P20、H611P20在3 400 cm-1处宽拉伸强峰为糖环上羟基的振动吸收峰,在2 930 cm-1附近有强的—CH3、—CH2、—CH等C—H伸缩振动吸收峰,在1 657 cm-1附近为结合水引起的吸收峰或为的伸缩振动峰[11],3 400 cm-1、2 930 cm-1、1 657 cm-13处吸收峰是多糖化合物的特征吸收[12]。在红外光谱中1 041 cm-1和1 161 cm-1处有两个伸缩峰,说明该糖组分含有键[13];H1P60、HCP60、H15P60、H91P60、H611P60除了含有多糖化合物具有的特征吸收峰之外,在1 008—1 161 cm-1之间存在3个峰,这是由于吡喃环拉伸引起的,由此可以推断糖环中存在吡喃糖苷类型[8]。猴头菌菌丝体20%、60%醇沉多糖组分在1 740 cm-1处均无吸收峰,说明不含有醛酸。杂交菌株糖组分与亲本菌株0605相同糖组分的红外吸收光谱无明显差异,与亲本菌株刺长20%醇沉多糖组分在2 925 cm-1、1 041 cm-1处的吸收值有细微差异。红外光谱结果说明,杂交育种方式没有引起猴头菌多糖基本结构明显变化。
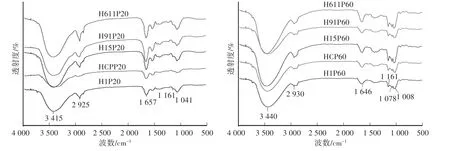
图2 猴头菌20%、60%醇沉多糖组分的红外光谱图Fig.2 FTIR spectrum of 20%and 60%ethanol precipitated polysaccharides from m ycelia of Hericium erinaceus
2.5 体外刺激巨噬细胞释放NO的活性试验
如图3所示,20%醇沉多糖组分体外免疫活性随着浓度的增大呈现逐渐升高的趋势,其中杂交菌株H15P20的活性显著高于其他菌株20%醇沉多糖组分,且呈显著的浓度依赖性,与阳性对照组相比有明显优势。60%醇沉组分中H1P60、H2P60、H91P60、H611P60体外刺激RAW 264.7巨噬细胞释放NO的量较高,且较低浓度就显示出了较明显的刺激巨噬细胞的活性;而H15P60免疫活性相对较低。这也说明杂交菌株15菌丝体的活性多糖组分在大相对分子质量部分;而杂交菌株91和611菌丝体的活性多糖组分在中小相对分子质量部分。结合表5中各糖组分糖含量数据可知,H15P20免疫活性较高可能与其菌丝体多糖含量较高有关,同时与H15P20中含有较高比例的半乳糖和葡萄糖有关。
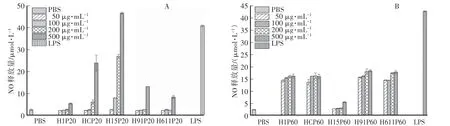
图3 猴头菌菌丝体20%、60%醇沉多糖对RAW 264.7巨噬细胞释放NO的影响Fig.3 Effect of 20%and 60%ethanol precipitated polysaccharides from Hericium erinaceus m ycelium on NO release from RAW 264.7 megalophages

表5 各菌株多糖组分得率与糖含量Table 5 Polysaccharide component yield and sugar content of each strain %
3 讨论
猴头菌是一种珍稀的食药两用真菌,传统应用以食疗药用为主,与其相关的育种研究工作较少。近年来,随着生活水平的提高,消费者对猴头菌的关注度增加,市场需求量逐渐扩大。液体发酵具有周期短、可控性强的特点,但由于猴头菌菌株退化、原料来源不稳定,产品中活性成分含量不高。为提高猴头菌产品中的活性多糖含量,获得优质种源,本课题组前期分别采用传统杂交育种、原生质体融合、ARTP诱变育种技术选育了具有高产多糖和较高生物活性的优势猴头菌菌株。
研究发现,通过ARTP诱变技术可选育获得高产多糖的猴头菌菌株,其发酵菌丝体生物量和多糖含量较出发菌株有明显提升,体外免疫活性显著增强[14];分析诱变菌株菌丝体多糖的结构特征发现,主要是大分子多糖组分发生了变化,其活性的提高与大相对分子质量多糖组分比例增加、单糖组成中葡聚糖、甘露糖比例增加的结构特征改变有一定的相关性[15]。本研究所用猴头菌株为杂交育种筛选得到的高产多糖优势菌株,液体发酵生物量和菌丝体多糖含量较出发菌株0605和刺长均有明显提升,说明筛选得到的杂合菌株集合了亲本菌株高生物量和高多糖含量的稳定遗传优势。猴头菌发酵菌丝体多糖不同组分结构特征分析表明,杂交菌株多糖相对分子质量分布及所占比例与某一亲本菌株相近或介于两亲本菌株之间;杂交菌株H15P20中半乳糖的比例较两亲本有所增加,H611P20中的单糖组成更接近亲本H1P20且半乳糖比例略下降、甘露糖比例略提高;杂交菌株多糖组分与亲本菌株的红外吸收光谱无明显差异。ARTP诱变对20%醇沉多糖组分相对分子质量分布和单糖组成比例产生的变化可能与育种原理有关,ARTP诱变可使遗传物质多样性损伤,引起微生物SOS修复机制,导致遗传物质在分子水平发生变化[16]。杂交育种属于自然选育方式之一,自发突变率低,其高产菌株的代谢产物可能不会发生根本性变化,但优势菌株会稳定表现其两亲本菌株的优势或其中一亲本菌株的优良遗传特性。杂交育种未大幅影响或改变控制大相对分子质量多糖合成的基因及代谢通路。本研究考察了优势高产多糖杂交菌株和亲本菌株发酵菌丝体各多糖组分对RAW 264.7巨噬细胞释放NO的影响,以及杂交育种对多糖体外免疫活性的影响。不同菌株菌丝体20%、60%醇沉多糖组分体外免疫活性表现不同,其中HCP20、H15P20、H1P60、H2P60、H91P60、H611P60体外刺激RAW 264.7巨噬细胞释放NO的量较高,推测与其多糖含量及单糖组成中半乳聚糖、甘露聚糖的比例有关[15]。Bhatia等[17]研究表明,半乳糖高比例对免疫细胞有刺激作用,在3.0μg·mL-1时,半乳甘露聚糖可增加核因子κB(NF-κB)诱导的荧光素酶在THP-1中的表达。本研究表明,优选的3株高产多糖杂交菌株菌丝体多糖均具有免疫活性,但在活性多糖的相对分子质量分布上有差异,未来可根据实际应用进行菌株的选择。
通过以上研究可知,杂交育种对猴头菌菌丝体多糖相对分子质量、单糖组成及多糖基本结构影响较小,对生物量和糖含量影响较明显。这可能与杂交选育是通过基因自由组合、交换或其他方式产生不同于亲本基因的杂交过程有关[5]。本研究表明,杂交优良菌株表现出了稳定的综合遗传优势,多糖结构特性未发生明显改变,但多糖含量大幅提高,活性也得到明显提升。与诱变育种相比,杂交选育同样可得到高产多糖的优良菌株,且具有较强的方向性和可操作性,并且遗传稳定。不同育种技术各有其优缺点,可针对食用菌实际生产需求采用不同育种手段,为猴头菌的深加工优质原料来源和开发利用提供优良种源。
