大豆乳清水一级浮渣中大豆异黄酮的薄层扫描检测方法
2019-09-17李成辉刘代成鲁绪强尹成文
李成辉 刘代成 鲁绪强 李 敏 尹成文
( 1)山东禹王生态食业有限公司,251200,山东禹城; 2)山东师范大学生命科学学院,250014,济南 )
低温脱脂豆粕经稀碱溶液提取后,可使大部分蛋白质溶出,盐酸调整浸提液pH值使蛋白质在等电点析出,分离得到蛋白质凝乳,排出的则为大豆乳清水.蛋白质凝乳经中和、灭菌和喷雾干燥等得到大豆分离蛋白.向大豆乳清水中三次加入聚合氯化铝和聚丙烯酰胺,鼓气成一、二、三级泡沫,再经捕沫、破泡和板框过滤得浮渣.因为浮渣中所含聚丙烯酰胺和聚合氯化铝有一定毒性,只能燃烧,目前尚未开发出其他用途.一个年产10万吨大豆蛋白的生产厂,大豆乳清水处理费用约每年4 000多万元,严重制约公司发展.另外,处理后的大豆乳清水仍含有小分子的大豆异黄酮,于是这种具有雌激素作用的大豆异黄酮废水排放后又变成了环境干扰素,干扰农作物的生长,进而干扰动物及人的生长代谢.
据记载,大豆异黄酮有抗癌、抗心血管疾病、抗骨质疏松、抗女性更年期综合症、抗老年性痴呆、抗机体免疫力下降、抗菌消炎、抗衰老等生理功能,是天然的植物保健品[1,2].美国、日本、德国和英国出现大豆异黄酮热.将大豆乳清水浮渣中的大豆异黄酮提取纯化成大豆异黄酮产品,不仅有利于健康,而且变废为宝获得良好经济效益,同时解决大豆蛋白生产厂所面临的投资和环境问题.
大豆乳清水浮渣是世界上从未研究利用过的新原料,从中提取、纯化和生产大豆异黄酮,小试、中试和规模化大生产都需要首先建立一个大豆乳清水浮渣中大豆异黄酮的简单、快速、准确的检测方法.依检测数据随时判断、指导小试、中试和生产的各个环节,才能选取、优化最佳工作参数和有效工作范围等.因此,检测方法为众中之首、重中之重.
1 试验部分
1.1原料和仪器原料:大豆乳清水一级浮渣粉(山东禹王生态食业有限公司);二氯甲烷、氯仿、甲醇、乙酸、丙酮(天津富宇精细化工有限公司),分析纯;黄豆黄苷、大豆苷、染料木苷、黄豆黄素、大豆苷元、染料木素(北京索莱宝科技有限公司),色谱纯.
仪器:恒温水浴锅(江苏省金坛市正基仪器有限公司),HH-S型;薄层扫描仪(winCATS 1.4.4软件)(瑞士CAMAG公司),CAMAG TLC scanner III型;凝胶成像仪(北京君意东方电泳设备有限公司),JY02G型;EYELA-旋转蒸发仪,EYELA株式会社;GF254硅胶板(青岛海洋化工有限公司),10×20 cm.
1.2方 法
1.2.1 提取及样品处理 将100 g大豆乳清水一级浮渣粉和700 mL丙酮加入蒸馏瓶,沸腾蒸馏1.5 h.滤纸过滤,滤液在50 ℃旋转蒸发至干,干物质量为0.62 g.
1.2.2 样品溶液的配置 用乙酸乙酯将0.62 g样品定容至3 mL,置于4 ℃备用.
1.2.3 标准品溶液的配置 用甲醇分别将黄豆黄苷、大豆苷、染料木苷、黄豆黄素、大豆苷元定溶为1.58、1.18、1.09、0.32、1.38 mg/mL.用乙酸乙酯将染料木素定溶为1.04 mg/mL.
1.2.4 薄层层析扫描方法
1) 苷(黄豆黄苷,大豆苷,染料木苷).将样品液和标准液点于同一块高效薄层硅胶板GF254(10×20 cm)上,展开剂(二氯甲烷∶甲醇∶乙酸=10∶2∶0.1),预平衡20 min,将板放入展开缸,上行展开,展开距:13 cm.
2)苷元(黄豆黄素,大豆苷元,染料木素).将样品液和标准液点于同一块高效薄层硅胶板GF254(10×20 cm)上,展开剂(三氯甲烷∶甲醇∶乙酸=93∶7∶0.5)[6],预平衡20 min,将板放入展开缸,上行展开,展开距:13 cm.
扫描条件:扫描速度 80 nm/s,分辨率200 μm/step,照射灯D2灯,波长260 nm,扫描宽度6.00×0.90 mm.
1.2.5 标准曲线的制备 精密吸取大豆异黄酮标准溶液,以梯度点样量点于同一高效薄层硅胶板GF254(10×20 cm)上,以上述方法进行展开、扫描.以大豆异黄酮标准品的质量(μg)为横坐标(X),峰面积积分值为纵坐标(Y),由薄层色谱仪管理软件winCATS 1.4.4直接得到线性回归方程.
1.2.6 精密度测定 精密吸取样品溶液10 μL,于同一高效薄层硅胶板GF254(10×20 cm)上点5个点,依照上述薄层层析扫描方法测得其峰面积积分值.
1.2.7 重复性测定 精密吸取10 μL样品液,在5块高效薄层硅胶板GF254(10×20 cm)上分别点样,依照上述薄层层析扫描方法测得其峰面积积分值.
1.2.8 稳定性测定 精密吸取10 μL样品液,在高效薄层硅胶板GF254(10×20 cm)上点样,依照上述薄层层析扫描方法测定0~12 h各部分峰面积积分值,每隔2 h测定一次.

图1 黄豆黄苷、大豆苷、染料木苷、样品3D扫描图a:样品中展开距与大豆苷对应峰,b:样品中与黄豆黄苷、染料木苷对应峰.
1.2.9 回收率 精密吸取已知异黄酮含量的样品液3份,各10 μl,分别点于3块高效薄层硅胶板GF254(10×20 cm)上,在3点上分别加大豆异黄酮标准品(分别为样品液含量的50%、100%、150%),依照上述薄层层析扫描方法,记录峰面积积分值,计算含量.
2 结果与讨论
2.1六种大豆异黄酮和样品的薄层扫描结果图1可知,黄豆黄苷、大豆苷、染料木苷的Rf值分别为:0.50、0.41、0.52,样品相对应的峰a、b的Rf分别为0.45、0.55,由此可知峰a对应大豆苷,峰b则对应黄豆黄苷和染料木苷.对此展开区间内各峰进行全波长扫描,得图2.由图2可知,样品峰b与染料木苷相对应,样品中无峰与黄豆黄苷峰图吻合.综上所述,样品中检测到大豆苷与染料木苷,未检测到黄豆黄苷.
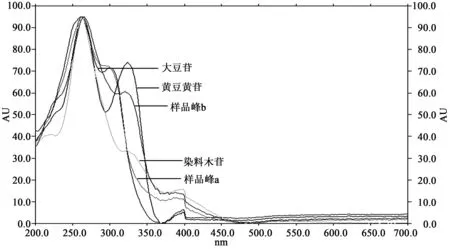
图2 黄豆黄苷、大豆苷、染料木苷、样品全波长扫描图

图3 黄豆黄素、大豆苷元、染料木素、样品3D扫描图 a:样品中展开距与大豆苷元对应峰,b:样品中与黄豆黄素、染料木素对应峰.
图3可知,黄豆黄素、大豆苷元、染料木素的Rf值分别为:0.52、0.31、0.50,样品相对应的峰a、b的Rf分别为0.35、0.52,由此可知峰a对应大豆苷元,峰b则对应黄豆黄素和染料木素.对此展开区间内各峰进行全波长扫描,得图4.由图4可知,样品峰b与染料木素相对应,样品中无峰与黄豆黄素峰图吻合.综上所述,样品中检测到大豆苷元与染料木素,未检测到黄豆黄素.

图4 黄豆黄素、大豆苷元、染料木素、样品全波长扫描图
2.2样品中六种大豆异黄酮含量分析对硅胶板进行薄层层析扫描,得到大豆异黄酮的标准曲线方程,各标准品在试验范围内线性关系良好,R值均大于0.999,RSD值均小于2%.表1可知,大豆乳清水一级浮渣中黄豆黄苷、大豆苷、染料木苷、黄豆黄素、大豆苷元、染料木素的含量分别为0、126.75 mg/100 g、48 mg/100 g、0、96.47 mg/100 g、179.34 mg/100 g.大豆乳清水一级浮渣中大豆异黄酮总量为450.56 mg/100 g.

表1 六种大豆异黄酮标准品标准曲线方程及其在样品中含量
2.3精密度、重复性、稳定性和回收率测定结果表2可知,精密度试验中标准品峰面积值的RSD值均小于2%,说明仪器精密度良好;对样品的5次平行测定的峰面积值的RSD值均小于2%,说明样品的重复性良好.稳定性试验中测定的峰面积在0~12 h保持稳定.

表2 大豆乳清水一级浮渣中大豆异黄酮的精密度、重复性和稳定性测定结果

表3 大豆乳清水一级浮渣中大豆异黄酮薄层层析回收率
由表3可知,大豆苷、染料木苷、大豆苷元、染料木素的平均加样回收率分别为99.32%、98.75%、100.19%、98.80%.
2.3讨 论大豆异黄酮的提取大多以豆粕为原料,提取时一般需要先进行脱脂,蔡立[1]鞠兴荣[2]采用石油醚脱脂,江英[3]用乙醚脱脂,三者最后均用乙醇提取.蔡立[1]又进而采用大孔树脂吸附-洗脱纯化.三者均采用紫外分光光度计法检测.
李文亮[4]以豆粕为原料,高荣海[5]和权静[6]以脱脂豆粕为原料先进行乙醇提取,HCl调等电点去杂,相继进行大孔树脂吸附[4,5],乙酸乙酯提取[1,5].袁建[7]则先进行等电点除杂(HCl沉淀),后又大孔树脂吸附-洗脱制备大豆异黄酮.胡卫新[8]以豆粕为原料,用乙醇提取后再进行盐析,等电点沉淀,离心除杂,几位研究人员都采用HPLC检测.权静[6]还进行了薄层层析扫描检测.
谢明杰[9]等以脱脂豆粕为原料,乙醇作为溶剂超声提取大豆异黄酮,并采用紫外分光光度计检测.郭睿[10]以大豆和豆芽为原料用石油醚和正己烷脱脂,然后乙醇提取,采用紫外/可见分光光度计检测大豆异黄酮含量.
亦有文献报道微波提取、CO2超临界提取和高压高温电解槽提取等大豆异黄酮提取方法,但文中上述方法囊括了目前实验室和生产上的主要提取和检测方法.
综上所述,目前制备大豆异黄酮的原料主要是豆粕和脱脂豆粕,以大豆和豆芽为原料者少,尚未见以大豆乳清水一级浮渣为原料提取大豆异黄酮的相关报道.提取大豆异黄酮过程中主要脱脂溶剂为石油醚、正己烷和乙醚等.乙醇是主要的提取溶剂,HCl处理、等电点沉淀及盐析等是主要的除杂方法,大孔树脂吸附是进一步精制的主要手段.而检测方法主要为紫外分光光度计法和HPLC法,TLC扫描法者极少.
上述提取大豆异黄酮的原料除含有大豆异黄酮外还有其他的黄酮成分,由于黄酮的黄色、相近的吸收波长范围,采用以上样品处理方法后进行紫外分光光度计检测,结果有一定偏差.HPLC法检测需要良好的样品前处理,否则会堵塞HPLC分离柱.薄层层析扫描方法可有效解决分光光度计法及HPLC法检测所面临的上述问题.
由表4可知,每位作者TLC检测目标物不同,分别为愈凤宁心片[11]、葛根[19]、酱油[17]、大豆废料[12]、大豆异黄酮酶解物[14]、纳豆菌葡萄糖苷酶大豆异黄酮酶解物[13]、蒲公英[21]、槐角和槐角丸[15]、大酱[20]、培根胶囊[18]、染料木素,大豆黄酮[22]和油菜饼[16].每种原料所含成分各不相同,而每种成分均可影响薄层展开分离的效果,因此原料决定了展开剂的使用.表中每位作者TLC检测的目的物种类、数目亦不相同,有的只检测一种大豆异黄酮[11~13],有的检测两种[6,14~16],有的三种[17,18],有的检测4种[19,20],有的检测的是总黄酮(而非仅仅是异黄酮)[21].在薄层层析检测中,就同一种原料来讲,显示一种目的物的斑点和显示两种目的物的斑点所用的展开剂亦不相同.因此,所检测目的物的种类和数目的差异决定了展开剂的差异.
表中所述TLC检测大多只是定性检测[12~14,16~18,22],进一步的定量分析多采用HPLC法[12~14,18,22]和紫外分光光度计法[17,12],而未进一步进行TLC扫描定量.虽然这可能与当时检测条件有关,但绝不是一个完备的薄层层析定量方法,表中扫描定量的方法缺乏技术的完整性.有的未进行精密度和回收率的检测[21],有的未进行精密度、回收率和稳定性检测[15],这不得不引起人们对方法可靠性的思考.表中方法较为完整的是权静的扫描定量方法,但只测了两种大豆异黄酮,不适用于本实验中6种大豆异黄酮的检测.因此,大豆乳清水一级浮渣粉中6种大豆异黄酮成分的TLC检测必须建立相对应的、新的、准确的方法.
3 结 论
本文通过对大豆乳清水一级浮渣样品前处理,建立了检测大豆异黄酮成分的标准曲线和标准曲线方程,变异在2%之内.薄层板样品斑点各自分离清晰,大豆异黄酮标准品斑点和样品中相同成分斑点一一对应,Rf值相近或相同,黄豆黄苷Rf=0.50,大豆苷Rf=0.41,染料木苷Rf=0.52,黄豆黄素Rf=0.52,大豆苷元Rf=0.31,染料木素Rf=0.50,表明了大豆异黄酮各成分展开、分离良好.进行了精密度、稳定性(在0~12 h稳定)和回收率(98.75%~100.19%)检测,可以肯定地说该方法灵敏、准确、可靠、稳定,是适合大豆乳清水一级浮渣及其大豆异黄酮产品检测的一个完整、快速、省时、实用的新方法.

表4 大豆异黄酮薄层层析研究文献总结
