龟甲的特异性PCR及高分辨率熔解曲线技术鉴别方法研究△
2019-09-17张雪艳袁媛胡启跳蒋超方成武
张雪艳,袁媛,胡启跳,蒋超,方成武
1.中国中医科学院 中药资源中心 道地药材国家重点实验室培育基地,北京 100700;2.安徽中医药大学 药学院,安徽 合肥 230012
龟甲是中国的传统名贵药材之一,来源于龟科动物乌龟Chinemysreevesii(Gray)的背甲及腹甲,具滋阴潜阳、益肾强骨、养血补心、固经止崩之功效[1]。龟甲在临床上应用广泛,且为细贵中药材,极易混伪,对破碎的、不完整的龟甲也无法进行客观、准确鉴别。龟甲混伪品有近20种,包括巴西龟、马来闭壳龟、黄缘闭壳龟、黄喉拟水龟、平胸龟、地龟、四眼斑水龟、印度棱背龟、庙龟、锯缘龟、凹甲陆龟、缅甸陆龟等[2-6],尤其是巴西龟在龟甲伪品中极为常见。
近年来DNA分子鉴别技术快速发展,位点特异性PCR、DNA测序等技术开始用于动物类药材的鉴别,多种动物药材已建立分子鉴别方法[7-11]。刘晓帆等[12]已使用基于COI序列的DNA条形码技术鉴定龟甲及其混伪品,邓莹等[13]根据Cytb序列设计特异性引物,使用酚-三氯甲烷法提取DNA并建立了龟甲特异性PCR鉴别方法。高分辨率熔解曲线技术(High resolution melting,HRM)因其具有高通量、低成本、简单快捷、和闭管操作等优点[14-15],避免了溴化乙锭、聚丙烯酰胺等有害试剂的使用和紫外照射,且有望检出正伪掺杂的样品,在中药DNA分子鉴定领域已有应用[16-19]。
本研究建立了龟甲药材和饮片DNA快速提取方法,建立并比较了龟甲特异性PCR鉴别方法和高分辨率熔解曲线鉴别方法的优劣,进行了系统的方法学考察,可快速、准确鉴别龟甲及其常见混伪品。
1 材料
1.1 药材
龟甲对照药材购自中国食品药品检定研究院(批号:121494-201604)。样品购自河北安国药材市场、安徽亳州药材市场、广州玉林药材市场、云南昆明药材市场。共获得龟甲与其混伪品42批,实验样品经张继教授、李军德教授鉴定,存于中国中医科学院中药资源中心,见表1。
1.2 试剂
柱式骨骼DNAout试剂盒(北京天恩泽公司,批号:91102-50);ExTaq(Takara公司,批号:RR001Q);SpeedSTAR HSTaq(Takara公司,批号:RR070Q);2×T5 Super PCR Mix(北京擎科新业生物技术有限公司,批号:TSE005);rTaqDNA(Takara公司,批号:DR100A);金牌Mix Green PCR(北京擎科新业生物技术有限公司,批号:TSE101);MightyAmp DNA聚合酶(Takara公司,批号:R071Q);LightCycler480 High Resolution Melting Master(Roche公司,批号:4909631001);2000 bp DNA Marker(Takara公司,批号:3427Q)。

表1 龟甲样品
1.3 仪器
VeritiTM型、GeneAmp 9700型(Applied Biosystems公司);TC-512型(Techne 公司);PTC-100型(Gene公司);PCR仪、LightCycler480型实时荧光定量PCR仪(Roche公司);SYNGENE 凝胶成像系统(GENE公司)。
2 方法
2.1 DNA提取
取药材约50 mg,粉碎成粉末。取粉末20 mg,置2 mL离心管中,使用柱式骨骼DNA提取试剂盒提取DNA,加入1000 μL 65 ℃预热的提取缓冲液,充分混匀;65 ℃水浴30 min;加入300 μL缓冲液及200 μL三氯甲烷;充分混匀,12 000 r·min-1下离心5 min;取500 μL上清至1个新的1.5 mL离心管,加入500 μL上柱缓冲液,充分混匀;加入DNA纯化柱中,12 000 r·min-1下离心1 min;弃穿透液;加入洗脱液500 μL,12 000 r·min-1下离心1 min;弃穿透液,加入洗脱液500 μL,12 000 r·min-1下再离心1 min;弃穿透液,离心DNA纯化柱2 min;加入50 μL无菌双蒸水,室温放置2 min后12 000 r·min-1下离心1 min,取穿透液稀释10倍用于PCR反应。
2.2 特异性引物的设计
从GenBank查找乌龟及巴西龟、黄喉拟水龟、拟鳄龟、平胸龟、中华花龟、缅甸陆龟伪品的COI序列。用BioEdit软件进行序列比对,找到差异片段,并设计鉴别引物:GJ-360.F 5′-GCTTTGGAAACTGACTTGTACCTTTAATG-3′和GJ-360.R 5′-GAGAGTAGTAATAGGACGGCTGTAATAAGTTCA-3′。
2.3 龟甲特异性PCR鉴别方法
在200 μL离心管中进行PCR反应。反应总体积为25 μL,包括10×PCR缓冲液2.5 μL、dNTP(2.5 mmol·L-1)1 μL、鉴别引物(10 μmol·L-1)各0.4 μL、TaqDNA聚合酶(5 U·L-1)0.2 μL和DNA模板1 μL,用无菌水补足反应体积。PCR反应程序:95 ℃预变性5 min,循环反应35次(95 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s),72 ℃延伸5 min,4 ℃保温结束反应。PCR产物经1.5%琼脂糖凝胶电泳,EB染色,置于凝胶成像仪上或紫外透射仪上成像。并考察主要参数:PCR退火温度、PCR循环次数、DNA模板用量、DNA聚合酶种类和PCR仪类型对龟甲特异性PCR鉴别方法的影响,获得最优鉴别条件。
2.4 熔解曲线分析
分别以龟甲药材DNA为模板,调整DNA浓度在合适范围内,在Light Cycler 480型实时荧光定量PCR仪上进行PCR扩增,而后直接进行熔解曲线分析。PCR反应总体积20 μL,PCR反应体系:2×High Resolution Melting Master Mix 10 μL、MgCl2(25 mmol·L-1)1.6 μL、COI通用引物序列RonM-tl 5′-TGTAAAAGGAGGGCCAGTGGMGCMCCMGATATR-GCATTCCC-3′;VRL-tl 5′-CAGGAAACAGCTATGACTAGACTTCTGGGTGGCCAAAGAATCA-3′。引物(10 μmol·L-1)各0.4 μL、模板DNA 1 μL、加ddH2O补齐到20 μL。反应程序为:95 ℃预变性10 min,95 ℃变性30 s、60 ℃退火30 s、72 ℃延伸45 s,40循环;而后进入高分辨熔解曲线分析程序:95 ℃ 1 min,40 ℃ 1 min,66 ℃ 1 s;40 ℃冷却10 s,每秒采集25个数据,获得龟甲及其混伪品的熔解曲线。
2.5 熔解曲线模型的建立
随机选取3批龟甲药材,使用COI通用引物进行PCR扩增和熔解曲线分析;利用罗氏Lightcycler 480 Software 1.5软件建立龟类熔解曲线模型,对其精密度、重复性进行考察。
2.6 PCR反应体系适用性分析
考察模板DNA用量、引物浓度、镁离子浓度对熔解曲线峰形和Tm值的影响,从而确定可依据峰形和Tm值鉴别龟甲药材真伪的适合条件。
3 结果与分析
3.1 龟甲的特异性PCR鉴别方法条件确定
使用设计的龟甲特异性鉴别引物进行PCR扩增,并依次考察PCR鉴别体系和鉴别条件关键因素对龟甲特异性PCR鉴别方法的影响,以获得最优鉴别条件。当退火温度设定为58、60、62 ℃,结果表明,在58~60 ℃时,龟甲正品均能扩增得到360 bp的条带,混伪品缅甸陆龟、黄缘拟水龟、中华花龟、四眼斑水龟、巴西龟等均无条带,使用相同方法依次对PCR循环次数、模板DNA用量、Taq酶种类和PCR仪型号进行考察,当退火温度为60 ℃,PCR循环次数为30个循环,模板DNA浓度为20 ng·μL-1,使用无5′-3′的TaqDNA聚合酶进行扩增时获得最优鉴别结果,龟甲正品均扩增获得360 bp特异性鉴别条带,混伪品无条带。其中Taq酶种类和模板DNA用量对鉴别结果有较大影响,高保真DNA聚合酶扩增保真率虽高,但效率低,产物获得率低,易出现假阴性结果。模板DNA用量过高(100 ng)易出现假阳性鉴别结果,混伪品均可出现假阳性条带,见表2。
3.2 龟甲特异性PCR鉴别方法的适用性考察
采用3.1确定的特异性PCR鉴别体系,对24批龟甲样品及18批伪品进行鉴别(见图1~2),结果表明,该体系能稳定、准确地鉴别龟甲药材和饮片。

注:M.DL2000 Marker;P.阳性对照;N.空白对照(dd H2O为模板);1~3.龟甲;4.巴西龟;5.马来龟;6.拟鳄龟;7.锯缘龟;8.缅甸陆龟;9.平胸龟;10.黄喉拟水龟;11.中华花龟;12.黄缘闭壳龟;13.四眼斑水龟;14.安南龟。图1 龟甲正伪品鉴别结果

表2 龟甲特异性PCR鉴别条件考察结果
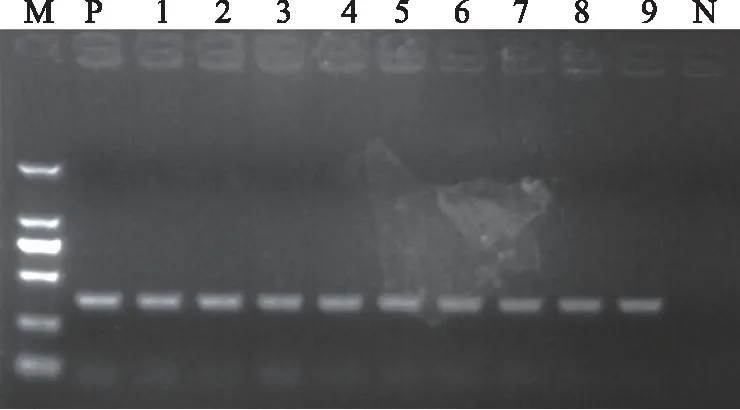
注:M.DL2000 Marker;P.阳性对照;N.空白对照(dd H2O为模板);1~6.不同市场来源龟甲药材;7~9.龟甲饮片。图2 不同批次龟甲特异性PCR鉴别结果
3.3 龟甲的高分辨率熔解曲线鉴别方法的建立
3.3.1 熔解曲线模型的建立 使用高分辨率熔解曲线技术对龟甲进行鉴别,建立其熔解曲线模型。随机选择不同来源的龟甲药材3批,分别提取其DNA,使用COI通用引物进行PCR扩增,并进行熔解曲线分析,结果表明,龟甲熔解曲线为双峰,其Tm值分别为(83.15±0.76)、(87.53±0.69)℃,RSD分别为0.91%、0.80%。对同一批龟甲DNA样品,进行熔解曲线分析,重复3次,其熔解曲线峰形一致,RSD值在分别在0.30%~0.80%、0.20%~0.80%(见图3)。

注:A.3批龟甲药材熔解曲线;B.龟甲COI熔解曲线参考模型。图3 龟甲药材熔解曲线模型的建立
3.3.2 高分辨率熔解曲线技术鉴别反应体系适用性分析 选取龟甲DNA,测定其浓度,并依次稀释为87.9、25.0、3.5、0.7 ng·μL-1,以COI作为引物进行扩增,获得熔解曲线,并分析不同浓度模板DNA对龟甲熔解曲线峰形和Tm值的影响。结果表明,模板DNA在3.5~87.9 ng·μL-1均获得较为均一的熔解曲线,可用于龟甲药材分子鉴别(见图4A)。

注:A.不同浓度模板DNA对龟甲熔解曲线峰形和Tm值的影响;B.不同引物浓度对龟甲熔解曲线峰形和Tm值的影响;C.不同浓度MgCl2对龟甲熔解曲线峰形的影响。图4 龟甲高分辨率熔解曲线鉴别条件考察结果
依据Light Cycler 480 High Resolution Melting Master说明书中引物最适浓度为0.1~0.3 μmol·L-1,在20 μL反应体系中分别加入0.2、0.4、0.6、0.8 μL引物(母液浓度为10 μmol·L-1),获得其熔解曲线,并分析不同引物浓度对龟甲熔解曲线峰形和Tm值的影响。结果表明,引物为0.2 μmol·L-1时可形成稳定的熔解曲线峰形(见图4B)。
在20 μL反应体系中分别加入1.5、2.0、2.5、3.0 μL的MgCl2溶液(母液浓度为25 mmol·L-1),获得其熔解曲线,并分析不同引物浓度对龟甲熔解曲线峰形和Tm值的影响。结果表明,引物浓度为2.0 mmol·L-1时可形成稳定的熔解曲线峰形(见图4C)。
3.3.3 高分辨率熔解曲线技术鉴别龟甲正伪品 选取4种常见龟甲伪品巴西龟、马来龟、拟鳄龟、黄喉拟水龟,分别提取其总DNA,进行熔解曲线分析,获得伪品熔解曲线。对龟甲及其伪品熔解曲线进行比较,结果表明,龟甲混伪品HRM曲线均与正品有显著差异,可以相互区分(见图5)。

图5 使用高分辨率熔解曲线技术鉴别龟甲正品及其混伪品(以巴西龟为例)
4 讨论
PCR鉴别准确性取决于DNA提取质量。动物药材来源广泛,其中,部分动物药材来自于甲壳、皮膜、分泌物、角质物等。由于这些药材在市场上流通时间长、加之高温等因素,使得药材DNA严重降解,从而给DNA提取造成麻烦。此外,Taq酶种类和模板DNA的用量也会对鉴别结果有较大影响,高保真DNA聚合酶扩增保真率虽高,但效率低,产物获得率低,易出现假阴性结果。模板DNA用量过高(100 ng)易出现假阳性鉴别结果,混伪品均可出现假阳性条带。另外,笔者对比了十二烷基硫酸钠法(SDS)、十六烷基三甲基溴化铵法(CTAB)、高盐低pH法及3种不同的柱式DNA提取试剂盒对龟甲DNA提取的效果,发现在不进行脱钙的情况下,仅柱式骨骼DNA提取试剂盒对龟甲药材和蒸制饮片具有较好的提取效果,基于硅胶膜离心柱的方法相对其他方法操作更为简单,易于标准化,且在角、甲类动物药材上具有良好的提取效果,已用于羚羊角、鹿角等动物药材的DNA提取[20-21],有望拓展到其他角、甲类药材的提取。
本文建立了快速简便的龟甲DNA提取和DNA鉴定方法,使用特异性PCR鉴别可在4 h内获得鉴定结果,该方法既可用于龟甲药材亦可用于龟甲饮片,有助于龟甲的质量控制,提高龟甲质量标准。同时本文也建立了龟甲的高分辨率熔解曲线技术鉴别方法,使用HRM鉴别可在3 h内获得鉴别结果,且HRM可替代凝胶电泳对PCR产物及其酶切片段进行检测,避免使用溴化乙锭、聚丙烯酰胺等有害试剂和紫外照射。然而,在对龟甲饮片进行扩增时发现,无论是使用通用引物L1490/H2198或引物RonM-tl/VRL-tl均无法扩出条带,推测是龟甲饮片经高温水煮后DNA严重降解,难以扩增获得400 bp以上的条带,表明直接使用通用引物结合HRM的方法无法鉴别龟甲饮片,下一步可考虑针对龟甲及其混伪品的序列差异,根据SNP位点设计引物,建立特异性的HRM鉴别方法[22-23]。