过氧乙酸对大鼠血清炎性因子水平及肺组织结构的影响*
2019-09-16史向华薛润苗李百强柴秋彦
史向华,薛润苗,王 美,李百强,柴秋彦
(山西省医药与生命科学研究院药理研究室,山西 太原 030006)
过氧乙酸(PAA)为高效广谱消毒剂,对各种微生物,包括细菌、病毒、真菌及芽孢等多种微生物均有杀灭作用[1]。目前,PAA常用作屏障环境实验动物房消毒剂[2],对实验动物饲养笼具、耐腐蚀物品及房间进行灭菌消毒。但PAA氧化性、腐蚀性强[3],可刺激生物机体皮肤、眼睛及呼吸系统[4],特别是吸入后可使呼吸系统产生明显的炎性反应。目前,已有文献报道PAA作消毒剂时的相关急性毒性研究[5-7],且多为口服染毒给药,而对屏障环境中PAA喷雾消毒对实验大鼠血清炎性因子的影响尚未见报道。本研究中检测了大鼠血清肿瘤坏死因子-α(TNF-α)、白细胞介素 6(IL-6)含量,观察肺组织结构,为了解PAA对呼吸系统的毒性提供参考。现报道如下。
1 材料与方法
1.1 动物、仪器与试药
动物:SPF级SD大鼠72只,雌雄各半,6周龄,体质量200~220 g,购自河北医科大学实验动物中心,实验动物生产许可证号为SCXK(冀)2008-1-003。饲养于山西省医药与生命科学研究院药理研究室屏障级动物房,实验动物使用许可证号为SCXK(晋)2010-0005。室温(22.0±2.0)℃,相对湿度(60.0±2.50)%,光照明暗交替12 h/12 h,自由饮水、摄食。
仪器:TL2003型手持式气溶胶喷雾器(上海隆拓仪器设备有限公司);BH-2型光学显微镜(日本Olympus公司);2910型全自动生化分析仪(美国ChemWell公司);BT2202S型电子分析天平(赛多利斯科学仪器<北京>有限公司);R960型半自动酶标仪(长春赛诺生物技术有限公司)。
试剂:PAA消毒剂(北京四环卫生器械厂有限公司,批号为 20121001);TNF-α,IL-6 酶联免疫吸附(ELISA)测定试剂盒(批号分别为 20130520,20130523),均购自北京四正柏生物科技有限公司;甲醛为分析纯,二甲苯、无水乙醇为优级纯。
1.2 方法
分组:将72只SD大鼠随机分为对照组(A组,0.9%氯化钠溶液)和PAA低、高剂量(0.2%、0.5%)组(B1组、B2组),每组24只;然后将各组分别分为1周,2周,4周3个亚组,每组8只。
PAA喷雾剂的配制:A、B剂按说明书配制。取配制好的PAA溶液(质量浓度为178.6 g/L)适量,以去离子水稀释,分别制成0.2%和0.5%PAA喷雾剂,24 h内用完。
给药方式和时程:将大鼠置离地面1 m密闭空间中,按8 mL/m3剂量以药物相应体积分数进行喷雾,1 min喷完,30 min后将大鼠转至屏障动物房中;每日1次,连续2周,然后停药2周,第4周时结束实验。
指标测定:观察大鼠一般情况并称定体质量。分别于1,2,4周时,以乙醚麻醉大鼠(乙醚倒入内装脱脂棉球的玻璃钟罩,让其挥发,放入大鼠),固定,剪开腹腔,分离腹主动脉,采血,室温下3000r/min离心15min,分离血清,置4℃保存;以ELISA法测定TNF-α和IL-6含量,严格按试剂盒说明书操作。常规石蜡包埋切片,苏木素-伊红(HE)染色,光学显微镜观察大鼠肺组织结构。
1.3 统计学处理
采用SPSS19.0统计学软件进行分析。数据以表示,两组间比较行t检验,多组间比较行方差齐性检验。P<0.05为差异有统计学意义。
2 结果
2.1 一般情况
A组大鼠饮水、进食、活动等正常,毛色顺滑、鲜亮,精神状态良好。与A组比较,B1组大鼠给药后呈现轻微兴奋症状,活动加强,部分大鼠出现抓耳挠鼻等不舒适表现,10 min后症状缓解甚至消失;B2组大鼠给药后立即呈现兴奋症状,活动明显加强,快速奔跑,均出现抓耳挠鼻等不舒适表现,持续时间达30 min,未见萎靡、眯眼、流泪、气促、咳嗽等现象。
2.2 体质量及炎性因子水平
结果见表1和表2。
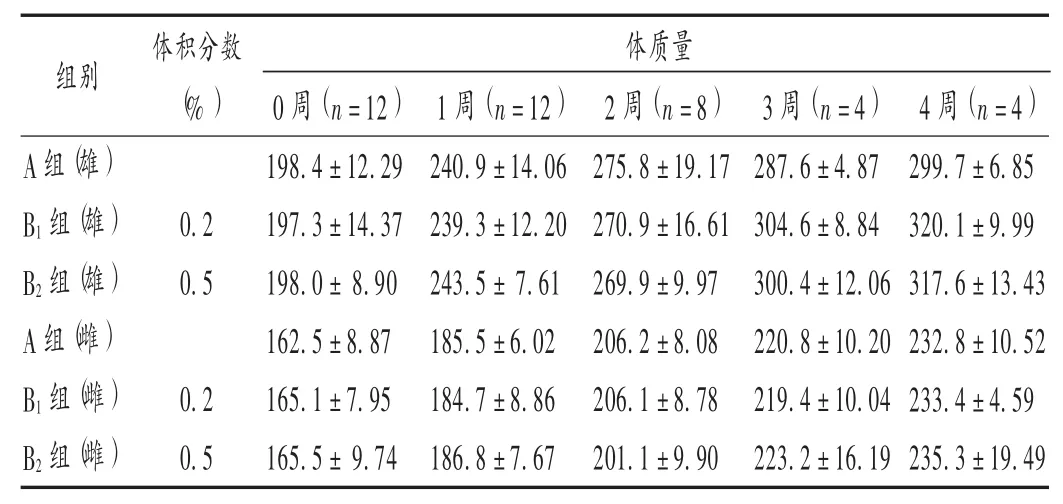
表1 各组大鼠体质量比较(X ± s,g)
表2 各组大鼠血清TNF-α及IL-6含量比较(±s)

表2 各组大鼠血清TNF-α及IL-6含量比较(±s)
注:与A组比较,*P<0.05。
组别给药1周(n=12) 给药2周(n=8) 停药2周(n=4)TNF-α(μg/mL)IL-6(pg/mL)TNF-α(μg/mL)IL-6(pg/mL)TNF-α(μg/mL)IL-6(pg/mL)A组B1组B2组21.37±5.69 19.11±5.53 22.69±6.24 65.86±27.88 97.68±60.91*113.10±53.58*22.14±5.24 24.75±8.06 21.94±7.08 90.24±38.56 116.99±39.67 109.72±36.06 22.64±9.04 24.39±9.78 23.22±12.42 104.96±54.45 109.24±62.85 94.68±12.42
2.3 大鼠肺组织结构
A组大鼠肺组织结构清晰、完整,肺泡大小、间隔正常,肺组织间质无增厚,间质细胞正常,间质无炎性细胞浸润。B1组和B2组大鼠肺组织结构紊乱,肺泡隔增厚,间质细胞增多,且随着药物浓度增加而加重;恢复2周后,仍未正常,与A组比较差异显著。详见图1。
3 讨论
屏障系统动物实验室适用于饲养清洁级动物和SPF级实验动物,温度、湿度、噪音、粉尘及病原菌等都可影响动物的生理机能,通过设备可对诸多因素进行控制,但各级别的动物室都存在通过人、物及实验动物带进的病毒、细菌等。清洗、消毒后,静态下几乎检测不出空气中的病菌,但饲养实验动物后环境中以大肠杆菌为主的微生物污染显著增加。屏障实验室在运行过程中经常要进行动物消毒,以严格控制环境中的微生物。

图1 PAA对大鼠肺组织结构的影响(HE,×20)
PAA具有高效、低毒、价廉、使用方便的优点,对控制细菌及病毒污染有显著作用[1-2],多用于空气、环境及预防消毒,可杀灭大肠杆菌、白色葡萄球菌、白色念珠菌、金黄色葡萄球菌等,实践中主要用于食品冻库、肉联厂、食品加工厂、畜禽圈舍、医疗场所、衣物、工具、物体表面、棚架等消毒。屏障环境动物实验室主要采用熏蒸、浸泡和擦拭等方式对地面、墙壁、门窗、动物饲养笼具和房屋空间等消毒。但PAA具有强烈的刺激性和腐蚀性,对眼睛、皮肤、呼吸道有强烈的刺激作用,吸入会导致化学性肺炎,接触后可引起烧灼感、咳嗽、喘息,且对仪器设备也有一定腐蚀作用。PAA消毒剂在以0.2%~0.5%的体积分数进行空气喷雾、熏蒸消毒时,会对消毒区域中人群的呼吸道、眼睛、皮肤等产生非常明显的刺激作用[8]。PAA吸入可强烈刺激动物呼吸道,不仅使其出现明显的炎性反应,并可使肺组织间质明显增厚,严重时可导致急性肺水肿、眼部损伤等[9-10]。
炎性反应是具有血管系统的活体针对损伤因子所产生的以防御为主的反应,病理检查可发现有大量炎性细胞(巨噬细胞、粒细胞)浸润和组织坏死。在这一过程中,IL-1,IL-6,IL-8,TNF-α 炎性细胞因子等均可促进炎性细胞聚集、活化和炎性介质的释放[11]。
参与炎性反应和肺组织损伤中的炎性细胞因子中,TNF-α 和 IL-6与肺组织损伤的程度紧密相关[12-13]。因此本研究中以这两者为评价指标。本研究结果显示,B1组和B2组大鼠血清TNF-α含量略有增加,但在各个时间点无明显变化;大鼠血清IL-6含量在PAA给药1周时与A组比较均明显增加;给药2周时与A组比较,仍有增加,但程度有所降低;停药2周后,与A组比较无明显差异(P>0.05)。结果提示,PAA使用后可引起大鼠机体明显的炎性反应,其炎性因子水平也可能有助于评估肺损伤程度。大鼠肺组织病理切片观察结果显示,大鼠肺组织在使用PAA后发生了明显变化,提示PAA吸入可刺激肺组织产生明显的炎性反应。
综上所述,PAA喷雾消毒对大鼠血清中IL-6含量及肺组织结构有明显影响,本研究结果可作为评价PAA对呼吸系统损伤的相关参考数据。基于此,为避免在屏障环境中,PAA对实验动物可能造成炎性损伤及呼吸道、肺部等损伤,在消毒时应采取必要的隔离措施,消毒后密闭环境适当通风,以减弱消毒剂对实验动物生理、实验数据及实验结果的影响。
