补阳还五汤对脑缺血/再灌注大鼠神经干细胞移植后神经功能的保护作用
2019-09-13董贤慧周晓红靳晓飞高维娟
吴 增,董贤慧,周晓红,靳晓飞,高维娟
(1.河北中医学院河北省心脑血管病中医药防治重点实验室,河北 石家庄 050200;2. 承德医学院病理生理学教研室,河北 承德 067000)
缺血性脑血管疾病是危害人类健康最常见的疾病之一,具有发病率高、致死率高、致残率高等特点。神经干细胞(neural stem cells,NSCs)是神经系统的始祖细胞,可以分化为神经元和神经胶质细胞,这一生理特性为神经再生和修复提供了理论上的依据。但内源性NSCs数量少,远不能满足神经功能修复的需要。研究表明,外源性NSCs移植可以促进脑缺血/再灌注损伤大鼠神经功能的恢复[1-2],并通过抑制神经凋亡蛋白的表达来减轻神经损伤[3]。补阳还五汤是治疗脑中风偏瘫的名方,具有补气、活血、通络之效,现代用于治疗缺血性脑病、中风后遗症、冠心病等。研究表明,在脑缺血后,补阳还五汤可以促进内源性NSCs的分化[4],降低神经元的凋亡率[5]。虽然补阳还五汤与NSCs移植对缺血性脑损伤均有确切的疗效,但补阳还五汤是否能够促进NSCs移植后脑缺血/再灌注大鼠神经功能的恢复?是否可以通过调节神经元凋亡,促进神经功能的恢复?相关方面的报导甚少。因此,本实验将补阳还五汤与NSCs移植相结合,探讨其对脑缺血/再灌注大鼠的神经保护作用。
1 材料
1.1 药物补阳还五汤,由河北中医学院门诊部提供,组方参考《方剂学》[6]:生黄芪120 g、当归尾6 g、赤芍5 g、地龙3 g、川芎3 g、红花3 g、桃仁3 g。将药物加蒸馏水浸泡2 h,一煎加蒸馏水500 mL,煎至150 mL;二煎加水300 mL,煎至100 mL,将两煎混合后浓缩至100 mL(1 mL约含1.43 g生药)。于4 ℃保存备用。
1.2 实验动物SPF级SD孕鼠10只;SPF级SD大鼠60只,♂,体质量(290±10) g,均由北京维通利华实验动物技术有限公司提供,许可证号:SCXK(京)2016-0011。
1.3 试剂DMEM/F-12(1 ∶1)、B-27、Accutase酶,购于Gibco公司;碱性成纤维细胞生长因子(basic fibroblast growth factor, bFGF)、表皮生长因子(epidermal growth factor,EGF),购于PeproTech公司;兔抗大鼠巢蛋白(nestin)多克隆抗体,购于北京博奥森生物技术有限公司;甲苯胺蓝染液,购于北京索莱宝科技有限公司;2、3、5,氯化三苯基四氮唑(TTC)染色剂,购于Biosharp公司;抗Bax、Bcl-2抗体,购于武汉塞维尔生物科技有限公司。
1.4 仪器3111型二氧化碳培养箱(Thermo);SW-CJ-2FD型洁净工作台(苏州安泰空气技术有限公司);DM5000B型光学显微镜、EG11508型组织包埋机、RM2255型全自动轮转切片机(Leica公司);IX73型生物显微镜(OLYMPUS公司);H2050R型离心机(长沙湘仪离心机仪器有限公司);51700型全自动脑立体定位仪(美国Stoelting)。
2 方法
2.1 NSCs提取、培养、鉴定[7]采用由DMEM/F12(97%)、B27(2%)、青链霉素(1%)、EGF(20 μg·L-1)、bFGF(20 μg·L-1)配制成的培养基。取孕14 d的SD大鼠,麻醉后,置于75%酒精中浸泡30 min,取出子宫,置于75%酒精中浸泡2 min,在超净台内取出胎鼠大脑皮质,置于含有D-Hank’s液的平皿中,分离并去除脑膜,将脑组织转移至含有培养基的平皿中,用眼科剪剪碎,收集入离心管,吹打至无可见组织块,离心后去上清,加入培养基,吹打均匀后过细胞筛。接种后,置于培养箱中培养,每2~3 d加液1.5 mL,每6~7 d传代1次,传代时用Accutase酶将神经球消化成单细胞,加入培养基终止消化,离心后去上清,加入培养基继续培养。取培养至第5代的NSCs进行nestin免疫荧光染色,鉴定细胞。
2.2 动物模型的制备采用改良线栓法建立大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)模型,方法如下:将大鼠适应性饲养1周,术前禁食12 h、不禁水,10%水合氯醛(3.5 mL·kg-1)腹腔注射麻醉,固定大鼠,备皮,碘伏消毒,在颈部正中做2 cm切口,钝性分离肌肉,解剖出左侧颈总动脉(common carotid artery,CCA)、颈内动脉(internal carotid artery,ICA)和颈外动脉(external carotid artery,ECA)。血管夹夹闭CCA和ICA,在ECA上靠近动脉分叉处与远离动脉分叉处,各结扎1根手术缝合线,靠近分叉处缝合线打结但不系死,用显微剪于两根手术线之间剪一斜口,将线栓经斜口插至颈动脉分叉处,将靠近分叉处缝合线系死,在两根缝合线之间离断ECA,松开血管夹,调整线栓插入方向与ICA一致,用眼科镊轻轻将线栓送入ICA,插入深度由分叉处算起(18±1)mm。缺血2 h后,拔出线栓,将ECA残端系死,碘伏消毒,缝合伤口。术后24 h进行神经功能缺损评分,按Zea Longa 5分制评分标准:0分,无神经系统缺损症状;1分,不能完全伸展对侧前爪;2分,行走向对侧转圈;3分,行走困难,向对侧倾倒;4分,不能自发行走,丧失意识;5分,动物死亡。1、2、3分为模型成功,列为实验对象。
2.3 分组与给药将60只SD大鼠随机分为5组:假手术组、模型组、补阳还五汤组、移植组、补阳还五汤+移植组。假手术组线栓由ECA插入ICA约5 mm即可,其余各组造模方法相同。采用灌胃给药的方式,补阳还五汤组与补阳还五汤+移植组于MCAO模型麻醉清醒后给药,剂量为14.8 g·kg-1·d-1,每日分两次给予,其余各组给予等体积的蒸馏水。各组大鼠于造模术后d 14进行指标检测。
2.4 NSCs移植对培养至第5代6~7 d的NSCs进行传代,将神经球消化成单细胞,以1 000 r·min-1离心10 min,去上清,加入无菌生理盐水,调整细胞浓度为1.0×1011·L-1备用。移植组与补阳还五汤+移植组在大鼠MCAO模型制备成功24 h后,重新麻醉,固定于脑立体定位仪上,头顶部皮肤备皮消毒,正中矢状位做2 cm切口,暴露前囟,微量注射器吸入备好的NSCs悬液10 μL,将微量注射器固定于脑立体定位仪上,以前囟为坐标原点,定位并钻孔,将NSCs悬液缓慢注射到左侧纹状体区(AP=0.36 mm,ML=3.15 mm,DV=5.5 mm)7 μL,注射到左侧大脑皮质(AP=0.36 mm,ML=3.15 mm,DV=2.0 mm)3 μL,注射速度为1 μL·min-1,注射完毕后留针10 min,缓慢拔出注射器,骨蜡封闭针孔,碘伏消毒,缝合皮肤。其余各组注射等体积无菌生理盐水。
2.5 TTC染色检测大鼠脑梗死体积大鼠断头取脑,迅速取出大脑置于脑切片磨具中,-80 ℃冰箱内冷冻5 min,从前至后对大脑行冠状位切片,共切5片,每片厚度为2 mm,置于由PBS配制的质量分数为2%的TTC染液中,37 ℃避光恒温孵育30 min,每隔15 min翻动1次。将脑组织切片置于4%多聚甲醛中固定4 h后拍照,采用Image-Pro Plus 6.0软件分析大脑梗死体积。
2.6 脑组织固定与切片将大鼠麻醉后固定于操作台,于胸腔正中迅速剪开皮肤、肌肉与肋骨,暴露心脏,于心尖处剪口,插入灌流针至主动脉处并固定,于右心房处剪一小口,先灌注50 mL预冷的生理盐水,再灌注预冷的4%多聚甲醛50 mL,迅速断头取脑,将脑组织浸泡于4%多聚甲醛中24 h。以AP=0.36 mm为起始面,对脑组织由前至后行2 mm厚冠状位切片,然后进行组织脱水、透明、浸蜡和包埋。用全自动轮转切片机做厚度为3 μm的冠状位石蜡切片。
2.7 尼氏染色观察缺血半暗带细胞形态并分析尼氏体累积光密度值将石蜡切片经二甲苯、梯度乙醇脱蜡至水,将切片放入0.5%甲苯胺蓝染液中染色5 min,蒸馏水洗,1%的冰醋酸稍分化,蒸馏水洗终止反应,显微镜下控制分化程度,蒸馏水洗后,无水乙醇脱水,二甲苯透明,中性树胶封片。光学显微镜下观察、拍照,观察细胞形态,并用Image-Pro Plus 6.0软件分析尼氏体累积光密度值。
2.8 免疫组织化学染色法检测缺血半暗带Bcl-2与Bax的表达将石蜡切片脱蜡至水,然后置于柠檬酸修复液中,于微波炉内进行抗原修复,切片放入3%双氧水溶液中,室温避光孵育25 min,山羊血清封闭液覆盖组织,室温封闭30 min,甩掉封闭液,在切片上滴加由PBS配制的一抗,切片平放于湿盒内4 ℃孵育过夜,滴加与一抗相应种属的二抗,室温孵育50 min,滴加DAB显色液,显微镜下控制显色时间,阳性为棕黄色,自来水冲洗切片终止显色,苏木精复染3 min,自来水冲洗,苏木精分化液分化数秒,自来水冲洗,苏木精返蓝液返蓝,流水冲洗,梯度乙醇、二甲苯脱水透明,切片稍晾干后,中性树胶封片,光学显微镜下观察、拍照,采用Image-Pro Plus 6.0软件对相同的棕黄色细胞进行计数。
3 结果
3.1 NSCs培养及鉴定结果如Fig 1所示,第5代神经球生长状态良好。nestin免疫荧光染色呈阳性(Fig 2)。
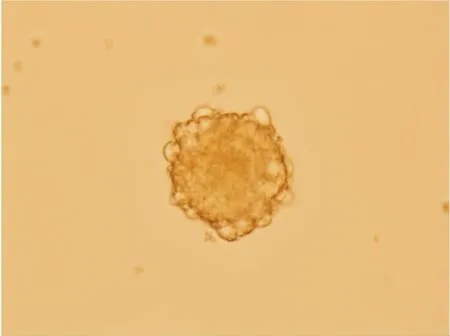
Fig 1 Neurospheres in good state (×400)
3.2 各组大鼠神经功能缺损评分的变化如Fig 3所示,大鼠造模术后14 d,假手术组无神经功能缺损。与假手术组相比,模型组神经功能缺损评分增高(P<0.05);与模型组相比,补阳还五汤组、移植组、补阳还五汤+移植组神经功能缺损评分降低(P<0.05);与移植组相比,补阳还五汤+移植组神经功能缺损评分降低,差异具有显著性(P<0.05)。

Fig 2 Positive pictures of 5th neurospheres nestin immunofluorescent staining (×400)A: The nestin protein of neurospheres labeled with Cy3; B: DAPI to redye the nucleus of NSCs; C: Merged A and B.
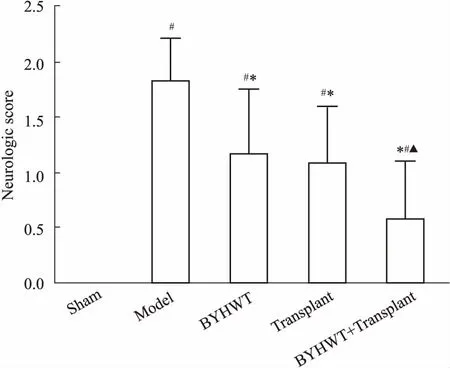
Fig 3 Statistical analysis of nerve function defect score of rats in each group n=6)
#P<0.05vssham;*P<0.05vsmodel;▲P<0.05vstransplant
3.3 各组大鼠脑梗死体积的变化如Fig 4所示,假手术组未见梗死灶。与假手术组相比,模型组脑梗死明显(P<0.05);与模型组相比,补阳还五汤组、移植组、补阳还五汤+移植组脑梗死体积明显缩小(P<0.05);与移植组相比,补阳还五汤+移植组脑梗死体积缩小,差异具有显著性(P<0.05)。
3.4 各组大鼠神经元形态学与尼氏体累积光密度值的变化如Fig 5所示,假手术组细胞数量较多,轮廓清晰,尼氏体丰富,细胞排列规则。与假手术相比,模型组细胞较少,轮廓模糊不清,尼氏体明显减少,细胞排列紊乱,尼氏体累积光密度值明显降低(P<0.05)。与模型组相比,补阳还五汤组、移植组、补阳还五汤+移植组细胞状态明显好转,轮廓较清晰,尼氏体增多,尼氏体累积光密度值明显增加(P<0.05)。与移植组相比,补阳还五汤+移植组尼氏体累积光密度值增加,差异具有显著性(P<0.05)。
3.5 各组大鼠脑组织中Bcl-2/Bax表达的变化如Fig 6所示,假手术组大鼠脑组织中仅有少量Bcl-2和Bax表达,与假手术组相比,模型组Bcl-2与Bax表达增加,Bcl-2/Bax明显下降(P<0.05)。与模型组相比,补阳还五汤组、移植组、补阳还五汤+移植组Bcl-2表达增加,Bax表达减少,Bcl-2/Bax明显升高(P<0.05)。与移植组相比,补阳还五汤+移植组Bcl-2表达增加,Bcl-2/Bax升高,差异具有显著性(P<0.05)。
4 讨论
对于脑血管疾病的治疗,目前临床上主要采用超早期溶栓、脑神经保护和恢复期的神经康复等措施,虽然部分患者神经功能恢复较好,但仍有一大部分患者遗留瘫痪、失语等严重疾患。因此,如何积极有效地促进脑缺血/再灌注损伤后恢复期神经功能的恢复,仍是目前研究的重点。近年来,随着体外培养NSCs技术的不断成熟,外源性NSCs移植已用于多种神经系统损伤和退行性疾病的治疗。NSCs移植治疗脑缺血/再灌注损伤的机制可能包括以下几个方面:①NSCs可以分化为神经元,替代受损的神经元而发挥生理作用;②抑制神经元凋亡,减轻神经元损伤[8];③NSCs可以产生许多生长因子,促进神经功能恢复;④激活损伤区神经元的自我修复功能;⑤促进缺血区微血管再生,改善局部微循环障碍[9]。
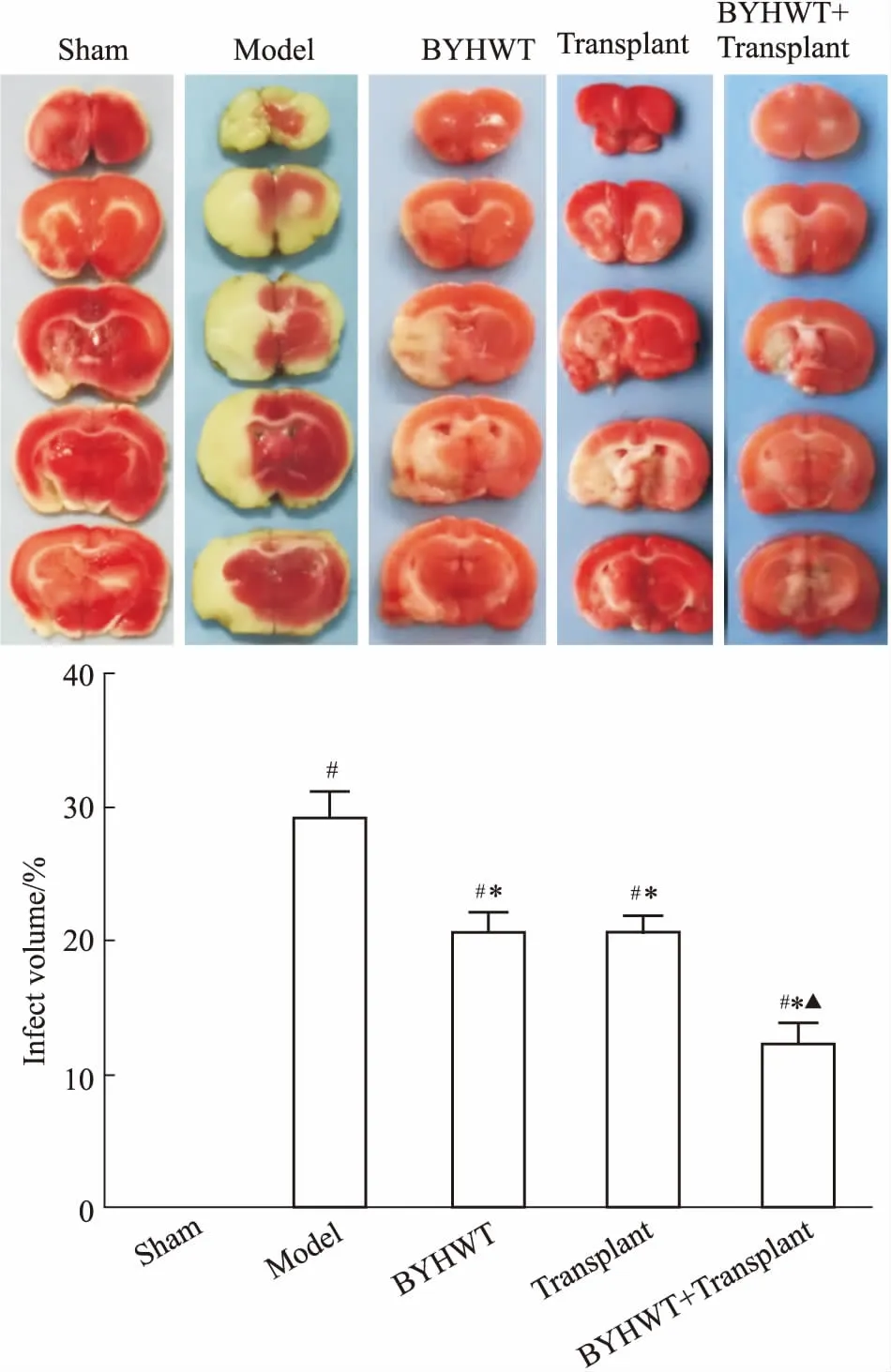
Fig 4 Cerebral infarct volume examined by TTC staining of rats in each group n=6)
#P<0.05vssham;*P<0.05vsmodel;▲P<0.05vstransplant
脑缺血/再灌注损伤属中医“中风”范畴,清代医家王清任提出“中风”乃系机体“元气亏损,经络空虚,气向一侧归并而呈半身不遂”,并创立了补阳还五汤。中风恢复期以气虚血瘀证候最为常见,气行则血行,气虚则血液运行不畅,脉络瘀阻,筋脉失养而发为偏枯,本证气虚为本,血瘀为标。补阳还五汤具有补气、活血、通络的功效,益气活血恰合病机。本方以黄芪为君药,补气以行血;当归尾活血通络而不伤血,用为臣药;桃仁、赤芍、红花、川芎协同当归尾活血祛瘀;地龙通经活络,周行全身,以行药力,诸药合用,则气旺、淤消、络通,诸症向愈。脑缺血/再灌注损伤的发病与兴奋性氨基酸毒性作用、脑组织能量衰竭、炎症反应、细胞凋亡、免疫调节异常等机制相关[10]。现代研究认为,补阳还五汤可以在许多方面发挥神经保护作用,如抑制细胞凋亡[11]、改善微循环障碍[12]、抑制血小板活化[13]、抗氧化[14]、调节脑组织能量代谢[15]等。细胞凋亡是在体内外因素诱导下,由严格和复杂的信号网络调控而发生的细胞自主性程序性的死亡过程。凋亡蛋白Bcl-2与Bax的比率反映了细胞凋亡的程度,比值越高,凋亡程度越轻,细胞存活率越高。
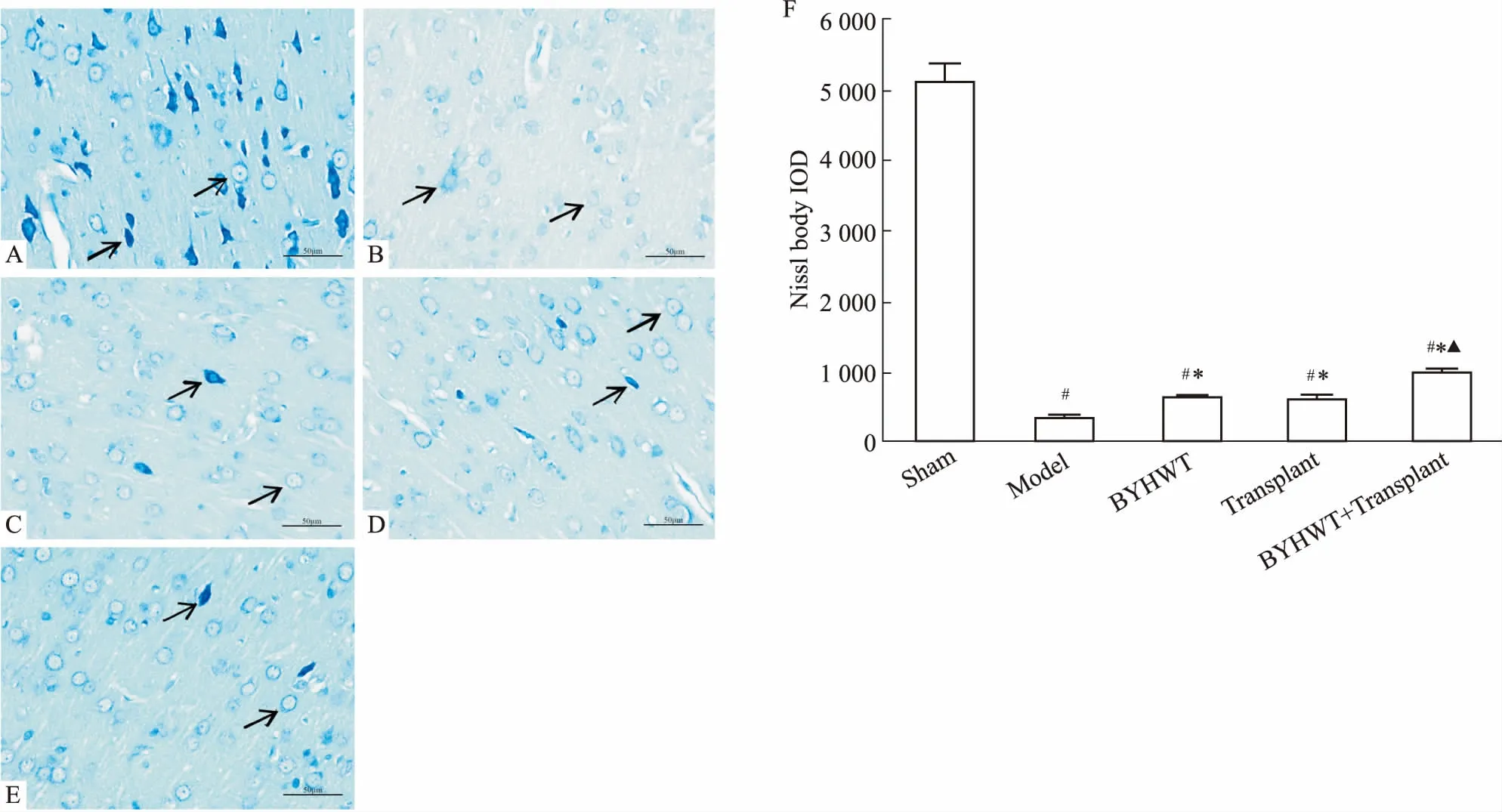
Fig 5 Nissl staining in brain tissue of rats in each group (×400)
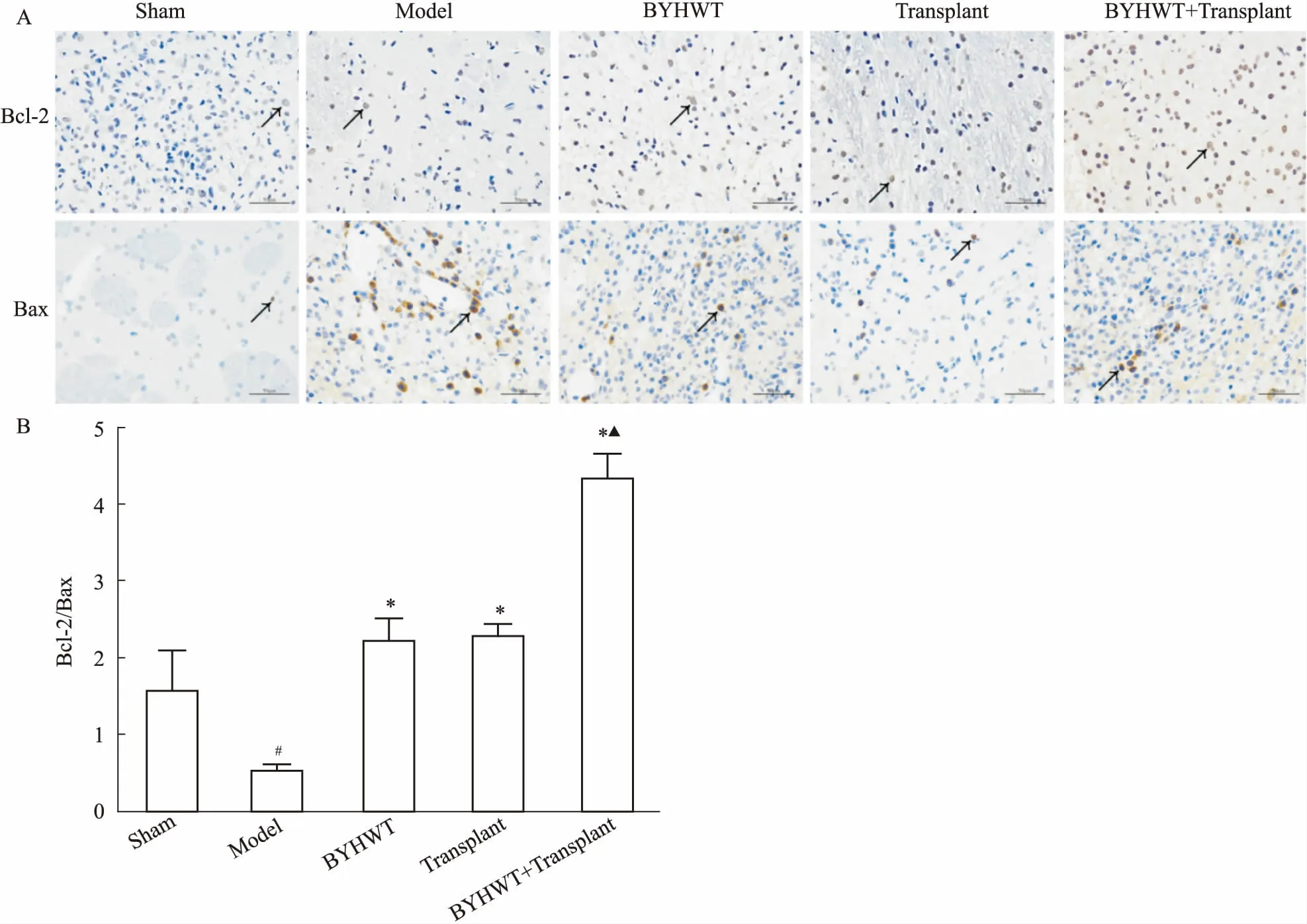
Fig 6 Expression of Bcl-2 and Bax of brain tissue of
rats in each group(×400)
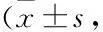
本实验发现,补阳还五汤组与移植组较模型组神经功能缺损程度减轻,脑梗死体积缩小,尼氏体累积光密度值增高,Bcl-2/Bax增高,而补阳还五汤+移植组神经修复作用更为明显。据此推测,补阳还五汤联合NSCs移植可能通过抑制脑缺血/再灌注损伤大鼠神经元凋亡,发挥神经保护作用。有研究表明,NSCs可以在神经损伤区存活和迁移,从而上调Bcl-2的表达,来抑制损伤区神经元凋亡[16]。补阳还五汤也可以促进NSCs移植后的增殖和迁移[17],促进体外培养的NSCs分化为神经元和神经胶质细胞。由此我们设想,补阳还五汤有可能对移植后NSCs增殖、分化及迁移起到促进作用,从而进一步抑制神经元凋亡,发挥神经保护作用。
综上所述,补阳还五汤可以对NSCs移植后脑缺血/再灌注大鼠神经元凋亡起到抑制作用,从而发挥神经保护作用。为了更好地发挥补阳还五汤与NSCs治疗缺血性脑损伤的协同作用,后续实验中我们将探讨补阳还五汤是否对移植后的NSCs增殖、分化及迁移有促进作用。