天冬酰胺酶-吴茱萸碱核壳型脂质纳米粒的药动学研究
2019-09-13黄永佳杨仕钰张景勍
黄永佳,杨 林,李 瑶,杨 强,杨仕钰,张景勍
(1. 重庆医科大学药学院重庆高校药物工程研究中心,重庆 400016;2. 重庆医药高等专科学校药学系,重庆 401331;3. 重庆市公共卫生医疗救治中心药学部,重庆 400036)
与小分子化疗药相比,生物大分子药物如酶、抗体等,具有特异性高和催化效力强的优点[1]。天冬酰胺酶(asparaginase,ASNase)是一种自然界中广泛分布的酶,其可以水解营养氨基酸天冬酰胺。在正常细胞中,天冬酰胺是一种非必需氨基酸,细胞可以通过自身的天冬酰胺合成酶合成天冬酰胺。然而,肿瘤细胞只能依赖于血液循环中提供的天冬酰胺,ASNase的使用会引起某些癌细胞的营养剥夺,从而导致肿瘤细胞死亡[2]。目前,临床上主要将ASNase与其他小分子化疗药或放射疗法联合,用于治疗急性淋巴细胞白血病。研究表明,接受ASNase治疗的白血病患者其生存期明显延长[3]。此外,ASNase在实体肿瘤,如乳腺癌[4]、卵巢癌[5]和肺癌[6]的研究中也取得了一定的效果。但是,治疗过程中发生的许多严重不良反应,如过敏反应、凝血异常、胰腺炎等,限制了ASNase的进一步应用[7]。此外,ASNase还具有稳定性差、生物利用度低等不足[8]。
吴茱萸碱(evodiamine,EVO)是一种天然抗肿瘤活性物质,可通过阻滞肿瘤细胞周期和诱导线粒体凋亡而抑制肿瘤细胞[9]。但EVO几乎不溶于水,生物利用度非常低,限制了其应用[10]。前期研究发现,将EVO与环糊精制备成包合物可提高EVO的水溶性,增加其生物利用度[11]。
综上所述,联合ASNase的肿瘤“饥饿疗法”和EVO的小分子化疗机制,即一方面剥夺肿瘤细胞的营养供给,另一方面予以营养缺陷的肿瘤细胞致命打击,理论上可以发挥良好的协同抗癌作用。为了解决两者临床应用上的不足,本研究首次制备了新型天冬酰胺酶-吴茱萸碱核壳型脂质纳米粒(asparaginase-evodiamine core-shell lipidic nanoparticles,AELNs)。首先通过透明质酸衍生物与羟丙基-β-环糊精在缓冲液中的自组装作用,将ASNase包封进去形成纳米粒的“核”。然后与复方药物EVO的环糊精包合物(evodiamine-hydroxypropyl-β-cyclodextrin inclusion complex,EH)一起包封于脂质囊壳中,从而形成具有“核-壳”型结构的纳米粒。AELNs具有长循环、生物相容性好、稳定性佳等优势,理论上能提高ASNase和EVO的生物利用度。
1 材料
1.1 实验动物清洁级SD大鼠,♂,体质量(250±20)g,购自重庆医科大学实验动物中心,合格证编号:SCXK-(渝)2016-0001。
1.2 药物与试剂ASNase,纯度96%,来源于E.coli.,购自以色列Prospec公司;EVO,纯度>99%,购自武汉远城科技发展有限公司;天冬酰胺,纯度98%,购自美国Sigma公司;Tris-HCl缓冲液(50 mmol·L-1,pH 7.3),自配;甲醇(色谱纯),购自美国天地有限公司;其余试剂均为分析纯。
1.3 仪器Agilent 1100液相色谱仪(美国安捷伦公司);UV-2600紫外分光光度计(岛津仪器有限公司);Milli-Q超纯水系统(美国Millipore公司);TGL-16B台式高速离心机(上海安亭科学仪器厂)。
2 方法
2.1 ASNase活性的测定
2.1.1Nessler试剂比色法 ASNase可以催化天冬酰胺分解产生游离氨,因此可以参照Nessler试剂比色法[12],间接测定ASNase的活性。配制适当浓度的天冬酰胺溶液,加入37 ℃预热的ASNase血浆样品,恒温反应10 min后,三氯乙酸终止反应。离心,取上清液,加入Nessler试剂显色,测定紫外吸收。根据氨氮标准曲线计算反应生成的氨量。1个酶活力单位是指在实验温度37 ℃、pH7.3条件下,转化1 μmol天冬酰胺所需的ASNase量。
2.1.2线性范围 配制系列硫酸铵标准溶液,含氮浓度分别为0、40、80、200、400、480、600、800 mg·L-1,分别按“2.1.1”项处理后(ASNase血浆样品替换为空白血浆),最终测定的氮浓度分别为0、0.1、0.2、0.5、1.0、1.2、1.5、2.0 mg·L-1。以不含氮组样品为空白参比,测定其余各样品在420 nm处的吸光度,根据氮浓度和吸光度值,绘制标准曲线。
2.1.3重复性 配制低、中、高(80、400、800 mg·L-1)浓度的硫酸铵标准溶液,每个浓度5份,分别按“2.1.1”项处理后测定吸光度值,根据氮标准曲线计算各测量值之间的RSD,考察方法的重复性。
2.1.4回收率 配制“2.1.3”项溶液,同法处理后,计算氮测得量与加入量的比值,考察方法的准确度。
2.2 EVO含量的测定
2.2.1血浆样品的处理 吸取100 μL血浆样品,加入10 μL内标工作液(和厚朴酚20 mg·L-1),加入氨水(2 ∶1,V∶V),涡旋0.5 min后,加入5倍体积的乙醚沉淀蛋白,继续涡旋3 min。所得样品溶液于6 000 r·min-1离心5 min,取上清液至离心管中,氮气挥去乙醚。加入等血浆体积的甲醇复溶,涡旋,离心,取上清液40 μL进样,检测EVO含量。
2.2.2色谱条件 色谱柱:Lichrospher C18柱(4.6 mm×250 mm,5 μm);检测波长:225 nm;流动相:甲醇 ∶水(70 ∶30,V∶V),柱温:35 ℃,流速:1.0 mL·min-1。
2.2.3专属性 取空白血浆、空白血浆+EVO+和厚朴酚、血浆样品+和厚朴酚,分别按“2.2.1”项方法处理血浆样品,在“2.2.2”项条件下进行分析,记录色谱图。
2.2.4线性范围 配制100 mg·L-1的EVO甲醇溶液,分别用流动相稀释至浓度为5、10、20、50、100、200、400、500、800、1 000、2 000、5 000 μg·L-1的EVO标准溶液。精密吸取SD大鼠空白血浆100 μL,分别加入上述EVO标准溶液10 μL制备模拟血浆样品。按“2.2.1”项方法处理后,进样检测药物峰和和厚朴酚峰。以EVO峰面积和和厚朴酚峰面积的比值(S∶Sr,Y)对EVO的浓度(C)做线性回归,得标准曲线的回归方程。
2.2.5精密度 制备低、中、高3个浓度的EVO模拟血浆样品(EVO浓度分别为1、5、20 mg·L-1),各浓度平行配制3份,分别按“2.2.1”项方法处理后,得到EVO浓度分别为100、500、2 000 μg·L-1的检测样品,在“2.2.2”项条件下进行分析,1 d内连续测定5次考察日内精密度,连续检测5 d考察日间精密度。
2.2.6回收率 制备“2.2.5”项检测样品,分别测定EVO的峰面积,计算各质量浓度的平均峰面积(Ar)。配制相同质量浓度的对照品溶液直接进样,计算平均峰面积(As)。由Ar与As的比值,分别计算低、中、高3个浓度EVO的提取回收率。
2.3 给药方案与样品采集
2.3.1AELNs的制备 首先称取处方量的ASNase溶于10 g·L-1的聚乙二醇化透明质酸溶液中,将其缓慢加入60 g·L-1的羟丙基-β-环糊精溶液中,冰浴下磁力搅拌2 h即得纳米制剂的“核”。接着,称取处方量的卵磷脂和胆固醇于圆底烧瓶中,加入适量二氯甲烷溶解,减压除去二氯甲烷至形成均匀薄膜后,加入乙醚复溶。称取处方量的EH,连同上述“核”溶液一起加入有机相中,超声至形成均匀带乳光的分散体系。在旋转蒸发仪上减压蒸发至凝胶状塌陷为均匀液体,即得核壳型脂质纳米粒AELNs,ASNase的浓度为5×105IU·L-1。
2.3.2ASNase溶液的配制 称取5 000 IU ASNase于10 mL容量瓶中,加入Tris-HCl缓冲液溶解并稀释至刻度,即得5×105IU·L-1的游离ASNase溶液。
2.3.3EVO混悬液的配制 称取5.0 mg EVO于10 mL容量瓶中,加入0.5%的羧甲基纤维钠液助悬,稀释至刻度即得0.5 g·L-1的EVO混悬液。
2.3.4动物实验 将18只SD大鼠随机分成3组,禁食不禁水12 h。分别尾静脉注射AELNs、游离ASNase或EVO混悬液(ASNase给药剂量为2 000 IU·kg-1,EVO给药剂量为2 mg·kg-1)。给药后,于不同时间点眼底静脉采集48 h内血样,采血体积约0.3 mL,离心,取上清液,置-20 ℃冷冻备用。
2.4 药动学研究分别按“2.1”和“2.2”项所述方法,测定血浆样品中ASNase和EVO的含量,绘制血药浓度随时间变化的曲线。根据血样测定结果,使用DAS软件(2.1.1版)计算药代动力学参数,比较制剂AELNs与游离药物ASNase或EVO的药代动力学行为和生物利用度差异。
3 结果
3.1 ASNase测定方法学经考察,氨氮浓度在0.1~2.0 mg·L-1范围内时,氨与Nessler试剂反应形成的络合物,在420 nm处的吸光度与氨氮浓度呈线性相关。线性回归方程为:Y= 0.220 5C-0.012 1(r=0.9997)。重复测定低、中、高3个浓度氨氮溶液5次结果的RSD分别为3.80%、1.08%、2.62%,平均回收率分别为112.55%、103.98%、104.27%。表明该方法重复性和准确性良好,符合测定要求。
3.2 EVO测定方法学如Fig 1所示,血浆中杂质或内源性物质对EVO的测定无干扰,表明该分析方法专属性强。经分析,EVO浓度在5~5 000 μg·L-1时,其峰面积比(Y)与EVO的浓度(C)线性相关,标准曲线为:Y=0.001 3C+0.033 1(r=0.999 4)。低、中、高3个浓度的日内精密度分别为3.18%、1.50%、3.83%,日间精密度分别为5.00%、4.11%、3.98%,平均回收率分别为92.70%、91.19%、93.13%,均满足方法验证的要求。
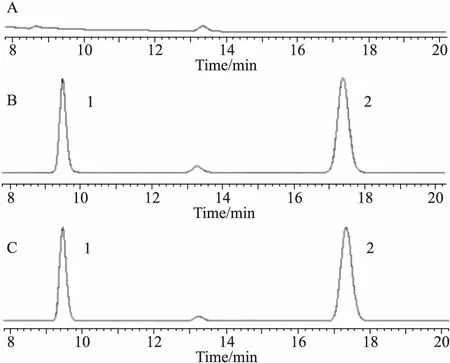
Fig 1 Chromatograms of blank plasma(A), blankplasma+EVO+honokiol(B) and plasma sample+honokiol(C)
1:EVO;2:honokiol
3.3 AELNs中ASNase的药动学研究以时间为横坐标,血浆中ASNase浓度为纵坐标,绘制静脉注射AELNs和游离ASNase后,大鼠体内ASNase的药-时曲线。如Fig 2所示,AELNs组的AUC(0~48 h)明显大于游离ASNase组。静脉注射游离ASNase后,酶活性下降较AELNs快,12 h时活性消失。而AELNs组失活较慢,24 h尚有一定活性。结果表明,AELNs可延长ASNase在大鼠体内的活性保留时间。
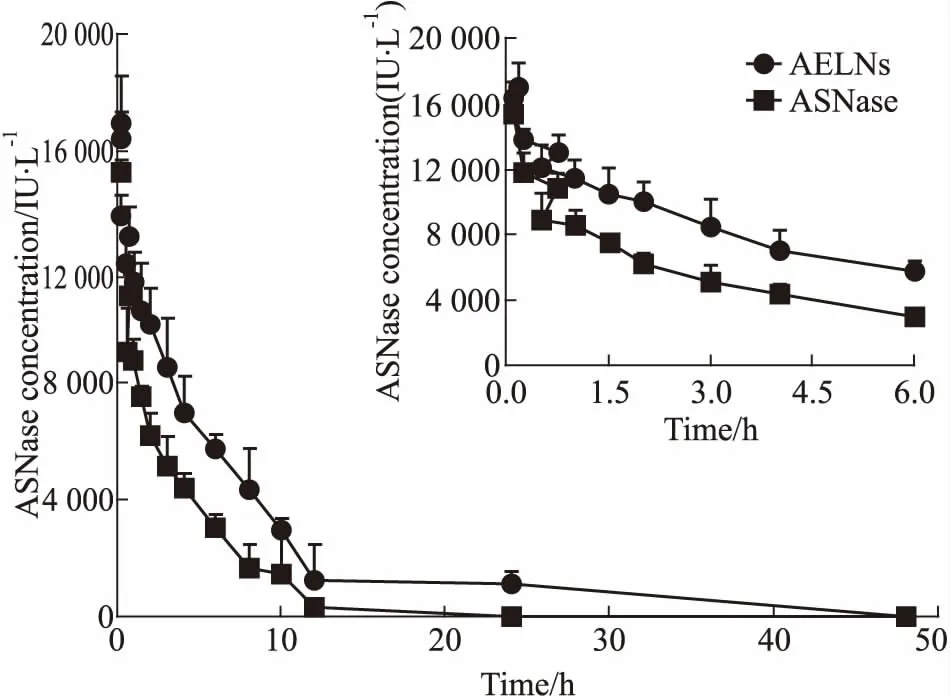
Fig 2 Mean concentration-time curve of ASNaseafter intravenous administration in
经DAS软件(2.1.1版)计算,得到AELNs和游离ASNase的药代动力学参数见Tab 1(非房室模型)和Tab 2(房室模型)。从非室模型药动学参数可知,AELNs的AUC(0~48 h)较游离ASNase增加了约39.07 U·mL-1·h-1,表明血液循环中AELNs的保留量增加;MRT(0~48h)和Cmax分别为游离ASNase的1.94倍和1.14倍,同时游离ASNase的血浆清除速率是AELNs的2.13倍,说明AELNs在血液循环中清除较慢,持续时间较长。房室模型结果与非室模型结果几乎一致。与游离ASNase相比,AELNs的相对生物利用度约为183.15%(非房室模型)或169.11%(房室模型)。以上结果表明,AELNs延长了ASNase在大鼠体内的血液循环时间,提高了ASNase的生物利用度。
3.4 AELNs中EVO的药动学研究绘制静脉注射AELNs和游离EVO后大鼠体内EVO的药-时曲线(Fig 3)。由于复方药物EVO的静脉给药量(2 mg·kg-1)较低,游离EVO组血药浓度低于检测限而未表示出来。如Fig 3所示,静脉注射相同剂量的AELNs(按EVO计)后,AELNs在大鼠血液循环中的保留时间长达6 h。从AELNs的非房室模型主要药动学参数(Tab 3)可知,AELNs的Cmax可达423.37 μg·L-1,AUC(0~48 h)为527.81 μg·L-1·h-1。与张雪等[11]研究结果经剂量换算后比较,在不考虑非线性动力学的情况下,AELNs的相对生物利用度约为游离EVO的28.94倍,EH的11.64倍。以上结果说明,AELNs可延缓EVO的体内清除速率,提高EVO在大鼠体内的生物利用度。
Tab 1 Non-compartment model pharmacokinetic parameters ofintravenously injected AELNs and free ASNase in

Tab 2 Compartment model pharmacokinetic parameters ofintravenously injected AELNs and free ASNase in
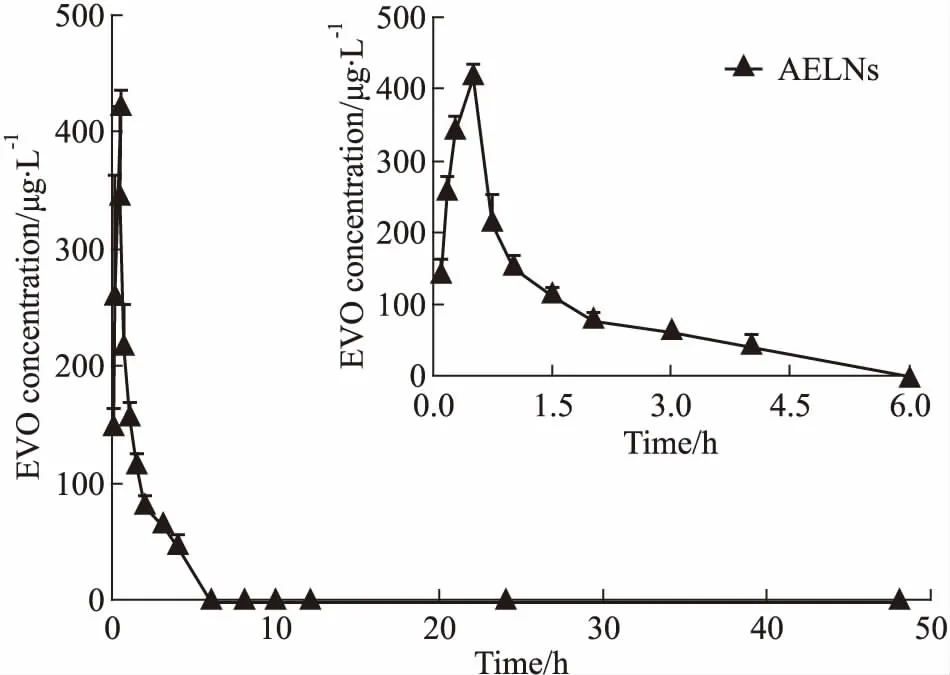
Fig 3 Mean concentration-time curve of EVO inAELNs after intravenous administration in
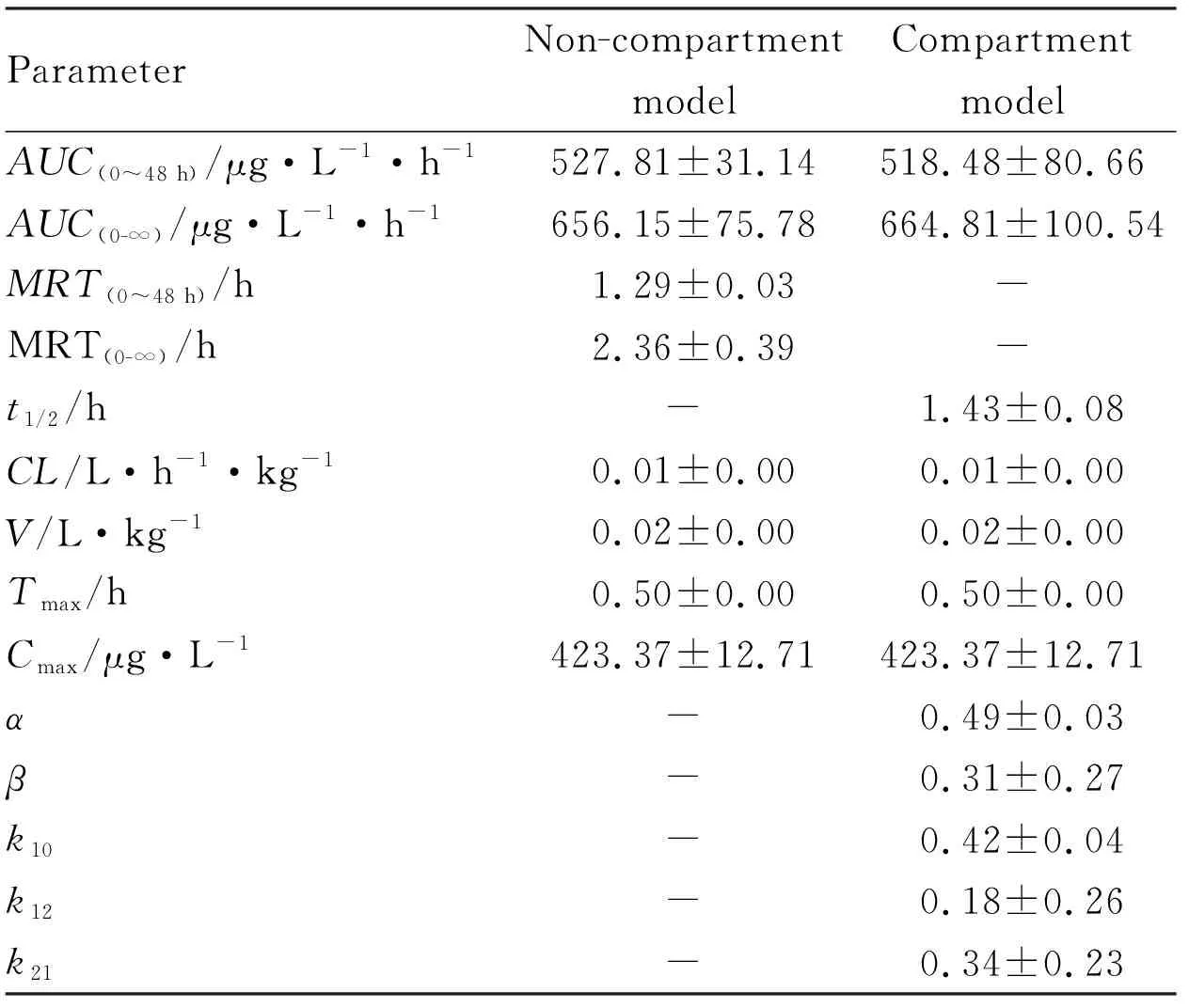
ParameterNon-compartmentmodelCompartmentmodelAUC(0~48 h)/μg·L-1·h-1527.81±31.14518.48±80.66AUC(0-∞)/μg·L-1·h-1656.15±75.78664.81±100.54MRT(0~48 h)/h1.29±0.03-MRT(0-∞)/h2.36±0.39-t1/2/h-1.43±0.08CL/L·h-1·kg-10.01±0.000.01±0.00V/L·kg-10.02±0.000.02±0.00Tmax/h0.50±0.000.50±0.00Cmax/μg·L-1423.37±12.71423.37±12.71α-0.49±0.03β-0.31±0.27k10-0.42±0.04k12-0.18±0.26k21-0.34±0.23
4 讨论
ASNase是一种有效的抗癌酶,其介导的是营养剥夺疗法。该酶可以将肿瘤部位的必需氨基酸天冬酰胺水解掉,从而导致肿瘤细胞营养缺陷[2],对化疗药物敏感。EVO可通过阻滞肿瘤细胞周期和诱导线粒体凋亡而抑制肿瘤细胞增殖[9]。两种药物的组合理论上可通过不同的作用机制增强抗癌作用。因此,本研究首次将ASNase和EVO共同包载于新型核壳型脂质纳米粒AELNs中,并初步考察了AELNs在大鼠体内的药代动力学行为。
本实验分别采用Nessler试剂比色法和HPLC法,测定血浆样品中ASNase和EVO的浓度,方法准确、可靠。大鼠体内药代动力学结果显示,AELNs的相对生物利用度约为游离ASNase的1.83倍。与张雪等[11]研究结果相比较,AELNs的相对生物利用度约为游离EVO的28.94倍。表明通过将药物包封在核壳型脂质纳米粒中,可明显提高药物的生物利用度。该纳米粒提高ASNase生物利用度的机制可能是:① 纳米粒表面的聚乙二醇可以减少载体与血液成分的相互作用,减少RES系统的摄取和肾脏的清除,从而延长纳米粒在体内的半衰期[13];② 纳米粒对ASNase具有封装保护效应,可以有效减少药物分子与血液循环中多种代谢酶的接触,从而减少血浆清除率;③ 纳米粒可以维持ASNase的有效构象,提高其稳定性和催化活性[8,12]。纳米粒提高EVO生物利用度的机制除了与ASNase相同的①、②两点外,可能还有:③ EVO属于难溶性药物,通过环糊精的包合技术可以增加其溶解度,改善其在体内的吸收和分布行为[11];④ 纳米粒中的脂质成分与生物细胞膜亲和力强,可以增加EVO到达靶部位的量[14]。综上所述,该新型核壳型脂质纳米粒可以有效提高ASNase和EVO的生物利用度。
本实验首次制备的新型自组装核壳型脂质纳米粒,不仅可以同时提高大分子药物ASNase和小分子药物EVO的生物利用度和延长血液循环时间,制剂结构中的透明质酸衍生物还具有肿瘤CD44受体靶向的特点[15]。因此,在本实验基础上,还可进一步考察AELNs的肿瘤靶向效率和协同抑癌作用,为构建生物相容性好、靶向性佳、疗效可靠的蛋白多肽类药物与小分子药物协同递送系统奠定良好的基础。
(致谢: 本实验在重庆医科大学重庆高校药物工程研究中心完成,在此真诚感谢实验室的所有老师和同学。)