板桥党参通过PP2A信号通路改善AD模型大鼠认知功能障碍
2019-09-13罗洪斌谢文执
谌 勤,罗洪斌, 2, 3,谢文执
(湖北民族大学1. 医学部生物化学与分子生物学教研室、2. 科技学院生物化学与分子生物学教研室、3. 神经精神共患病研究所,湖北 恩施 445000)
阿尔茨海默病(Alzheimer′s disease,AD)是最常见的老年痴呆症,临床主要表现为记忆力、计算能力及定向能力障碍。老年斑(senile plaque,SP)、神经纤维缠结(neurofibrillary tangles,NFTs)、胆碱能系统功能失调、突触受损及神经元缺失[1]为其主要病理改变。Tau蛋白磷酸化假说认为[2],在AD患者的临床早期即发生其大脑内Tau被过度磷酸化修饰(其磷酸化水平高于正常人的3~4倍),导致Tau与微管蛋白的结合能力下降,并引起该蛋白从微管中脱落,进而影响中枢神经细胞发育、轴突运输及突触间信息的传递。脱落的过度磷酸化Tau会互相聚集形成NFTs,并具有明显的神经毒性,且磷酸化修饰程度与AD患者的痴呆程度呈正相关[3]。大量研究表明,蛋白磷酸酯酶2A (protein phosphatase 2A,PP2A) 能使过度磷酸化修饰的Tau发生去磷酸化修饰,并恢复Tau的正常微管组装能力,而PP2A活性的下降会导致AD的特征性病理改变[4-5]。冈田酸(okadaic acid,OA)是PP2A的特异性抑制剂,大鼠脑海马注射OA后可明显下调PP2A活性,并诱导Tau发生过度磷酸化修饰,进而导致大鼠空间学习记忆障碍[6]。因此,以PP2A为靶点的AD药物研究策略,可为该病的治疗带来新的希望。
板桥党参(BanqiaoCodonopisisPilosula,BCP)为桔梗科党参,属川党参中的小条党参,因主产于恩施州板桥镇,故简称“板党”,为恩施州道地药材,具有补气补血活血之功效。现代药理研究表明,BCP临床疗效确切,在增强免疫力、活血、抗氧化、延缓衰老等方面具有重要的药理作用[7-9]。BCP还可通过糖原合成酶激酶3β(glycogen synthase kinase 3β,GSK-3β)信号通路,改善AD模型大鼠的学习记忆能力,恢复海马受损神经元功能,促进神经发育[10]。但AD发病机制中除GSK-3β信号通路外,PP2A信号通路也发挥了重要作用,查阅文献暂未发现BCP能作用于此信号通路。故有必要探讨BCP对PP2A信号通路的影响,可为中药防治AD提供新的研究思路。
1 材料与方法
1.1 药物与试剂按60 kg成人为标准,给予BCP低、中、高用药剂量分别为15、30、60 g·kg-1·d-1,大鼠按250 g为标准,相当于成人的临床等效的低、中、高剂量分别为0.54、1.08、2.16 g·kg-1·d-1。换算方法根据《药理实验中动物间和动物和人体间的等效剂量换算》计算获得[11]。BCP水煎液制备方法:称量432 g BCP切片,煎取3次,合并滤液,浓缩定量至2.16 kg·L-1备用。OA购自美国Millipore公司;pT231、pS396、pS404、pT181、p307-PP2Ac抗体,购自美国SAB公司;DM-PP2Ac抗体,购自美国Santa Cruz公司;Tau-5、PP2Ac、M-PP2Ac抗体,购自美国Abcam公司;甲酯酶(PME)、N-甲基-D-天冬氨酸受体1(NMDAR1)、突触素(Synaptophysin)抗体,购自美国Millipore公司;NMDAR2B、突触蛋白-1(Synapsin-1)抗体,购自美国Proteintech公司;β-actin抗体,购自美国Bioworld Technology公司。
1.2 仪器脑立体定位仪(美国Stoelting公司);DMS-2型Morris水迷宫系统(中国医学科学院药物研究所);VT1200S振荡切片机(德国Leica公司);三目数字摄影显微镜(日本Nikon公司);099CK5424匀浆机(美国Glas-Col公司);1510全波长酶标仪(美国Thermo Fisher Scientific公司);电泳仪(美国Bio-Rad公司);Odyssey双色红外激光成像系统(美国基因公司)。
1.3 实验动物与分组♂SD大鼠120只,体质量(250±30)g,购自湖北省实验动物研究中心,合格证号为42000600017418。自由进食饮水2周后,随机分为10组:DMSO组(分为1周组和2周组)、OA组(分为1周组和2周组)、BCP低、中、高剂量组(每个剂量组又分为1周组和2周组),共10组,每组10只,另选20只备用。
1.4 AD模型的建立、给药及Morris水迷宫训练DMSO、OA组用温水灌胃,BCP治疗组分别用低、中、高剂量BCP水煎液灌胃,所有大鼠灌胃时间均分为1周和2周。1周组在灌胃的d 2开始水迷宫训练,2周组在灌胃的d 9开始水迷宫训练,训练时间均为5 d,水迷宫训练结束后d 2造模(水迷宫训练方法参考文献[10]),选择能在15 s内找到隐藏平台大鼠(其搜索轨迹笔直简单)用于后续实验[12]。造模方式参考本课题组前期实验[13],分别为DMSO组双侧脑海马各注射10% DMSO 1.5 μL,OA组和BCP治疗组大鼠双侧脑海马各注射OA(0.392 mmol·L-1) 1.5 μL。造模后将大鼠放入温暖环境,等待苏醒。造模24 h后立即进行Morris水迷宫测试。记录实验大鼠寻找隐藏平台的潜伏期和游泳轨迹。实验过程见Fig 1。
1.5 Western blot实验水迷宫测试后,取新鲜大鼠脑海马组织,匀浆后进行Western blot操作。实验方法参照本课题组前期实验[10]。一抗(PME、pS307-PP2Ac、p-Tau-Ser 396、p-Tau-Ser 404、NMDAR 1、Synaptophysin等)孵育过夜;荧光二抗孵育1 h后,TBST洗涤3次,每次10 min。Odyssey扫描仪扫描,ImageJ计算灰度值,SPSS 22.0进行统计分析。
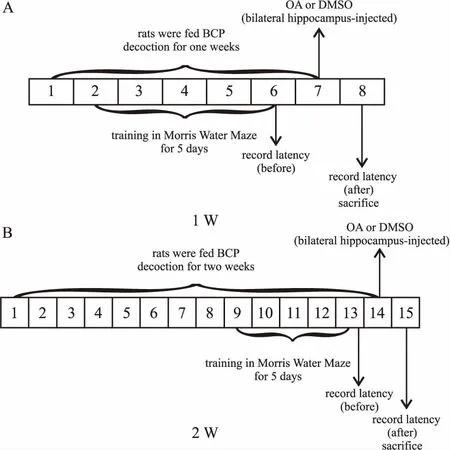
Fig 1 1 week and 2 weeks of experiment procedure
A:1 week of experiment procedure; B: 2 weeks of experiment procedure.
1.6 尼氏染色测试结束后,选3只大鼠进行多聚甲醛灌流,完整的取出整个大脑,浸泡在4%多聚甲醛溶液中,4 ℃冰箱保存。1周后取出大脑,用振荡切片机切片,厚度约30 μm,选取合适脑片进行尼氏染色,中性树胶封片,显微镜下观察拍照分析。
2 结果
2.1 BCP对AD模型大鼠学习记忆能力的影响Fig 2水迷宫实验结果发现,OA模型组大鼠其逃避潜伏期明显延长,同时游泳轨迹凌乱无章,说明大鼠空间学习记忆发生障碍。而低、中、高剂量的BCP不论是1周还是2周治疗组,其逃避潜伏期均明显缩短,目的性强,游泳路程缩短,且呈剂量依赖性。此结果提示,不同剂量的BCP在短期使用和长期使用后,均可明显改善AD大鼠空间学习记忆障碍。
2.2 BCP对AD模型大鼠脑海马组织PP2A活性的调节作用Fig 3的Western blot结果显示,OA组的甲酯酶PME水平增高,进而导致PP2Ac第309位点去甲基化和第307位点磷酸化升高,第309位点的甲基化水平降低。此结果证明,甲酯酶PME增高能引起PP2Ac第309位点甲基化水平降低、第307位点磷酸化升高,最终导致PP2Ac活性下降,说明本实验造模成功。同样的实验结果又发现在BCP中﹑高剂量组中,不管是短时间使用,还是长时间使用,各组甲酯酶PME的表达量及PP2Ac第309位点去甲基化﹑第307位点磷酸化水平均明显下降,而第309位点甲基化水平明显升高,差异具有统计学意义。说明BCP能明显提高PP2Ac活性,且中﹑高剂量组效果更为明显。
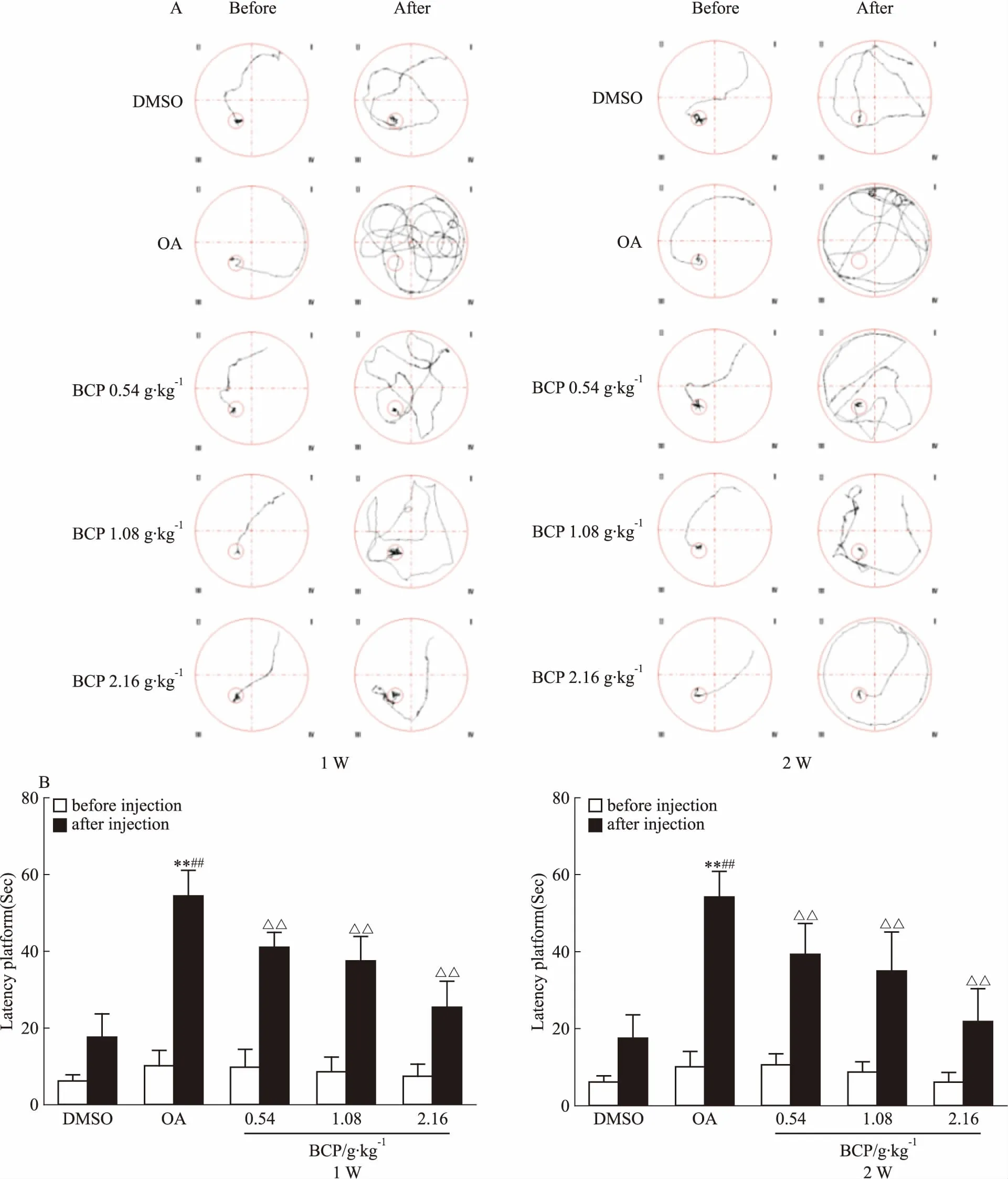
Fig 2 1 week and 2 weeks of BCP administration prevented rats from OA-induced spatial memory retention
A: 1 week and 2 weeks BCP administration improved swimming pathways, which were recorded 24 h after OA injection; B: 1 week and 2 weeks BCP administration shortened the escape latency of OA-injected SD rats in a dose-dependent manner.**P<0.01vscontrol;##P<0.01vsbefore OA injection;△△P<0.01vsOA injection.
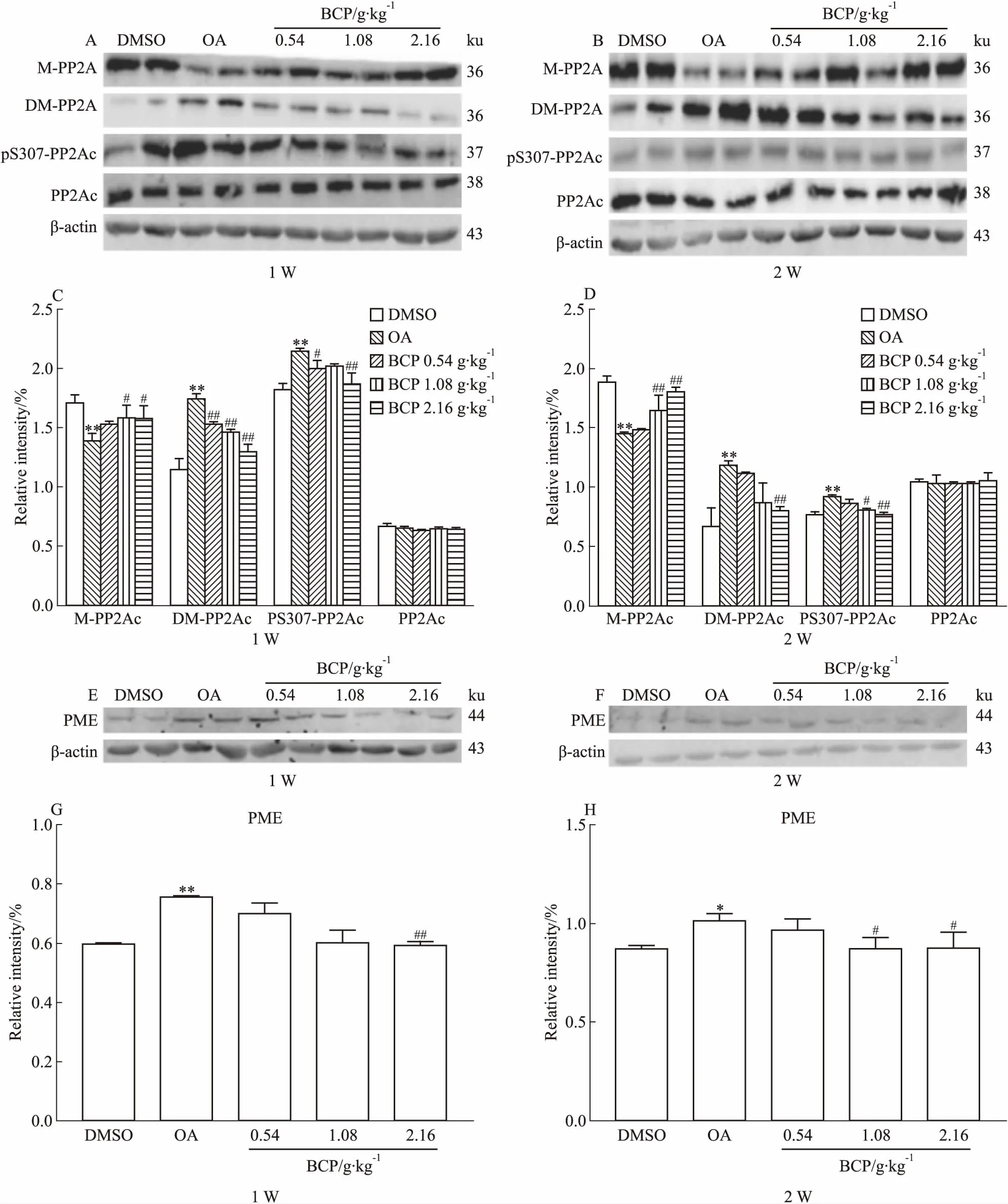
Fig 3 Effects of 1 week and 2 weeks of BCP administration on OA-induced inhibition of n=10)
*P<0.05,**P<0.01vscontrol;#P<0.05,##P<0.01vsOA injection
2.3 BCP对AD模型大鼠脑海马组织中Tau蛋白磷酸化水平的调控作用Fig 4结果显示,OA模型组Tau蛋白pT181、pT231、pS396、pS404这4个位点的磷酸化水平高于DMSO对照组,说明OA确能上调Tau蛋白的磷酸化水平。而BCP治疗1周和2周的中、高治疗组,其Tau蛋白pT181和pS404位点的磷酸化水平明显下降,且具有明显的剂量依赖性。说明中、高剂量的BCP均能明显降低Tau蛋白的异常磷酸化。

Fig 4 Effects of 1 week and 2 weeks of BCP administration onOA-induced Tau hyperphosphorylation in SD rat n=10)
*P<0.05,**P<0.01vscontrol;#P<0.05,##P<0.01vsOA injection
2.4 BCP对AD模型大鼠脑海马组织突触相关蛋白表达的影响如Fig 5所示,OA组突触蛋白表达较DMSO组明显下降,说明OA能明显降低突触相关蛋白的表达量。BCP治疗组突触蛋白较OA组增加,BCP中﹑高剂量组灌胃1周其海马组织Synapsin-1和NMDA-2B蛋白表达上调,而Synaptophysin蛋白在用药第1周的各组中也表达升高;在BCP灌胃2周的高剂量组,Synapsin-1蛋白增加,同时该中﹑高剂量组的Synaptophysin和NMDA-2B蛋白表达同样增加。说明中﹑高剂量的BCP可明显提高OA诱导的AD模型大鼠脑海马组织中的突触相关蛋白表达量。
2.5 BCP对AD模型大鼠脑海马神经元活性的影响Fig 6尼氏染色结果发现,OA模型组与DMSO对照组相比脑海马CA1和CA3区其尼氏小体着色变浅,数量明显减少。而BCP中、高剂量组在大鼠脑海马CA1和CA3区神经元尼氏小体着色加深且数量增多,特别是2周组,同时还具有剂量依赖性。此结果证明,中、高剂量BCP在两个时间点均能增加大鼠脑海马尼氏小体数量,恢复AD大鼠神经元活性。
3 结论
AD患者因其高昂的护理和治疗成本,给家庭和社会带来沉重的经济压力和精神负担,因此,寻找防治AD的有效药物就显得尤为重要。本课题组前期实验发现,BCP能抑制蛋白激酶GSK-3β活性,改善因该酶活性升高诱导的AD模型大鼠认知功能障碍,促进神经发育[10]。说明该药在防治AD方面具有重要的研究价值。大量文献已证明,PP2A活性降低可促进Tau蛋白过度磷酸化,最终导致NFTs形成[14]。因此,寻找能有效提高PP2A活性的药物就成为AD防治的重要研究内容,同时,查询文献又未发现BCP能作用于PP2A信号通路,逆转AD的病理改变。因此,本研究拟采用大鼠脑海马注射PP2A特异性抑制剂OA来构建AD动物模型,再给予BCP处理,探讨使用不同剂量的BCP是否具有改善OA诱导的AD模型大鼠认知功能障碍的作用,并探明此药的量效关系和不同使用时间(即1周和2周两个时间点)的药效关系。
本实验的水迷宫实验结果发现,大鼠脑海马注射OA能导致大鼠空间学习记忆障碍,而该模型中不同剂量的BCP在使用1周和2周后,均可明显改善OA诱导的AD模型大鼠空间学习记忆障碍,且呈剂量依赖性。提示BCP在行为学方面具有改善学习记忆能力的作用。
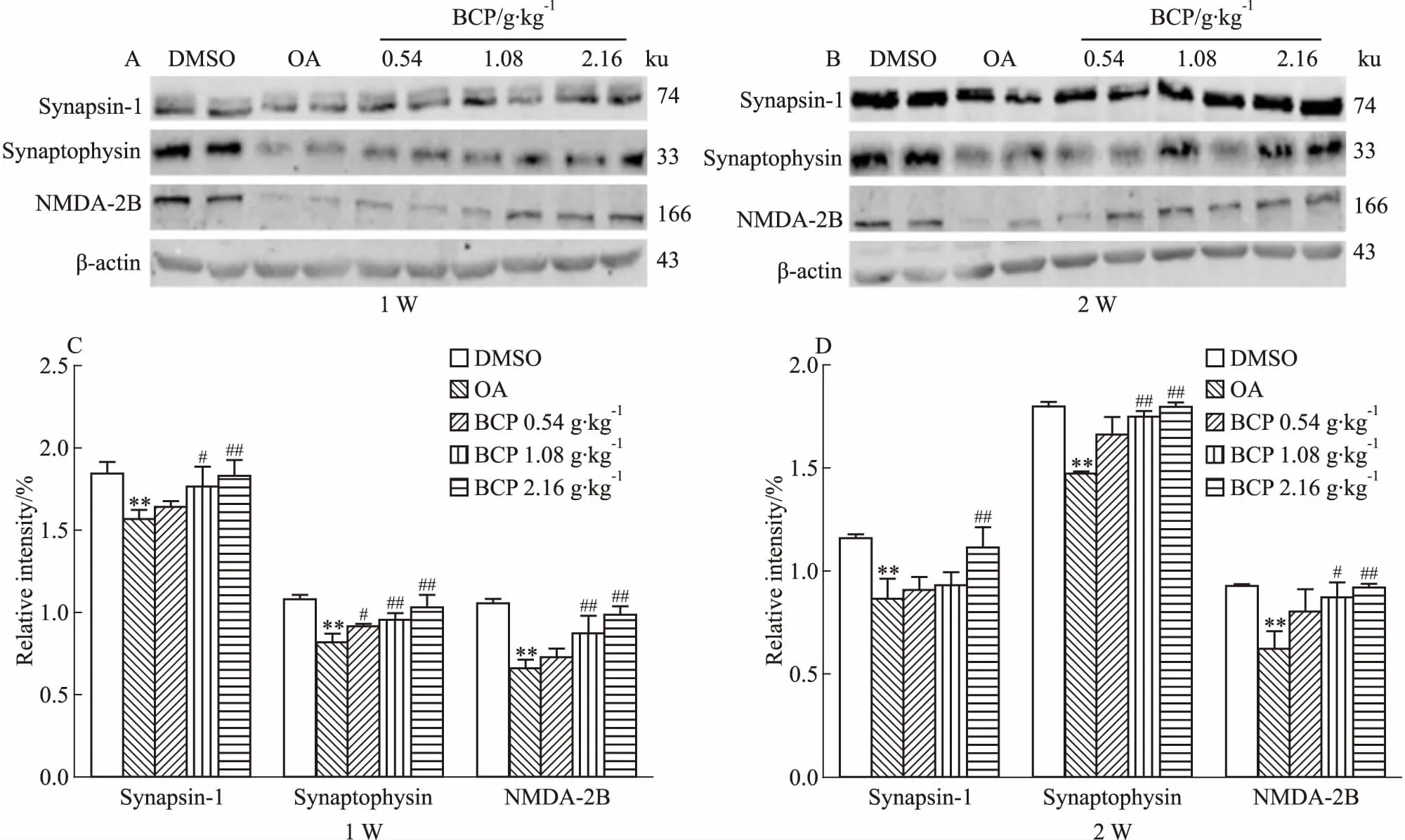
Fig 5 Effects of 1 week and 2 weeks of BCP administration on OA-induced synaptic proteins in SD rat n=10)
**P<0.01vscontrol;#P<0.05,##P<0.01vsOA injection
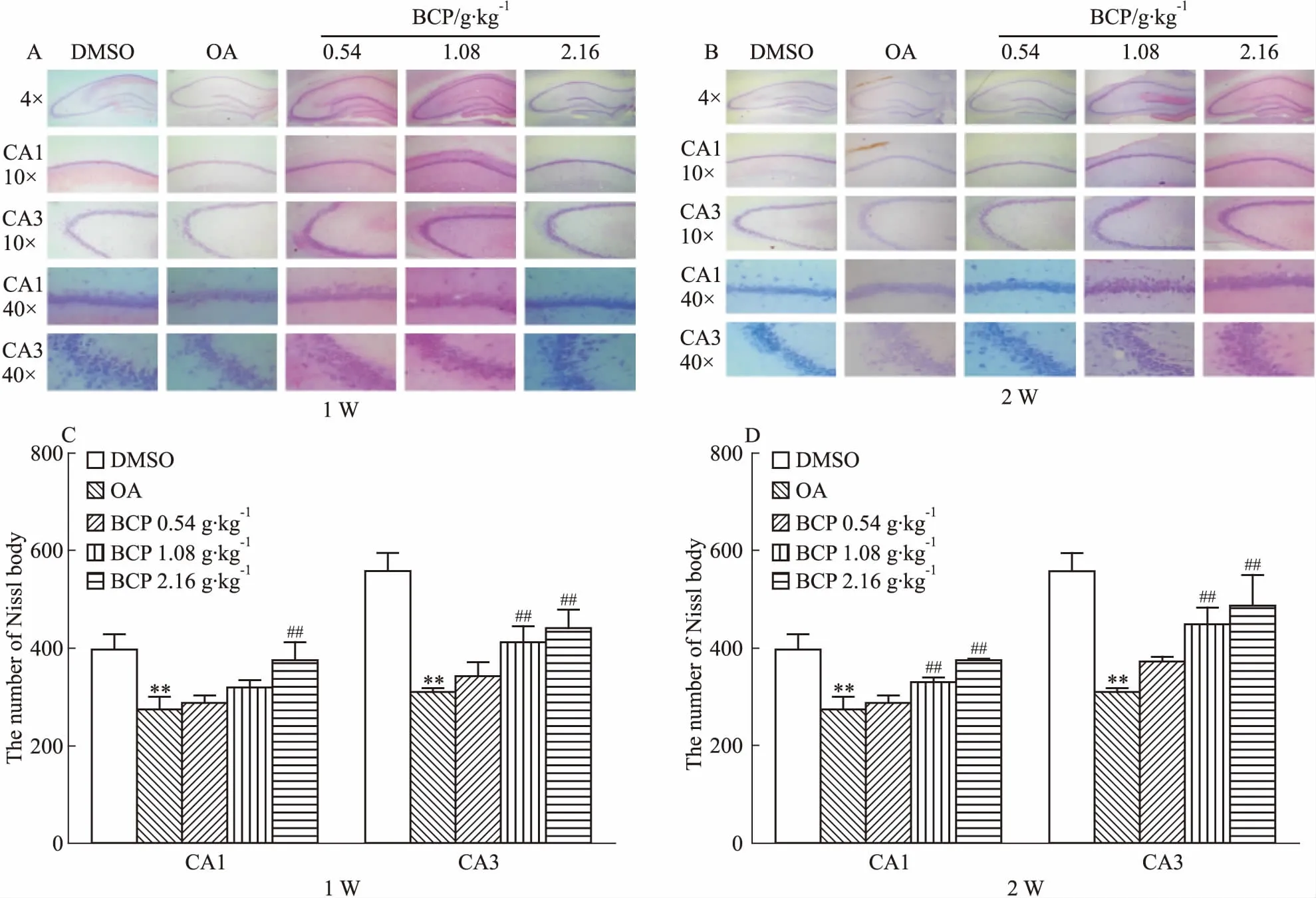
Fig 6 Effects of 1 week(A) and 2 weeks (B) of BCP administration on OA-induced Nissl body decrease in SD rat hippocampus n=3)
**P<0.01vscontrol;##P<0.01vsOA injection
为探明BCP增加学习记忆能力的机制,研究者又进行了Western blot实验,以检测PP2A信号通路中各相关蛋白表达情况。结果发现,BCP能有效抑制AD模型大鼠脑海马组织中PME的表达,该酶作用的底物蛋白PP2A总的表达量虽未见明显变化,但PP2A的催化亚基——PP2Ac的甲基化、去甲基化和磷酸化水平均有明显改变,其中PP2Ac甲基化水平升高,而去甲基化和磷酸化水平明显降低,最终提高了PP2A活性。故研究者认为,两个时间点的BCP均能通过抑制PME表达,来上调AD模型大鼠脑海马中的PP2A活性。
BCP是否能够通过上调PP2A活性来下调Tau的磷酸化水平呢?本研究又选取了与PP2A相关的Tau蛋白磷酸化特异性位点修饰情况进行研究。结果发现,预先给予两个时间点的BCP,即使脑海马注射了PP2A特异性抑制剂,Tau蛋白pT181、pT231、pS396、pS404这4个位点的磷酸化水平也明显下降(该4个位点的过度磷酸化均能不同程度促进NFTs的形成[15]),且与剂量密切相关。上述实验结果提示,BCP能通过上调PP2A活性,来下调Tau蛋白特异性位点的磷酸化水平。
由于认知水平与海马组织中突触相关蛋白表达水平存在正相关,因此,我们又检测了使用BCP后AD大鼠脑海马中突触相关蛋白的表达情况。结果发现,BCP灌胃1周和2周后,突触相关蛋白Synapsin-1、NMDA-2B及Synaptophysin表达均明显增高,其中、高剂量组尤为明显。提示BCP可提高因PP2A活性下降导致的AD模型大鼠脑海马组织中突触相关蛋白的表达水平,促进突触发育。
尼氏小体结构变化能反映神经元功能情况,当受损神经元功能修复后,已溶解甚至消失的尼氏小体可重新出现[16]。为验证BCP是否具有修复受损神经元的功能,我们又进行了尼氏小体染色实验。结果发现,中、高剂量的BCP使用1周和2周后,均能使AD模型大鼠脑海马CA1和CA3区尼氏小体数量增多,着色加深,并呈剂量依赖性。提示中、高剂量的BCP能在不同时间点增加尼氏小体的数量和分布,修复AD大鼠脑海马受损神经元。
综上所述,BCP能有效改善OA诱导的AD模型大鼠认知功能障碍,其可能的作用机制是通过调节PP2A信号通路中各相关蛋白的表达水平,进而上调PP2A活性,最终降低了Tau蛋白的磷酸化水平。同时,还可通过上调PP2A活性,提高海马组织中突触相关蛋白表达水平,修复受损神经元,且该药效与其使用时间、剂量具有一定相关性。这一研究结果可为BCP的临床应用提供实验依据,但要明确其有效作用成分还有赖于进一步的研究探讨。