二甲双胍治疗Ⅱ型糖尿病大鼠的代谢组学研究
2019-09-13曾晓会卓俊城谢凯枫李钰婷占心佾陈玉兴甘海宁黄雪君黄丹娥
曾晓会, 卓俊城,3, 谢凯枫,3,李钰婷,3, 占心佾,3, 陈玉兴, 甘海宁, 黄雪君, 黄丹娥
(1. 广东省中医药工程技术研究院,广东 广州 510095; 2. 广东省中医药研究开发重点实验室,广东 广州 510095;3. 广州中医药大学第五临床医学院,广东 广州 510405)
2型糖尿病(type 2 diabetic melitus,T2DM)是一种经典的糖脂代谢性紊乱疾病,主要病因为胰岛素相对缺乏,或者胰岛素敏感性下降引起的胰岛素抵抗,症状表现为胰岛素代偿、高血糖以及高血脂,长期发展将衍生危害性极大的并发症,如糖尿病肾病、眼病及残足,严重影响患者生活质量[1]。据世界卫生组织预计,在2035年,全球罹患T2DM的人数将达到5.3亿[2]。
目前认为,脂质代谢的紊乱是T2DM发病机制的重要诱因,故临床上采取的治疗策略是降糖与调脂并重。研究发现,脂肪酸、磷脂和胆汁酸代谢的异常能促进胰岛素抵抗进程,从而进一步恶化T2DM,但关于这部分的作用机制尚未明确[3-4]。二甲双胍是治疗T2DM的一线药物,临床使用已超过50多年。目前认为,它的药理作用机制主要是通过促进糖酵解和脂肪酸氧化,以及抑制糖异生途径和脂肪酸合成,从而改善胰岛素抵抗,治疗T2DM[5]。虽然二甲双胍调节脂质代谢的作用机制目前有所进展,但研究者们认为还未充分认识二甲双胍在脂质代谢中扮演的角色,所以还需要对其药理作用进一步研究和发现[6]。
代谢组学是运用高通量仪器,对机体内分子质量小于1 000的代谢物质进行定性定量分析,旨在寻找与生理病理存在规律的特异性分子标志物,适用于研究代谢性疾病的发病机制及治疗药物的作用机制。已有多篇文献运用代谢组学手段研究T2DM的发病机制,并且取得了一定的进展[7-8]。故本实验欲采用非靶向代谢组学手段,研究二甲双胍对T2DM大鼠血清中脂质代谢物质的影响,并通过潜在的生物标志物,预测并用分子生物学手段验证二甲双胍可能作用的代谢通路,为二甲双胍创新开发提供理论依据。
1 材料
1.1 实验动物健康♂Wistar大鼠,体质量(180~220) g,购自广东省医学实验动物中心,实验动物生产许可证号:SCXK(粤)2013-0002,实验动物质量合格证号:GDPITCM160805。动物饲养在广东省中医药工程技术研究院SPF级动物实验室,设施使用许可证号:SYXK(粤)2010-0059。
1.2 药物与试剂链脲佐菌素(streptozotocin,STZ),纯度>98%,Biosharp公司;盐酸二甲双胍片(批号:AAN6706,每片0.5 g),购自中美上海施贵宝制药有限公司;胆固醇(total cholesterol,TC)试剂盒(批号20180415)、甘油三酯(triglyceride,TG)试剂盒(批号20180415)、游离脂肪酸(free fatty acids,FFA)试剂盒(批号20180415)、葡萄糖(glucose,GLU)试剂盒(批号20180415),均购自南京建成生物工程研究所;HPLC级乙腈(美国默克公司);HPLC级甲酸(美国Acros);AB Sciex 5600 Triple TOF校正液(美国AB Science公司)。
1.3 仪器AB Sciex 5600 Triple TOF液质联用仪(UPLC/ESI-T-TOF/MS,美国AB Science公司);Acquity BEH C18色谱柱(美国Waters);IQTM5型荧光定量PCR仪(美国Bio-Rad公司);SmartSpec plus 核酸蛋白测定仪(美国Bio-Rad公司)Velocity 14R高速冷冻离心机(澳大利亚Dynamic);超纯水仪Milli-Q(美国MILLIPORE);Varioskan Flash型全波长多功能酶标仪(美国Thermo公司);LBY-N7500AHemsr全自动血流变检测仪(北京普利生仪器有限公司);5450型小型高速离心机(德国Eppendorf公司);BSA2245型电子天平(赛多利斯科学仪器有限公司);YD-L6型智能型生物组织包埋机(浙江省金华市益迪医疗设备厂)。
2 方法
2.1 T2DM大鼠模型的制备高脂高糖大鼠饲料(high fat and high sugar diet,HFSD)的配比为:20%果糖、12%猪油、5%脱脂奶粉、2%鸡蛋黄和61%普通饲料。大鼠在恒温(24±2)℃、光照周期12 h/12 h环境中分笼饲养,适应性饲养1周。用HFSD喂养Wistar大鼠连续4周后,肌肉注射35 mg·kg-1STZ,72 h后测定空腹血糖,空腹血糖连续3 d≥11.1 mmol·L-1,判断为T2DM。
2.2 分组及给药随机选取10只Wistar大鼠作为正常对照组,将剩余20只大鼠造模后,根据血糖值,随机分成模型组和二甲双胍组,每组10只。二甲双胍组大鼠灌胃给予二甲双胍180 mg·kg-1,按照给药体积10 mL·kg-1与去离子水每天现配现用;正常组和模型组每天灌胃给予等量去离子水,连续给药8周后结束实验。
2.3 样品采集实验结束后,10%水合氯醛麻醉大鼠,腹主动脉取血,分别置于EDTA抗凝管及普通采血管中;将肝脏和胰腺各取部分,置于10%甲醛溶液中保存,其余部分于-80 ℃储存。
2.4 代谢组学样品制备将冻存血清从-80 ℃冰箱取出,在室温缓慢解冻,向300 μL血清加入900 μL乙腈,2 000 r·min-1涡旋混匀2 min,4 ℃、15 000 r·min-1离心15 min,然后取上清液,转移至2.0 mL进样瓶内。
2.5 液质联用分析检测条件
2.5.1液相条件 Acquity BEH C18分析柱(100 mm×2.1 mm,1.7 μm),流动A相为0.1%甲酸水溶液;流动B相为乙腈,通过梯度方式洗脱样品,具体梯度组成:0~2.0 min,98% A;2.0~4.0 min,98%-75% A;4.0~10.0 min,75%-50% A;10.0~12.0 min,50%-35% A;12.0~22.0 min,35%-15% A;22.0~30.0 min,15%-0% A;30.0~32.0 min,0% A。流速为0.4 mL·min-1,柱温为30 ℃,进样量为2 μL。
2.5.2MS条件 实验选用ESI源,在正、负离子两种模式下检测分析,均采用高分辨和动态背景扣除模式,并分别设置为1级(TOF MS)和2级(Product Ion)检测参数。TOF MS参数设为采集范围100~2 000 Da;采集时间30 min;扫描时间0.08 s;脱溶剂气流速度为50 mL·min-1;雾化气流速度为50 mL·min-1;气帘气流速为35 mL·min-1;脱溶剂气温度为500 ℃;去簇电压为+80/-100 V;离子喷雾电压为+5 500/-4 500 V;碰撞能±10 V;排除同位素4 Da;质谱漂移范围50 mDa。Product Ion参数设为采集范围50~1 000 Da;采集时间31 min;扫描时间0.1 s;脱溶剂气流速为50 mL·min-1;雾化气流速为50 mL·min-1;气帘气流速为35 mL·min-1;脱溶剂气温度为500 ℃;去簇电压为+80/-100 V;离子喷雾电压为+5 500/-4 500 V;碰撞能为±40 V;碰撞能分散度为15;离子束宽度25;离子释放延迟70;排除同位素4 Da;质谱漂移范围在50 mDa。
2.6 qPCR检测大鼠肝脏基因mRNA的表达各组大鼠取同一位置肝脏100 mg,液氮下研磨,然后加入1 mL TRIzol试剂,混匀后转移到至离心管中,室温放置5 min。4 ℃、12 000 r·min-1离心10 min。取出上清液,转入新的离心管中,加入200 μL氯仿,混匀,4 ℃、12 000 r·min-1离心10 min。上清液转移到新的离心管,加入等体积异丙醇,-20 ℃冰箱静置过夜。次日,4 ℃、12 000 r·min-1离心10 min。弃上清,沉淀用75%乙醇洗涤两次后,室温下干燥。最后用200 μL灭菌超纯水溶解沉淀,并用核酸蛋白测定仪测定OD260/OD280比值,算出RNA的浓度和纯度[9]。加入上述提取的总RNA,用RevertAidTMFirst Strand cDNA合成试剂盒进行反转录,合成cDNA。取1 μL cDNA、12.5 μL MaximaTM SYBR Green/Fluorescein qPCR Master Mix (2×)、1 μmol·L-1正向引物和1 μmol·L-1反向引物,配成25 μL的反应体系。cDNA使用特定引物加热变性,混合后加入至PCR仪进行扩增。第1步94 ℃ 5 min;第2步95 ℃ 30 s,55 ℃ 30 s,72 ℃ 50 s,45个循环;第3步72 ℃ 7 min。引物由生工生物工程(上海)有限公司合成,引物序列见Tab 1。
2.7 病理组织切片将肝脏以及胰腺除去器官周围的脂肪及结缔组织,生理盐水冲洗后,用10%甲醛固定组织,随后依次使用乙醇浓度梯度法脱水,将脱水后的组织浸入二甲苯,待组织呈透明状时,停止二甲苯浸泡。随后,将组织进行包埋、切片和烘干。经二甲苯脱蜡后,用乙醇梯度法洗去二甲苯。之后进行苏木精-伊红染色,用乙醇脱水,二甲苯透明,最后用中性树脂封片,并观察。
3 结果
3.1 生化指标结果如Fig 1所示,与对照组相比,模型组的体质量和胰腺指数明显下降(P<0.05),肝脏指数明显上升(P<0.01);二甲双胍组的体质量和胰腺指数均明显回升(P<0.05),且肝脏指数明显降低(P<0.01)。从糖脂生化指标的结果可明显看出,与对照组相比,OGTT在模型组中明显受损,模型组中的胰岛素含量明显降低,TC、TG、FFA和GLU均明显升高(P<0.01),表明模型大鼠已呈现明显的胰岛素抵抗症状,糖脂已明显紊乱;而二甲双胍能明显改善OGTT,升高胰岛素水平,降低TG、FFA和GLU水平(P<0.05)。Tab 2结果显示,在模型大鼠中,低切、中切、高切和血液黏度均明显升高(P<0.01),呈现血瘀的症状,而二甲双胍均能明显降低这4个血液流变学指标(P<0.05)。
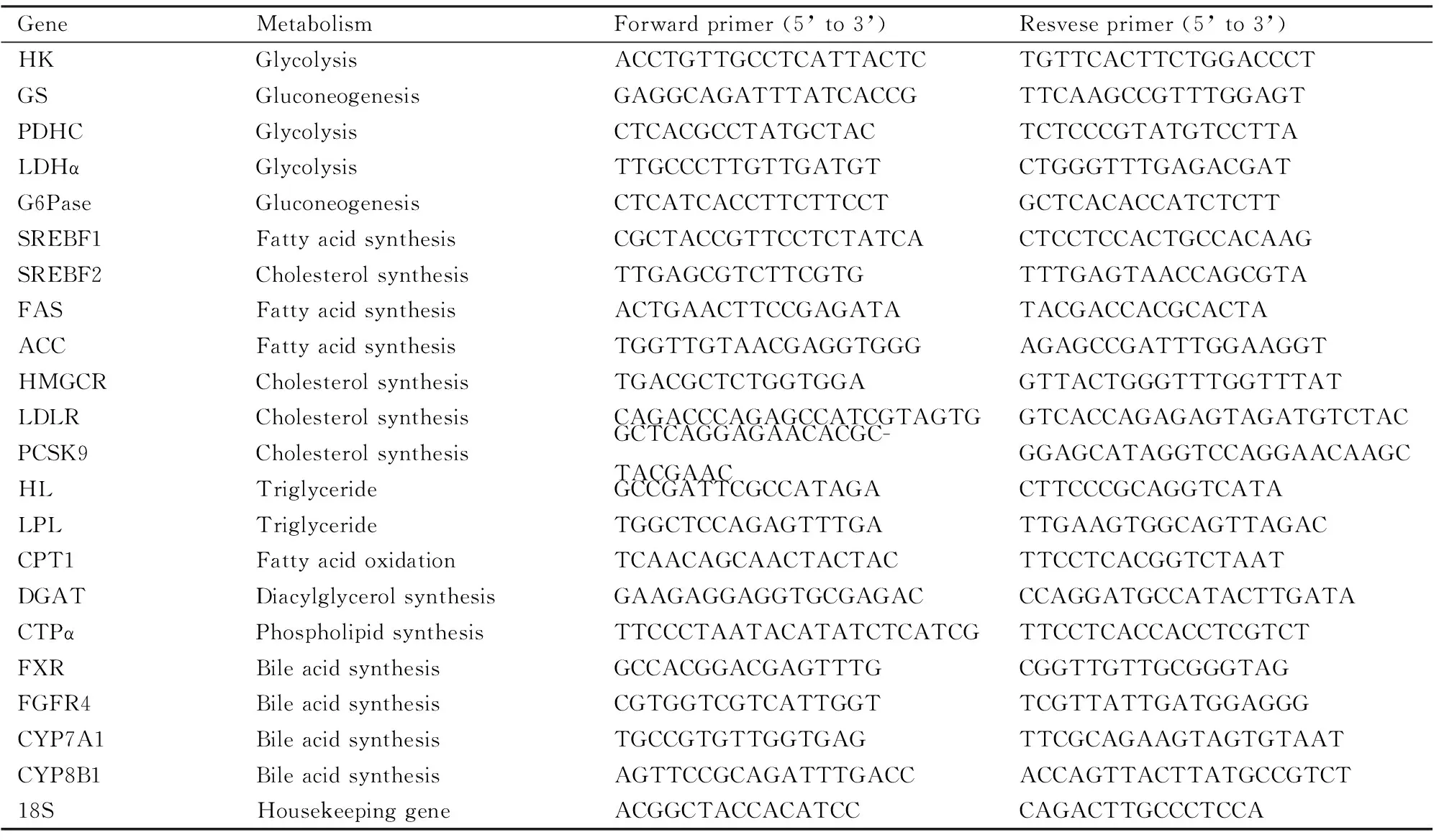
Tab 1 Primer sequences
G6Pase:glucose-6-phosphatase; GS:glucogen synthase; HK:hexokinase; PDHC:pyruvate dehydrogenase complex; LDHalpha:lactate dehydrogenase alpha; ACC:acetyl coenzyme A carboxylase; CPT1:carnitine acyltransferase 1; FAS:fatty acid synthase; HMGCR:methyl-glutamyl coenzyme A; HL:hepatic total esterase; LDLR:LDL receptor; LPL:lipoprotein esterase; PCSK9:proprotein convertase subtilisin/kexin type 9;SREBF1:steroid response element binding factor 1; SREBF2:steroid response element binding factor 2; FXR:fanisoloid X receptor; FGFR4:fibroblast growth factor receptor 4; CYP7A1:cholesterol 7alpha-hydroxylase; CYP8B1:cytochrome P450 family 8 subfamily B member 1; CTPα:cyphadine triphoste alpha; DGAT:diglyceride acyltransferase.
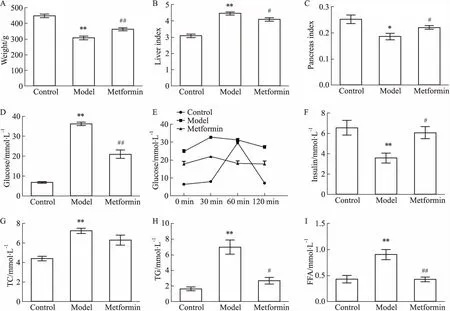
Fig 1 Effect of metformin on serum biochemical indicators in T2DM
A:Body weight; B:Liver coefficient; C:Pancreas coefficient; D:Blood sugar; E:OGTT; F:Insulin; G:Total cholesterol; H:Total triglycerides; I:Free fatty acids.*P<0.05,**P<0.01vscontrol group;#P<0.05,##P<0.01vsmodel group.
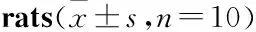
Tab 2 Effect of metformin on hemorheological indicators in T2DM
**P<0.01vscontrol group;#P<0.05,##P<0.01vsmodel group
3.2 PCA结果分析本实验中,先采用非监督的PCA分析方法识别不同组别之间的主成分,相似的样本会聚在一起,有差异的样本则会分布于不同的区域,通过每一个样品在空间中的分布可以清晰地了解代谢变化的趋势。从PCA score图中可明显看出(Fig 2A、2B),在正、负离子模式下,模型组与正常组之间分离良好,说明代谢谱可以有效辨别疾病与正常大鼠之间的差异;且二甲双胍组与模型组之间分离良好,无交叉重叠的现象,说明二甲双胍对T2DM大鼠的代谢物质具有一定的影响。离子加载图(inion loading)则能直观地看出是否存在潜在的分子标志物,离绿色聚集区距离越远的离子,对差异的贡献度就越高。由Fig 2C、2D可分析出,在正、负离子模式下,均存在潜在的分子标志物。
3.3 PLS-DA结果分析采用PLS-DA对代谢谱差异进行了最大限度的分析。结果显示,正离子模式:R2X=0.914,R2Y=0.981,Q2 (cum) =0.934;负离子模式:R2X=0.589,R2Y (cum)=0.989,Q2 (cum) =0.908;以上各组的PLS-DA图中Q2Y(cum)、R2Y(cum)的值均接近于1,并且R2Y(cum) 与Q 2Y(cum)之间的差值小于0.3,表明该模型具有良好的拟合度和预测能力。由Fig 3A、3B可以清晰地看出,模型组与对照组之间离散程度良好,表明该两组间的代谢物质有明显的改变,其T2DM大鼠内源性代谢物质的变化可区别于正常组大鼠。在正、负离子模式下,二甲双胍组与正常组、模型组之间均分离良好;在PLS-DA Score的三维模式下(Fig 3C、3D),可直观地看出,二甲双胍组与正常组、模型组之间并没有空间上的叠合,结果说明二甲双胍对T2DM大鼠的代谢物质有明显的影响。
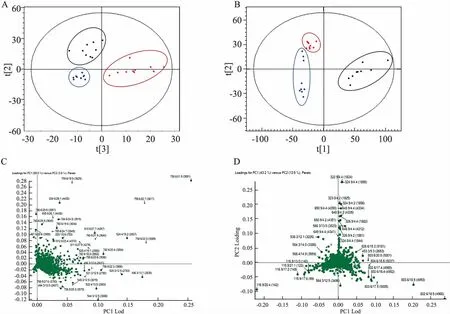
Fig 2 PCA results of serum metabonomics and ion loading maps of T2DM rats
A, B:Two-dimensional PCA diagrams in positive and negative ion modes; C, D:Ion loading diagrams in positive and negative ion modes respectively.
Fig 3 PLS-DA results of serum metabonomics in T2DM rats
A, B:PLS-DA two-dimensional maps in positive and negative ion mode; C, D:PLS-DA three-dimensional maps in positive and negative ion mode respectively.
3.4 潜在的生物标志物的分析根据在PCA和PLS-DA分析中的显著性指标,在t检验和变异重要性(VIP)>1的标准下,筛选出具有显著性差异的化合物。结果在各组中找到了17个具有明显差异的化合物(Tab 3)。然后,根据所得到的分子式进行数据库检索,鉴定出其差异性代谢产物,并将其大致归类为:磷脂类[溶血磷脂类:LPCs, 磷酯胆碱类:PCs和PGP (18 ∶1)], 磷脂降解产物 (磷脂酸乙醇胺:CNE), β氧化产物 (3-羟基己二酸:HAA,乙烯酰甘氨酸:VAG,二十四碳六烯酸:THA), 胆酸 (胆酸:CA; 去鹅氧胆酸:CDCA,去猪氧胆酸:IDCA), 三酰甘油水解产物[单酰甘油,MG (22 ∶4)], 糖代谢产物 (葡萄糖-6-磷酸:G6P), 胆固醇合成产物 (醛固酮:ADO),花生四烯酸产物 (三羟基缩水甘油三酯酸:11,12,15-THETA)。发现其主要涉及的代谢通路有脂肪酸代谢、胆酸代谢、胆固醇代谢、糖代谢以及磷脂代谢等重要代谢途径。
此外,通过聚类和热图分析(Fig 4),可以直观地看出内源性代谢物在各组间差异的行为表现。其中发现,二甲双胍能上调的差异性生物标志物有MG(22 ∶4)、THETA、CNE、CA、CDCA、IDCA和THA;下调的差异性生物标志物有G6P、LPCs、PCs、PGP(18 ∶1)、HAA、VAG和ADO;并且经生物标志物含量测定及对比,差异具有统计学意义。
The response values of metabolites in model group and metformin group were calibrated with those in blank control group, ↑ indicating an increase in the level, ↓ indicating a decrease in the level.*P<0.05,**P<0.01vsnormal group,#P<0.05,##P<0.01vsmodel group.
Normal group (Control 01~Control 10), model group (Model 01~Model 10), metformin group (Met01~Met10).
3.5 qPCR结果分析Tab 4结果显示,与正常组相比,模型组中G6Pase、LDHα和GS的基因表达均明显上调(P<0.01),PDHC的基因表达明显下调(P<0.05);二甲双胍则能明显下调这3个基因的表达(P<0.05),上调PDHC的表达水平。同时,模型组与二甲双胍组之间HK的基因表达差异无显著性 (P>0.05)。与FFA合成代谢相关的SREBF1、FAS、ACC、CTP1和LPL的基因,在模型组中的表达均较正常对照组明显上调(P<0.05),而二甲双胍明显下调SREBF1、FAS、ACC、CTP1和LPL的表达(P<0.05);HL表达在各组间差异无统计学意义(P>0.05)。与正常对照组相比,与胆固醇合成有关的SREBF2、HMGCR、LDLR、PCSK9在模型组中的基因表达明显上调(P<0.05),而二甲双胍能明显下调SREBF2在模型中的表达(P<0.05),对HMGCR、LDLR、PCSK9的表达无明显影响(P>0.05)。与正常对照组相比,模型组CYP7A1和CYP8B1基因表达均明显上调(P<0.05),而二甲双胍明显下调CYP7A1和CYP8B1的基因表达水平(P<0.05)。在模型组中,FXR和FGFR4的基因表达与正常对照组之间差异无统计学意义(P>0.05),但二甲双胍能明显上调FXR和FGFR4的基因表达(P<0.05)。此外,与正常对照组相比,模型组DGAT和CTPα基因表达均明显上调(P<0.01),而二甲双胍能明显下调DGAT和CTPα基因表达(P<0.05)。在模型组中,TNF-α和IL-6基因表达均明显升高(P<0.01),二甲双胍能明显降低这两个炎症基因的表达水平(P<0.01)。
3.6 病理结果分析肝脏和胰腺组织的病理结果见Fig 5,正常组中的肝细胞呈类圆形,胰腺细胞呈卵圆形,边界清晰且细胞核完整;与对照组相比,模型组肝细胞与胰腺细胞均出现排列紊乱,形状不规则,并伴随细胞边界模糊和细胞核的萎缩,呈现弥漫性脂肪样变;与模型组对比,在二甲双胍治疗组中,肝组织细胞与胰腺细胞的结构与边界均较为清晰整齐,脂肪空泡大小和数量均有不同程度的减少,与模型组相比病理程度有所减轻。说明二甲双胍能够减轻脂肪变性对肝组织和胰腺细胞造成的损伤。
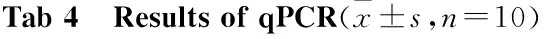
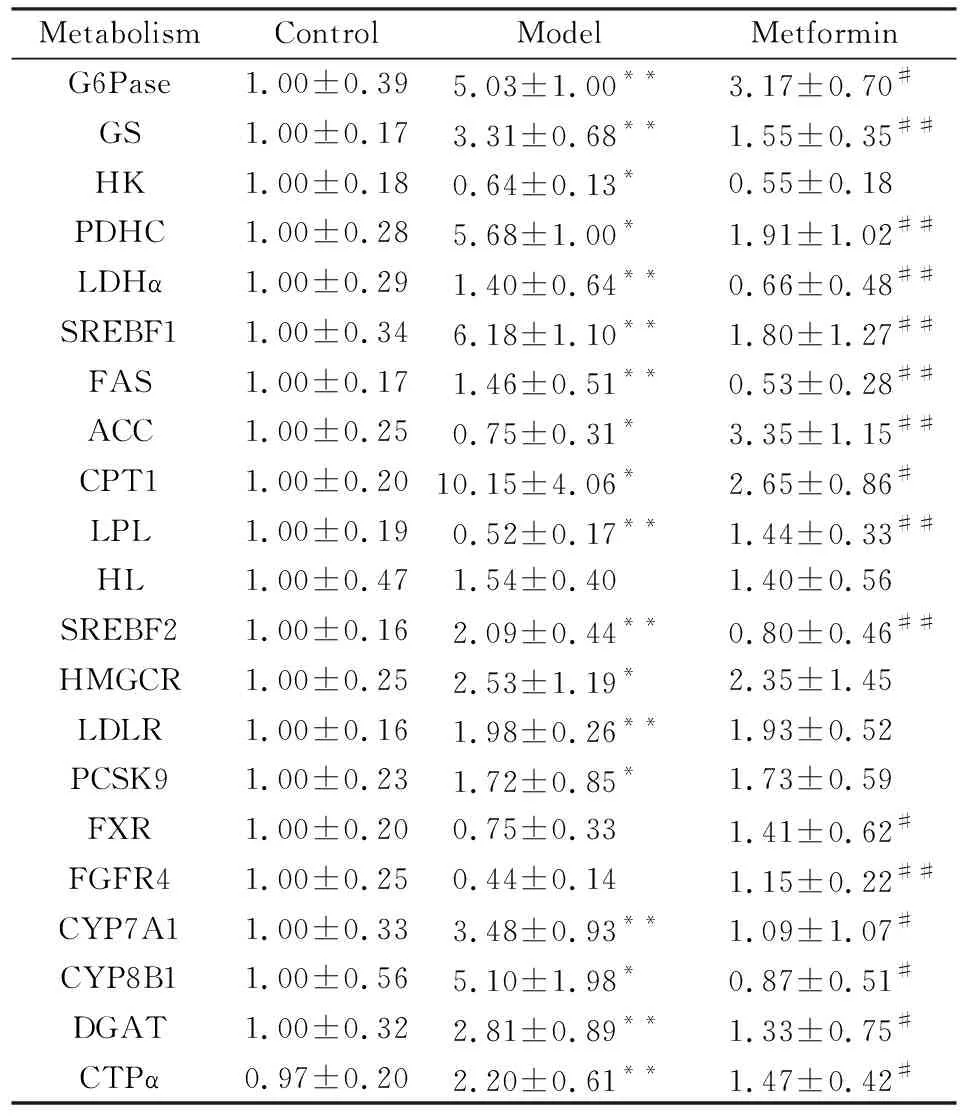
MetabolismControlModelMetforminG6Pase1.00±0.395.03±1.00**3.17±0.70#GS1.00±0.173.31±0.68**1.55±0.35##HK1.00±0.180.64±0.13*0.55±0.18PDHC1.00±0.285.68±1.00*1.91±1.02##LDHα1.00±0.291.40±0.64**0.66±0.48##SREBF11.00±0.346.18±1.10**1.80±1.27##FAS1.00±0.171.46±0.51**0.53±0.28##ACC1.00±0.250.75±0.31*3.35±1.15##CPT11.00±0.2010.15±4.06*2.65±0.86#LPL1.00±0.190.52±0.17**1.44±0.33##HL1.00±0.471.54±0.401.40±0.56SREBF21.00±0.162.09±0.44**0.80±0.46##HMGCR1.00±0.252.53±1.19*2.35±1.45LDLR1.00±0.161.98±0.26**1.93±0.52PCSK91.00±0.231.72±0.85*1.73±0.59FXR1.00±0.200.75±0.331.41±0.62#FGFR41.00±0.250.44±0.141.15±0.22##CYP7A11.00±0.333.48±0.93**1.09±1.07#CYP8B11.00±0.565.10±1.98*0.87±0.51#DGAT1.00±0.322.81±0.89**1.33±0.75#CTPα0.97±0.202.20±0.61**1.47±0.42#
The response values of metabolites in model group and metformin group were calibrated with blank control group.*P<0.05,**P<0.01vscontrol group,#P<0.05,##P<0.01vsmodel group.
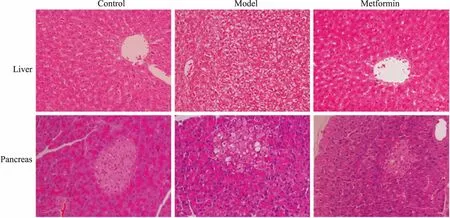
Fig 5 HE staining of liver and pancreas(×200)
4 讨论
脂质代谢紊乱是T2DM的重要发病基础,二甲双胍作为治疗T2DM的一线药物,近几年来不断地被发现具有调节脂质紊乱的作用,但机制尚未完全明确。故本实验采用非靶向代谢组学的手段,研究二甲双胍对T2DM中脂质代谢的作用机制,为完善和发现其新的作用通路。
二甲双胍降血糖的作用主要是通过腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)能量代谢通路来完成,其中包括对糖异生和糖原合成途径的抑制作用,促进PDHC依赖的有氧糖酵解,以上的药理作用已被广泛证明[6]。本实验发现,二甲双胍对脂质代谢有明显影响,主要包括脂肪酸、胆汁酸和磷脂代谢。
二甲双胍对脂肪酸代谢的影响,主要包括对SREBF1、ACC、FAS和CPT1的表达调控,这3个基因的上调将会导致T2DM患者体内FFA水平升高,随后刺激线粒体内膜上CPT1的活性,增强对FFA转运的效率,从而为机体提供大量的ATP,这也是T2DM患者的主要供能方式[10-11]。然而,二甲双胍干预后,MG(22 ∶4)水平升高,TG水平降低,LPL的活性增强,同时,SREBF1、ACC、FAS和CTP1的表达均明显下调,说明二甲双胍能增强对TG的水解作用,并抑制FFA的内源性合成以及氧化。虽然TG向MG的转化过程会释放FFA,但FFA在机体内的总量是降低的,进一步说明FA的内源性合成是导致机体积聚大量FFA的主要原因。此外,肝脏和胰腺的HE染色结果证明,二甲双胍抗炎作用的机制可能与抑制其内源性合成及氧化分解有关。
二甲双胍对胆汁酸代谢的影响,则包括了对FXR/FGFR4/CYP7A1的调节。CA、CDCA和IDCA是一类能增强对胆固醇的溶解性,以及促进TG水解的胆汁酸[12]。其中,CDCA与FXR的亲和力最强,通过与该核受体的结合,激活FGFR4,从而实现对胆汁酸的负反馈调节[13]。然而,高表达的CYP7A1和CYP8B1,以及低水平的CA、CDCA和IDCA,揭示了机体对胆汁酸的负反馈调节失去了控制;二甲双胍干预后,FXR和FGFR4表达上调,同时,CYP7A1和CYP8B1表达下调,体内胆固醇向CDCA的转化增强[14],增强了溶解胆固醇和水解TG的作用。这一结果表明,二甲双胍可能通过激活FXR和FGFR4,实现对CYP7A1和CYP8B1的抑制,调节胆汁酸的合成。与此同时,二甲双胍干预后,T2DM大鼠体内DAGT和CTPα的表达明显下调,MG (22 ∶4)水平升高,磷脂类代谢产物水平降低,表明了由二酰甘油胞苷5磷酸二钠介导的磷脂合成途径受到了限制[15]。
另外,本实验发现,二甲双胍还能够改善血液循环。ADO为肾素-血管紧张素,能够调节循环血容量;THETA为内皮血管舒张因子,能使平滑肌舒张,降低血液黏稠度和血压。中医理论认为,T2DM病机特点为阴虚,燥热及血瘀,而血瘀则被认为与脂质紊乱和炎症相关[16-17]。二甲双胍能明显降低ADO,升高THETA的含量,从而改善T2DM血液循环,降低血液黏稠度。此外,THETA主要由磷脂通过15-脂氧酶介导的途径合成[18],二甲双胍能明显提高这一代谢产物在体内的含量,间接表明二甲双胍能降低体内磷酯类代谢产物的含量。
综上所述,通过代谢组学手段,本实验发现大鼠血清中有17种潜在的生物标志物。经过qPCR验证,发现二甲双胍除了能通过AMPK能量代谢途径调节糖代谢,还能通过FXR/FGF4R调节胆汁酸代谢,介导SRBEF1/ACC/FAS/CPT1途径调节脂肪酸合成及氧化,以及通过CTPα/DAGT途径抑制磷脂合成。此外,二甲双胍还能通过调节ADO和THETA的水平,改善T2DM血瘀的症状。
(致谢:本实验在广东省中医药工程技术研究院中药药理研究室和广东省中医药研究开发重点实验室开展,衷心感谢各位老师和同学的帮助与支持。)