超高效液相色谱串联质谱法同时测定香辛料中7种真菌毒素
2019-09-11黄思瑜董宪兵周纯洁邓宇杰杨小珊
黄思瑜,董宪兵,周纯洁,邓宇杰,李 红,杨小珊
(重庆市食品药品检验检测研究院,重庆 401121)
真菌毒素是一类由真菌产生的具有毒性的二次代谢产物,能够广泛污染农作物及食品[1],比较常见的真菌毒素有:黄曲霉毒素(aflatoxin,AF)、赭曲霉毒素(ochratoxin,OT)、伏马菌毒素(fumonisin,FB)等。研究表明,真菌毒素可以引起人类的急性或慢性中毒,许多真菌毒素的毒性是多器官性的。根据联合国粮食及农业组织(FAO)估计全球每年约有25%的农作物遭受真菌及其毒素污染,全球每年因真菌毒素污染而造成的直接及间接损失将达到数百亿美元[2]。
我国是香辛料的主要生产国和出口国之一,主要的品种有辣椒、花椒和八角等[3]。香辛料是一种很容易受到霉菌及其产生的真菌毒素污染的植物性农产品。在香辛料加工、贮藏、运输和销售过程中都容易受到霉菌的侵染,污染香辛料的霉菌在适宜的条件下可以产生真菌毒素,主要有黄曲霉毒素、赭曲霉毒素、伏马菌毒素等,这些真菌毒素的存在会对消费者健康产生潜在的危害[4]。香辛料中真菌毒素的检测目前主要有高效液相色谱法、高效液相色谱串联质谱/质谱法和酶联免疫吸附测定法,但以上仅针对香辛料中单一真菌毒素的检测。随着各种高精尖仪器的成功应用,快速筛查技术、高通量的检测技术,即专属、高效、经济的前处理手段,多成分同时分析的检测手段以及成功避免假阳性的技术已成为未来检测多真菌毒素技术的发展趋势[5-6]。王玉娇等[7]建立了超高效液相色谱—串联质谱法同时检测干果中16种真菌毒素,杨万颖等[8]建立了液相色谱串联质谱法同时测定小麦粉中10种真菌毒素,葛宝坤等[9]用免疫亲和柱净化-液相色谱-串联质谱法测定中药材中的14种真菌毒素。此外,关于植物油、粮谷饲料、桑葚等基质中多真菌毒素的检测也有相关研究[10-15]。但是基质相对复杂的香辛料中多真菌毒素的高通量检测方法还没有相关的报道。
本文选用香辛料中常用的辣椒、花椒和八角作为研究基质,通过优化质谱条件,对比不同真菌毒素提取溶剂的提取效果,不同定容溶液的定容效果,建立了香辛料中7种真菌毒素同时测定的超高效液相色谱-串联质谱分析方法。
1 材料与方法
1.1 材料与仪器
青花椒、重庆石柱辣椒、广西八角 重庆盘溪粮油批发市场;黄曲霉毒素B1、B2、G1、G2标准溶液 美国Supelco公司;赭曲霉毒素A标准溶夜 粮食局科学研究院;伏马菌毒素B1、B2标准溶液 Romer国际贸易(北京)有限公司;乙腈、甲醇 色谱纯,德国Merck公司;磷酸二氢钾、十二水磷酸氢二钠、氯化钾、氯化钠 分析纯,成都市科龙化工试剂厂;甲酸 色谱纯,德国CNW公司。
ACQUITYTM型超高效液相色谱、HSS T3型液相色谱柱 美国Waters公司;API4000型液质联用仪 美国AB SCIEX公司;Allegra X-30型高速离心机 美国贝克曼库尔特公司;Milli-Q型全自动超纯水机 美国Millipore公司;SB25-120TN型超声波清洗仪 宁波新芝生物科技股份有限公司;FW200型粉碎机 江苏金坛市友联仪器研究所;Myco6in1TM多真菌毒素免疫亲和净化柱 美国Vicam公司;电子天平SQP 德国Sartorius公司;Vortex3涡旋混匀器 德国IKA仪器有限公司;MD200-2型氮吹仪 杭州奥盛仪器设备有限公司。
1.2 实验方法
1.2.1 混合标准溶液的配制 各取适量上述真菌毒素标准溶液用甲醇配成浓度分别为黄曲霉毒素B1(AFB1)50 μg/L、黄曲霉毒素B2(AFB2)100 μg/L、黄曲霉毒素G1(AFG1)100 μg/L、黄曲霉毒素G2100 μg/L(AFG2)、赭曲霉毒素A(OTA)100 μg/L、伏马菌毒素B1(FB1)2000 μg/L、伏马菌毒素B2(FB2)2000 μg/L的混合标准使用溶液,用于添加回收实验和制备标准系列溶液,4 ℃条件下避光保存。
1.2.2 样品前处理 分别把青花椒、重庆石柱辣椒、广西八角三种样品用粉碎机粉碎,称取5 g(精确至0.01 g)粉碎后样品于50 mL离心管中,加入12 mL水,涡旋振荡15 min,再加入28 mL甲醇(甲醇∶水=7∶3,V/V),继续涡旋振荡15 min,8000 r/min离心10 min,玻璃纤维滤纸过滤,收集滤液于干净的容器中,准确移取5 mL滤液,在40 ℃条件下氮吹至2 mL,在浓缩液中加入5 mL PBS(pH7.4±0.1)缓冲液[16],涡旋混匀,待净化。
将上述7 mL稀释液缓慢通过Myco6in1TM真菌毒素免疫亲和净化柱,直至空气进入净化住,将10 mL PBS(pH7.4±0.1)溶液以1滴/s的流速通过亲和柱,直至空气进入亲和柱。将2 mL甲醇加入到亲和柱中,使亲和柱凝胶部分完全浸泡在甲醇中,且不流出,并将亲和柱底部用原帽堵住,静置5 min。然后以两秒1滴的流速淋洗亲和柱,将淋洗液收集于玻璃试管中。再加入2 mL纯水过亲和柱,以两秒1滴的流速淋洗亲和柱,将淋洗液收集于同一玻璃试管中。取2 ml洗脱液在40 ℃氮吹至近干,准确加入1 mL甲醇-水(50∶50,v/v)定容,混匀,0.22 μm滤膜过滤,供液相色谱-串联质谱测定。
1.2.3 色谱条件 色谱柱:HSS T3(50 mm×2.1 mm,1.7 μm);流动相:0.1%甲酸水溶液(A),0.1%甲酸乙腈溶液(B),梯度洗脱:0~0.5 min,5% B;0.5~1.5 min,5%~60% B;1.5~3.5 min,60%~95% B;3.5~4 min,95%~60% B;4~5 min,60%~5% B。流速:0.4 mL/min;进样体积:5 μL。
1.2.4 质谱条件 离子化模式:电喷雾电离正离子模式(ESI+);质谱扫描方式:多反应监测(MRM);电喷雾电压(IS):4500 V;离子源温度(TEM):5500 ℃;气帘气压力(CUR):30 psi;雾化气压力(GSI):40 psi;辅助气压力(GS2):50 psi;碰撞气压力(CAD):5 psi;各真菌毒素质谱参数详见结果与分析中的表1。
2 结果与分析
2.1 质谱条件的优化
分别将7种真菌毒素化合物的标准溶液配制成浓度为0.5 μg/mL的标准溶液,以10 μL/min的流速注入质谱中。在全扫描模式下对标准物质先进行一级质谱分析(Q1扫描),得到分子离子峰,选取相应的母离子峰,对其子离子进行二级质谱分析(Q2扫描),得到碎片离子信息,然后对得到的质谱参数进行优化。得到每种真菌毒素合适的离子模式、母离子、子离子及相对应的碰撞能量、去簇电压。各个真菌毒素的母离子、子离子及对应的质谱参数见表1。
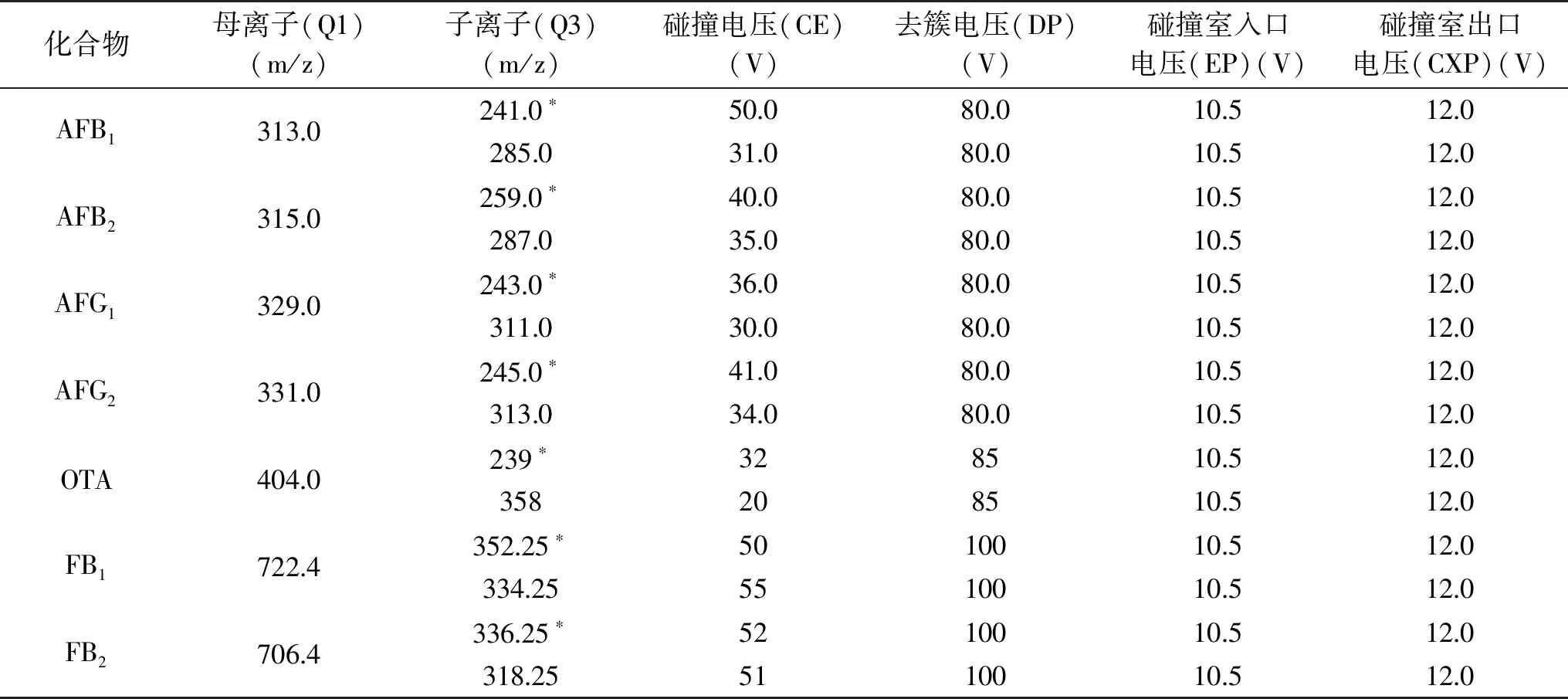
表1 真菌毒素的质谱参数Table 1 MS/MS condltlons for mycotoxins
2.2 提取条件的优化
乙腈和甲醇是近年来生物毒素分析中最常用的2种萃取溶剂。在优化提取实验过程中,以回收率实验比较,选用最佳提取溶剂。参考郑荣等[17]、孙娟等[18]的方法,选用50%甲醇、70%甲醇、90%甲醇、50%乙腈、70%乙腈、90%乙腈作为提取溶剂,分别考察各个提取液回收率。根据图1可知,不同浓度和不同试剂的提取液对真菌毒素提取效率有一定影响,随着有机试剂浓度增加,提取回收率逐渐升高,但是有机试剂浓度过高时,回收率反而会降低。可能是当甲醇、乙腈浓度增加时,会适当增加真菌毒素的萃取回收率,但是随着浓度的增大会降低多功能净化柱的净化中分析物在净化柱的保留效果,反而会降低真菌毒素的回收率[18]。70%甲醇溶液和70%乙腈溶液提取效率差别不大,综合考虑经济成本选用70%甲醇溶液作为提取试剂。实验发现,先用水提取后再按比例加入甲醇提取的回收率高于直接用70%甲醇。本实验最终选用先加12 mL水提取后再加入28 mL甲醇提取。

图1 提取液浓度对7种真菌毒素提取效果的影响Fig.1 Effect on recovery rate of 7 mycotoxins under different concentrations of extractant
2.3 定容溶液的选择
本实验选用20%甲醇、50%甲醇和80%甲醇作为定容溶液。结果显示,当选用50%甲醇定容时目标峰面积高于选用20%甲醇和80%甲醇定容的峰面积,有可能是当定容溶液中水的比例过高时,目标物不溶,有机试剂比例较高时,可能导致部分目标物在水相比例较大时在色谱柱中析出[20]。故本实验最终选用50%甲醇定容上机测定。
2.4 方法的定量限
取空白样品,按照1.2.3方法处理后添加真菌毒素混合标准溶液,进行检测。以信噪比(S/N)为10计算得出本方法定量限(LOQ)为AFB1为0.5 μg/kg,AFB2、AFG1、AFG2为1.0 μg/kg,OTA为1.0 μg/kg,FB1、FB2为20 μg/kg。7种真菌毒素在测定方法定量限时的标准溶液色谱图见图2。
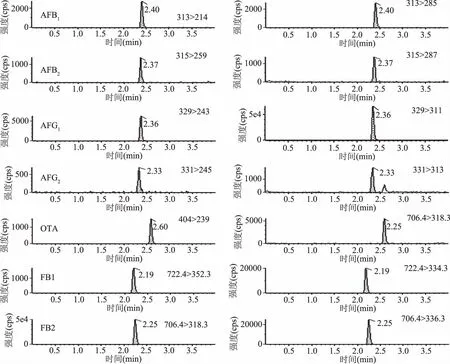
图2 真菌毒素标准溶液的MRM色谱图Fig.2 MRM chromatogram of mycotoxin standard solutions注:左边为该化合物定量离子色谱图,右边为定性离子色谱图。
2.5 方法的线性范围
在本方法所确定的实验条件下,用甲醇-水溶液(50∶50,v/v)配制系列浓度的真菌毒素标准溶液并分别进行测定,以峰面积(Y)对相应真菌毒素的浓度(X)绘制标准曲线(表2),结果表明AFB1浓度在线性范围为0.5~10 μg/kg,AFB2、AFG1、AFG2、OTA浓度在线性范围为1~20 μg/kg,FB1和FB2浓度在线性范围为20~400 μg/kg时与其峰面积呈良好线性关系,相关系数(r)在0.995以上。

表2 各种真菌毒素的线性关系Table 2 Linear relationships of 7 mycotoxins
2.6 方法的回收率和精密度
采用不含以上7种真菌毒素的辣椒、花椒、八角为空白样品基质,进行3个水平的添加回收实验,3个添加量分别为1倍、2倍和10倍的各真菌毒素的测定方法定量限,每个浓度水平进行6次重复实验,分析并测定其精密度及回收率(表3),3个加标水平下平均回收率为67.25%~113.47%,相对标准偏差为1.07%~10.20%,符合痕量分析的要求,详见表3。
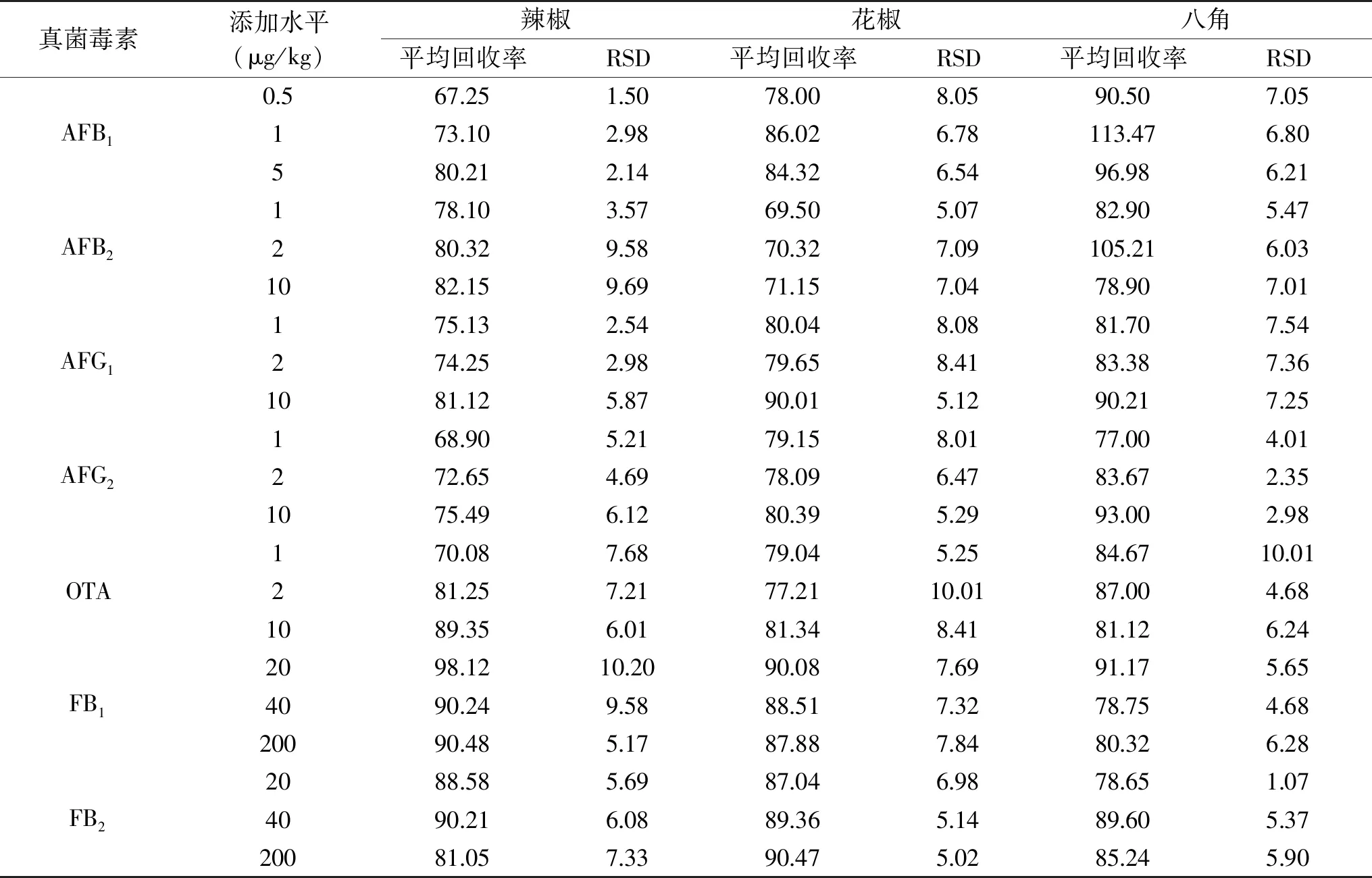
表3 方法的加标回收率和精密度(n=6,%)Table 3 Results of recovery and precision tests(n=6,%)
3 结论
本文建立了超高效液相色谱-串联质谱同时测定香辛料中7种真菌毒素的方法。粉碎后的样品先用水提取后按比例加入甲醇提取(甲醇-水,70∶30,v/v),多功能免疫亲和柱净化后浓缩,50%甲醇定容,用超高效液相色谱-串联质谱进行分析。结果表明:该方法前处理简单、净化效果好、灵敏度高和高通量检测,适用于香辛料中7种真菌毒素残留的分离和检测。该方法填补了香辛料中多真菌毒素高通量检测的空白,能为香辛料中真菌毒素风险监测提供技术支持。
