静乐黑枸杞多糖的提取及抗氧化性分析
2019-09-11曹叶霞王泽慧贺金凤
曹叶霞,王泽慧,贺金凤,左 鑫
(忻州师范学院化学系,山西忻州 034000)
黑枸杞是我国传统食药两用名贵中药材,与普通枸杞相比,黑枸杞的营养价值更高。黑枸杞中多糖是发挥其功能的主要物质,具有良好的保湿性,能有效防止视力降低,在保健方面对人体大有益裨,可减缓人体血管硬化,对预防心脏疾病、增强大脑记忆力等方面都有显著功效,经过研究发现黑枸杞多糖在抗氧化性、免疫等生物活性方面有重大作用[1]。
目前黑枸杞多糖的研究还较局限,主要集中在新疆和甘肃产地的黑枸杞。Liu等[2]将青海黑枸杞用Box-Behnken设计和响应面结合,优化出用微波辅助提取多糖的最佳条件,而且具有良好的抗氧化活性。Peng等[3]对青海黑枸杞多糖结构进行了研究,得到了5种结构的多糖分子。鲁小静等[4]对新疆黑枸杞采用传统水提醇沉法进行了提取工艺研究,结果表明热水温度90 ℃,时间66 min,料液比1∶25 (g/mL)条件下黑果枸杞多糖得率为29.36%。白红进等[5]主要研究了四种提取方法对新疆黑枸杞多糖得率的影响,结果表明超声-微波协调萃取提取多糖的效果最佳。但未见对静乐县2012年引进试种的黑枸杞进行系统的研究,本文以此为研究对象,采用超声波法探索黑枸杞多糖的最佳提取条件,同时测定提取物对DPPH·、·OH、ABTS+·的清除能力和总还原能力。以期为深加工产品提供理论依据,进一步增加其经济价值。
1 材料与方法
1.1 材料与仪器
黑枸杞 产自山西省忻州市静乐县;ABTS 阿拉丁上海晶纯生化科技股份公司;DPPH 西格玛奥德里奇贸易公司;透明质酸 化妆品级,山东福瑞达生物医药公司;其他试剂 均为国产分析纯;实验用水 均为二次蒸馏水。
KQ-400KDE型超声波清洗器 昆山市超声仪器公司;V-5100型可见分光光度计 上海元析仪器公司。
1.2 实验方法
1.2.1 静乐黑枸杞的预处理 将黑枸杞在避光条件下阴干,将其粉碎,过60目筛,然后进行回流脱脂处理:粗称200.0 g黑枸杞于1000 mL圆底烧瓶中,加入500 mL石油醚,控制温度60 ℃水浴回流2 h,抽滤[6],滤渣用少许石油醚洗涤3~4次,挥尽石油醚并于55 ℃烘箱中干燥,制得静乐黑枸杞样品,装瓶待用。
1.2.2 葡萄糖标准曲线的绘制 准确称量0.0750 g葡萄糖,配成0.15 mg·mL-1葡萄糖储备溶液,分别取7个25 mL比色管,依次加入0.00、0.50、1.00、1.50、2.00、2.50、3.00 mL储备液,补加蒸馏水至5.00 mL,用苯酚-硫酸法[7]在484 nm处测其吸光度,记录数据,得到标准曲线。A=38.457C+0.0132,其中R=0.9999。
1.2.3 黑枸杞多糖的提取及测定 准确称取0.5000 g静乐黑枸杞样品置于100 mL锥形瓶中,按实验要求加入定量蒸馏水,在一定条件下进行超声提取,提取结束后在转速为4000 r·min-1下离心10 min,将离心后的提取液同洗涤液一起转移至25 mL容量瓶中定容。从此容量瓶中取1.00 mL多糖提取液于另一个25 mL容量瓶中,加蒸馏水定容至刻度线。取0.50 mL稀释液显色后测定其吸光度,根据下式计算多糖的得率Y:
式中C:显色后溶液的浓度,由标准工作曲线得到,mg·mL-1,D:稀释倍数,V:溶液体积mL,M:样品质量,g。
1.2.4 单因素实验 用1.2.3下方法提取黑枸杞多糖,提取条件为:固定超声条件为温度60 ℃,时间1 h,功率320 W,考察液料比(mL/g)分别为20∶1、30∶1、40∶1、50∶1、60∶1对多糖得率的影响;固定超声条件为温度60 ℃,液料比(mL/g)40∶1,功率320 W,考察超声时间分别为30、40、50、60、70、80、90 min对多糖得率的影响;固定超声条件为温度60 ℃,液料比40∶1,时间50 min,考察超声功率为160、200、240、280、320、360、400 W对多糖得率的影响;固定超声条件为功率320 W,液料比(mL/g)40∶1,时间50 min,考察超声温度40、50、60、70、80 ℃对多糖得率的影响。
1.2.5 响应面试验 应用响应面软件设计实验,见表1。
纯氮施用量为102 kg/hm2。基肥可施用复合肥(10∶8∶24)594 kg/hm2,采用定点定位环行施肥法在理墒前施下。提苗肥在烟株移栽后7 d内施加,30%的追肥在栽后20~25 d施加。
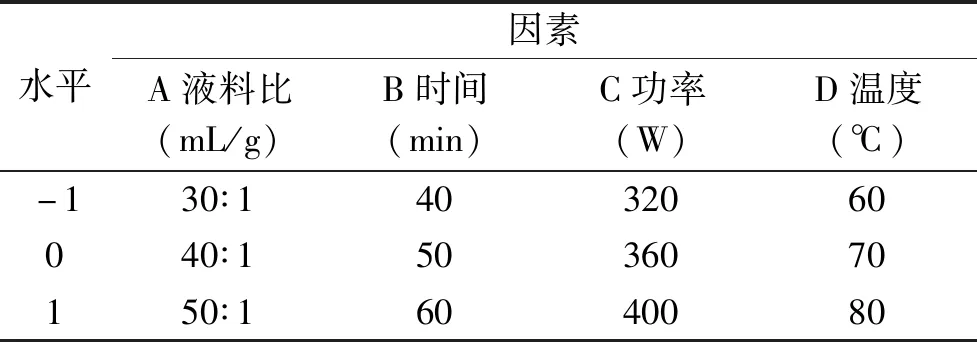
表1 响应面分析法的因素与水平Table 1 Factors and levels used in response surface methodology
1.2.6 黑枸杞提取物抗氧化性实验 取适量的黑枸杞样品在最佳条件下用水提取,提取液在85%~90%的乙醇中醇沉24 h。在4000 r·min-1转速下离心5 min得提取物固体,将固体放入冷冻干燥机中干燥,得到静乐黑枸杞提取物装瓶待用。
1.2.6.1 静乐黑枸杞提取物对ABTS+·清除率测定 将5.00 mL的7.40 mol·L-1ABTS储备液与88 μL 2.60 mol·L-1K2S2O8混匀,在冰箱静置12~16 h,制得ABTS+·工作液(此工作液要现配现用,而且要求低温避光保存)。准确移取0.40 mL ABTS+·,用 PBS(pH=7.40)溶液稀释,在常温下730 nm处吸光值为0.719。精确吸取2.00 mL ABTS+·和1.00 mL 0.06、0.08、0.12、0.20、0.25、0.33、0.40、0.50、0.67、0.83、1.00 mg·mL-1样品混合摇匀,在常温避光静置6 min,在波长为730 nm下测吸光度Ai,以蒸馏水代替样液测定吸光度A0,平行测定3次[8],同时以抗坏血酸做对照。ABTS+·清除能力S见下式。
IC50表示在该浓度下样品的清除率为50%,在实验中常用它的值来表示样品抗氧化活性的高低。
1.2.6.2 静乐黑枸杞提取物对DPPH·清除率测定 配制DPPH·储备液,浓度为1×10-4mol·L-1,取20.00 mL定容于100 mL容量瓶中,配制成 2×10-5mol·L-1工作液。加入0.03、0.04、0.06、0.07、0.10、0.20、0.22、0.50、1.00 mg·mL-1提取物溶液1.00 mL和2.00 mL DPPH·溶液,混匀,静置20 min,在波长为517 nm下测定吸光度AD。分别以等量二次蒸馏水代替不同浓度提取物加入反应体系,测定吸光度为A水,以无水乙醇代替DPPH·,测定吸光度为A糖,吸光度取平行测定三次后的均值[9],同时以抗坏血酸做对照。计算DPPH·清除率见下式。
1.2.6.3 静乐黑枸杞提取物对·OH清除率测定 将2.00 mL pH=7.40的磷酸盐缓冲液加入25 mL比色管中,然后加入1.00 mL 2.50×10-3mol·L-1邻二氮菲溶液和0.15 mL 6.25×10-4mol·L-1硫酸亚铁溶液,最后用水定容到10 mL为A0溶液,2.00 mL缓冲溶液用水定容到10 mL作为A0参比溶液。在25 mL比色管中加入精确吸取的2.00 mL缓冲液,然后再加入1.00 mL邻二氮菲溶液和0.15 mL硫酸亚铁溶液,2.00 mL水,振荡摇匀后加入1.00 mL 5.00×10-3mol·L-1过氧化氢后再次摇匀,用水定容到10 mL为A1溶液,参比溶液为2.00 mL缓冲溶液和1.00 mL过氧化氢定容到10 mL。将A1中的2.00 mL水换为2.00 mL不同质量浓度的提取物溶液为Ai,将A1参比溶液中的1.00 mL过氧化氢换为2.00 mL不同质量浓度的提取物溶液为Ai的参比溶液。将上述的比色管放置于37 ℃水浴保温90 min,在510 nm处测其吸光度[10-12]。按下式计算清除率,同时以抗坏血酸做对照,平行测定3次。
1.2.6.4 静乐黑枸杞提取物总还原能力的测定 在比色管中加入2.50 mL 0.10、0.50、0.80、0.10、1.00、2.00、3.00、4.00、6.00 mg·mL-1的样品溶液,2.50 mL pH=6.64磷酸盐缓冲液,2.50 mL 0.1%铁氰化钾溶液,于50 ℃水浴反应20 min,将比色管取出加入2.50 mL 10%三氯乙酸溶液终止反应,加入1.00 mL 0.1%三氯化铁溶液,在50 ℃水浴锅中反应10 min。在700 nm处测其吸光度[13],同时以抗坏血酸做对照,平行测定3次。
1.3 数据处理
2 结果与分析
2.2 单因素实验分析
2.2.1 液料比对静乐黑枸杞多糖得率的影响 如图2所示,静乐黑枸杞多糖的得率随液料比的增加先上升后下降。液料比太小时多糖无法充分溶解,液料比增大得率增大,液料比大于40∶1 mL/g时,由于液料比太小时,单位体积受到的超声作用变小,从而影响多糖的溶出,使得得率降低[18]。因此静乐黑枸杞中多糖提取最佳液料比为40∶1 mL/g。
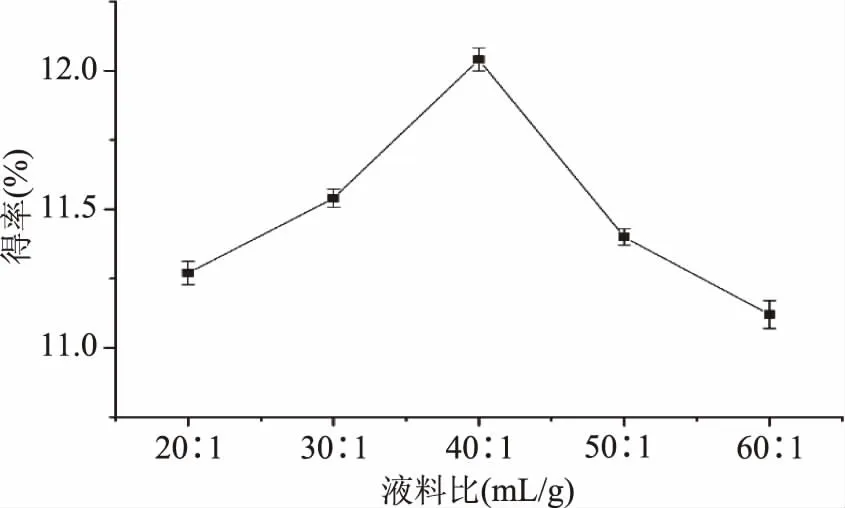
图2 液料比对多糖得率的影响Fig.2 Effects of ratio of material to liquid on extraction yield

图3 超声时间对多糖得率的影响Fig.3 Effects of extraction time on extraction yield
2.2.3 超声功率对静乐黑枸杞中多糖得率的影响 如图4所示,静乐黑枸杞中多糖的得率随超声功率的增加先上升后下降。超声波产生声波空化作用会破坏黑枸杞的细胞壁,加速细胞中的多糖的溶出,空化作用越大,得率越高,而过大的空化作用会破坏多糖分子结构[19],使得得率降低。在功率为360 W时达到最大,因此,静乐黑枸杞中多糖提取最佳超声功率为360 W。
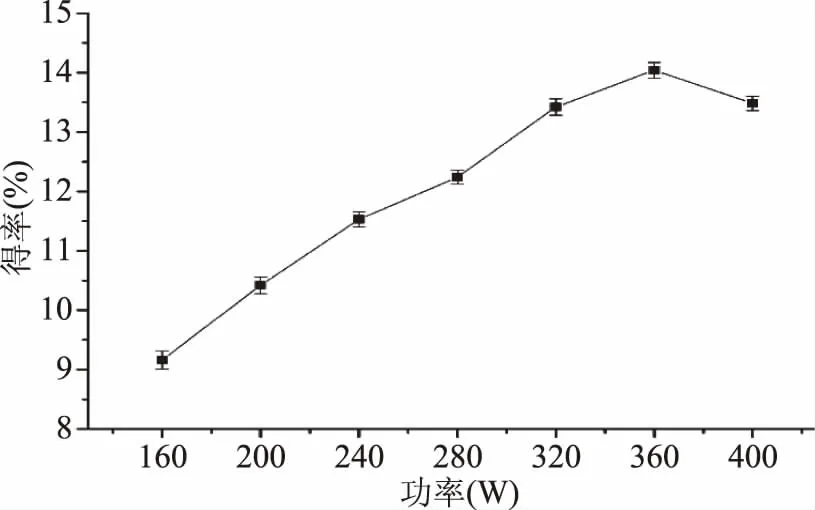
图4 超声功率对多糖得率的影响Fig.4 Effects of ultrasonic power on extraction yield
2.2.4 超声温度对静乐黑枸杞中多糖得率的影响 如图5所示,静乐黑枸杞中多糖的得率随温度的升高先上升后下降。一般来说,温度的升高会通过增加溶剂分子和溶质分子的运动,促进扩散,从而有利于提高多糖得率,但温度过高破坏多糖结构[20]。因此,静乐黑枸杞中多糖提取最佳超声温度为70 ℃。
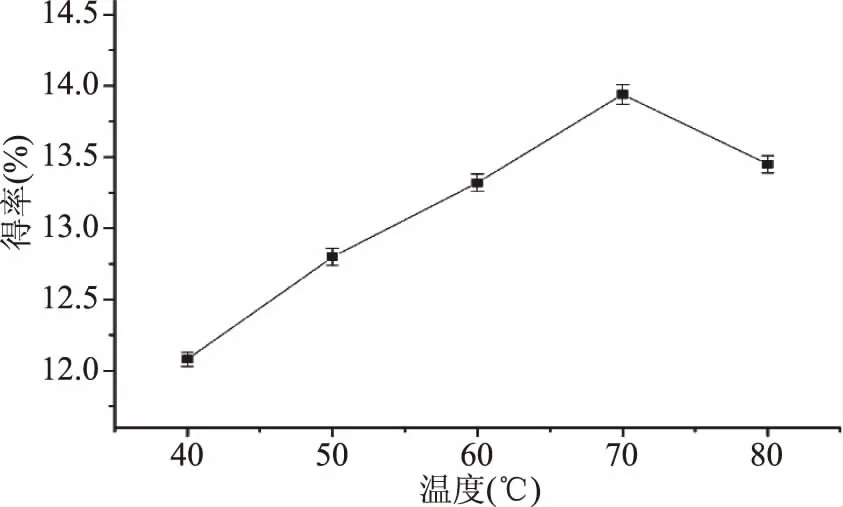
图5 超声温度对多糖得率的影响Fig.5 Effects of ultrasonic temperatures on extraction yield
2.3 响应面优化试验结果
2.3.1 静乐黑枸杞多糖的得率回归模型的建立及显著性实验 按照Box-Behnken试验方案结果见表2。将得率利用Design Expert软件进行拟合,得到以多糖得率(Y)为目标函数的二次回归方程:
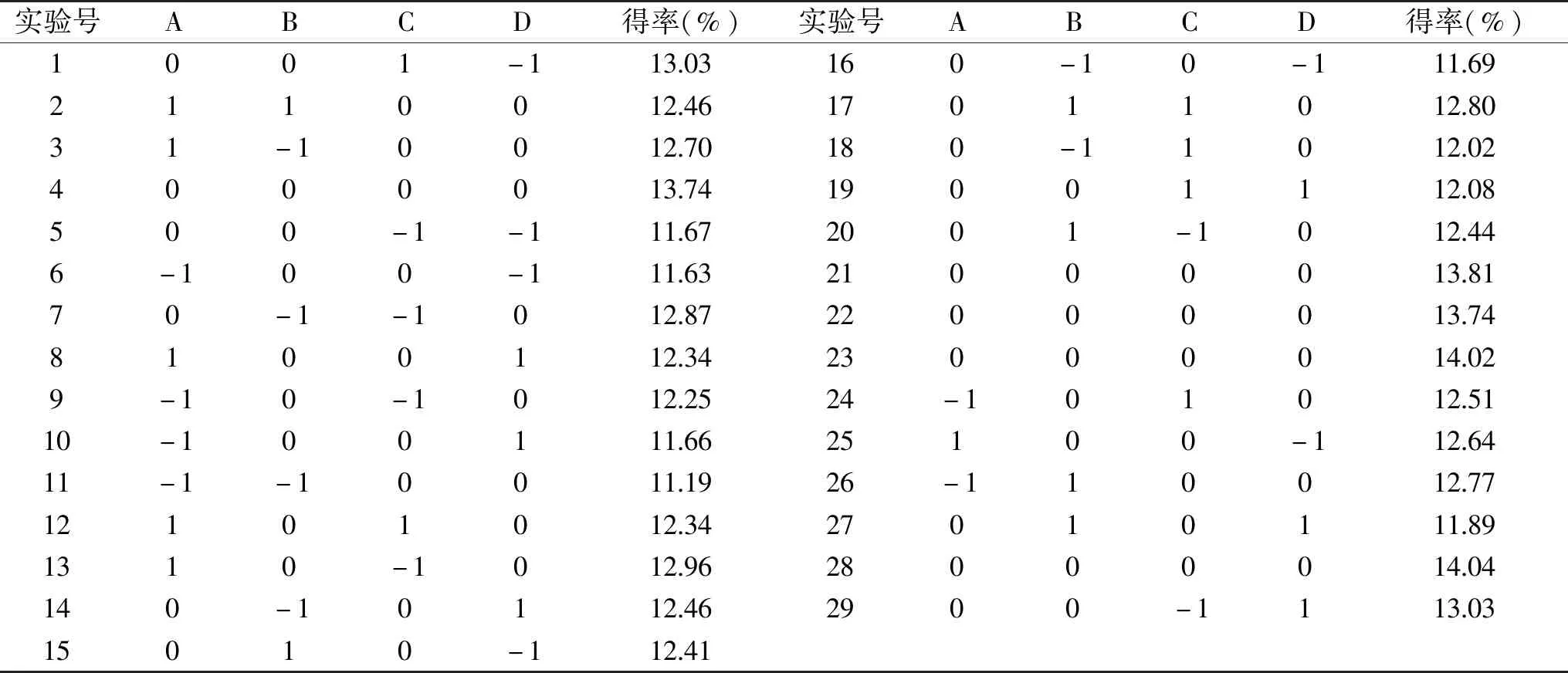
表2 静乐黑枸杞多糖得率Box-Behnken试验结果Table 2 Arrangement and experimental results of the BBD
Y(%)=13.90+0.29A+0.15B-0.037C+0.033D-0.46AB-0.22AC-0.083AD+0.30BC-0.32BD-0.58CD-0.84A2-0.81B2-0.52C2-0.96D2
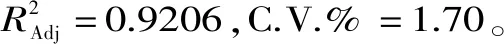
为了检验回归方程是否可以使用,对黑枸杞多糖提取的回归模型进行方差分析,从表3中可以看出,模型p<0.01为极显著,失拟误差为0.1287>0.05,不显著,所以此回归模型与实验结果拟合程度比较好。四个单因素之间的影响作用为液料比>超声时间>超声功率>超声温度。AB、BD、CD的p<0.01,为极显著水平,BC的p=0.0133<0.05为显著水平。
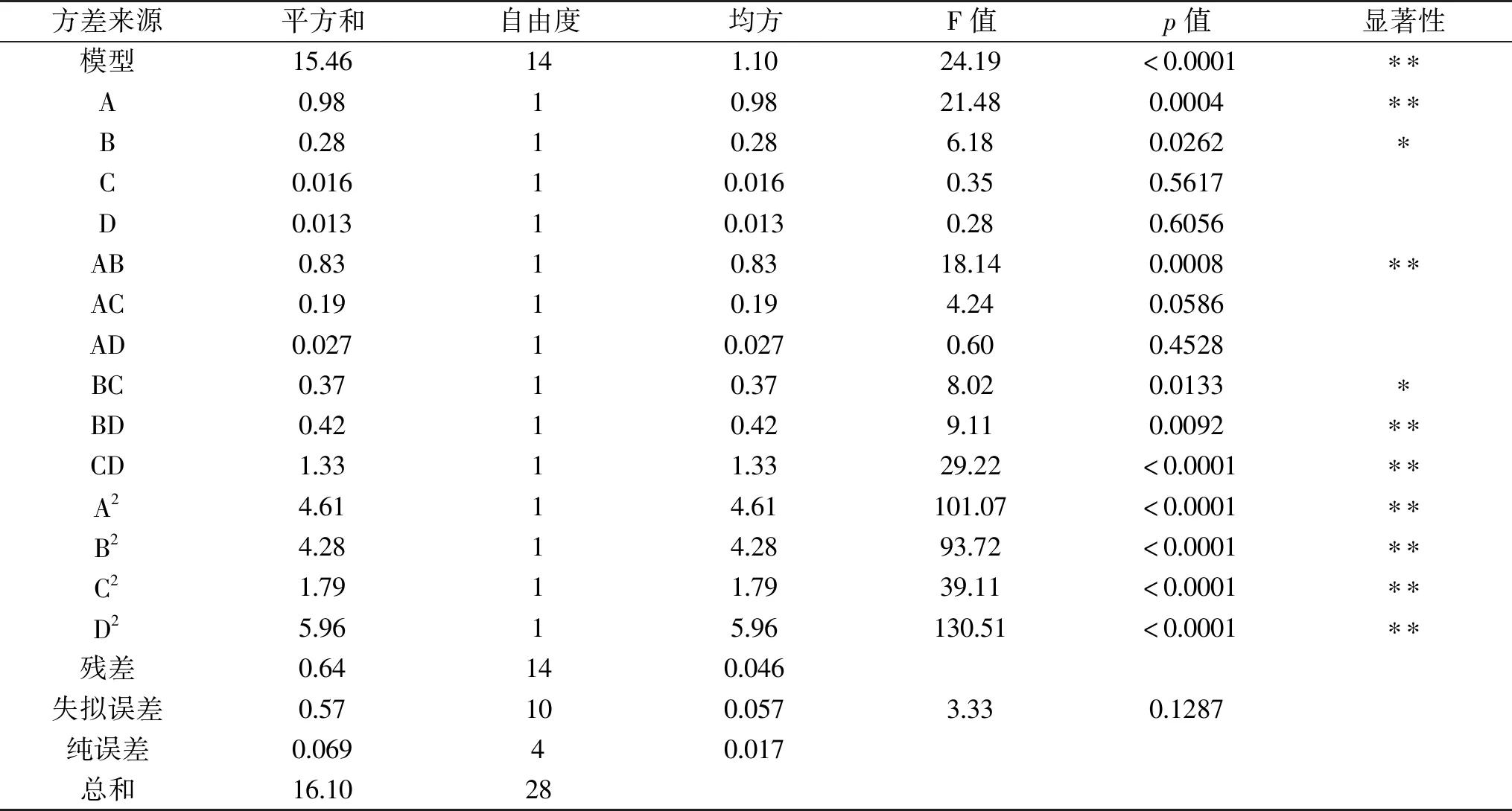
表3 回归模型方差分析Table 3 Analysis of variance of regression equation
2.3.2 静乐黑枸杞多糖的等高线图和响应面图分析、优化 等高线图越接近椭圆,3D图中坡度越陡峭,说明两因素之间的交互作用越显著,即对得率的影响越大。从图6可以得知,液料比和超声时间、超声功率和超声温度、超声时间和超声温度的3D图很陡峭,而且等高线图接近椭圆形,因此液料比和超声时间、超声功率和超声温度、超声时间和超声温度之间的交互作用极显著(p<0.01),而超声时间和超声功率的3D图较陡峭,同时等高线图近似椭圆,所以超声时间和超声功率之间的交互作用显著(p<0.05)。

图6 各因素交互作用对多糖得率影响的3D图和等高线图Fig.6 Response surface and contour plot of variable parameters on the yield of polysaccharides
2.3.3 静乐黑枸杞多糖最佳提取条件的确定和验证实验 利用Design Expert软件分析,多糖的最佳提取条件液料比、超声时间、超声功率、超声温度依次为41.72∶1 (mL/g)、50.25 min、356.77 W、70.29 ℃,得率的预测值为13.92%。由于考虑到实际操作情况最后确定最佳工艺条件为40∶1 (mL/g)、50 min、360 W、70 ℃。在此条件下进行三次平行实验,静乐黑枸杞多糖平均得率为13.89%,与预测值的相对误差为0.22%,说明此方程与实际情况拟合较好。
2.4 静乐黑枸杞提取物抗氧化性试验结果
2.4.1 静乐黑枸杞提取物清除ABTS+·的能力 如图7所示,随着提取物浓度的增加,ABTS+·清除率增加,提取物的清除率最大可以达到96.46%,其IC50=0.40 mg·mL-1,但是在相同的浓度下,抗坏血酸对ABTS+·的清除能力较大。
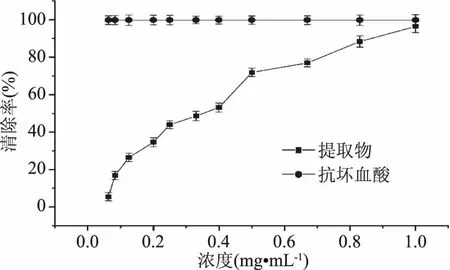
图7 静乐黑枸杞提取物清除ABTS+·的能力Fig.7 Scavenging effects of the extracts of Lycium ruthenicum of Jingle on ABTS+·free radicals
2.4.2 静乐黑枸杞提取物清除DPPH·的能力 如图8所示,随着抗坏血酸和提取物浓度的增加,DPPH·清除率均增加,静乐黑枸杞提取物的浓度达到0.3 mg·mL-1时清除率为88.07%,并逐渐趋于平缓,其IC50=0.125 mg·mL-1,比宁夏黑枸杞IC50=1.22 mg·mL-1小[21],但是在相同的浓度下,抗坏血酸对DPPH·清除能力较大。
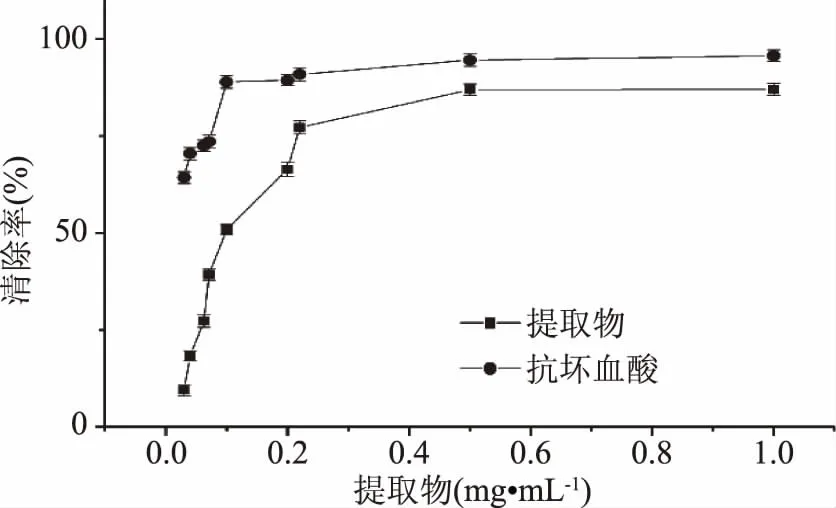
图8 静乐黑枸杞提取物清除DPPH·的能力Fig.8 Scavenging effects of the extracts of Lycium ruthenicum of Jingle on DPPH· free radicals
2.4.3 静乐黑枸杞提取物清除·OH的能力 由图9可知,静乐黑枸杞提取物清除·OH的能力随着浓度的加大而升高,其最大清除率可以达到77.91%,其IC50=6.00 mg·mL-1,比柴达木盆地黑枸杞的IC50=1.84 mg·mL-1大[2],同时远低于相等浓度的抗坏血酸对·OH的清除率,因此静乐黑枸杞提取物对·OH的清除效果不如抗坏血酸。
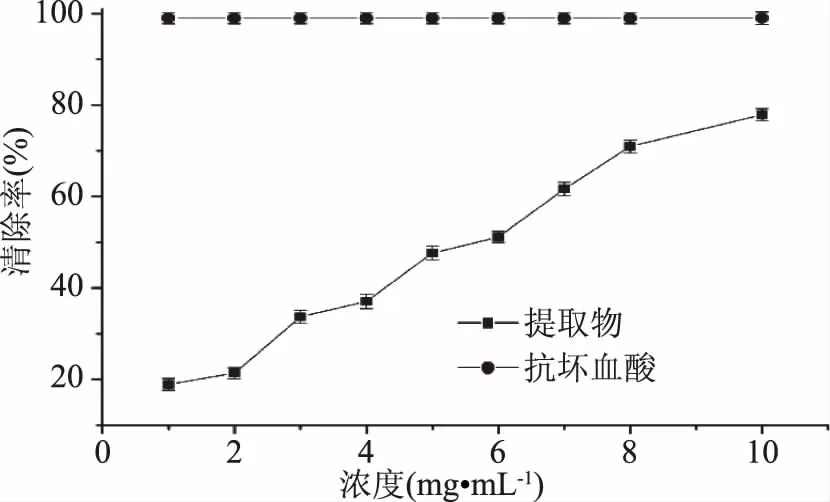
图9 静乐黑枸杞提取物清除·OH的能力Fig.9 Scavenging effects of the extracts of Lycium ruthenicum of Jingle on hydroxyl free radicals
2.4.4 静乐黑枸杞提取物总还原能力 一种化合物的还原能力可以作为潜在的抗氧化活性的一个重要指标。一般情况下,样品的还原能力与抗氧化性呈显著的相关性;样品反应后的生成物在700 nm处有最大吸收,吸光值的大小反映了抗氧化能力的大小,吸光度值越大,则样品的还原能力越。如图10所示,随着浓度增大静乐黑枸杞提取物和抗坏血酸的还原能力在增大。当静乐黑枸杞提取物的浓度达到3.00 mg·mL-1时还原能力达到最大,并逐渐趋于平缓,而抗坏血酸浓度达到0.08 mg·mL-1时,还原能力达到最大并逐渐趋于平缓,表明黑枸杞提取物还原能力较小。
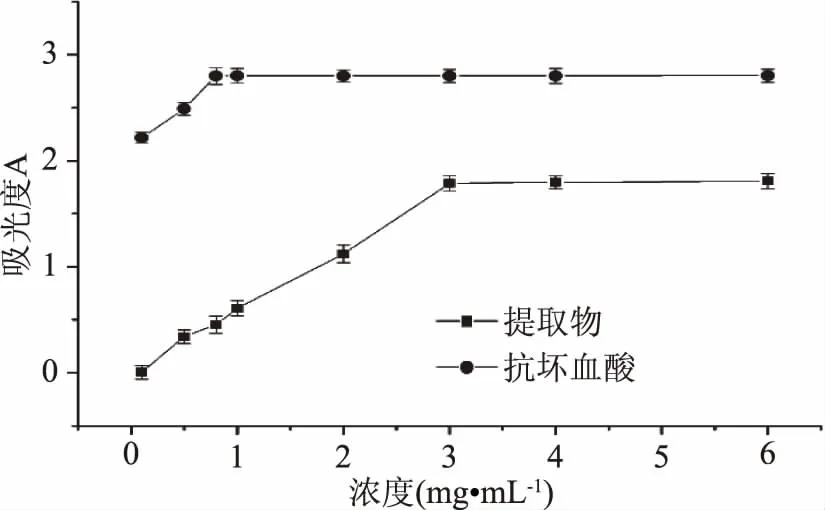
图10 静乐黑枸杞提取物的还原能力Fig.10 Reducing capacity of the extracts of Lycium ruthenicum of Jingle
3 结论
静乐黑枸杞多糖最佳提取工艺条件:液料比、超声时间、超声功率、超声温度依次为40∶1 (mL/g)、50 min、360 W、70 ℃,多糖的得率为13.89%,与理论预测值的相对误差为0.22%,说明优化工艺可靠。静乐黑枸杞提取物对DPPH·、·OH以及ABTS+·清除能力,随着提取物浓度的升高而增加,其中IC50分别为0.125、6.00、0.40 mg·mL-1,因此,静乐黑枸杞提取物具有较好的抗氧化活性。
