牛乳铁蛋白肽衍生肽结构设计及其在毕赤酵母中表达后的活性分析
2019-09-11张恩鹏吕自力郭爱珍
张恩鹏,吕自力,戴 甜,郭爱珍,王 亮,*
(1.江苏大学食品与生物工程学院,江苏镇江 212013;2.成都中医药大学第二附属医院,四川成都 610041)
牛乳铁蛋白肽(Bovine Lactoferricin,LFcinB)是牛乳铁蛋白在酸性环境下,经胃蛋白酶水解得到的长25个氨基酸残基的小分子生物活性肽,具有多种生物活性,在已发现的人、山羊、牛、骆驼、鼠等哺乳类动物乳铁蛋白肽中,LFcinB抗菌活性最高,对四种肠出血性大肠杆菌的抑制活性比牛乳铁蛋白高300~350倍[1]。LFcinB具有良好的耐热性、非抗原性、免疫调节活性、广谱抗菌和抗病毒活性[2-4],可广泛作为食品防腐剂[5]、抗氧化剂、营养添加剂等[6]。LFcinB分子量3126.4 Da,相对疏水性48%,电荷数+8。抑菌过程中,LFcinB两亲性结构与膜脂多糖相结合,疏水残基与膜的亲脂部分相互作用[7],使细胞膜形成穿孔,细胞内容物外泄起到抑菌杀菌作用[8],且不产生耐药性。目前抗生素耐药性的威胁已经亟需控制,新的抗菌性药物寻找已迫在眉睫[9],LfcinB无耐药性特点表明LfcinB是极具潜力的抗菌药物。由于天然来源有限,酶解分离困难,化学合成成本高昂,因此利用基因工程技术生产LfcinB已经成为研究和发展趋势[10]。
近年来,研究人员致力于抗菌肽结构与功能关系的研究,以期通过对抗菌肽结构的改变(两亲性参数,净电荷数,疏水性参数)获得具有更高抗菌活性的衍生肽[11]。Edwards等[12]通过对六种β-发卡型抗菌肽的研究,发现随着两亲性的增加其抗菌活性也逐渐增加。Strøm等[13]对LFcinB的15个残基进行了丙氨酸扫描,发现Trp6和Trp8氨基酸是保持其活性的关键。Lejon等[14]对LFcinB的15个残基进行了色氨酸化学合成替代研究,发现Cys3、Arg4、Met10和Gln14被色氨酸替代后,显示出比原肽更强的抗菌活性,Cys3、Arg4、Met10和Gln14为设计衍生肽的潜在替换位点。
本研究中,根据抗菌肽数据库和生物信息学分析,首先对不同物种来源的乳铁蛋白肽序列进行同源性分析,确定LFcinB的非保守氨基酸位点。其次针对非保守氨基酸位点进行了替代性分析,优化设计出LfcinB-W4。合成LFcinB-W4序列基因后根据多克隆位点构建至外泌型表达载体pPIC9K中,构建的重组表达载体为pPIC9K-LFcinB,电转化至毕赤酵母GS115后,使用甲醇作为诱导剂诱导LFcinB-W4表达,以期获得具有高抗菌活性的衍生肽。
1 材料与方法
1.1 材料与仪器
金黄色葡萄球菌(StaphylococcusaureusATTC25923)、肠沙门氏菌(SalmonellaentericaCGMCC1.755)、大肠杆菌(EschenchiacoliDH5α)、巴斯德毕赤酵母(PichiapastorisGS115)、表达质粒pPIC9K 本实验室保藏;限制性核酸内切酶SacI、EcoRI、NotI、AvrⅡ、NdeI和T4DNA连接酶 Thermo Fisher Scientific公司;PCRMix及质粒提取试剂盒、胶纯化试剂盒、基因组提取试剂盒 Qiagen公司;培养基LB、YPD、PCR引物、LFcinB-W4,10基因序列 上海生工生物工程有限公司;MD琼脂培养基:葡萄糖20 g/L,YNB 13.4 g/L,琼脂粉15 g/L;BMGY培养基:蛋白胨20 g/L,酵母粉10 g/L,YNB 13.4 g/L,甘油10 mL/L;BMGY培养基:蛋白胨20 g/L,酵母粉10 g/L,YNB 13.4 g/L,甲醇25 ml/L。
SW-CJ型系列超净工作台 苏州安泰空气级数邮箱公司;QYC200型恒温摇床 上海福马实验设备有限公司;BPMJ-250F型系列霉菌培养箱 上海一恒科学仪器又按公司;Eppendorf5418R型高速离心机 德国艾本德股份公司;1645050型DNA水平电泳仪、Gene-PluserXcellTM型电转仪 Bio-Rad生命医学产品有限公司。
1.2 实验方法
1.2.1 基因设计与合成 从NCBI数据库(https://www.ncbi.nlm.nih.gov/)[15]获取了7个不同哺乳动物的乳铁蛋白肽序列,利用生物学软件ClustalW对其序列进行了同源性对比分析,由此确定LFcinB的非保守氨基酸位点[16]。实验对LFcinB第4位Arg(非保守氨基酸位点)替换成Trp替换。抗菌肽数据库APD(http://aps.unmc.edu/AP/)[17]和ExPASy(http://web.expasy.org/protparam)[18]预测了替代后的牛乳铁蛋白肽衍生肽的理化参数,包括净电荷、疏水残基比例、分子量、等电点、脂肪族指数和亲水指数。实验设计中使用同源建模工具SWISS-MODEL(https://www.swissmodel.expasy.org/)[19]对衍生肽的空间结构进行了模拟;同时采用抗菌肽数据库APD和CAMP(http://www.camp.bicni rrh.res.in/index.php#)[20]预测软件对其抗菌活性进行了预测。实验依据毕赤酵母密码子表达的好嗜性对衍生肽的基因序列进行了优化(图1),并在基因序列两端添加EcoRⅠ和NotⅠ酶切位点,优化后的衍生肽基因序列交由上海生物工程公司合成并构建至pUC载体。

图1 LFcinB-W4基因序列Fig.1 LFcinB-4 gene sequence
1.2.2 重组表达载体的构建EcoRⅠ和NotⅠ双酶切携带目的基因的质粒pUC-SP-LFcinB-W4,经琼脂糖凝胶电泳检测并回收,将回收基因片段与同样经EcoRⅠ和NotⅠ双酶切的pPIC9K质粒通过T4 DNA连接酶连接构建表达载体质粒pPIC9K-LFcinB-W4(图2),pPIC9K-LFcinB-W4热激法转化感受态大肠杆菌DH5α进行扩增。用质粒抽提试剂盒提取重组质粒,1%琼脂糖凝胶电泳检测。并进一步对其进行AvrⅡ和NdeI双酶切鉴定及测序鉴定。

图2 重组表达载体pPIC9K-LFcinB-W4构建Fig.2 Construction of recombinant vector pPIC9K-LFcinB-W4
1.2.3 重组表达载体电转毕赤酵母GS115及PCR鉴定 感受态毕赤酵母GS115制备[21]。取300 μL种子液接种于含有150 mL新鲜YPD培养基的500 mL摇瓶中,30 ℃ 250 r/min养过夜至A600达1.3~1.5;取1 mL细胞培养物于4 ℃,1500×g离心10 min,弃上清,用1 mL预冷的无菌水重悬沉淀;重复上述操作一次,使用1 mL预冷的无菌1 mol/L山梨醇溶液重悬沉淀,收集菌体后加入300 μL预冷的1 mol/L山梨醇溶液重悬菌体沉淀,冰浴待转化。
重组表达载体pPIC9K-LFcinB-W4经SacI酶切线性化后用DNA纯化试剂盒纯化,取10 μL线性化的pPIC9K-LFcinB-W4与80 μL感受态毕赤酵母GS115混合均匀,置入电击杯中,冰浴5 min后以1500 V,200 Ω,5 ms的条件脉冲电击转化,加入1 mL预冷的1 mol/L山梨醇溶液,静置1~2 h后,于MD培养基30 ℃培养2~3 d。
毕赤酵母GS115体内无天然质粒,重组表达载体需线性化后与宿主染色体发生同源重组,将外源基因表达框架整合于染色体中以实现外源基因的表达。当线性化的重组表达载体pPIC9K-LFcinB-W4与毕赤酵母发生同源重组时存在两种情况:一种是通过单交换整合入酵母染色体,此时AOX1基因仍被保留,得到的转化子表型为Mut+;另一种是通过重组替换了酵母染色体上的AOX1基因,从而造成AOX1的缺失,得到的转化子表型为Muts。实验挑取10个转化子接种于25 mL YPD培养基中过夜培养,酵母基因组抽提试剂盒提取基因组DNA。基因组DNA PCR扩增,扩增引物5′AOXⅠ:5′-GACTGGTT CCAATTGACAAGC-3′,3′AOXⅠ:5′-GCAAATGGCAC TGACATCC-3′。PCR反应程序为:94 ℃,5 min(预变性);94 ℃,1 min(变性);55 ℃,45 s(退火);72 ℃,1 min(延伸),30个循环反应后再延伸7 min。实验设置ddH2O作为空白对照,未转化质粒的酵母基因组为阴性对照。
1.2.4 LFcinB-W4诱导表达 诱导表达时探究最佳甲醇诱导浓度及发酵时间,需控制培养基成分,发酵温度,发酵转速恒定。PCR鉴定后的阳性转化子于5 mL BMGY培养基30 ℃、250 r/min培养18 h,随后接种1 mL上述种子液于100 mL BMGY培养基30 ℃、250 r/min培养20 h至A600值为2~6。室温、3000×g离心15 min收集菌体,重悬于100 mL BMMY培养基中并转移至500 mL摇瓶中于30 ℃、240 r/min进行甲醇诱导培养。甲醇浓度分别设置为:2.0%、2.5%、3.0%、3.5%、4.0%,发酵时间为120 h,每24 h取样测定抑菌活性,获取甲醇最佳诱导浓度与发酵时间。
1.2.5 抑菌活性分析 琼脂扩散法检测发酵上清液的抑菌活性[22]。将100 μL、菌体浓度为108CFU/mL的活化黄色葡萄球菌和沙门氏菌培养液分别接种于25 mL LB琼脂培养基中,于40~50 ℃混匀后制备平板,待平板凝固后使用直径4 mm的无菌打孔器打孔。每孔加入80 μL,10000×g离心10 min制得的发酵上清液,以80 μL氨苄青霉素溶液(50 mg/mL)作为阳性对照,以未转化的酵母发酵上清液为阴性对照,37 ℃培养16 h,测量抑菌圈大小,分析其抑菌活性。
1.2.6 浓缩发酵上清液抑菌活性与氨苄青霉素的对比分析 100 mL LfcinB-W4的发酵上清液-60 ℃冷冻干燥48 h,加入10 mL ddH2O复溶,10000×g离心10 min取上清。按1.2.5所述的方法,制备金黄色葡萄球菌平板,用直径4 mm的打孔器打孔。分别加入80 μL 5和10倍浓缩液,以80 μL氨苄青霉素溶液(50 mg/mL)作为阳性对照,37 ℃培养16 h,分析其抑菌活性。
1.2.7 LFcinB-W4与LFcinB及LfcinB-W10,14对比分析 按照1.2.5所述方法制备金黄色葡萄球菌平板,用直径4 mm的打孔器打孔。每孔加入80 μL实验室保存的同等发酵条件下制备的LFcinB、LFcin-W10,14及LFcinB-W4发酵上清液,以80 μL氨苄青霉素溶液(50 mg/mL)作为阳性对照,37 ℃培养16 h,分析其抑菌活性。
1.2.8 LFcinB-W4 Tricine-SDS-PAGE检测 收集抑菌活性强的发酵上清液,经3 kDa超滤管过滤,收集10 mL滤液,-60 ℃冷冻干燥48 h,加入100 μL ddH2O复溶,进行Tricine-SDS-PAGE分析[23],实验设置未变异GS115同等发酵条件获取的上清液为空白对照。
1.3 数据处理
实验使用ClustalW对氨基酸序列进行同源性比较分析,使用SWISS-MODEL利用同源建模的方法模拟衍生肽空间结构,采用数据分析软件Origin Lab2017对抑菌数据进行处理,分析获取最佳甲醇诱导浓度和最佳发酵时间。
2 结果与分析
2.1 基因设计与合成
7种哺乳动物来源的乳铁蛋白肽序列同源性对比分析结果如图2所示,相同功能及保守位置的氨基酸残基用彩色标记,无色的为非保守氨基酸位点。结果显示LFcinB第4、5号位置的Arg为非保守氨基酸。研究发现,牛乳铁蛋白肽发挥抑菌作用时,色氨酸(Trp)残基与磷脂头部的甘油分子相互作用,使细胞膜形成穿孔,导致细胞内容物的外泄[24],Trp是牛乳铁蛋白肽发挥抑菌功能的关键氨基酸[13],因此设计中将第4位Arg替换为Trp以获得优化设计的衍生肽。
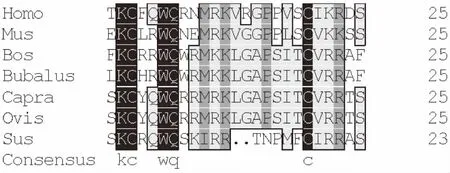
图3 7个哺乳动物来源的乳铁蛋白肽序列同源性分析,无色的为非保守氨基酸位点Fig.3 Homogenization analysis of 7 mammalian-derived lactoferrin peptides,colorless non-conservative amino acid sites注:Homo:人;Mus:鼠;Bos:牛;Bubalus:蟾蜍;Capra:羊驼;Ovis:绵羊;Sus:猪。
APD数据库的Prediction工具和ExPASy的ProtParam预测分析软件对LFcinB和LFcinB-W4理化参数的对比分析结果表明(表1),相较于原肽,衍生肽的疏水残基由48%提升至52%;由于Arg的替换,其净电荷数由+8降低至+7,可能有利于在表达过程中降低宿主蛋白酶对目的蛋白的降解。

表1 LFcinB及LFcinB-W4理化参数分析Table 1 Analysis of physical and chemical parameters of LFcinB and LFcinB-W4
SWISS-MODEL同源建模得到的LfcinB及其衍生肽空间结构如图4所示。LFcinB-W4和LFcinB的二级折叠结构是一致的,衍生肽依然具备和原肽类似的结构及生物学功能。

图4 LFcinB及LfcinB-W4空间结构对比Fig.4 Comparison of spatial structure between LFcinB and LfcinB-W4
CAMP的抗菌肽预测工具对衍生肽的抗菌活性指数预测结果如表2所示,LFcinB-W4的两数据高于原肽,表明设计的衍生肽氨基酸序列在理论上具有优于原肽的抗菌性,为下一步合成衍生肽基因,构建表达载体提供了理论基础。

表2 LfcinB及LfcinB-W4抗菌活性预测Table 2 Prediction of antibacterial activity of LfcinB and LfcinB-W4
2.2 重组表达载体的构建
EcoRI和NotI双酶切目的基因扩增质粒pUC-SP-LFcinB-W4,2.2%琼脂糖凝胶电泳检测,检测到的82 bp条带(图5)与目的基因一致。EcoRI和NotI双酶切pPIC9K,T4 DNA连接酶构建表达载体质粒pPIC9K-LFcinB-W4。根据重组表达载体质粒和空表达载体质粒的序列分析,当使用AvrⅡ和NdeI进行双酶切鉴定时,空载质粒被切成5881和3395 bp的两条DNA电泳条带,而重组质粒由于缺失了AvrⅡ酶切位点只能够被线性化,电泳时表现为一条带,1.0%琼脂糖凝胶电泳分析如图6所示,测序结果如图7所示,结果与预期相符,说明重组表达载体构建成功。

图5 pUC-SP-LfcinB-W4双酶切电泳Fig.5 pUC-SP-LfcinB-W4 double enzyme digestion注:M:DNA marker(100~3000 bp); 1:pUC-SP-LfcinB-W4酶切产物。

图6 pPIC9K-LFcinB-W4双酶切鉴定Fig.6 pUC-SP-LfcinB-W4 double enzyme digestion注:M:DNA marker(250~10000 bp); 1:pPIC9K-LfcinB-W4,10;2:pPIC9K。

图7 pPIC9K-LFcinB-W4测序Fig.7 DNA sequencing of pPIC9K-LFcinB-W4
2.3 重组表达载体电转毕赤酵母GS115及PCR鉴定
以转化子的基因组DNA为模板,PCR后经琼脂糖凝胶电泳分析,结果(图8)显示泳道3~9既含有目的基因条带(562 bp)也含有AOX1基因条带(约2.2 kb),为阳性克隆,其甲醇利用型为Mut+;泳道10只有目的基因条带,为阳性克隆,其甲醇利用型为Muts。

图8 转化子PCR鉴定Fig.8 Transformants PCR identification注:M:marker;1:空白对照;2:阴性对照;3~10:转化子基因组PCR。
2.4 LFcinB-W4的诱导表达及抑菌活性检测
甲醇利用型为Mut+的阳性转化子不同的甲醇浓度诱导表达结果(图9a、图9b)表明甲醇诱导浓度为2.5%、发酵时间为96 h后,离心收集的发酵上清液抑菌效果最佳,可以推测LFcinB-W4在该条件下具有较高的表达量,抑菌活性高于阳性对照氨苄青霉素。甲醇诱导浓度低于2.5%或位于2.5%~3.0%时,虽具有抑菌活性,但相较于2.5%甲醇诱导浓度,发酵上清液抑菌活性有所降低,即可推测LFcinB-W4表达量低于2.5%甲醇诱导效果。当诱导浓度高于3.0%时,发酵上清液没有抑菌活性,表明LFcinB-W4在发酵过程中没有进行表达。实验以2.5%的甲醇浓度对同一转化子进行诱导表达,抑菌结果显示(如图10a、图10b),随着发酵时间的增加,其抑菌活性逐渐增加,发酵时间为96 h时抑菌活性高于阳性对照氨苄青霉素,抑菌活性但发酵时间超过96 h后,抑菌活性逐渐下降,分析是宿主本身的蛋白酶积累增加了LFcinB-W4的降解[25]。金黄色葡萄球菌(革兰氏阳性菌)和肠沙门氏杆菌(革兰氏阴性菌)的抑菌结果(图11)可以看出,LFcinB-W4对革兰氏阳性菌和革兰氏阴性菌均有较强的抑菌活性。
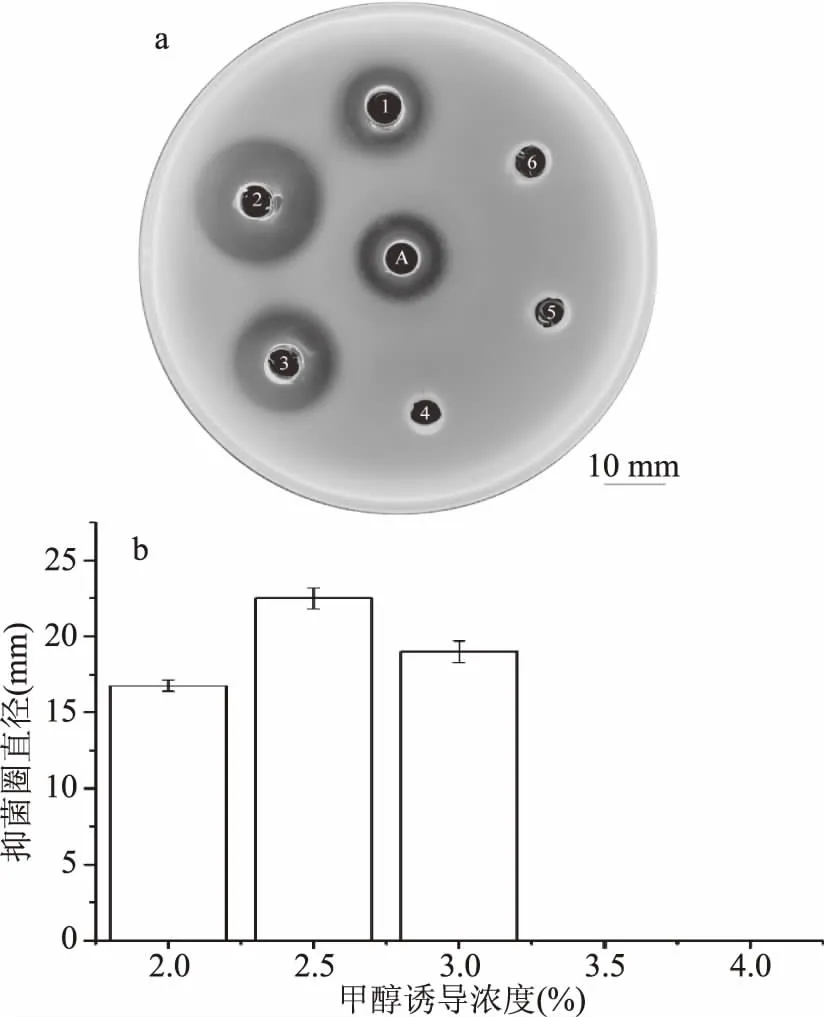
图9 甲醇浓度诱导对发酵上清液表达活性的影响Fig.9 Effects of induction of different methanol concentration on the expression activity offermentation supernatant 注:1~5:2.0%~4.0%甲醇浓度;6:阴性对照;A:阳性对照。

图10 发酵时间对发酵上清液抑菌活性的影响Fig.10 Effects of different fermentation time on antibacterial activity of fermentation supernatant注:1~5:24~120 h;6:阴性对照;A阳性对照。

图11 发酵上清液对典型革兰氏阴性菌和革兰氏阳性菌的抑制作用Fig.11 Inhibition of typical Gram-negative bacteria and Gram-positive bacteria by fermentation supernatant 注:a:沙门氏菌;b:金黄色葡萄球菌;1~4:20~80 μL发酵上清液;5:阴性对照;A:阳性对照。
2.5 浓缩发酵上清液与氨苄青霉素抑菌活性对比分析
发酵上清浓缩液抑菌效果(图12)表明,未浓缩时,同体积发酵上清液抑菌效果同50 mg/mL的氨苄青霉素溶液抑菌效果相当,当上清液通过冷冻干燥的方法浓缩10倍时,其抑菌效果相当于同体积的氨苄青霉素(50 mg/mL)2.5倍左右。

图12 浓缩发酵上清液抑菌活性与氨苄青霉素对金黄色葡萄球菌抑菌作用的对比分析Fig.12 Comparative analysis of antibacterial activity of concentrated fermentation supernatant and inhibition of ampicillin against Staphylococcus aureus注:1:未浓缩发酵上清液;2:10倍浓缩上清液。
2.6 LFcinB-W4与LFcinB及LfcinB-W10,14对比分析
通过与LFinB及LFcinB-W10,14的对比分析发现(图13),LfcinB-W4的抗菌活性优于LFinB,与本实验室设计的LFcinB-W10,14相似,说明关键位点氨基酸的替换,可以提高LFinB的抗菌活性。

图13 LFcinB-W4发酵上清液与LFcinB及LfcinB-W10,14活性对比分析Fig.13 Comparative analysis of antibacterial activity of LFcinB-W4 fermentation supernatant and LFcinB and LfcinB-W10,14注:1:LFcinB-W4发酵上清液;2:LFcinB-W10,14发酵上清液;3:LFcinB发酵上清液;A:阳性对照。
2.7 LFcinB-W4 Tricine-SDS-PAGE检测
通过Tricine-SDS-PAGE分析发现(图14),在分子量约3 kDa处出现一条明显的条带,而空菌的发酵液未出现条带,说明衍生肽LFcinB-W4表达成功。

图14 Tricine-SDS-PAGE鉴定Fig.14 Tricine-SDS-PAGE identification注:M:蛋白Marker;1:LfcinB-W4;2:空白对照。
3 结论
实验在7种哺乳动物来源的乳铁蛋白肽序列同源性对比分析的基础上,对牛乳铁蛋白肽第4位Arg(非保守氨基酸位点)进行了Trp替换,并依据毕赤酵母密码子表达的好嗜性对衍生肽的基因序列进行了优化,实验旨在探究氨基酸残基的改变对衍生肽抗菌活性的影响。乳铁蛋白肽第4位Arg(非保守氨基酸位点)进行了Trp替代后抑菌活性增加,在一定程度上增加了衍生肽的疏水性,有利于衍生肽与细胞膜脂的相互作用,同时正电荷一定程度上的降低减少了毕赤酵母自身分泌的蛋白酶对衍生肽的降解。这些结果证明适当改变衍生肽的理化性质、空间结构,可在一定程度上影响抗菌肽的抗菌活性。也为进一步优化设计衍生肽增强其抗菌活性提供了一定的理论指导基础。
实验在LFcinB-W4基因两侧添加了EcoRI和NotI的限制性酶切位点,构建重组表达载体质粒pPIC9K-LFcinB-W4,经SacI线性化后电转至毕赤酵母宿主菌GS115中,PCR鉴定后,共获得10株整合成功的阳性转化子,其中9株为甲醇利用快型(Mut+),实验结果其中1株LFcinB-W4表达及抗菌效果最佳,其发酵优化条件为甲醇诱导浓度为2.5%,发酵时间为96 h。同时抑菌实验也表明设计得到的牛乳铁蛋白肽衍生肽对革兰氏阴性菌和革兰氏阳性菌均具有较强的抑制作用,但对革兰氏阳性菌的抑菌作用优于革兰氏阴性菌。
毕赤酵母异源蛋白表达系统容易出现宿主蛋白酶降解表达产物的现象。研究发现当发酵时间高于96 h时,发酵上清液抑菌效果有所降低,分析为可能是由于宿主蛋白酶积累增加了LFcinB-W4降解的结果,为了大量获得LFcinB-W4,需设计相关实验增加融合蛋白设计,降低表达产物正电荷携带量,同时进一步研究优化发酵条件、培养基组成、降低LFcinB-W4降解速率。
