一株有氧条件下高产乙醇酵母的筛选、鉴定及其生物学特性研究
2019-09-11范光森刘朋肖吴秋华富志磊朱宇婷成柳洁李秀婷
范光森,刘朋肖,吴秋华,富志磊,朱宇婷,成柳洁,李秀婷,*
(1.北京工商大学,北京食品营养与人类健康高精尖创新中心,北京 100048;2.北京工商大学,北京市食品添加剂工程技术研究中心,北京 100048;3.北京工商大学食品学院,北京 100048)
白酒是我国国酒,其虽非是人民生活必需品,但却在我国人民日常生活中扮演着重要的角色[1]。乙醇是白酒的主体成分,乙醇体积分数不仅是评价白酒品质的重要质量指标,关系到酒的香气、口味和风格,而且也会影响到白酒的产量[2]。众所周知,白酒生产过程中影响其乙醇含量的因素有很多,包括原料、酿造工艺、微生物菌群、蒸馏等,在这些众多因素中,微生物的生命活动无疑是最为关键的因素。在酒精饮料中,酵母菌无疑是负责生产乙醇的重要菌群,尤其是酿酒酵母,是白酒整个发酵过程中的优势菌株,担负着乙醇发酵的重要作用,对于白酒发酵速率、风味及品质具有重要的贡献[3]。
虽然,我国白酒生产仍沿袭传统酿造工艺手段,但随着我国白酒走向国际化,其传统酿造过程中暴露的不足势必会推动我国白酒酿造的革新,在传承的基础上,逐步走向白酒酿造的现代化式生产,由现今粗放型的酿造向智能化标准型酿造转型。在这一过程中,尝试新的酿造方式有利于白酒产业的发展如不锈钢槽车地面恒温发酵系统代替传统地缸发酵,发酵桶、发酵池代替传统发酵设备陶缸或窖池[4]。在这种由地下转为地上的酿造方式转变过程中,白酒酿造环境也发生了微妙的变化,其中较为突出的便是酿酒过程中氧气含量的变化,由原来较为严格的厌氧环境转变为微氧或有氧环境,这种变化势必要求酿造所用微生物特性也随之改变[5-6]。选育获得在有氧条件下高产乙醇的酵母,并对其进行相关生物学特性的研究,有目的地将其应用于白酒实际生产中,对改善我国白酒生产工艺,促进中国白酒的发展具有重大的现实意义[7]。然而,有关研究工作相对欠缺,已有的研究主要集中于酵母利用非葡萄糖碳水化合物转化产乙醇。为此,本文通过传统筛选方法旨在获得一株适应有氧环境下高产乙醇的酵母,为未来白酒生产方式变革提供素材。
1 材料与方法
1.1 材料与仪器
清香型大曲 取自河北衡水老白干酿酒集团2017年12月制备的大曲,粉碎后按照四分法取样于4 ℃保存备用;乙醇标准品 购自Sigma公司;真菌基因组DNA提取试剂盒 购自北京索莱宝科技有限公司;葡萄糖、蛋白胨、酵母浸粉、琼脂粉、硫酸铵、磷酸二氢钾、硫酸镁等试剂 均为国产生物或分析纯试剂;YPD培养基(g/L) 葡萄糖20,蛋白胨20,酵母浸粉10,琼脂粉20,115 ℃灭菌20 min;乙醇发酵培养基(g/L) 葡萄糖200,酵母浸粉10,蛋白胨20,硫酸铵1,磷酸二氢钾1,硫酸镁1,蒸馏水定容,115 ℃灭菌20 min。
YQX-SG46-280S高压蒸汽灭菌器 上海博迅实业有限公司医疗设备厂;BCN-1360型生物洁净工作台 北京东联哈尔仪器公司;电子天平、pH计 赛多利斯科学仪器有限公司;LHS-100CL恒温恒湿培养箱 上海一恒仪器设备有限公司;TU-19紫外-可见分光光度计 北京普析通用仪器有限责任公司;CKX41-F32FL倒置荧光显微镜 日本OLYMPUS;Tprofessional PCR仪 Biometra公司;Microfuge 2R离心机 北京田林恒泰科技有限公司;1260series高效液相色谱仪 Agilent科技有限公司。
1.2 实验方法
1.2.1 酵母菌株的筛选和分离 采用YPD培养基进行白酒大曲中酵母菌的筛选和分离,方法参照许岱等[8]的方法。用无菌水将酒曲曲粉制成菌悬液后,逐级稀释不同浓度梯度的菌悬液,取不同梯度菌悬液100 μL涂布于YPD平板上,30 ℃倒置培养,挑取单菌落划线分离后进行显微镜观察,确定其为纯菌株。
1.2.2 有氧条件下产乙醇酵母菌株筛选 将1.2.1中所筛选得到的酵母接种于YPD液体培养基中,于30 ℃,转速为120 r/min的摇床中活化培养24 h,按1%接种量接入乙醇发酵培养基中,于30 ℃,转速为90 r/min培养48 h。发酵液于室温条件下,10000 r/min离心10 min,获得的上清液采用高效液相色谱法检测乙醇含量。
1.2.3 菌株鉴定
1.2.3.1 菌落形态和显微结构观察 将1.2.2初筛获得的高产乙醇菌株接种至YPD培养基上,30 ℃下培养2 d后进行观察;挑取YPD平板上单菌落少量菌体,涂布并固定在载玻片上,进行美蓝染色液染色,制作临时装片,置于荧光倒置显微镜载物台上,采用油镜(×1000)观察,记录细胞形态特征、出芽情况。
1.2.3.2 生理生化分析 菌株生理生化分析参照《酵母菌的特征与鉴定手册》,包括糖发酵、碳源同化、氮源同化、淀粉水解试验、甲基红试验、吲哚试验、尿素试验、硫化氢试验、牛奶石蕊试验、V.P.试验、明胶水解试验和柠檬酸盐试验[9]。
1.2.3.3 分子生物学鉴定 采用真菌基因组DNA提取试剂盒提取1.2.2初筛获得的高产乙醇酵母基因组DNA,参考许岱等[8]的PCR扩增条件,采用引物NL1(5′-GCATATCAATAAGCGGAGGAAAAG-3′)和NL4(5′-GGTCCGTGTTTCAAGACGG-3′)扩增26S rDNA D1/D2区序列。将验证后的PCR扩增产物送至北京诺赛基因组研究中心有限公司测序。测序结果在NCBI(http://www.ncbi.nlm.nih.gov/)上进行BLAST同源性比对,使用MEGA 6.0生物学软件进行多序列比对分析,利用Neighbor-Joining方法构建系统发育树。
1.2.4 菌株生物学特性研究 酵母菌株生物学特性研究包括NaCl耐受性(0%、5%、10%、15%、20%、25%和30%,w/v)、乙醇耐受性(0%、6%、8%、10%、12%、14%、16%、18%和20%,v/v)、葡萄糖耐受性(10%、30%、40%、50%、60%、70%、80%和90%,w/v)、乙酸耐受性(0%、0.25%、0.5%、0.75%、1.0%、1.25%、1.5%、1.75%和2.0%,v/v)、生长温度范围(20、25、30、35、40、45、50、55和60 ℃)和pH范围(1、2、3、4、5、6、7、8、9、10、11和12)。具体操作方法参照文献[10]。
1.2.5 高效液相色谱法测定乙醇含量 发酵液离心后上清液用0.22 μm 水系滤膜过滤,进行高效液相色谱检测乙醇。具体方法参照Sun等[11]:BioRad Aminex HPX-87H(300 mm×7.8 mm);0.01 mol/L H2SO4,流速:0.5 mL/min;柱温25℃,进样量20 μL,外标法定量。
1.3 数据处理
每组试验进行三个平行,数据采用平均值±标准差表示,利用Excel 2016和Origin 9.0绘图软件处理试验数据。
2 结果与分析
2.1 高产乙醇酵母菌筛选结果
通过梯度稀释结合平板涂布方法先后从老白干大曲中分离出60株菌株,经菌落形态观察,初步确定这些菌株为酵母菌。将上述酵母菌分别接种到乙醇发酵培养基中,并对其发酵液中乙醇含量进行测定,试验结果见表1。有24株酵母能够在摇动条件下,即有氧环境下发酵产乙醇,并且乙醇产量基本都在10.0 g/L以上,其中酵母YF1914和YF1703发酵液中乙醇含量超过50.0 g/L,尤其是YF1914为这些酵母中乙醇产量最高菌株,其乙醇含量达到60.1 g/L,为此将其确定为本研究的目标菌株。
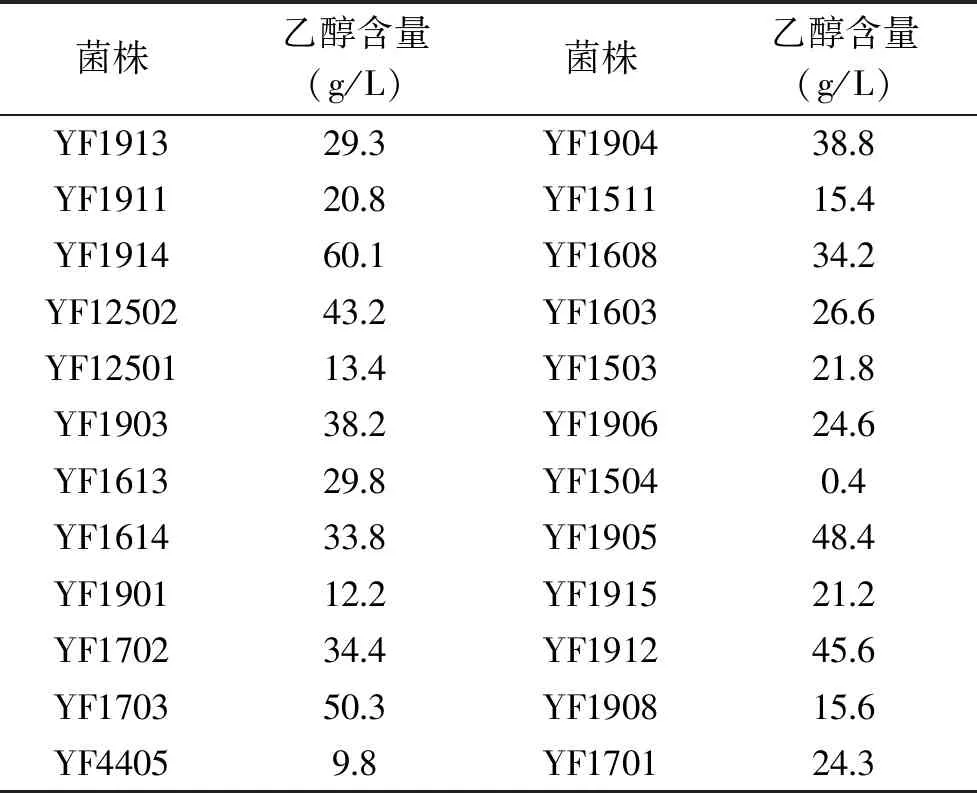
表1 不同酵母发酵液中乙醇含量比较结果Table 1 Comparison of alcohol production after fermentation by different yeasts
2.2 酵母YF1914的鉴定结果
2.2.1 酵母YF1914形态特征 菌株YF1914在YPD鉴定平板上的生长特征如图1a所示,菌落呈白色,表面光滑,突起,边缘规则,内部湿润易挑起;显微镜下细胞形态特征如图1b所示,细胞为卵圆形或纺锤型,一端出芽(图1b中圈标记处),无菌丝体,属典型酵母特征。根据菌株的菌落形态和细胞形态初步确定菌株YF1914为酵母菌。
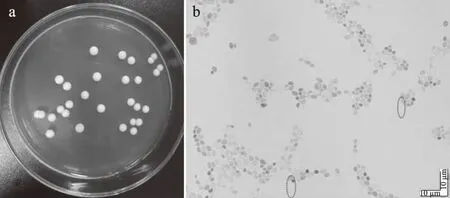
图1 酵母YF1914在YPD培养基上菌落形态特征(a)及显微镜下细胞形态特征(10×100)(b)Fig.1 Colony morphology(a)of yeast strain YF1914 on YPD culture medium and cell morphology(b)of yeast strain YF1914 captured by microscope(10×100)注:b中圈出酵母处于出芽状态。
2.2.2 酵母YF1914生理生化结果 从表2可以看出,酵母YF1914能利用葡萄糖、半乳糖、麦芽糖发酵产酸产气,利用蔗糖发酵只产气不产酸,利用纤维二糖发酵只产酸不产气,而不能利用乳糖、可溶性淀粉、木糖和阿拉伯糖产酸或产气。该酵母能利用葡萄糖、蔗糖、半乳糖、麦芽糖、乳糖、可溶性淀粉、木糖、阿拉伯糖、纤维二糖、柠檬酸、乙醇、海藻糖等碳源生长,而不能利用山梨醇、甘露醇、山梨糖、鼠李糖进行生长。氮源同化试验结果表明,该酵母能利用尿素、硫酸铵、硝酸钾和L-苯丙氨酸作为唯一氮源进行生长,而不能利用亚硝酸钾作为氮源进行生长。除了吲哚试验和尿素试验为阳性反应外,淀粉水解试验、甲基红试验、V.P.试验、硫化氢试验、柠檬酸盐试验、明胶水解试验和牛奶石蕊试验等都为阴性反应。根据《酵母菌的特征与鉴定手册》[9],该酵母菌与酿酒酵母属(Saccharomycescerevisiae)的生理特性相似度最高,初步认为该菌属属于酿酒酵母属。
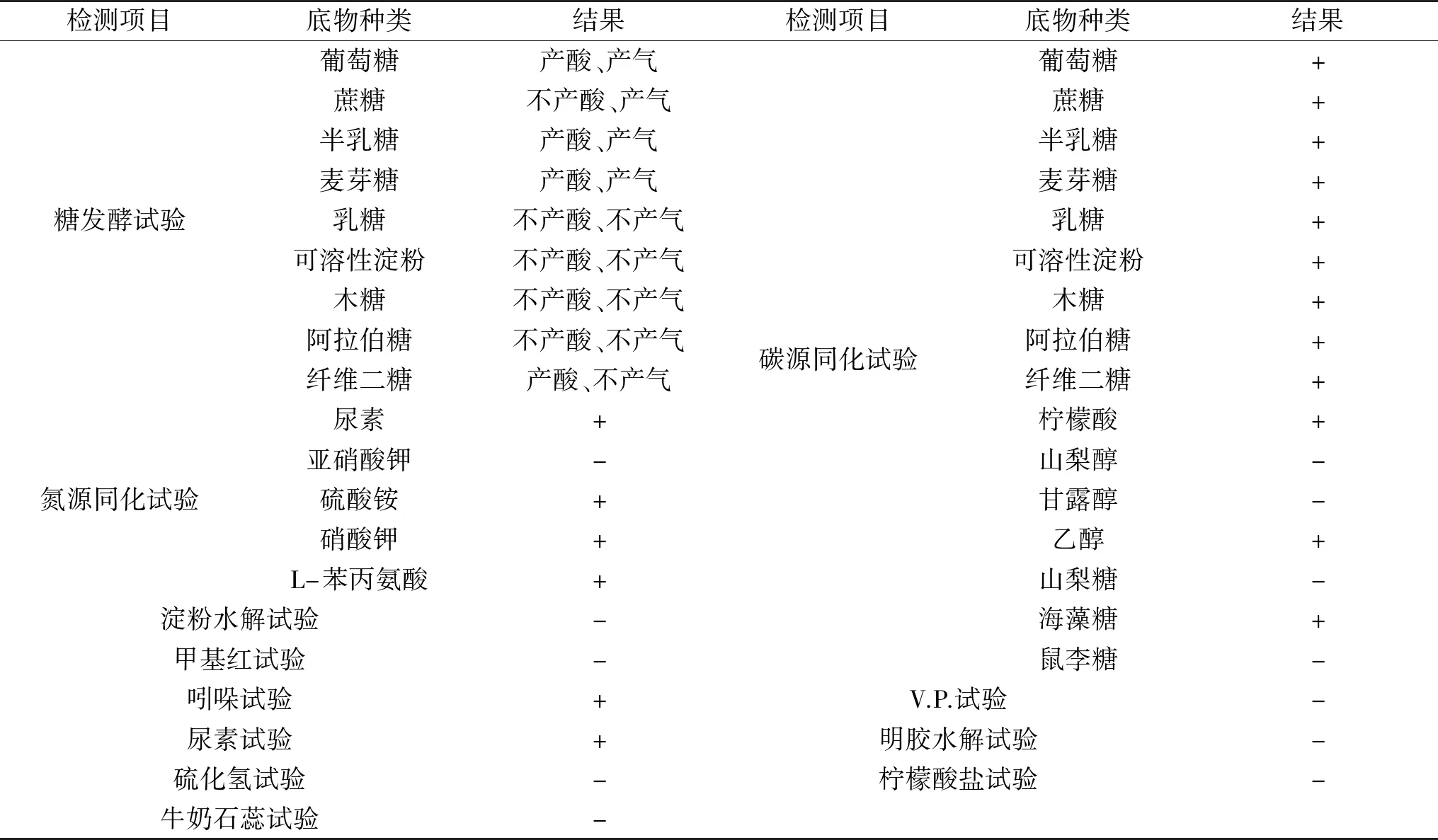
表2 酵母YF1914生理生化特征Table 2 Physiological and biochemical characteristics of yeast strain YF1914
2.2.3 酵母YF1914分子生物学鉴定结果 通过真菌基因组DNA提取试剂盒提取分离酵母YF1914基因组DNA,并以其为模板成功扩增获得该酵母的26S rDNA基因条带(图2),将酵母YF1914的26S rDNA产物进行测序,测序结果在NCBI上进行BLAST比对,结果表明,该菌与酿酒酵母(Saccharomycescerevisiae)的26S rDNA序列同源性最高,相似度达到99%。利用MEGA 6.0软件中的Neighbor-Joining方法对该菌株及与其序列相似度较高的菌株构建系统发育树(图3)。由图3可以看出该酵母与酿酒酵母(Saccharomycescerevisiae)KP070744.1的亲缘关系最近。综合以上试验结果,菌株YF1914被鉴定为酿酒酵母(Saccharomycescerevisiae)。
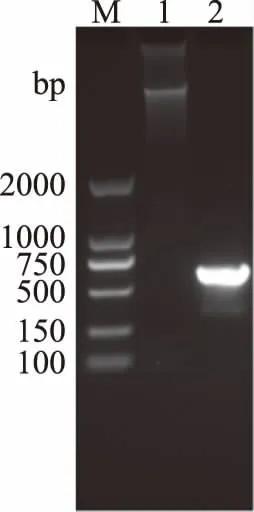
图2 琼脂糖凝胶电泳图Fig.2 Agarose gel electrophoresis 注:M:DL2000 DNA Marker;1:YF1914总DNA;2:YF1914扩增26S rDNA D1/D2序列。

图3 酵母YF1914基于26S rDNA D1/D2序列及Neighbor-Joining法构建的系统发育树Fig.3 Phylogenetic tree of yeast strain YF1914 using neighbor-joining analysis based on the 26S rDNA D1/D2
2.3 酵母YF1914生物学特性分析
2.3.1 NaCl耐受性 渗透压能够引起细胞内水分活度、细胞结构及组成成分的变化,甚至会破坏细胞膜上或胞内的酶活,从而影响微生物的生长。不同种类的微生物由于生长所处的外界环境不同,通过环境压力的选择而产生了适应不同渗透压的微生物菌群[10]。白酒酿造环境比较复杂,因此会产生不同适应能力的微生物。由图4可以看出酵母YF1914具有一定的耐盐性,随着NaCl质量分数的增加(0~15%),酵母生长速率虽然受到的抑制程度加强,但当NaCl质量分数为15%时,酵母YF1914仍然能够生长,培养24 h,OD560为0.35,当NaCl质量分数继续增加至20%时,其生长停滞(图4)。一般而言,NaCl质量分数大于15%时,会抑制大多数微生物的生长繁殖[12]。韦元琪等[13]利用盐浓度梯度富集培养从洋河酒曲中筛选获得了1株在1.4 mol/L NaCl浓度下生长的库德里阿兹威氏毕赤酵母,该酵母在高盐条件下生长时,其胞内海藻糖的积累显著增加;付肖蒙等[14]为提高酱油生产效率和产品品质,筛选获得了多株在添加了6%质量分数NaCl的培养基中能很好生长的酵母;本研究课题组在前期从酒曲中也获得多株高耐受NaCl酵母菌株,其中酵母Y1401最高NaCl耐受质量分数高达20%[10]。这些高耐受NaCl酵母可能是由于白酒酿造过程中的复杂环境造成的,有利于其快速适应白酒酿造环境。

图4 酵母YF1914的NaCl耐受性Fig.4 NaCl tolerance of the strain YF1914
2.3.2 乙醇耐受性 酵母耐乙醇能力在一定程度上决定了其产乙醇能力,也决定了其在白酒酿造中的应用。由图5可以看出,酵母YF1914在不同浓度乙醇的生长规律与在不同NaCl浓度条件下的情况类似,随着浓度的增加,生长速率逐渐下降,即乙醇对酵母产生了一定的毒害作用。值得注意的是,该酵母即使在乙醇浓度为18%时仍能生长(生长24 h,OD560为0.30)。按照酵母乙醇耐受性划分标准,其属于乙醇高耐受性酵母[15],该酵母这一特点有利于其在白酒酿造中的应用。姚淑敏等[16]从甜酒酿中筛选获得一株乙醇耐受浓度为16%的东方伊萨酵母;滕超等[17]从老面团中分离到两株酵母Q3505和Q5503,这两株酵母都具有高乙醇耐受性,耐受能力分别为14%和16%。研究表明,酵母的细胞壁和细胞膜的构成会影响酵母乙醇耐受性[18],推测白酒复杂的酿造环境可能会引起酵母细胞壁和细胞膜构成发生改变,从而适应复杂的酿造环境。
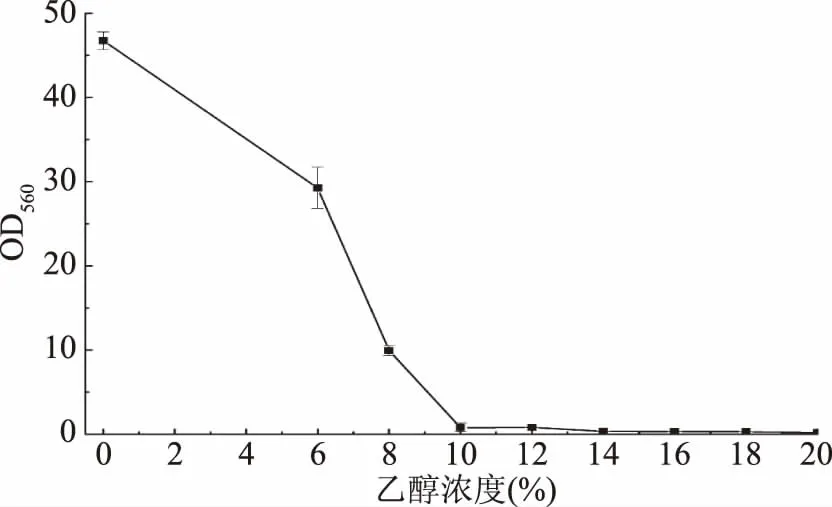
图5 酵母YF1914的乙醇耐受性Fig.5 Ethanol tolerance of the strain YF1914
2.3.3 葡萄糖耐受性 酵母菌大多数能够适应高糖的环境,并且,在酿酒过程中发酵的基础物质是糖,具有高糖耐受性的酵母有利于酿造发酵产乙醇。由图6可以看出,在较低葡萄糖浓度条件下培养时,葡萄糖主要作为碳源提供酵母充足的营养物质,促进酵母的生长,但随着浓度的增加,高浓度的葡萄糖形成的高渗透压对酵母细胞产生抑制作用,从而导致其生长速率下降,这与张莉等[19]研究结果一致。另外,可以发现该酵母在葡萄糖浓度为80%时仍能够生长,具有较高的葡萄糖耐受性,该酵母这一特征从发酵底物耐受性角度进一步表明,其在白酒酿造中具有潜在的提高白酒产率的应用价值。
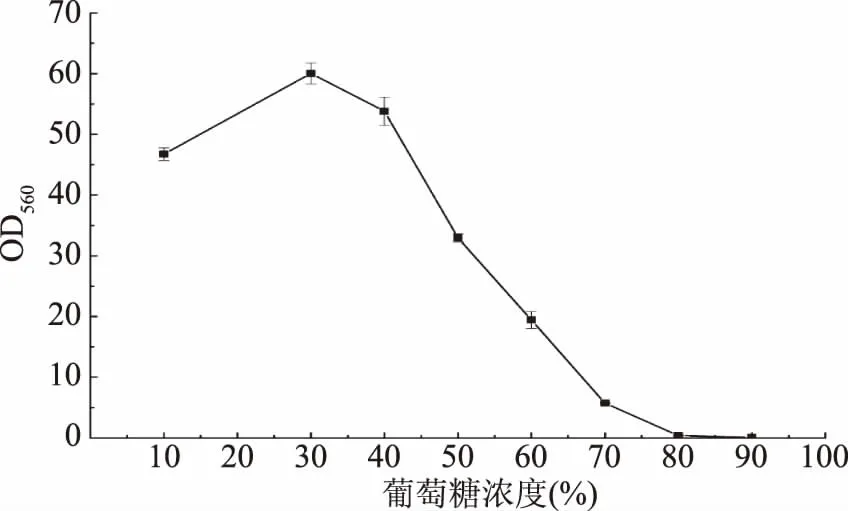
图6 酵母YF1914的葡萄糖耐受性Fig.6 Glucose tolerance of the strain YF1914
2.3.4 乙酸耐受性 在白酒酿造发酵产乙醇过程中会伴随产生很多种风味物质,其中短链有机酸物质在这一过程中会大量积累,尤其是乙酸,不仅因其是白酒重要风味物质的前体物质,也因其会影响白酒酿造过程中微生物菌群的改变,从而影响到白酒的品质。图7表明,酵母YF1914具有一定的乙酸耐受性,在乙酸浓度为0.5%时能够较好的生长,但超过0.75%时该酵母不能够生长,这与付肖蒙等[14]筛选得到的酵母乙酸耐受能力较为接近。该酵母这一特性能在一定程度上转化白酒酿造环境中产生的乙酸形成乙酸乙酯等白酒重要风味物质,不仅提高白酒酿造高产乙醇,而且还具有增香特性。
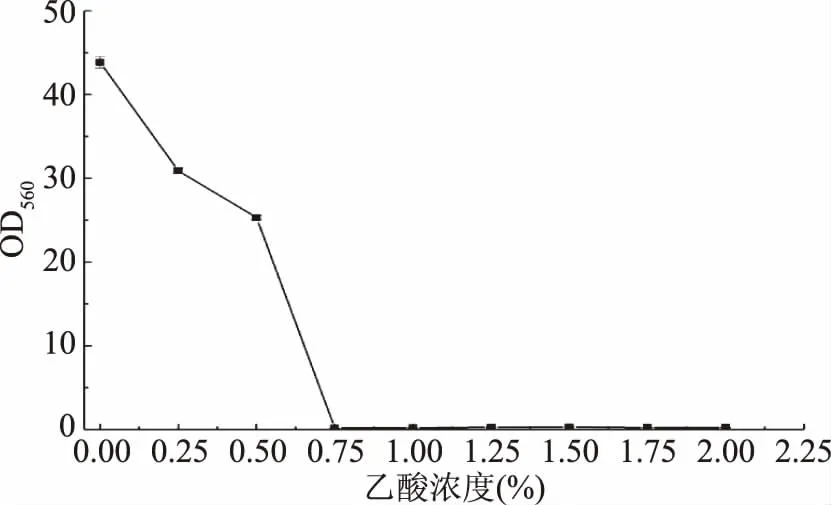
图7 酵母YF1914的乙酸耐受性Fig.7 Acetic acid tolerance of the strain YF1914
2.3.5 生长温度 在白酒酿造过程中,温度存在较大的变化范围,如果酵母能够很好的适应宽广的温度范围,那么势必将会在白酒酿造整个过程中发挥更大的作用。研究结果表明,该菌能够在较宽广的温度范围内生长(20~50 ℃),并且其最适生长温度为25~35 ℃(图8)。这一结果表明酵母YF1914能够很好的适应白酒酿造过程中温度的变化,在白酒酿造中具有较好的应用价值。耐高温酿酒酵母因能更好的适应白酒酿造实际环境,同时可以通过辅加一定真空条件实现乙醇边发酵边挥发的持续酿造,降低生成能耗等优势,得到了越来越广泛地关注[20]。酵母YF1914生长温度范围比较宽广可能是在白酒酿造过程中自然筛选的结果。

图8 酵母YF1914在不同温度下生长情况Fig.8 The growth of strain YF1914 at different temperature
2.3.6 生长pH 在白酒发酵过程中,酵母菌和环境生态因子之间地相互作用导致酸性物质逐渐产生和积累,从而导致发酵环境pH下降,进而影响到酵母菌的生理代谢。因此,酵母菌对环境pH变化地适应能力是决定其发酵过程中原料利用和产物转化的关键因素[21]。从图9的实验结果可见,该酵母能够在pH1~10范围内生长,并且最适生长pH为5~6,由此可见该酵母能够很好的适应白酒酿造过程中pH的变化。

图9 酵母YF1914在不同pH下生长情况Fig.9 Growth of strain YF1914 at different pH
3 结论
本研究从老白干香型大曲中筛选获得一株在有氧环境下高产乙醇的酵母,通过形态观察、生理生化分析和分子生物学检测综合结果鉴定为酿酒酵母(Saccharomycescerevisiae)。该酵母具有良好的乙醇耐受性、NaCl耐受性和葡萄糖耐受性以及宽广的温度和pH适应性。综上可见,该酵母适合应用于白酒酿造过程中,并且可以作为功能强化菌调控白酒的风味。
