一株产胶原蛋白酶细菌的鉴定及产酶条件优化
2019-09-11李茂琳王红英钱斯日古楞
李茂琳,谭 军,王红英,王 迪,张 宇,徐 桐,钱斯日古楞,*
(1.大连工业大学生物工程学院,辽宁大连 116034;2.内蒙古河套农牧业技术研究院,内蒙古巴彦淖尔 015000)
胶原蛋白是一种纤维蛋白,在生物结构中起着连接作用,是许多生物体中最丰富的蛋白分子之一,具有良好的生物相容性、低免疫原性、可再生性等功能活性,在食品、保健品、生物药品、化妆品、新能源功能材料等行业中都有着广泛的应用[1-3]。因其有特殊的三螺旋多肽链结构,分子结构十分稳定,因此难以提取也难以被利用[4]。利用胶原蛋白酶将胶原蛋白的三螺旋结构打开后得到的胶原短肽,更为完整的保留了其生物活性,更易于被人体吸收利用,具有很好的可消化性、抗氧化性、促进皮肤代谢、消除体内自由基等诸多生理活性[5-6]。
目前,已知产胶原蛋白酶的微生物有枯草芽孢杆菌[7]、蜡样芽孢杆菌[8]、嗜虫沙雷氏菌、放线菌[9-10]等,其中嗜虫沙雷氏菌的酶活最高,为98.37 U/mL[11]。微生物源的胶原蛋白酶相比从动物、植物体中分离出的种类少,关于胶原酶产生菌株的开发以及所产胶原酶的研究也相对较少,且大多因产量少、酶活低、安全性低等诸多原因不适合大规模生产[12-13]。有研究表明,海参肠道中存在的大量蛋白酶导致其自溶[14],且溶解后不影响其食用安全性[15],故海参源菌株产出的胶原蛋白酶具有一定的高产性和安全性。
因此,本实验对一株从海参肠道中分离出的已知产胞外胶原蛋白酶的菌株AL-13进行鉴定及产酶条件优化,以期获得安全、便捷、高效、低成本、高产量的胶原酶生产方法,为使用胶原蛋白酶获得胶原蛋白以及对胶原蛋白的利用和工业化生产提供理论依据,具有良好的研究前景。
1 材料与方法
1.1 材料与仪器
产胶原蛋白酶菌株AL-13 本实验室在前期工作中从海参肠道中筛选、保存并提供;牛肉膏、蛋白胨、酵母膏 北京奥博星生物技术有限责任公司;聚乙烯醇、吐温-20、明胶 均为化学纯,天津市光复科技发展有限公司;琼脂、氢氧化钠、氯化钠、无水氯化钙、硫酸铵、醋酸钠、磷酸二氢钾、磷酸氢二钾、植酸钙 均为分析纯,天津市科密欧化学试剂有限公司;种子培养基:酵母膏10 g/L,蛋白胨10 g/L,NaCl 5 g/L,pH6.5~8.5;LB培养基:酵母膏5 g/L,蛋白胨10 g/L,NaCl 10 g/L,pH7.0~7.4;固体LB培养基:酵母膏5 g/L,蛋白胨10 g/L,NaCl 10 g/L,琼脂2%,pH7.0~7.4。
FA1204B电子分析天平 上海精密科学仪器有限公司;HH-S6/ZK6双列六孔数显控温恒温水浴锅 巩义市英峪予华仪器厂;80-2型离心沉淀机 北京医用离心机厂;PHS-3B精密pH计 上海雷磁仪厂;HZQ-F160A高低温恒温振荡培养箱 上海智城分析仪器制造有限公司;721可见分光光度计 上海第三分析仪器厂;YXQ-50A立氏压力高温干热灭菌锅 上海博远实业有限医疗设备厂。
1.2 实验方法
1.2.1 菌株的形态特征观察、生理生化特征分析及16S rDNA基因序列分析 将菌株AL-13涂布于固体LB培养基上,30 ℃条件下培养24 h长出单菌落,观察其菌落形态特征。在固体培养基平板上挑取单菌落,用无菌水稀释制成菌悬液,将菌悬液涂于载玻片上自然风干,通过扫描电镜观察菌体形态特征;参照《常见细菌系统鉴定手册》[16]和《伯杰细菌鉴定手册》[17]进行生理生化特征分析;将菌体移交至大连宝生物工程有限公司进行16S rDNA基因序列分析。
1.2.2 种子液制备、酶活测定
1.2.2.1 种子液的制备 挑选保存于斜面培养基上的单菌落接种至固体平板培养基进行活化,30 ℃恒温培养24 h,长出菌落后挑取一个饱满单菌落接种于50 mL液体种子培养基中,置于30 ℃、180 r/min的摇床中摇瓶培养24 h,即得种子液,通过稀释平板计数法测得此时种子液中细菌的浓度约为108cfu/mL。种子液应于4 ℃保存,使用时间不宜超过3 d。
1.2.2.2 酶活力的测定 参考SB/T10317-1999《中华人民共和国行业标准蛋白酶活力测定法》,采用Folin-酚法,以酪蛋白为底物,酪氨酸为标准物,对发酵上清液中的酶活进行测定[18]。相对酶活为试验中各因素的吸光度与其中最大吸光度的百分比。
1.2.2.3 酪氨酸标准曲线的绘制 精确配制浓度分别为0、20、40、60、100 μg/mL的酪氨酸标准溶液,与Folin-酚试剂进行显色反应后分别测定其吸光度,以吸光度值为纵坐标,酪氨酸浓度为横坐标,绘制标准曲线,得到线性回归方程y=0.0101x-0.004,R2=0.9991。酶活定义为在40 ℃条件下,每分钟水解酪蛋白产生1 μg酪氨酸的量为1个酶活力单位(U)。
1.2.3 单因素实验确定培养条件 将AL-13种子液以4%的接种量接种于自然pH的LB培养基中,于30 ℃、180 r/min的条件下摇瓶培养,于30 h取样测定酶活为16.14 U/mL,此为菌株AL-13优化前的酶活,在此基础上对菌株AL-13的培养条件及产酶培养基进行优化。
将AL-13种子液以4%的接种量接种于自然pH的LB培养基中,于30 ℃、180 r/min的条件下摇瓶培养,分别于12、24、30、36、48、54、60 h取样后测定酶活,计算相对酶活,确定最佳培养时间;将菌株以4%接种量接种于自然pH的LB培养基中,在温度分别为20、25、30、35、40、45、50 ℃的条件下以180 r/min速度摇瓶培养至48 h后,确定最佳培养温度;将菌株以4%的接种量分别接种于pH为4、5、6、7、8、9、10的LB培养基中,在25 ℃条件下培养48 h后,确定最佳初始pH;将菌株以2%、4%、6%、8%、10%的接种量分别接种至pH为8的LB培养基中,在25 ℃下培养48 h后,确定最佳接种量。
1.2.4 单因素实验确定培养基组份
1.2.4.1 碳源及碳源浓度对产酶的影响 以1.2.3得到的最佳培养条件为基础,固定LB培养基其他成分,分别选取蛋白胨、葡萄糖、蔗糖、麦芽糖、果糖、可溶性淀粉作为唯一碳源,浓度均为10 g/L,摇瓶培养后测定酶活,计算相对酶活,确定最佳碳源;添加浓度分别为1、3、5、10、15、20 g/L的最佳碳源物质,摇瓶培养后测定相对酶活,确定最佳浓度。
1.2.4.2 氮源及氮源浓度对产酶的影响 确定葡萄糖浓度10 g/L,固定LB培养基其他成分不变,分别选取酵母膏、牛肉膏、蛋白胨、明胶、尿素、硫酸铵为唯一氮源,添加量均为10 g/L,摇瓶培养后确定最佳氮源;添加浓度分别为1、3、5、10、15、20 g/L的最佳氮源物质,摇瓶培养后确定最佳浓度。
1.2.4.3 氯化钠浓度对产酶的影响 采用最佳碳源和氮源的最佳浓度,添加氯化钠浓度分别为0.5、1、3、5、10、15 g/L,摇瓶培养后确定最佳氯化钠浓度。
1.2.4.4 金属离子及离子浓度对产酶的影响 向单因素确定的最佳培养基中额外添加钙离子、铜离子、镁离子、亚铁离子、锌离子、锰离子,使其浓度分别达到0.05、0.10、0.15、0.20、0.40、0.60、1.00 g/L,以不额外加金属离子的培养基为对照,摇瓶培养后确定最适金属离子及浓度。
1.2.4.5 产酶促进剂及浓度对产酶的影响 许多产酶促进剂能够促使蛋白酶产生菌的生长繁殖,对有些酶起到激活作用,提高产酶量[19]。在1.2.4.4已确定的培养基组份中分别添加聚乙烯醇、醋酸钠、吐温-20、磷酸二氢钾、磷酸氢二钾、植酸钙,添加量均为3 g/L,以不加产酶促进剂的培养基为对照,摇瓶培养后确定最佳产酶促进剂;选取浓度为1、3、5、10、15 g/L的最佳产酶促进剂物质,摇瓶培养后确定其浓度。
1.2.5 响应曲面法优化培养基 在单因素实验确定培养基组成成份的基础上,以培养基组份中的五个因素为研究对象,采用响应面试验设计考察培养基各组分的主效应及交互效应对菌株积累胶原蛋白酶的影响,对培养基的组成进一步优化[20]。采用Box-Behnken的中心组合设计原理,设计5因素3水平的响应面试验,以葡萄糖(A)、牛肉膏(B)、氯化钙(C)、磷酸氢二钾(D)、氯化钠(E)为自变量,发酵液内胶原蛋白酶活性Y(U/mL)为响应值。每组实验设三个平行,重复两次,取各组数据的均值进行响应面回归分析。试验因素与水平的选取见表1。
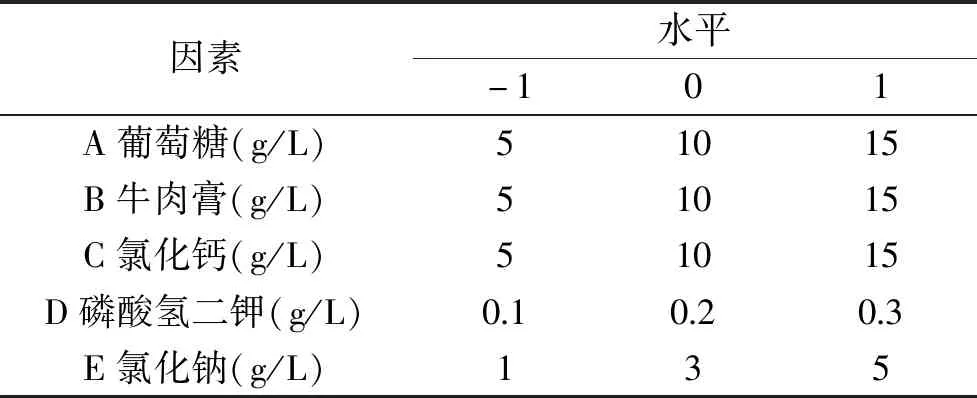
表1 Box-Behnken试验因素与水平Table 1 Factors and levels of Box-Behnken
1.3 数据处理
菌株鉴定结果通过NCBI中BLAST功能进行同源性比对分析,选取与实验菌种同源性90%以上的菌株分析比对结果并使用MEGA6.0软件构建系统发育树;单因素试验优化培养条件用Excel 2003进行数据处理,并用Origin 9.0作图;用SPSS 21.0软件进行方差分析(ANOVA);用Design-Expert 8.0.6软件对试验结果进行多元回归拟合,并对46组试验结果进行响应面回归分析。
2 结果与分析
2.1 菌株的生理生化特征测定及菌种鉴定
AL-13在固体平板培养基上的菌落为乳白色圆形,直径约2~5 mm,菌落不透明,表面光滑,边缘整齐,中间微凸起,有轻微辛辣味。在扫描电镜下放大6900倍,如图1,菌体为椭圆形,直径约1.3~1.8 μm。
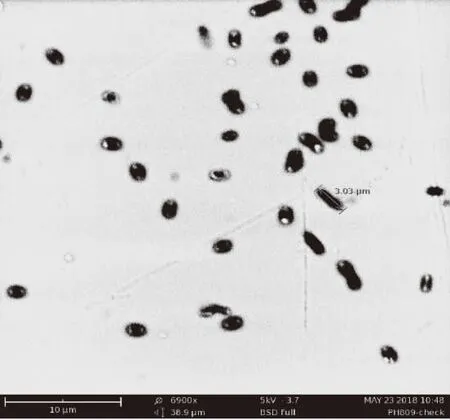
图1 AL-13扫描电镜图Fig.1 Scanning electron micrograph of AL-13
AL-13的生理生化特征鉴定见表2。结果表明该菌为革兰氏阴性菌,有芽孢生成,可降解明胶,生长过程中产酸产气,具有接触酶、氧化酶、淀粉酶等多种酶活性。

表2 AL-13生理生化特征Table 2 Physiological and biochemical characteristics of AL-13
将与AL-13的16S rDNA基因序列同源性90%以上的序列构建系统发育树,由图2可知该菌与Brevibacilluslaterosporusstrain BGSC 40A10、Brevibacilluslaterosporusstrain KMM5等12株菌的亲缘关系非常近,尤其与Brevibacilluslaterosporusstrain NRRL NRS-314的同源性达到了100%,结合形态特征、生理生化特征可将菌株AL-13鉴定芽孢杆菌属中的侧孢短芽孢杆菌。
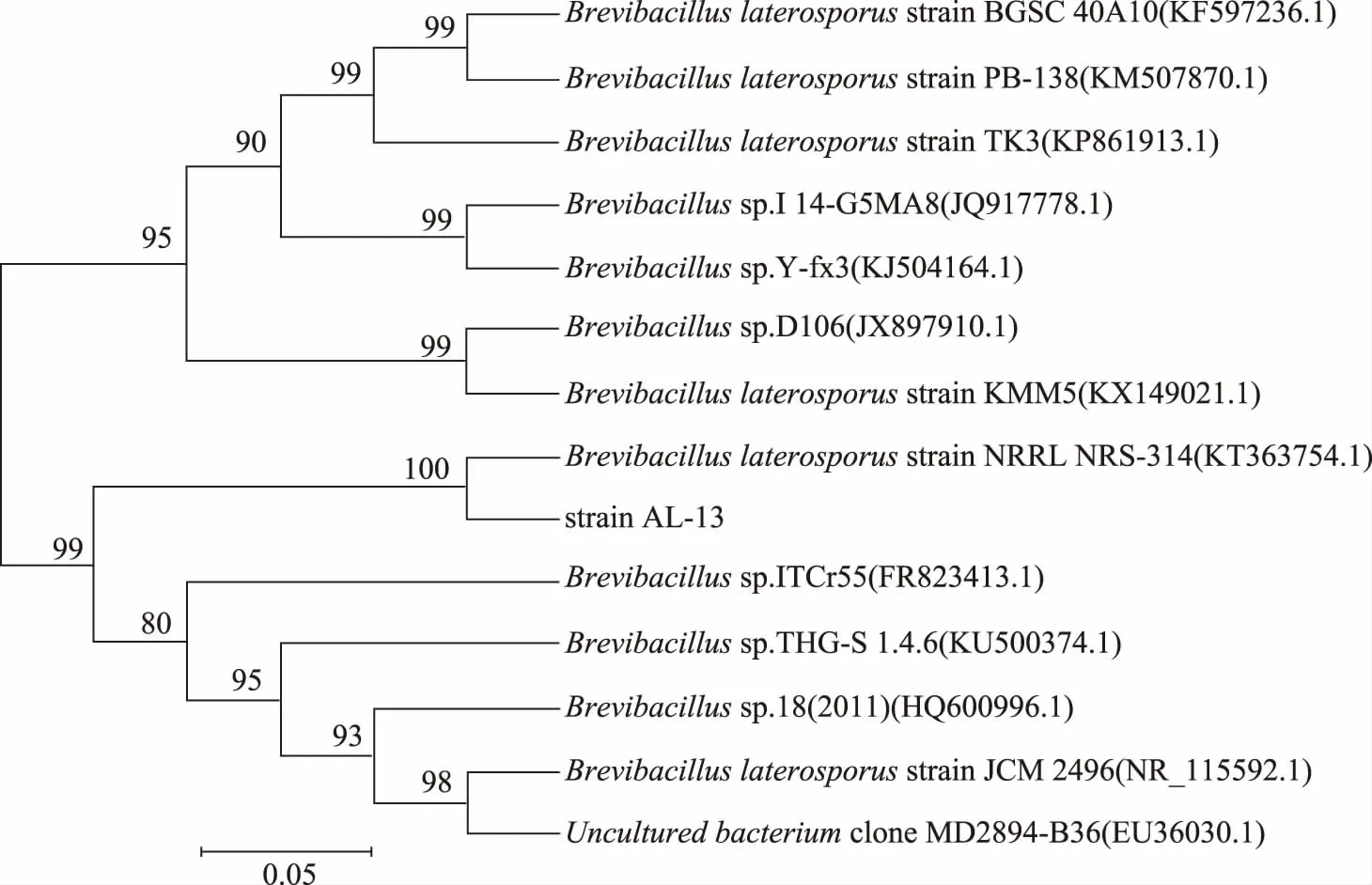
图2 AL-13的系统发育树Fig.2 Phylogenetic tree of AL-13
2.2 培养条件单因素实验结果
2.2.1 培养时间的确定 由图3a可知,在培养12 h时细菌开始产酶,在培养至24 h时,酶积累量开始快速增多,到48 h相对酶活达到最高,48 h后开始下降。这可能是因为在发酵培养前期菌量多,使得酶积累量增多,到后期菌体逐渐转变为芽孢,不再产酶,而原先积累的酶又有所消耗,使得相对酶活降低。因此确定最佳培养时间为48 h。

图3 不同培养条件下所产胶原蛋白酶的相对酶活变化Fig.3 Changes of relative enzyme activity of collagen proteinase produced under different culture conditions
2.2.2 培养温度的确定 由图3b可知,在25 ℃的条件下培养,相对酶活达到最高,继续提高温度,相对酶活开始降低,至45 ℃时几乎失活,因此确定最佳培养温度为25 ℃。由于海洋环境温度较低,此为海洋菌株,所以培养温度相对较低[21]。
2.2.3 初始pH的确定 由图3c可知,菌株在初始pH小于6、大于9的培养基中培养,相对酶活随着pH逐渐极端化在快速降低,而在pH为6~9的条件下培养,相对酶活较高,在初始pH为8时,相对酶活达到最大值,因此确定最佳初始pH为8,这与Yang等[22]对侧孢短芽孢杆菌的研究一致。
2.2.4 接种量的确定 由图3d可知,当接种量由2%开始增加时,相对酶活逐渐增大,这可能是因为增加初始菌体的量导致菌体生长加快、发酵周期缩短。当接种量达到6%时,相对酶活达到最高,高于6%后又出现下降趋势,这可能是因为过高的接种量使得底物更多的用于菌体生长,而用于产酶的量减少[23]。因此确定最佳接种量为6%。
2.2.5 最优培养条件下酶活 得到菌株AL-13产胶原蛋白酶的最佳培养条件为:培养时间48 h、培养温度25 ℃、初始pH8.0、接种量6%。在此培养条件下使用LB培养基进行培养,酶活达到73.77 U/mL,比优化前(16.14 U/mL)提高了约4.5倍。
2.3 培养基单因素优化结果
2.3.1 最佳碳源及碳源浓度的确定 如图4a所示,以葡萄糖为碳源时,相对酶活达到最高,因此选择葡萄糖作为最佳碳源;如图4b所示,葡萄糖浓度由1 g/L增加到10 g/L时,相对酶活快速升高,当葡萄糖浓度大于10 g/L时相对酶活开始下降,这可能是因为高浓度的葡萄糖增大了细胞的渗透压,抑制菌体的生长[24]。因此培养基葡萄糖初始浓度应控制在10 g/L。
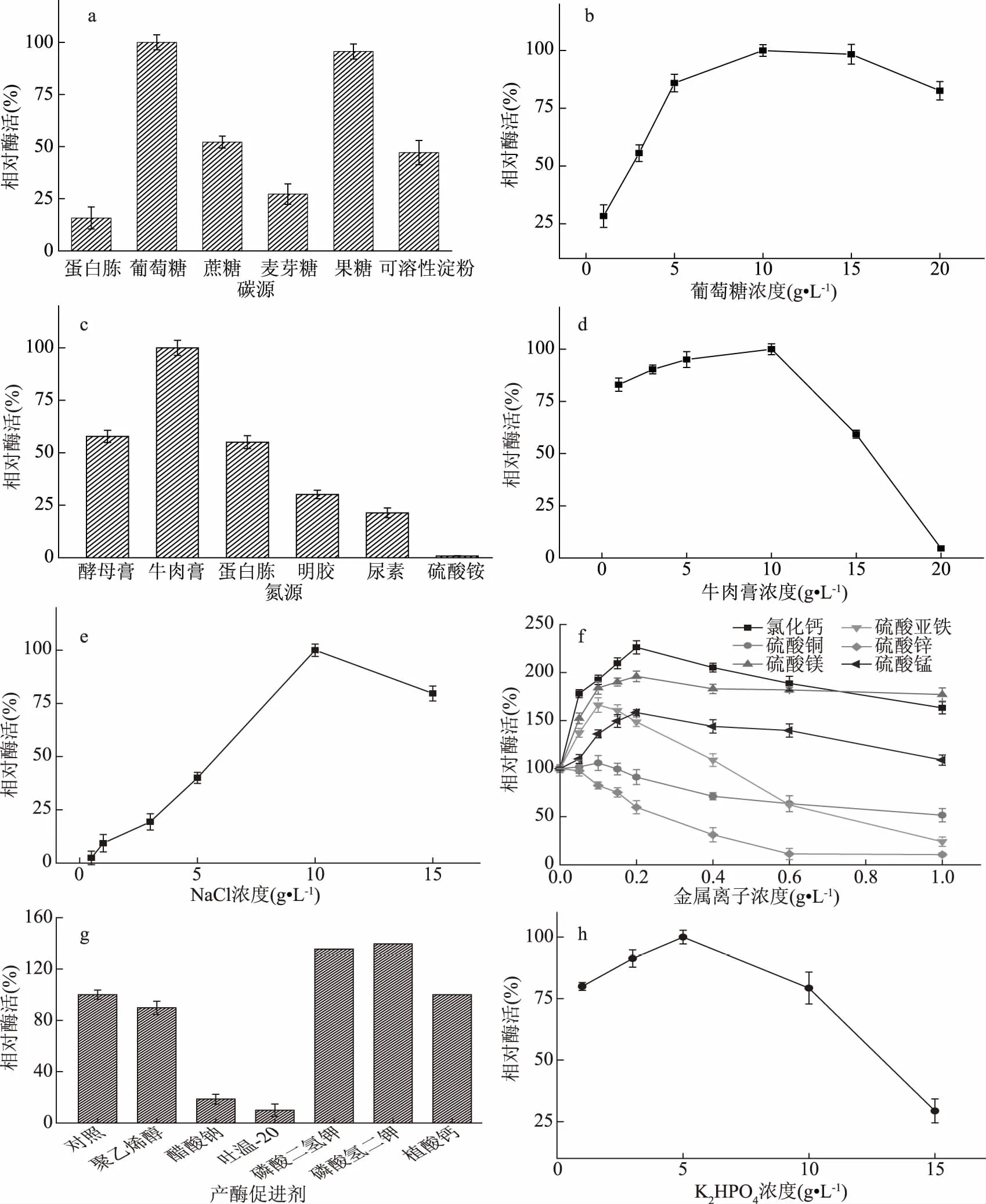
图4 培养基单因素筛选结果Fig.4 Single factors screening of culture medium
2.3.2 最佳氮源及氮源浓度的确定 如图4c所示,以牛肉膏为氮源时,相对酶活远高于其他氮源,且牛肉膏的营养物质含量丰富,含氮量也高于其他氮源[25],因此选择牛肉膏作为最佳氮源;如图4d所示,牛肉膏浓度由1 g/L增加到10 g/L时,相对酶活持续上升,当牛肉膏浓度大于10 g/L时相对酶活开始下降,因此培养基牛肉膏初始浓度应控制在10 g/L。
2.3.3 氯化钠浓度的确定 不同的盐浓度对菌体产酶也有一定的影响,如图4e所示,氯化钠浓度由1 g/L增加到10 g/L时,相对酶活快速上升,当氯化钠浓度大于10 g/L时则开始下降,因此培养基氯化钠初始浓度应控制在10 g/L,产生此种现象的原因还需要进一步的研究。
2.3.4 金属离子及离子浓度的确定 如图4f所示,钙离子、镁离子和锰离子对产酶均有促进作用,其中钙离子的促进作用更为显著。这与一定浓度的钙离子对大多数酶都具有激活作用的现象一致,钙离子结合在酶的特定位点,可以加强酶的稳定性[26]。亚铁离子随其浓度增加,由促进转为抑制。铜离子和锌离子对产酶有明显抑制作用。综上所述,金属离子选择钙离子,添加浓度控制在0.2 g/L。
2.3.5 产酶促进剂及浓度的确定 如图4g所示,磷酸氢二钾胶原蛋白酶相对酶活最高,这可能是由于磷酸盐为微生物的生长提供了营养[27],因此选择磷酸氢二钾为最佳产酶促进剂。如图4h所示,磷酸氢二钾浓度大于5 g/L时,酶活开始呈现下降趋势,因此磷酸氢二钾浓度应控制在5 g/L。
2.4 培养基响应面实验结果
2.4.1 Box-Behnken实验设计及结果 Box-Behnken试验方案及结果见表3。根据Box-Behnken结果,利用Design-Expert 8.0.6软件对试验结果进行拟合,得到五个自变量因素的二次多项回归方程:Y=144.27-14.78A+19.67B+0.49C-10.97D+7.91E-22.96AB+2.85AC-9.01AD+16.41AE-7.35BC-18.41BD-20.47BE+28.88CD+1.62CE-0.87DE-23.65A2-53.65B2-23.69C2-21.04D2-19.46E2。

表3 Box-Behnken实验设计及结果Table 3 Design and results of Box-Behnken experiment
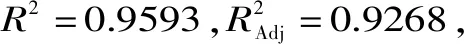

表4 回归方程方差分析Table 4 Variance analysis of regression equation
由F检验可知,各因素对酶活的影响主次顺序为:B>A>D>E>C,其中葡萄糖、牛肉膏、氯化钙、磷酸氢二钾均对酶活的线性影响极显著;各因素的交互作用中AC、BC、CE、DE曲面效应不显著,AD显著(p<0.05),AB、CD、BE、BD、AE达到极显著(p<0.0001)。而在各因素的平方项中,A2、B2、C2、D2、E2均达到了极显著(p<0.0001),表明各因素对酶活的影响较大。
2.4.3 响应曲面及等高线分析 对交互作用曲面效应达到极显著和显著水平的因素利用Design-Expert绘制响应曲面图和等高线图,即葡萄糖和牛肉膏浓度、磷酸氢二钾和氯化钙浓度、氯化钠和牛肉膏浓度、葡萄糖和氯化钠浓度、磷酸氢二钾和牛肉膏浓度、磷酸二氢钾和葡萄糖浓度对胶原蛋白酶活性的影响的响应曲面图和等高线图。如图5所示。

图5 交互作用极显著因素对酶活影响的响应曲面图和等高线图Fig.5 Response surface map and contour map of the interaction of very significant factors on enzyme activity注:(a):葡萄糖和牛肉膏浓度对酶活性的影响;(b):葡萄糖和氯化钠浓度对酶活性的影响;(c):氯化钠和牛肉膏浓度对酶活性的影响;(d):磷酸氢二钾和牛肉膏浓度对酶活性的影响;(e):磷酸氢二钾和氯化钙浓度对酶活性的影响;(f):葡萄糖和磷酸氢二钾浓度对酶活的影响。
响应曲面的坡度变化、等高线的形状及紧密程度都反映着因子之间的交互作用,响应曲面坡度的平缓与陡峭程度可以表明培养基含量变化对胶原蛋白酶活力的响应灵敏程度。等高线的形状可以反映交互项对响应值影响的强弱,圆形表示交互作用对响应值的影响不显著,椭圆形表示交互作用对响应值的影响显著[31]。由图5可以直观的反映出AB、CD、BE、BD、AE、AD之间的交互作用均对侧孢短芽孢杆菌产胶原酶的酶活有显著影响(p<0.05或p<0.01),等高线图均呈椭圆形,进一步说明交互作用的显著性。
2.4.4 最佳产酶条件的确定及验证试验 从图5中可看出胶原酶活力响应值存在最大值,由求得的最优回归方程得到酶活力达到最大值时的最优培养基为:葡萄糖8.14 g/L、牛肉膏11.63 g/L、氯化钙0.17 g/L、磷酸氢二钾2.08 g/L、氯化钠9.48 g/L,此时的最大酶活力为154.89 U/mL。为检验试验结果的可靠性,采用优化后的培养基进行3次平行试验。得到的酶活分别为157.13、149.28、152.76 U/mL,平均值为(153.06±3.73) U/mL,此结果与预测值接近,相对误差为0.04%,表明该模型能够准确的预测实际值,具有一定的实用价值。
3 结论
通过菌株的形态特征、生理生化特征及菌种鉴定得出实验菌株AL-13为侧孢短芽孢杆菌。对其产胶原蛋白酶的条件进行优化,得到最适培养条件为培养时间48 h、培养温度25 ℃、初始pH8.0、接种量6%,最适培养基为葡萄糖8.14 g/L、牛肉膏11.63 g/L、氯化钙0.17 g/L、磷酸氢二钾2.08 g/L、氯化钠9.48 g/L。在该产酶条件下胶原蛋白酶活力预测值为154.89 U/mL,验证培养得到胶原蛋白酶活力为(153.06±3.73) U/mL,产酶条件优化后的酶活(153.06 U/mL)较优化前(16.14 U/mL)提高了9.5倍。本实验成功优化了一株产胶原蛋白酶细菌的产酶条件,为微生物来源的胶原蛋白酶的研究提供了一定的理论指导,对将胶原蛋白酶大规模的应用于实际生产以获得高质量的胶原短肽提供了理论依据,具有良好的研究前景。
