发芽对不同品种花生营养成分和生物活性成分的影响
2019-09-11徐学明苏佳佳张钰清苏雪倩金亚美吴凤凤
杨 天,徐学明,2,3,江 宇,苏佳佳,张钰清,苏雪倩,姚 佩,杨 哪,2,金亚美,2,吴凤凤,2,*
(1.江南大学食品学院,江苏无锡 214122;2.江南大学食品科学与技术国家重点实验室,江苏无锡 214122;3.江南大学粮食发酵工艺与技术国家工程实验室,江苏无锡 214122)
花生(ArachishypogaeaL.)是蔷薇目、豆科、落花生属的一年生草本植物,在亚洲、非洲和美洲国家广泛种植,被认为是一种营养丰富的经济作物。花生营养丰富,含有约25.8%蛋白质、49.2%脂质、16.1%碳水化合物、6.5%水分和2.3%灰分[1-2]。花生中生物活性成分也十分丰富,如维生素、植物甾醇、黄酮类、芪类和生物碱,这些物质赋予了花生延缓大脑衰退、降低罹患癌症和心脏病的风险、降低胆固醇、血压和血脂等功效[3]。
发芽是一种将谷物浸泡在水中直至饱和然后在一定条件下萌发的过程,在生产实践中经常被用作改善种子营养质量。种子发芽的机理是大量内源酶的活化和释放以及它们从结合态转化为游离态的过程[4]。在发芽过程中,水解酶被活化从而水解大分子如蛋白质、多糖和脂肪,导致肽和游离氨基酸、单糖和寡糖以及脂肪酸含量的增加[5]。此外,发芽期间的这些酶促反应使各种生物活性物质的含量大大增加,同时种子中的抗营养素水平降低[6]。研究发现,发芽谷物的摄入可降低慢性病的风险,包括癌症、糖尿病、高血压、高脂血症、肥胖和心脏病[5,7]。同一种类不同品种的发芽谷物其营养成分的变化是不同的。Siecheong等[8]研究发现,发芽过程对不同品种水稻中γ-谷维素积累的影响是不同的。罗旭等[9]研究了4个品种大豆发芽过程中总多酚、总黄酮、大豆异黄酮和γ-氨基丁酸含量的变化,结果表明不同品种的发芽大豆对生物活性物质的富集程度不同。发芽花生产品已在中国市场销售多年。目前对发芽花生的研究主要集中在发芽花生体外实验中的蛋白质、白藜芦醇和功能特性上。研究发现,花生种子发芽过程中蛋白质含量发生显著变化,蛋白质水解物中的含氮量降低,而肽和氨基酸含量增加[10]。发芽过程中白藜芦醇含量的变化也是一个研究热点。Limmongkon等[11]发现,花生发芽过程中白藜芦醇含量显著提高;Wang等[12]进一步发现花生不同部位的白藜芦醇含量不同;而Yu等[13]发现外源诱导(如超声处理)增强了白藜芦醇在发芽花生中的富集。此外,在发芽花生提取物中发现了更高的多酚含量和抗氧化活性,并且细胞实验显示其具有神经保护作用[14]。然而,关于不同品种花生发芽过程中的营养物质和生物活性物质变化的研究很少。
本论文研究了5个品种的花生在发芽过程中的蛋白质、脂肪、可溶性糖、游离氨基酸、游离脂肪酸、γ-氨基丁酸(GABA)、生育酚、白藜芦醇和总酚的含量以及多肽分子量的变化规律,旨在为优化花生发芽工艺、开发优质发芽花生食品提供理论参考。
1 材料与方法
1.1 材料与仪器
5个品种的新鲜花生种子(鲁花1号、鲁花11号、花育20号、青兰1号和青兰8号) 购于青岛茂源种子有限公司,于2017年收获,置于4 ℃冰箱中保存备用;白藜芦醇、γ-氨基丁酸和生育酚标准品 购于美国Sigma公司;福林酚试剂和没食子酸标准品 购于百灵威公司;其他药品和试剂 均来自国药集团化学试剂有限公司。
PQX型多段可编程人工气候箱 宁波东南仪器有限公司;77530-30L冻干机 照生有限公司;YS-04型高速粉碎机 北京燕山正德机械设备有限公司;旋转蒸发仪 上海亚荣生化仪器厂;均质仪 德国IKA公司;TU-1900双光束紫外可见分光光度计 北京普析通用仪器有限公司;LC-20A高效液相色谱仪GC2010气相色谱仪 日本岛津公司;Agilent 1100高效液相色谱系统 美国安捷伦公司;835-50氨基酸自动分析仪 日本日立公司;Waters 1525 HPLC分析系统 美国沃特世公司。
1.2 实验方法
1.2.1 花生发芽处理 发芽方法参照张雅君等[15]的方法并根据实际情况进行修改。花生种子经挑选后,在5%次氯酸钠溶液中室温浸泡10 min,用去离子水洗涤三次后在30 ℃黑暗条件下浸泡6 h,再用去离子水冲洗后置于30 ℃黑暗条件下发芽。分别在发芽的0、1、2、3、4、5 d取样,样品冷冻干燥后用高速粉碎机粉碎,过60目筛,保存于4 ℃冰箱中。
1.2.2 发芽过程中可食部位生物重量的变化测定 取新鲜的发芽花生,将其根部剪掉,保留可食部位(子叶与芽)。每个发芽时间取30个均匀的发芽花生进行称重后,取平均值计算可食部位生物重量的变化。
1.2.3 基本营养成分测定 蛋白质和脂肪的测定采用GB 5009.5-2016[16]和GB 5009.6-2016[17],可溶性糖的测定采用苯酚-硫酸法[18],所得标准曲线为y=0.0121x-0.0137,R2=0.9937。
1.2.4 游离氨基酸分析与γ-氨基丁酸(GABA)测定 游离氨基酸和γ-氨基丁酸的测定参照Komatsuzaki等[19]的方法。将2.5 g花生粉末放入含有25 mL 70%乙醇溶液的试管中,将混合物在室温下振荡提取1 min,然后在4 ℃下4000×g离心10 min,收集上清液。另将相同体积的70%乙醇溶液加入到沉淀物中重复提取,4 ℃下4000×g离心10 min,合并上清液。将上清液在40 ℃下真空旋转蒸发至干,残余物溶于5 mL含有1.5 g柠檬酸三锂,19.8 g柠檬酸,12.0 g LiCl和20.0 g 2,2-硫代乙醇的柠檬酸锂洗脱缓冲液(pH2.2)中,通过0.45 μm微孔滤膜过滤,注入氨基酸自动分析仪测定氨基酸和GABA含量。
1.2.5 游离脂肪酸测定 脂肪酸测定的方法参照Dong等[20]提供的方法。将1.00 g的样品加入到含有20 mL正己烷的三角瓶中,振荡2 h,在4 ℃下4000×g离心10 min后收集上清液。溶剂蒸发后,移取100 μL花生油,加入2 mL 0.5 mol/L NaOH甲醇溶液,将混合物置入在60 ℃的水浴中直至油珠消失。然后,将2 mL三氟化硼甲醇溶液(1∶3,v/v)加入管中,将混合物在60 ℃下温育20 min,冷却至室温。将2 mL正己烷和2 mL饱和NaCl溶液加入管中,并将混合物摇动1 min。4 ℃下4000×g离心10 min后,收集上层溶液并进行气相色谱(GC)分析。GC分析在配备有PEG 20M毛细管柱(30 m×0.32 nm,0.25 μm)的GC2010系统上进行。使用氮气作为载气,流速恒定为3 mL/min。温度最初在120 ℃保持5 min,以10 ℃/min的速度升至190 ℃并保持1 min,然后以2 ℃/min的速率升至220 ℃并保持12 min。进样口和检测器的温度设定为250 ℃。根据混合标准品使用内标法来确定各脂肪酸含量。
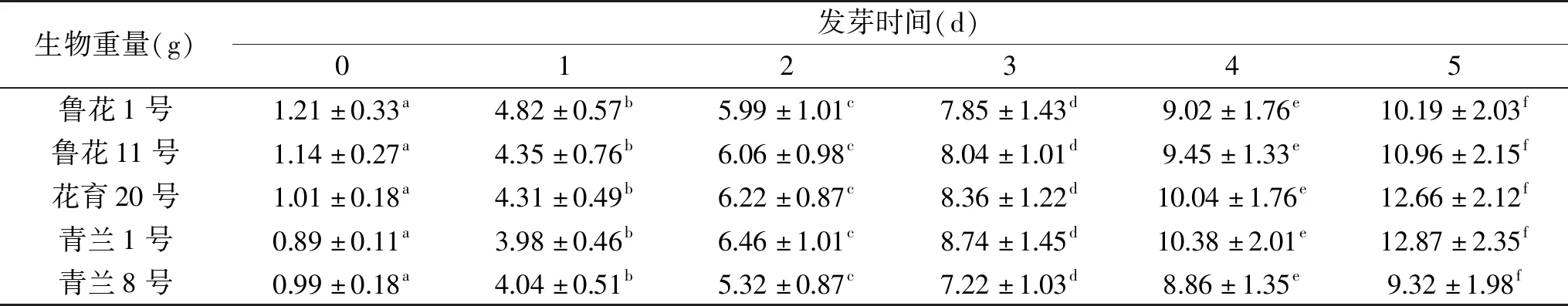
表1 花生发芽过程中可食部位生物重量的变化Table 1 Changes in the weight of the edible parts during peanut germination
1.2.6 多肽分子量分布 发芽花生多肽分子量分布在配备有UV检测器的Waters 1525 HPLC系统分析,使用TSK gel 2000 SWXL柱(300 mm×7.8 mm),柱温箱的温度设定为30 ℃。每种样品用含有0.1% TFA的40%乙腈洗脱,流速为0.5 mL/min,波长为220 nm。细胞色素C(12384 Da)、抑肽酶(6512 Da)、芽孢杆菌酶(1422 Da)、甘氨酸-甘氨酸-酪氨酸-精氨酸(451 Da)和甘氨酸-甘氨酸-甘氨酸(189 Da)为标准分子量样品。
1.2.7 生育酚含量测定 根据Maguire等[21]描述的方法测定生育酚的含量并稍作修改。将1.00 g的样品加入乙醇均质后,加入0.1 g抗坏血酸,2 mL KOH(1∶1,w/v),将混合物在60 ℃水浴中温育30 min。冷却至室温后立即加入10 mL正己烷,并将混合物振荡10 min。在4 ℃下4000×g离心10 min后,收集上层正己烷,将残余物再萃取两次,合并所有上层并在40 ℃下真空旋转蒸发至干。将干物质溶解在2 mL甲醇中,通过0.45 μm微孔滤膜用于HPLC分析。在配备有Symmetry C18柱(5 μm,250×4.6 mm)和RF-535荧光的Agilent 1100 HPLC系统上进行生育酚的分析。柱温为30 ℃,流动相为95%(v/v)甲醇水溶液,流速为1 mL/min,激发波长为295 nm,发射波长为330 nm。得到标准曲线y=3807.2x-15.6470,R2=0.9986。
1.2.8 白藜芦醇含量测定 根据Limmongkon等[12]人描述的方法测量白藜芦醇含量。称取1.00 g样品至50 mL离心管中并用80%乙醇提取。将混合物4 ℃下4000×g离心10 min,然后收集上清液,将残余物沉淀重新提取两次。合并所有上清液,蒸发溶剂。将萃取物用10 mL甲醇溶解并通过0.22 μm微孔滤膜过滤。使用C18柱(4.6×250 mm,5 μm)在LC-20A RP-HPLC系统上使用UV检测器在306 nm处进行测试。使用反式白藜芦醇做标准曲线为y=198140x-58576,R2=0.9938。
1.2.9 总酚含量测定 根据Dewanto等[22]描述的方法,使用福林酚法测量总酚。取0.4 mL适当稀释的样品溶液,分别加入2.6 mL去离子水,0.5 mL福林酚试剂,充分混合并在室温下静置6 min后,加入1.5 mL 20 g/100 mL Na2CO3溶液,最后用去离子水补足至10 mL。将混合物置于黑暗中于40 ℃反应2 h,在760 nm处测量吸光值。以甲醇代替样品作空白对照,没食子酸作为标准品绘制标准曲线(y=4.0341x+0.0326,R2=0.9981)。总酚含量表示为每克干重样品所对应的没食子酸当量(mg GAE g-1)。
1.3 数据处理
实验设3次重复,用SPSS 20.0软件进行统计方差分析,实验结果以平均值±标准差的形式表示,采用LSD法对结果进行显著性分析,p<0.05时表示存在显著性差异。
2 结果与分析
2.1 花生发芽过程中可食部位生物重量的变化
不同品种的花生在发芽过程中可食部位的生物重量均显著增加。整体来看,种子的重量均在1 g左右,而在发芽的第1 d,重量显著增加,这是由于种子在发芽之前充分浸泡吸水导致的。发芽2~5 d重量增加趋于平缓。发芽5 d后,青兰1号的生物重量最大,达到(12.87±2.35) g,青兰8号的重量相对最低,达到(9.32±1.98) g。由于整个发芽过程在自然条件下进行,消耗的外源添加物仅为水,且后续研究结果表明花生发芽后比发芽前更具营养价值,故花生发芽后重量的持续增加势必带来一定的经济效益。
2.2 花生发芽过程中基本成分含量变化
花生发芽过程中蛋白质含量的变化是复杂的。蛋白质在蛋白酶的作用下被水解成氨基酸和肽,然后参与新氨基酸的分解代谢和合成,从而使得蛋白质和氨基酸含量发生变化[23]。花生种子在不同发芽阶段的粗蛋白含量见表2。5个品种的花生表现出相似的蛋白质含量变化趋势:蛋白质含量在发芽2~3 d变化不明显,在4~5 d时有所降低。其中青兰1号花生的蛋白质含量变化最显著,在发芽5 d后下降了11.95%;变化最不显著的是鲁花11号花生,发芽5 d后仅下降了3.39%。据报道,在种子发芽期间,许多蛋白质相关的酶被激活,一些蛋白质被水解,而一些蛋白质被合成,这种平衡决定了蛋白质的含量[6]。有研究发现,发芽绿豆[24]和发芽糙米[25]中蛋白质含量随发芽时间延长而增加。这些差异可能与不同类型的种子及发芽条件的差异有关。
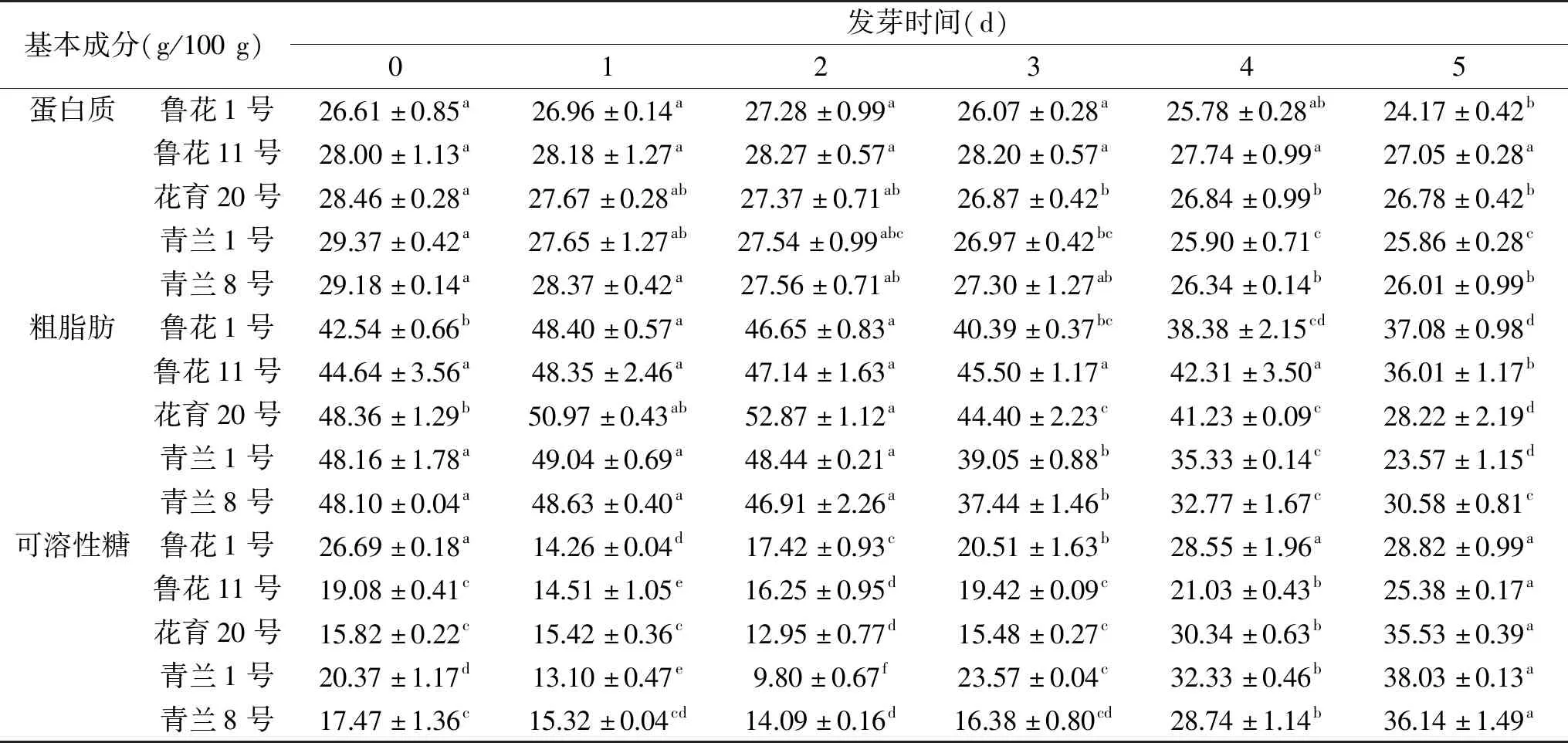
表2 花生发芽过程中基本成分含量的变化Table 2 Changes of basic components contents during peanut germination
在发芽过程中,脂质降解并为种子生长提供能量,从而导致其含量降低[26]。不同发芽阶段的脂质含量变化见表2。未发芽花生的脂质含量为干重的42%~49%。在发芽的前2 d含量略有增加,但随着发芽时间的继续延长而显著下降。其中,发芽5 d后,青兰1号花生的脂肪含量最低,比未发芽时降低了51.06%。于淼[27]检测了10个不同品种的花生在发芽过程中的脂肪含量变化,发现脂肪含量均有不同程度的下降,本文研究结果与此研究相似。
可溶性糖含量与花生品种和发芽时间相关。糖在许多代谢功能的调节中起重要作用,并且可以在发芽期间干扰发育调节基因的表达[28]。花生发芽过程中可溶性糖的含量见表2。可溶性糖含量在发芽的前期(第1~2 d)有所降低,之后开始显著增加。不同品种间变化趋势相同,但增加幅度有所差异,其中,青兰1号花生的可溶性糖含量最高,发芽5 d后提高了86.70%。据报道,可溶性糖含量增加主要是由于大分子碳水化合物在发芽后期大量分解而产生提供种子生命活动所需的能量,从而导致小分子糖含量急剧增加[29]。
2.3 花生发芽过程中游离氨基酸含量变化
不同发芽阶段花生中游离氨基酸的含量变化如图1、图2和表3所示。本研究共检测了17种氨基酸,包括除色氨酸之外的7种人体必需氨基酸。5种花生在发芽第5 d时的氨基酸总量分别比发芽前提高12.34倍、14.76倍、19.68倍、16.21倍和14.81倍(表3)。除酪氨酸含量在发芽3 d后出现下降趋势外,其余各氨基酸含量都随发芽时间的延长而显著增加(图1、图2)。氨基酸含量的增加可归因于内源性蛋白酶的活化,它可以诱导花生贮藏蛋白以及肽的水解[30]。因此,发芽花生可以改善蛋白质消化率并进一步增加对食用者的健康益处。整体来看,在未发芽的花生和经5 d发芽处理的花生中,谷氨酸、精氨酸、丙氨酸和脯氨酸是主要的氨基酸。赖氨酸和半胱氨酸在未发芽阶段含量最低,而在发芽后含量显着增加,分别高达25.05~60.25 mg/100 g(图1(g))和3.37~7.35 mg/100 g(图2(i))。发芽前后含量变化最大的是脯氨酸,在发芽第5 d时含量增加27.53倍、56.67倍、31.26倍、209.96倍、123.40倍,且含量占游离氨基酸总量的近一半(图2(j))。Kuo等[31]和Kim等[32]的研究表明发芽也可以使大豆和其他豆类的游离氨基酸含量增加。

表3 花生发芽过程中游离氨基酸总量的变化Table 3 Changes of total free amino acid contents during peanut germination
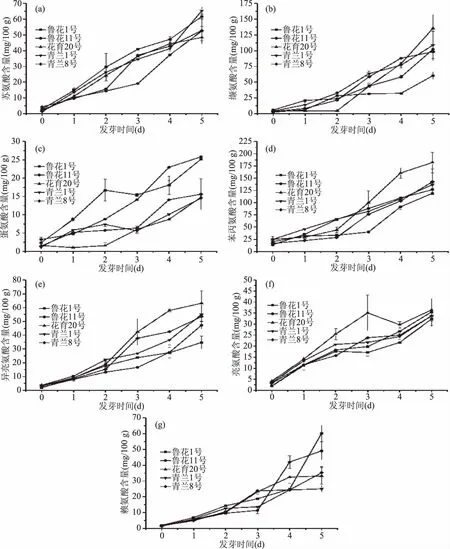
图1 花生发芽过程中必需氨基酸含量变化Fig.1 Changes of essential amino acid content during peanut germination注:(a)苏氨酸;(b)缬氨酸;(c)蛋氨酸;(d)苯丙氨酸;(e)异亮氨酸;(f)亮氨酸;(g)赖氨酸。
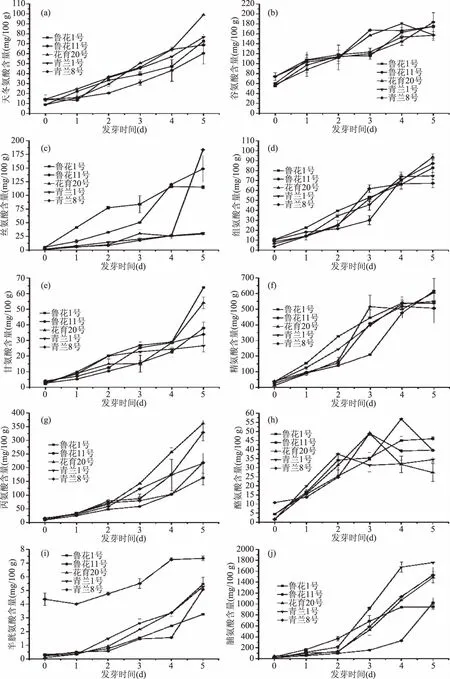
图2 花生发芽过程中非必需氨基酸含量变化Fig.2 Changes of non-essential amino acid content during peanut germination注:(a)天冬氨酸;(b)谷氨酸;(c)丝氨酸;(d)组氨酸;(e)甘氨酸;(f)精氨酸;(g)丙氨酸;(h)酪氨酸;(i)半胱氨酸;(j)脯氨酸。
2.4 花生发芽过程中脂肪酸组成变化
花生油因其独特的营养和药用价值,成为一种广泛使用的食用油[33]。脂肪酸组成对于花生油稳定性以及产品中是否会出现哈喇味具有重要意义,是影响花生油商业贸易的重要因素[2]。花生在不同发芽阶段的脂肪酸含量见表4。花生脂肪酸主要由肉豆蔻酸、棕榈酸、棕榈油酸、硬脂酸、油酸、亚油酸、γ-亚麻酸、α-亚麻酸、花生酸、花生一烯酸、二十二碳酸、二十四碳酸和芥酸等组成(因数据太多,此部分数据没有列出),其中饱和脂肪酸占8.02%~10.66 g/100 g(SFA,主要是棕榈酸),单不饱和脂肪酸为21.47~26.04 g/100 g,占42.85%~56.76%(MUFA,主要是油酸),多不饱和脂肪酸12.22~16.23 g/100 g,占22.33%~36.07%(PUFA,主要是亚油酸),且发芽处理不会改变花生的脂肪酸组成成分。在发芽过程中,鲁花1号、鲁花11号、花育20号和青兰1号花生SFA的含量呈现先增加再减少的趋势,在发芽的第1或第2 d达到最大值,青兰8号花生SFA含量呈下降趋势;鲁花1号、鲁花11号、花育20号、青兰8号MUFA的含量呈现先增大再减小的趋势,在发芽的第2或第3 d达到最大值;各品种花生的PUFA含量呈现先增大后减小的趋势,在发芽的第1或第2 d达到最大值。与饱和脂肪酸相比,不饱和脂肪酸具有降低血脂的作用,因此较低的饱和脂肪酸和较高的不饱和脂肪酸摄入对膳食营养有益[34]。油酸/亚油酸的比值(O/L)在延长产品保质期中具有重要作用,较高的O/L值与产品保质期的延长和产品酸败度的降低相关[35]。因此,发芽花生因其合理的脂肪酸组成、丰富的不饱和脂肪酸含量和较高的O/L值而成为一种优质的烹饪和煎炸油[33]。
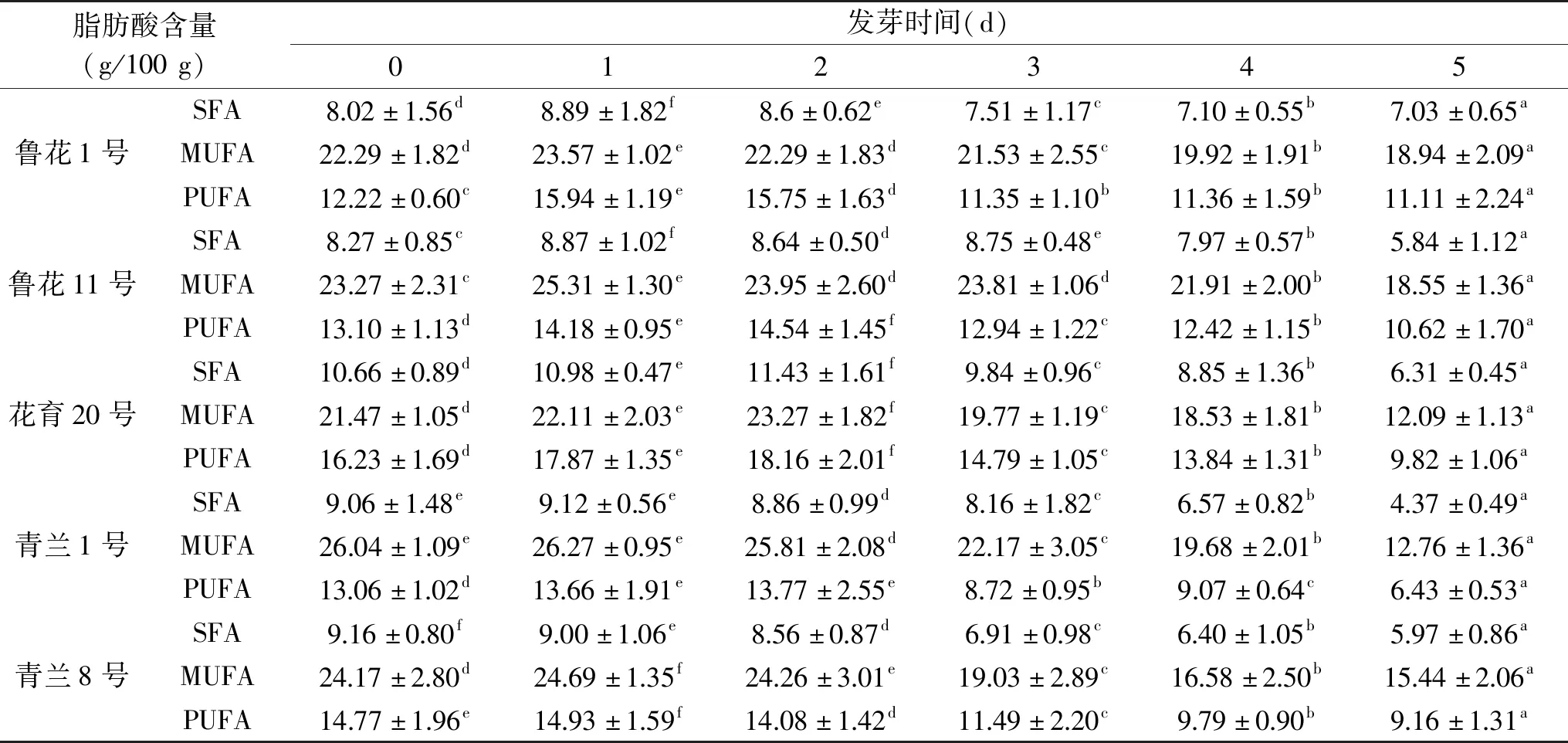
表4 花生发芽过程中脂肪酸含量的变化Table 4 Changes of fatty acid contents during peanut germination
2.5 花生发芽过程中多肽分子量分布的变化
近年来,多肽类物质由于其潜在的功能和营养特性而获得了广泛关注[36]。有研究表明,发芽会导致花生中蛋白质降解并增加肽和氨基酸含量[10]。本研究分析了不同发芽阶段花生中多肽的分子量分布,结果如图3所示。结果表明,发芽花生中的肽主要由小肽(Mw<500 Da)组成,占总肽的79.64%~93.40%。随着发芽时间的延长,分子量超过10000 Da的肽(占总肽的1.54%~5.00%)的比重逐渐增加,可能是由于在发芽过程中一些大分子蛋白质降解为肽。分子量超过180 Da且小于1000 Da的肽的浓度先逐渐增加后略有降低,造成这种现象的原因可能是多肽被进一步降解为氨基酸。López-Barrios等[37]发现发芽处理可使黑豆蛋白水解物具有更高的抗氧化和抗炎作用;Vernaza等[30]发现发芽大豆粉具有更高的抗氧化能力,且蛋白提取物显示出对炎症标志物NO、PGE2、TNF-α和iNOS的显著抑制。这说明发芽可使谷物蛋白(肽)具有更高的生物活性。
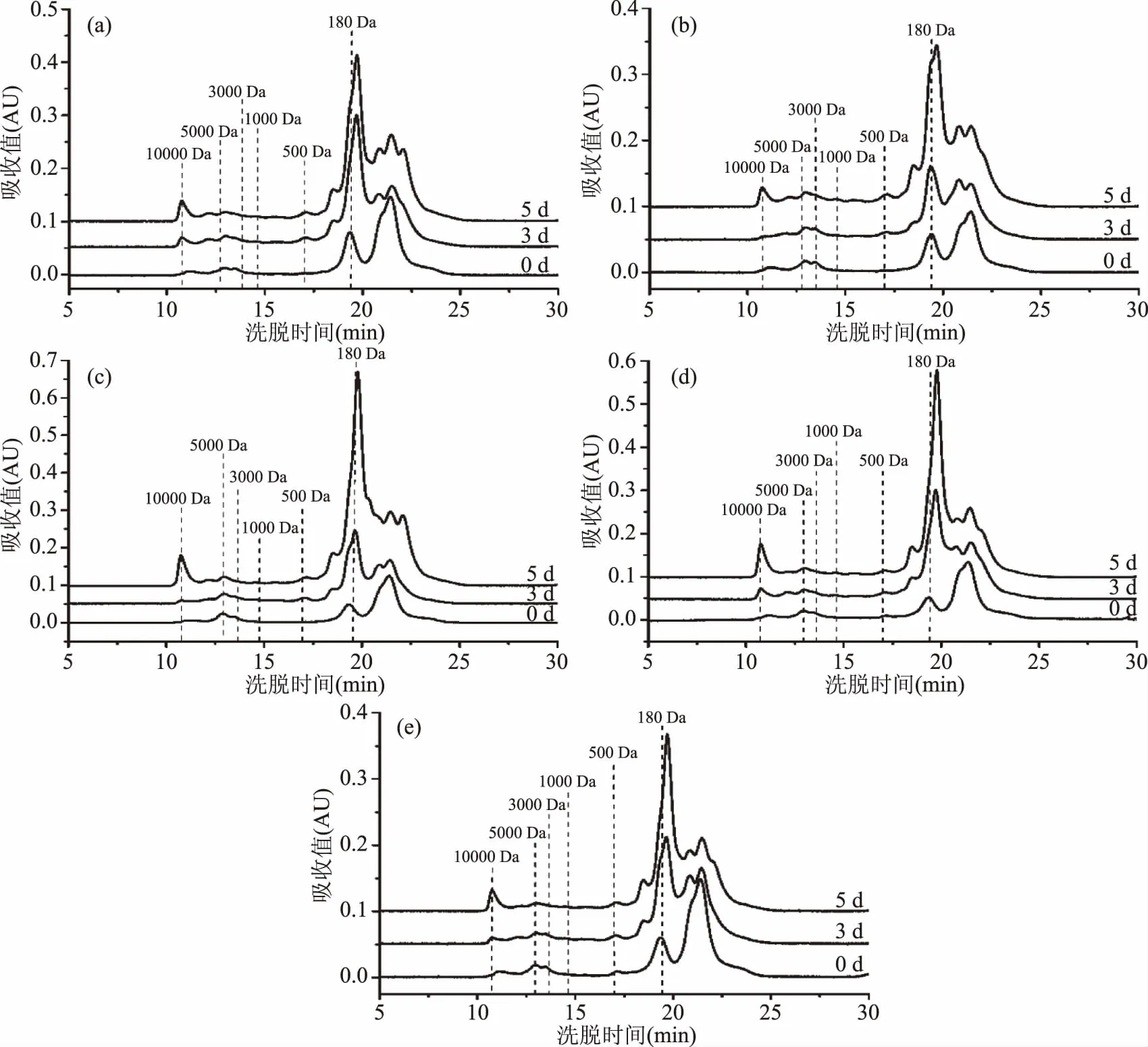
图3 花生发芽过程中多肽分子量分布的变化Fig.3 Changes of molecular weight distribution of peptides in peanut sprout at different germination stages注:(a)鲁花1号;(b)鲁花11号;(c)花育20号;(d)青兰1号;(e)青兰8号。
2.6 花生发芽过程中GABA含量的变化
花生在不同发芽阶段的GABA含量如图4所示。不同品种花生的GABA含量有所差异,但均在发芽后显著增加。并且5种花生的GABA含量均在第5 d达到最大值,分别比未发芽时增加14.99倍、11.77倍、8.34倍、8.61倍和7.97倍。GABA含量的大幅度增加主要由于谷氨酸脱羧酶在发芽期间被激活,从而导致谷氨酸转化为GABA[19]。GABA是广泛存在于植物和动物中的非蛋白氨基酸,它是哺乳动物神经系统中重要的抑制性神经递质,还可以调节血压和心率、减轻疼痛和焦虑,并增加胰岛素的分泌[38]。有关发芽处理富集谷物GABA的报道很多:Cornejo等[25]研究发现用48 h发芽后的糙米粉制成的面包GABA含量比用普通糙米粉制成的面包高6倍;Huang等[39]研究发现发芽3 d后的黄豆GABA含量比未发芽时增加11.58倍,黑豆增加2.73倍;Xu等[6]的研究表明薏米经60 h发芽后的GABA含量达到102.07 mg/100 g,比未发芽时增加2.44倍。因此,发芽花生或发芽谷物是获得GABA有价值的来源。
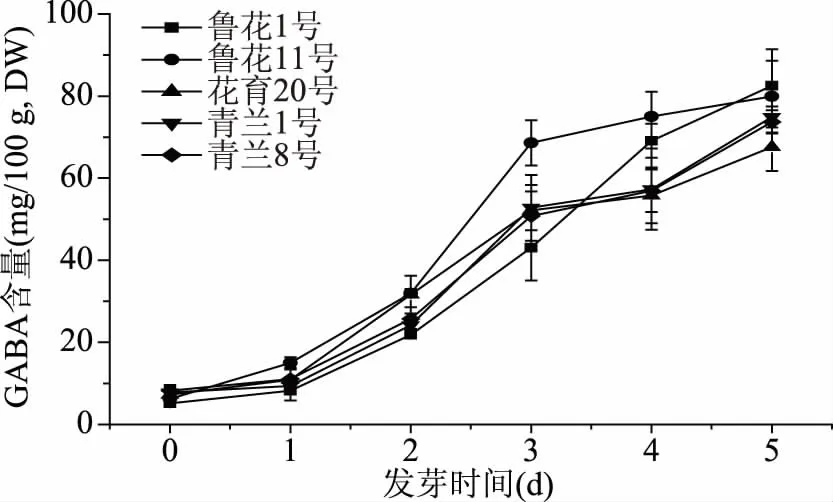
图4 花生发芽过程中GABA含量的变化Fig.4 Changes of GABA content during peanut germination
2.7 花生发芽过程中生育酚含量的变化
生育酚由8个结构相关的分子组成,每个分子都含有一个具有四种不同甲基化模式的色甘醇环,分别命名为α、β、γ和δ。α-生育酚通常被认为是体内最有效的抗氧化剂,是最具生物活性的生育酚类型,并且在大鼠生育能力测试中唯一有效的类型[40]。不同品种花生发芽期间的生育酚含量如图5所示。在未发芽种子中,青兰1号花生和青兰8号花生中的生育酚含量比其他三个品种高1倍左右。所有品种花生中生育酚含量在发芽前2~3 d明显增加之后开始下降。这种趋势与脂肪含量变化趋势类似,可能与脂质的变化有关。其中,青兰1号花生在发芽第2 d时含量最高,鲁花1号花生生育酚含量在发芽期间的变化不如其他品种明显。有研究报道,不同处理方式也会导致生育酚含量的差异,如通过高压处理的发芽糙米中具有更高含量的生育酚[41]。据报道,生育酚可降低血压,并具有抗癌、抗衰老、抗不育等功能[42]。因此,发芽花生中生育酚含量的增加可赋予其更好的功效。

图5 花生发芽过程中生育酚含量的变化Fig.5 Changes of tocopherol content during peanut germination注:不同小写字母表示同一花生品种不同发芽天数间差异显著(p<0.05),图7同。
2.8 花生发芽过程中白藜芦醇含量的变化
白藜芦醇(3,5,4′-三羟基均二苯乙烯)是一种天然多酚,它广泛存在于植物(如葡萄、花生和桑椹),以及许多食品中(包括红葡萄酒、葡萄汁和花生酱)。研究表明,发芽处理可以显著增加花生的白藜芦醇含量[12]。发芽过程中花生的白藜芦醇含量变化如图6所示。不同品种花生间白藜芦醇的含量差异较大,其在发芽5 d时的含量青兰1号>青兰8号>鲁花11号>花育20号>鲁花1号。5个品种花生的白藜芦醇含量均随发芽时间延长不断增加,但增加幅度因品种而异。其中,青兰1号花生中的白藜芦醇在发芽5 d后含量最高,比未发芽时增加了5.68倍。其次是青兰8号花生,比未发芽前提高了7.40倍。鲁花1号花生种子的白藜芦醇含量最低,经过5 d的发芽处理后其白藜芦醇含量仍低于其他4个品种,但是它的增加幅度最大,比未发芽时增加了32.58倍。于淼[27]在先前的研究中检测了10个品种花生发芽过程中的白藜芦醇含量,结果表明,不同品种花生在发芽之前与发芽后的白藜芦醇含量有差异,随发芽时间的延长白藜芦醇含量均有增加,但增加幅度不一致,这与我们的研究结果类似。据报道,反式白藜芦醇具有抗氧化、抗炎和抗增殖作用,可以保护心脏、抗衰老和抗癌变[43]。Ghanim等[44]在摄入高脂膳食的受试者饮食中增加含有白藜芦醇的补充剂,发现白藜芦醇在受试者的餐后状态具有应急抗氧化和抗炎作用。可见,发芽处理是富集花生白藜芦醇的一种简便、经济的方法,选择合适的花生品种进行发芽处理有利于获得较高累积量的白藜芦醇。
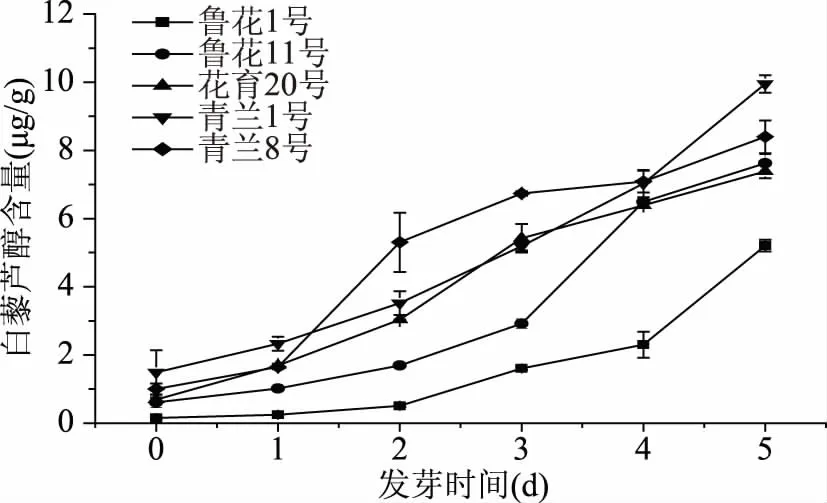
图6 花生发芽过程中白藜芦醇含量的变化Fig.6 Changes of resveratrol content during peanut germination
2.9 花生发芽过程中总酚含量的变化
不同发芽阶段花生的总酚含量变化如图7所示。在发芽初期,酚类化合物含量略有下降,从发芽第2 d开始显著增加。5个品种花生的总酚含量均在发芽第5 d达到最大值,分别增加41.03%、30.61%、128.90%、47.37%、16.44%。种子中总酚含量最低的花育20号花生在发芽后含量反而最高,增加量也最为明显;种子中含量最高的青兰8号花生发芽5 d后的增加量最小。酚类化合物是植物中的次生代谢产物,在植物的生长繁殖中发挥重要作用,起到抵御病原体、寄生虫和捕食者的防御机制的作用,并有助于植物颜色的保持[45]。迄今为止,酚类化合物因其具有抗氧化和预防慢性炎症、心血管疾病、癌症和糖尿病等多种潜在疾病的作用而被广泛研究[46]。发芽花生中酚类化合物含量的变化表明,发芽处理是一种改善花生营养价值和功能性的有效方法。Cornejo等[25]发现经过48 h的发芽,糙米中总酚的含量比未发芽时增加了50%;Huang等[47]研究发现经过5 d发芽黄豆中的总酚含量比未发芽时增加了91.30%,而发芽过程中绿豆总酚的变化则比较复杂,在发芽第1 d含量急剧上升,增加了11倍,而后下降并在发芽第3 d达到最小值,然后又略微上升。
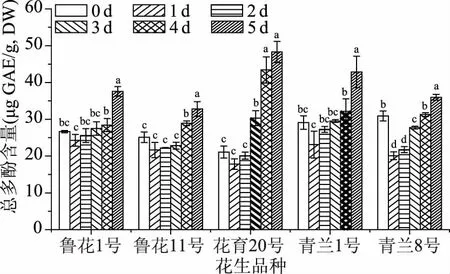
图7 花生发芽过程中总酚含量的变化Fig.7 Changes of total phenolic content during peanut germination
3 结论
发芽是一种方便有效的改善花生营养品质和富集活性物质的处理方法。在花生发芽过程中,大分子物质被降解成小分子,导致蛋白质和脂质含量降低,小肽、游离氨基酸和可溶性糖含量显著增加;随着发芽时间的延长,GABA和白藜芦醇的含量急剧增加;多酚的含量在前期略微下降后也显著增加,并在发芽第5 d达到最大值;生育酚的含量在发芽过程先增后降,并在发芽第2或3 d达到最大值。因此,发芽花生由于具有更高的营养价值和生物活性,在食品工业中具有更好的发展潜力。不同品种花生在发芽过程中营养成分的变化趋势大致相同,变化幅度差异较大。在本论文选取5个花生品种中,青兰1号花生是富集营养物质和生物活性物质的优秀品种。
