羊乳活性发酵饮品中益生元增菌特性及发酵工艺优化
2019-09-11王海燕梁秀珍崔秀秀葛武鹏
文/王海燕 姚 路 高 鹏 梁秀珍 崔秀秀 葛武鹏*
(1 西北农林科技大学食品科学与工程学院;2 陕西飞天乳业有限公司;3 陕西百跃羊乳集团有限公司)
益生元,又称益生素,在人体内不会被肠道消化吸收,能够选择性刺激肠内有益菌群生长增殖,提高菌体活性[1~3]。益生元除常见的菊粉(Inuline)、低聚异麦芽糖(IMO)、低聚果糖(FOS)等功能性糖类外,还包括蛋白质水解物、天然植物及中草药提取物等[4]。目前,菊粉[5,6]、低聚果糖[7]、低聚异麦芽糖、低聚半乳糖(GOS)等功能性低聚糖被广泛应用于保健食品和饲料中[8~11],已替代或部分替代蔗糖应用到乳制品中[12~14]。
活性益生菌发酵饮品以独特的风味、色泽及多重营养保健功效,深受消费者青睐。目前,市场主流活性益生菌发酵饮品多以牛乳为基料,尚未出现羊乳发酵饮品[15]。而现如今羊乳及其制品的营养特性已被越来越多的消费者接受,渐成流行之势,消费者对羊乳制品种类的需求层次不断提高[16,17]。本试验以副干酪乳杆菌为发酵剂,以活菌数为指标,绘制其在羊乳中的生长曲线,并对低聚果糖、低聚半乳糖、菊粉、低聚异麦芽糖四种益生元进行筛选和复配,得到增菌效果较好的益生元;同时对活性益生菌羊乳发酵饮品的发酵工艺进行优化,为活性益生菌羊乳发酵饮品的开发提供理论支撑,以促进羊乳制品种类多样化发展,满足消费者需求。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
西北农林科技大学西农萨能乳山羊畜牧基地生产的羊乳;新西兰恒天然(中国)有限公司生产的脱脂乳粉;陕西百跃优利士乳业有限公司提供的低聚果糖(纯度≥95%)、菊粉(纯度≥90%)、低聚半乳糖(纯度≥55%)、低聚异麦芽糖(纯度≥50%);发酵剂为台湾生合生物科技有限公司生产的副干酪乳杆菌。
1.1.2 试剂
MRS培养基;其余试剂均为分析纯。
1.2 仪器与设备
立式蒸汽灭菌器、高速离心机、净化工作台、电热恒温培养箱、电子天平、电热恒温水浴锅、冰箱、发散乳化机、恒温振荡器、微量移液器、干燥箱。

表1 正交试验因素水平表
1.3 方法
1.3.1 发酵剂的制备
制备灭菌脱脂乳培养基(12%脱脂乳粉,加入0.50‰葡萄糖,115 ℃、20 min高温高压灭菌),冷却至40 ℃,在无菌条件下接种副干酪乳杆菌,在37 ℃恒温培养箱中培养至凝乳。经2~3 次活化使其活力充分恢复后,即可作为酸奶发酵剂。
1.3.2 副干酪乳杆菌生长曲线的测定
取制备好的副干酪乳杆菌以4%的接种量接种于杀菌脱脂羊乳(1 500 ×g、30 min离心脱脂)中,37 ℃培养77 h,每隔7 h取样测定活菌数,绘制生长曲线。活菌数测定参考GB4789.35—2016[18],利用无菌生理盐水对发酵羊乳进行梯度稀释,通过预试验确定合适的稀释梯度,取1.00 mL稀释样品于选择性培养基以平板涂布法计数样品中活菌数,统计菌落数,结果取其平均值,单位为CFU/mL。
1.3.3 滴定酸度测定
根据GB5009.239—2016酸度测定方法[19],用0.10 mol/L的NaOH标准溶液滴定测定,单位以吉尔涅尔度(°T)表示。
1.3.4 益生元的增菌特性
脱脂羊乳中分别添加低聚果糖、低聚半乳糖、菊粉、低聚异麦芽糖四种益生元,添加的浓度依次为0.00%、0.70%、1.40%、2.10%、2.80%(m/v),杀菌后冷却至37 ℃,接种副干酪乳杆菌,37 ℃恒温发酵,在39 h、42 h、47 h时,测定活菌数,筛选增菌效果较好的益生元。
1.3.5 益生元复配
复配菊粉和低聚果糖,总添加量为1.40%,菊粉与低聚果糖的比例为1∶9、2∶8、3∶7、4∶6、5∶5、6∶4、7∶3、8∶2、9∶1,以二者复配组为实验组,以单独添加菊粉、低聚果糖组及不添加益生元组为空白对照组。37 ℃恒温发酵,在39 h、42 h、47 h时,测定活菌数,确定最佳复配比例。
1.3.6 接种量确定
向已杀菌冷却至37 ℃的脱脂羊乳中分别接入2%、3%、4%、5%、6%(v/v)副干酪乳杆菌,37℃培养42 h,测定活菌数和滴定酸度,确定最佳接种量。
1.3.7 最优发酵条件确定
以益生元添加量、接种量及发酵时间为因素,以活菌数和滴定酸度为评价综合指标,采用L9(34)正交表,进行三因素三水平正交试验,利用排队评分法和公式评分法相结合的综合评分法对试验结果进行分析,确定活性益生菌羊乳发酵饮品最优发酵工艺条件。正交试验各因素水平见表1。
1.4 数据处理
采用Excel和SPSS进行统计分析,采用排队评分法和公式评分法相结合的综合评分法对结果进行双指标分析,显著性水平设定为P<0.05。
2 结果与讨论
2.1 副干酪乳杆菌在羊乳中的生长曲线
由图1可知,副干酪乳杆菌在脱脂羊乳中的生长曲线呈“S”型,菌体延滞期比较短,很快进入对数生长期,活菌数迅速增加。当发酵至21 h时,菌体开始进入稳定期。此菌的稳定期长,为21~42 h,这一时间段,活菌数基本维持不变,42 h活菌数达到最大值,为1.87×109CFU/mL。42 h后,活菌数开始下降,逐渐进入衰退期,乳酸积累过多,抑制菌体生长,发酵至77 h时,活菌数为1.23×109CFU/mL。
2.2 菊粉在羊乳中的增菌性能分析
试验探究菊粉增菌特性,以添加菊粉组为实验组,以不添加菊粉组为空白对照组,结果如图2。随着菊粉添加量的增加,活菌数先增加后减少,活菌数对菊粉有一定浓度依赖性。菊粉添加量对菌体生长有显著性影响(P<0.05)。当菊粉添加量为1.40%时,活菌数最高,39 h、42 h、47 h分别达到2.21×109CFU/mL、2.47×109CFU/mL和2.31×109CFU/mL,空白对照组分别为1.84×109CFU/mL、1.95×109CFU/mL和1.85×109CFU/mL,实验组活菌数明显高于空白对照组;且39~42 h时间内,活菌数增长率比空白对照组高5.79%。结果表明,菊粉有较好的增菌作用,且最适添加量为1.40%。菊粉可以被乳酸菌发酵,具有双歧杆菌增值因子的作用[20],菊粉可以作为益生元调节肠道益生菌,同时还具有降血脂、降胆固醇、减肥和保护肝脏、预防癌症和促进维生素及矿物质吸收等多种生理功能[21]。
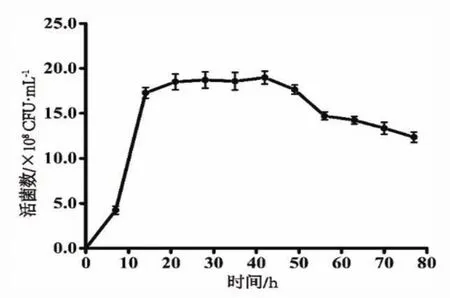
图1 副干酪乳杆菌在羊乳中生长曲线
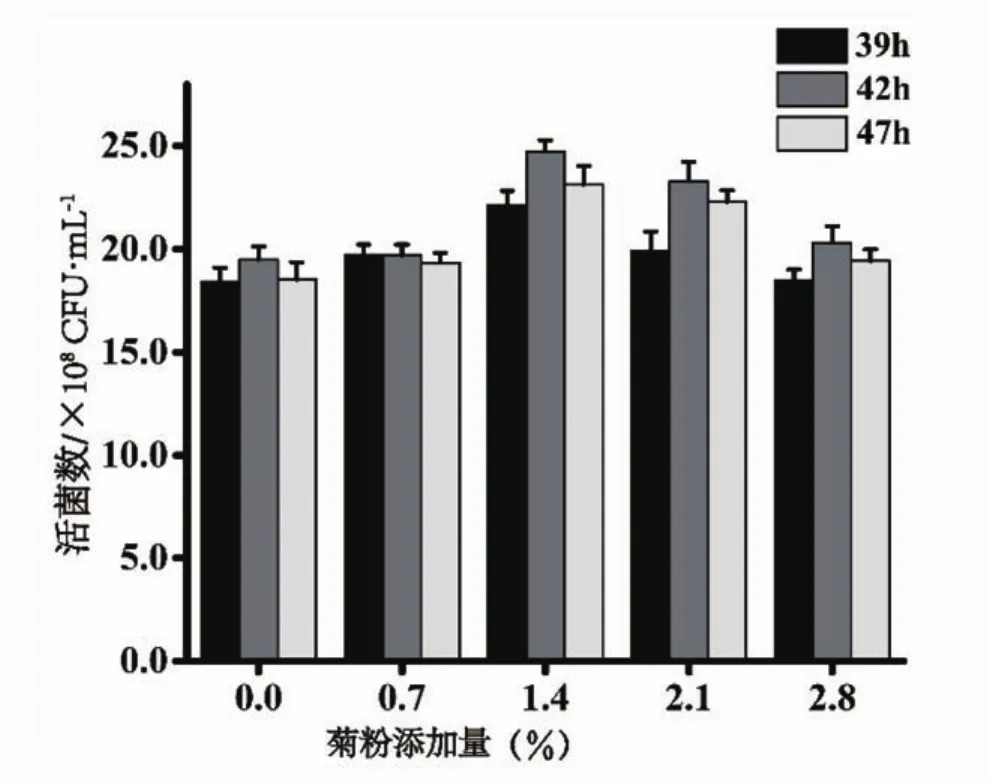
图2 菊粉添加量对发酵羊乳中活菌数的影响

图3 低聚果糖添加量对发酵羊乳中活菌数的影响
2.3 低聚果糖在羊乳中的增菌性能分析
本试验探究低聚果糖增菌特性,以添加低聚果糖组为实验组,以不添加低聚果糖组为空白对照组,结果如图3。低聚果糖添加量为0.70%~2.10%时,实验组活菌数均高于空白对照组,当添加量为2.80%时,实验组活菌数低于空白对照组,可能是因为低聚果糖添加量过大,造成渗透压偏高,导致菌体生长受到抑制。经方差分析可知,不同低聚果糖的添加量对菌体生长有显著影响(P<0.05)。当低聚果糖添加量1.40%时,发酵羊乳中活菌数最高,在39 h、42 h、47 h时,分别达到3.09×109CFU/mL、3.37×109CFU/mL和3.15×109CFU/mL,空白对照组分别为2.80×109CFU/mL、2.91×109CFU/mL和2.53×109CFU/mL;39~42 h时间内,菌体增长率比空白对照组高5.13%,说明低聚果糖有较好的增菌作用。
低聚果糖添加量为1.40%时,在42~47 h内,空白对照组活菌数减少10.69%,实验组仅减少7.10%,表明低聚果糖一定程度上有利于延缓菌体的衰亡。试验结果表明,低聚果糖有较好的增菌作用,且最适添加量为1.40%,并一定程度上有利于延缓菌体衰亡。在发酵羊乳中添加低聚果糖,可以延长产品货架期,增强乳制品良好的口感风味,增加水溶性可吸收钙的含量,使乳制品更易消化吸收,提高发酵乳产品的功效[22]。
2.4 低聚半乳糖在羊乳中的增菌性能分析
试验探究低聚半乳糖增菌特性,以添加低聚半乳糖组为实验组,以不添加低聚半乳糖组为空白对照组,结果如图4。低聚半乳糖添加量为0.70%~2.10%时,实验组活菌数与空白对照组相比略有增加,添加量为2.80%时,实验组活菌数低于空白对照组,可能是由于添加量过多,不利于菌体生长。经方差分析可知,低聚半乳糖对菌体的生长无显著影响(P>0.05)。
当低聚半乳糖添加量2.10%时,发酵羊乳中活菌数较高,在39 h、42 h、47 h时,分别达到2.29×109CFU/mL、2.55×109CFU/mL和2.50×109CFU/mL,空白对照组分别为2.17×109CFU/mL、2.40×109CFU/mL和2.32×109CFU/mL,39~42 h时间内,活菌数增长率比空白对照组高0.76%。结果表明,低聚半乳糖有一定增菌作用,且最适添加量为2.10%,但促进作用不如菊粉和低聚果糖明显。
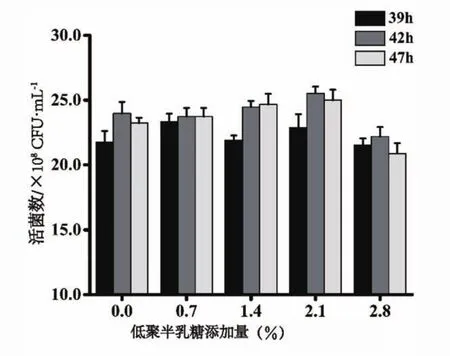
图4 低聚半乳糖添加量对发酵羊乳中活菌数的影响
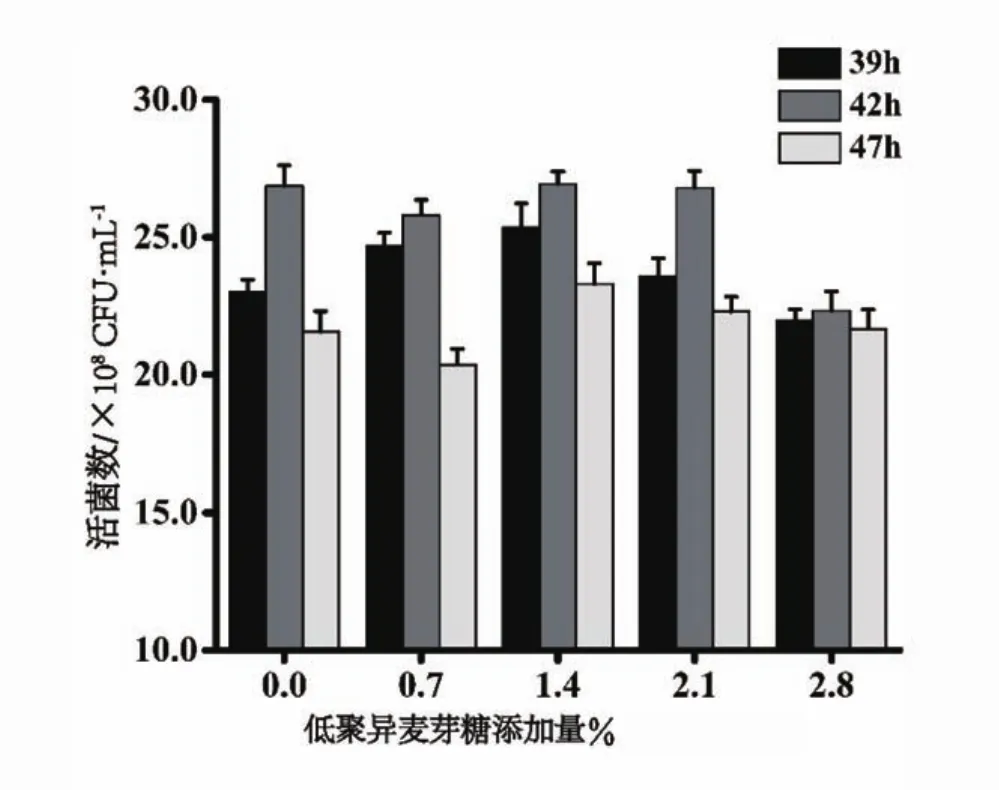
图5 低聚异麦芽糖添加量对发酵羊乳中活菌数的影响
2.5 低聚异麦芽糖在羊乳中的增菌性能分析
试验探究低聚异麦芽糖增菌特性,以添加低聚异麦芽糖组为实验组,以不添加低聚异麦芽糖组为空白对照组,结果如图5。实验组中低聚异麦芽糖添加量为1.40%时,实验组活菌数略高于空白对照组,在39 h、42 h、47 h时,分别为2.31×109CFU/mL、2.70×109CFU/mL和2.33×109CFU/mL,对照组分别为2.30×109CFU/mL、2.69×109CFU/mL和2.16×109CFU/mL;39~42 h时间内,活菌数增长率与空白对照组基本一致。当添加量为2.80%时,实验组活菌数低于空白对照组,可能是因为添加量过大,造成渗透压偏高,不利于菌体生长。方差分析可知,低聚异麦芽糖的添加量对活菌数有显著影响(P<0.05),但增菌效果不如菊粉和低聚果糖明显。
2.6 低聚糖复配
由以上试验结果发现,菊粉与低聚果糖能较好的促进发酵羊乳中菌体增殖,故选择菊粉与低聚果糖进行复配,观察二者共同作用的增菌效果是否优于单独使用。
由图6可以看出,单独添加菊粉、低聚果糖或者二者复配添加后,活菌数均高于不添加任何益生元的空白对照组,且复配比例对活菌数有显著影响(P<0.05)。菊粉与低聚果糖的比例为9:1时,在42 h活性益生菌羊乳发酵饮料中的活菌数达到最大值,为2.86×109CFU/mL。
2.7 接种量对菌体生长的影响
由图7可知,随着接种量的增加,活菌数不断增加,滴定酸度不断增大,这是因为接种量越多,乳酸菌在乳中定植生长越快,产酸速度也越快,接种量由2%增加至4%时,活菌数迅速增加,超过4%后,活菌数增加趋势减小,经方差分析可知,接种量对发酵羊乳中副干酪乳杆菌菌体数量和滴定酸度有显著影响(P<0.05)。接种量超过5%时,发酵乳中乳清析出现象随着接种量的增加而加剧,综合考虑,试验选择3%、4%、5%三个水平进行正交设计,确定最佳接种量。
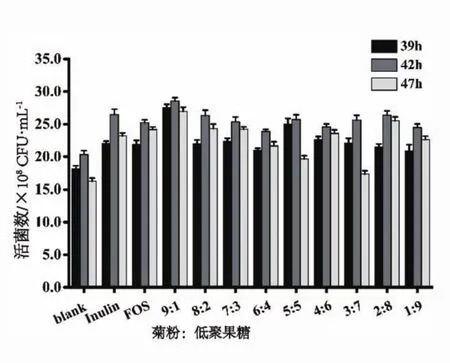
图6 菊粉/低聚果糖复配对发酵羊乳中活菌数的影响

图7 接种量对发酵羊乳中活菌数和滴定酸度的影响
2.8 最佳发酵条件确定
以接种量、发酵时间及益生元为单因素,以活菌数和滴定酸度为评价综合指标,试验采用L9(34)正交表,进行三因素三水平的正交设计,确定最佳发酵工艺条件,结果如下。
由表2和表3可知,益生元添加量(A)、接种量(B)、发酵时间(C)三个因素对试验综合评分影响的主次顺序为益生元添加量>发酵时间>接种量,即益生元添加量对综合评分有极显著影响(P<0.01),为决定性因素;其次为发酵时间和接种量,二者对综合评分有显著性影响(P<0.05),其中接种量的影响最小。活性益生菌羊乳发酵饮料的最佳发酵条件是A2B2C1,即益生元添加量为1.50%,接种量为4%,发酵时间为40 h。
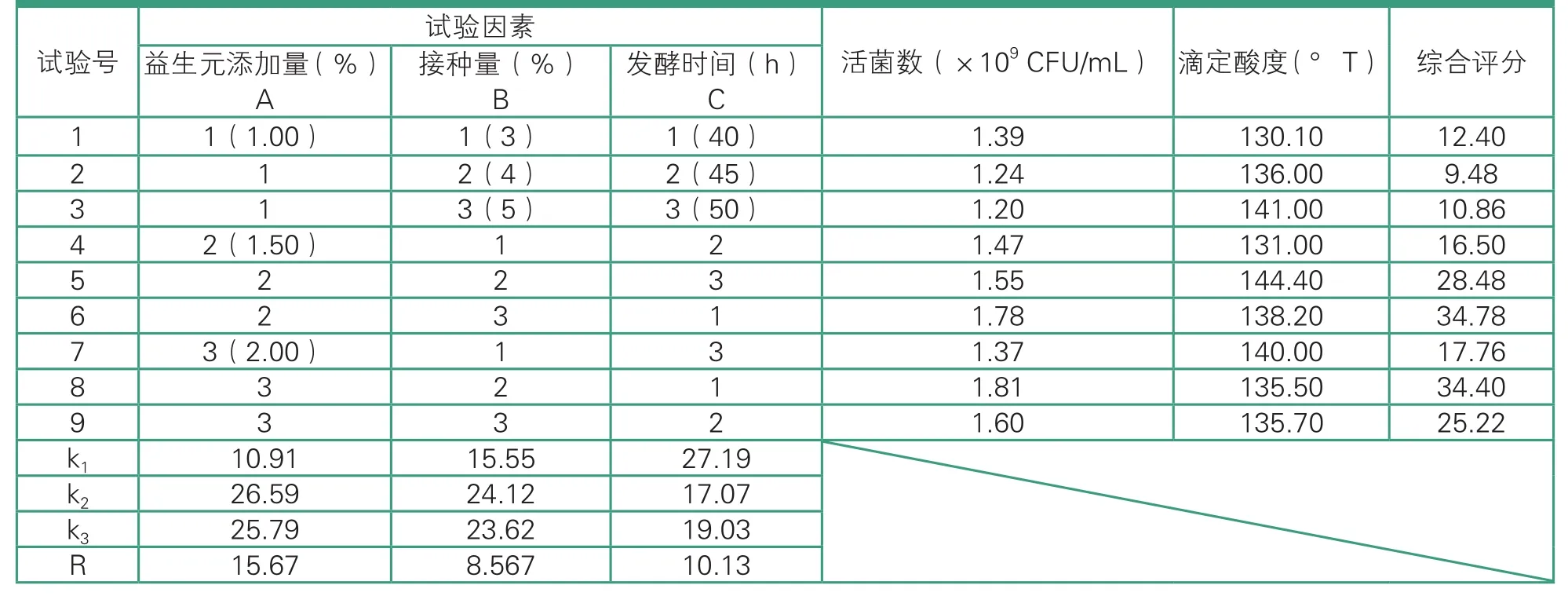
表2 正交试验结果与分析
2.9 正交试验验证
对正交试验分析得到的最优发酵组合A2B2C1,进行多次重复性(n=3)验证试验,结果表明,发酵羊乳中活菌数达到1.91×109CFU/mL、滴定酸度为138.90 °T(P>0.05),且凝乳均匀细腻,香味浓郁,故活性益生菌羊乳发酵饮料的最佳发酵工艺优化条件是A2B2C1,即益生元添加量为1.50%,接种量为4%,发酵时间为40 h。
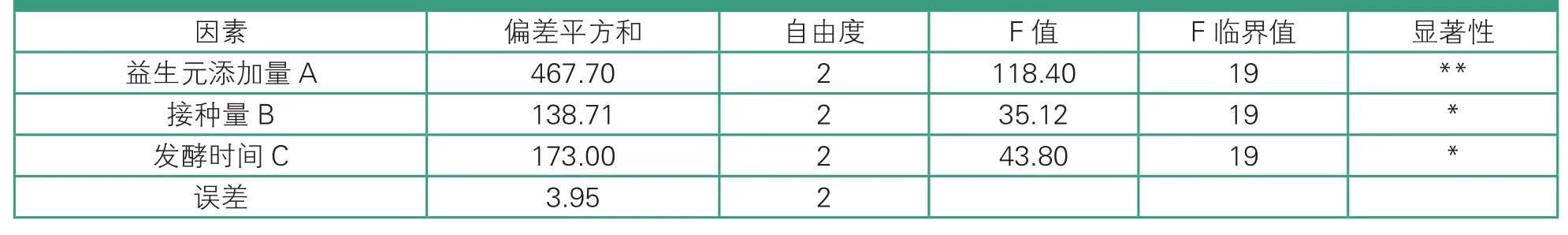
表3 方差分析
3 小结
3.1 发酵剂副干酪乳杆菌在羊乳中发酵42 h时,活菌数达到最大值,为1.87×109CFU/mL。
3.2 以活菌数为指标,研究低聚果糖、低聚半乳糖、菊粉、低聚异麦芽糖四种益生元的增菌特性,结果表明,四种益生元均能促进乳酸菌的体外生长增殖,增殖效果较好的是菊粉和低聚果糖,且最适添加量均为1.40%。
3.3 在菊粉和低聚果糖混合制的复合益生元研究中,发现菊粉与低聚果糖复配比例为9:1时,对增菌作用较为明显,且优于单独使用。
3.4 发酵工艺优化发现,以益生元添加量、接种量、发酵时间为因素,经正交优化和验证试验确定活性益生菌羊乳发酵饮品的最优发酵工艺参数是:益生元添加量为1.50%,接种量为4%,发酵时间为40 h,此条件下,发酵羊乳中活菌数达到1.91×109CFU/mL。
