鲎血细胞之鲎素Tachyplesin I对水产常见病原菌之抑菌作用
2019-09-10高德友,郑学渊
高德友,郑学渊
摘要:鲎的血淋巴中所存在的鲎素(tachyplesin)为抗菌肽的一种,本研究使用中国鲎(Tachypleus tridentatus)为研究材料,自鲎血细胞中以高效液相层析仪萃取鲎素,并利用电泳分析测定其分子量,确定所萃取蛋白质为鲎素,以之进行水产常见病原的抗菌试验,希望作为未来新药开发以及运用生物技术防范病害的可能。以不同浓度的鲎素进行细菌的抗菌试验,发现鲎素有显著的抗菌效果。在低浓度鲎素处理组中(1及2 µg/ml),24小时内各细菌间之活存率没有显著差异(<0.05),鲎素对于Vibrio alginolyticus、Aeromonas hydrophila、Lactococcus garvieae 以及 Photobaterium damselae之半致死剂量(LD50)分别为7.31 µg/mL、13.26 µg/mL、15.27 µg/mL及6.68 µg/mL。以50 µg/mL鲎素加入菌液经过24小时后,V. alginolyticus、A. hydrophila、L. garvieae及P. damselae之活存率分别只有5.8%、11.6%、18.9%及3.2%,显示鲎素对于上述细菌具有一定的抑菌作用。
关键词:鲎;鲎素;抑菌作用;抑菌肽
中图分类号:Q2-3 文献标识码:A
抗菌肽(antimicrobial peptides, AMPs)广泛分布在许多的生物体中,在如蜜蜂(Apis melliferal) 刺裡的毒液中所发现的抗菌肽-melittins [1]、比目鱼(Pleuronectes americanus)中所发现的抗菌肽-pleurocidin [2]、植物wheat seeds中所发现的抗菌肽-purothionins [3],甚至在人类的嗜中性白血球 (neutrophils)、单核球细胞(monocyte)及T淋巴球细胞 (T lymphocyte) 中所发现的抗菌肽-LL-37 [4],都可以发现到抗菌肽的存在。
抗菌肽的研究大约是由80年代开始兴起。Hultmark等人[5]由天蚕(Hyalophora cecropia)中分离纯化得到具有抗菌性的多肽链-cecropin后,学者便相继由细菌、昆虫、植物、哺乳动物甚至人类体内发现到抗菌胜肽的存在。目前所发现的抗菌胜肽已有800多种。抗菌肽可藉由其结构区分为双性和疏水性螺旋肽 (amphipathic and hydrophobic α-helices)、β-褶板肽及较小的蛋白质 (β-Sheet peptides and small proteins)以及拥有特殊胺基酸组成的抗菌胜肽等[6]。
鲎素(tachyplesin)为含有17个胺基酸的β-褶板肽,分子量约为2.36 kDa。鲎素具有抑菌作用,另外对于部分真菌如Candida albicans [7],以及对于肿瘤细胞亦有抑制的效果[8]。过去对抗细菌多使用抗生素,造成细菌对抗生素的抗药性正快速增加,而对抗此一现象的方法以天然型态的抗菌肽最有潜力。
近年来水产养殖出现大量细菌性疾病,造成在鱼介贝类养殖的重大损失,本研究以中华鲎(Tachypleus tridentatus)为材料,取其血细胞进行培养,收集其鲎素进行水产养殖常见之病原菌如Vibrio alginolyticus、Aeromonas hydrophila、Lactococcus garvieae以及 Photobaterium damselae之抗菌试验,以了解鲎素对上述菌的抑菌作用,希望做为未来水产新药开发以及运用生物技术防范病害的可能,因此抗菌胜肽的研究在目前医学的发展及疾病的控制中是刻不容缓的课题。
1 材料与方法
1.1 鲎的来源与畜养
鲎收购后先蓄养于检疫预备槽,经用淡水冲洗污泥,并进行消毒去除寄生虫后再移入蓄养池,蓄养两周后可进行抽血,蓄养环境底部放置细沙,并以过滤后之海水进行蓄养,蓄养其间每两天投喂一次解冻的生饵,包括下杂鲜鱼、小卷、乌贼、牡蛎及带壳虾子做为饲料。
1.2 鲎血淋巴抽取
抽血所使用的玻璃器皿,先以界面活性剂清洗后,用超音波震蕩清洗一小时,经二次蒸馏去离水冲洗后、沥干,以铝箔纸包好于180℃干热灭菌4小时后备用。采血部位为后头胸甲部与腹甲部交接关节韧带中央,采血时先将腹甲固定,将头胸甲与腹甲间关节曲折并固定,使鲎不易挣脱。采血部位先以优碘及70%酒精的棉棒消毒,代表面干后,以1 1/2” 18G无热原针头穿透韧带膜即可达后围心腔进行采血。采取之血液与抗凝血剂均匀混合,在注入无热原离心管中,进行离心。
细胞培养皿先以0.1 mg/mL 之poly-L-lysine进行涂抹,在直径100 ㎜及150 ㎜的细胞培养皿中放入poly-L-lysine,半小时后回收使用并用无菌水清洗两次,放置于无菌操作台内烘干即可,以利细胞黏着。细胞培养液的配方以DMEM为主酸碱值调整至7.4,将鲎血细胞培养在直径150 mm的细胞培养皿,置于37℃,10% CO2/90%air,湿度100%的培养箱(incubator)进行培养,每隔二至三天更换新培养液。培养皿已事先覆盖一层poly-L-lysine,继代培养(passage)的时候使用trypsin-EDTA(0.05%(w/v) trypsin, 0.5 mM EDTA, pH 7.4)以分散鲎血细胞。
1.3 鲎素萃取
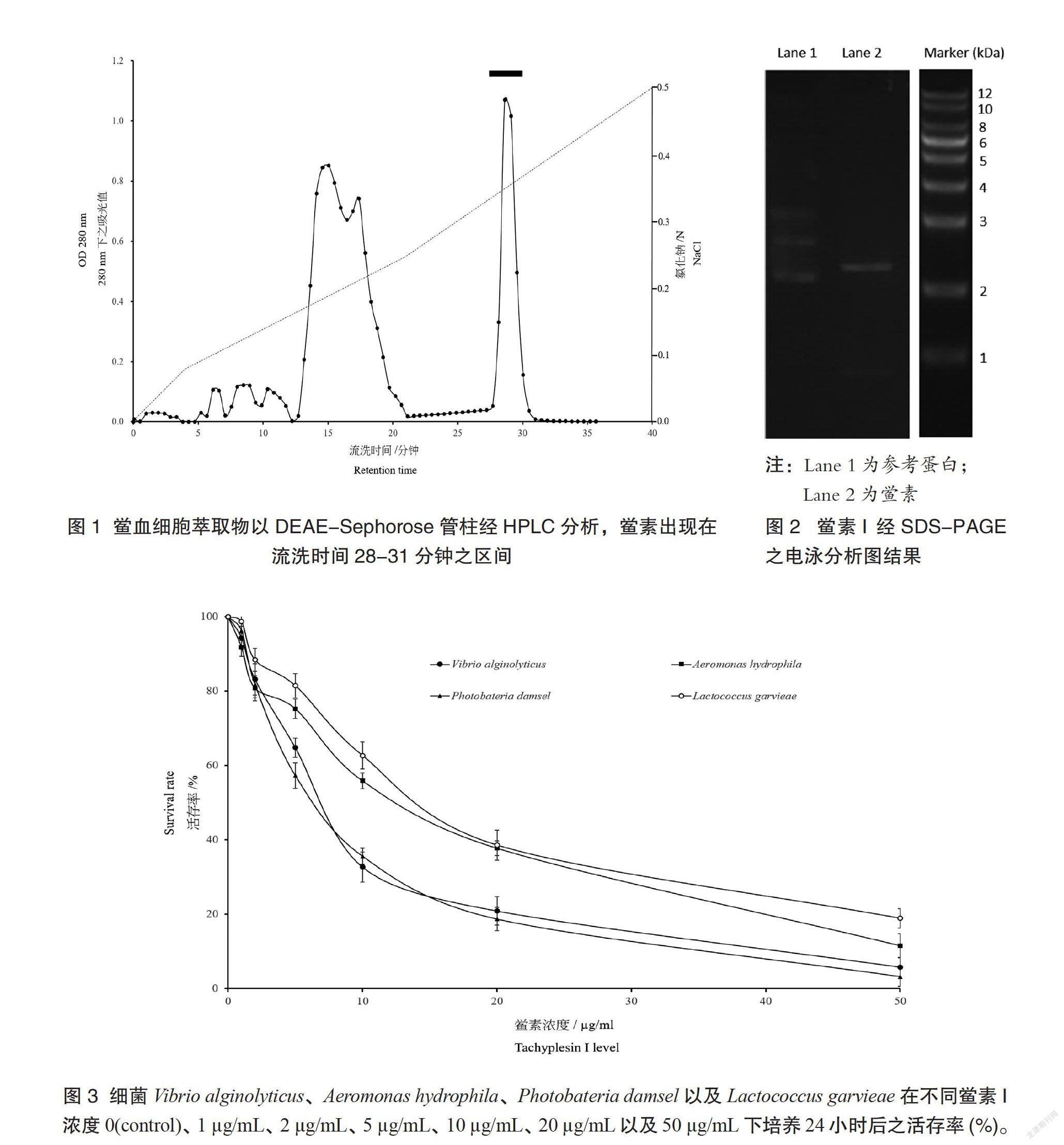
将鲎血细胞经超音破震碎机震碎后稀释至适当倍数,在离心机上以10300 g离心30分钟,取其上清液通过0.22 µm的过滤膜过滤后,注入高效液相层析仪(high-performance liquid chromatography)中,以高压帮浦将A缓冲溶液(20 mmol/l Tris-HCl)与B缓冲溶液(20 mmol/l Tris-HCl,0.5 M NaCl)以0.5 mL/min的流速打入DEAE-Sepharose管柱中,并连接紫外光检测器与电化学检测器进行鲎素分离与萃取,并收集鲎素测定蛋白质浓度。
取protein assay kit(Bio-Rad, No.500-0006)稀释5倍,取稀释液5 mL加入稀释至适当倍数之血淋巴0.1 mL,在分光亮度计上以波长595 nm测定其吸光值,并以BSA(bovine serum albumin, 66 kDa, Sigma)做为蛋白标准以换算萃取鲎素的蛋白质浓度。自HPLC分液收集器收集鲎素后,取鲎素10 µg加入sample buffer (1% SDS,1% 2-mercapto-ethanol, 10 mM pH 6.8 Tris buffer,1% bromophenol blue) 以12.5% SDS-PAGE进行电泳分析,电泳架设完成后,将胶体通以电流10 mA,20分钟后再将电流改为15 mA直至bromophenol blue跑出胶体外即切断电源。将胶体取出后以染色剂(2.5% coomassi brilliant blue溶于50% methanol及10% acetic acid)进行染色40分钟后,以脱色剂 (25% methanol及7% acetic acid)进行脱色直至背景颜色消失为止,胶片以电泳胶片扫描机扫描后分析其分子量以确定收集之蛋白质为鲎素。
1.4 鲎素抗菌试验
调配鲎素浓度至0(control)、1 µg/mL、2 µg/mL、5 µg/mL、10 µg/mL、20 µg/mL、50 µg/mL于含有50 mL NB液态培养基之锥形瓶中,置于37℃恒温培养箱,分别以转速150 rpm 震荡培养24小时及48小时。培养后将菌液以6, 000 ×g,4℃离心10分钟,取上清液,随即进行4种病原菌之抑菌实验,本抑菌试验所用之菌株分别为Vibrio alginolyticus、Aeromonas hydrophila、Photobaterium damselae以及Lactococcus garvieae。
将上述4种病原菌分别接种于盐度34‰之tryptic soy broth (TSB)液態培养基,置于27℃恒温培养箱,培养24小时。将病原菌之浓度调整为109 cfu/mL,取100 µL之菌液,涂盘于TSA固态培养基上 (使成每片plate有108 cfu) 各处理组进行5重复分析。经24小时后,测定细菌数并记录。
所得细菌活存率以SAS软件进行单因子变异数分析(one-way ANOVA table),检验样本之间是否具有显着差异,显著水平设为p<0.05。
2 结果
鲎血淋巴以HPLC分析后,以分液收集器收集其流洗液,发现鲎素出现在28-31分钟之流洗区段(图1)。收集流洗液后以SDS-PAGE电泳分析其分子量,确定其分子量约为2.36 kDa,以确定为鲎素(图2)。
将鲎素进行抗菌试验的结果中,分现在24小的培养后,低浓度鲎素(1 µg/mL、2 µg/mL) 的试验组中﹐各细菌的活存率在统计上没有显著的差别(p>0.05)。在5 µg/mL的试验组中,在V. alginolyticus、A. hydrophila、P. damselae以及L. garvieae之活存率分别只有控制组的64.8%、75.3%、57.3%及81.5%。在50 µg/mL之试验组中,经果24小时后,发现于V. alginolyticus及P. damselae 之活存率更只剩下5.8及3.2%,明显低于A. hydrophila及L. garvieae的11.6及18.9% (p<0.05)。因此鲎素对于本研究所设定之四种细菌均有抑菌能力(图3)。
鲎素对于V. alginolyticus、A. hydrophila、P. damselae 及L. garvieae之半致死剂量(LD50) 95%置信区间分别为7.31±1.04 µg/mL、13.26±2.05 µg/mL、6.68±1.13 µg/mL及15.27±2.18 µg/mL。
3 讨论
鲎有活化石之称,目前全世界的鲎共有四种,分别为中国鲎(T. tridentatus)、南方鲎(T. gigas)、圆尾鲎(Carcinoscorpius rotundicauda)及美洲鲎(Limulus polyphemus),本研究所使用的中国鲎主要分布于日本南方沿海及中国长江以南,包括浙江、福建、广东、广西、海南及台湾西部沿海之潮间带。
鲎之血淋巴细胞中所含的鲎素(tachyplesin I)是一个含有17个胺基酸以及两个双硫键的肽,现存的四种鲎中均可发现。本研究将鲎血淋巴取出后,以高效液相层析仪经DEAE-Sepharose管柱分离鲎素,收集28~31分钟之流洗液,经SDS-PAGE电泳分析后,测定其主要蛋白质之分子量约为2.36 kDa,与其他文献所提及之鲎素相同,因此本研究所萃取之主要蛋白质应为鲎素。
近几年,养殖鱼虾类大量死亡,本研究想要了解鲎素对于常见水产疾病的病原菌的抑菌作用,弧菌属的细菌性疾病是最早被发现在水产养殖病原菌之一,常见于河口、半淡咸水、海水养殖及野生生物中[9][10]。海水的弧菌种类繁多,其中可引起虾类疾病产生的约有6~7种,这些弧菌会产生大量的外毒素侵袭虾体,引发虾体组织细胞病变,进而引起虾只急性及慢性死亡。且环境长期受到有机或无机物质的污染,或病原菌的大幅增长,这些因素都构成虾类病变死亡,且是主要导致养虾业经营困难的原因。
溶藻弧菌Vibrio alginolyticus 最早出现在以色列的鲷类(Sparus aurata)养殖中[11],之后发现在海水乌鱼(mugil cephalus)的红斑症,也会感染虾类早成细胞和溶解及肝胰脏周围结缔组织的空洞化[12]。V. alginolyticus是海洋弧菌中的格兰氏阴性菌,此一弧菌可能造成在身体末端的伤口感染,不但造成伤口感染,还会造成软组织及耳感染。另外,在人身上V. alginolyticus会引起中耳炎、外耳炎、结膜炎及伤囗感染,有时引起败血症,在人体有伤口或是免疫力降低时才会发病 [13]。
親水性产气单孢菌A. hydrophila为革兰氏阴性杆菌,因具有极性的单鞭毛,使其具有移动性,属于人畜共通病原菌,亦是主要的水生病原菌之一[14][15]。感染鱼类后之典型病征为体表及鱼鳍基部溃烂及产生出血性败血症、腹水,并造成脾及肾脏等造血组织坏死[16]。
P. damselae属于革兰氏阳性菌,生存的栖息地大多数位于热带海洋近海沿海海岸附近,造成海洋动物的死亡而且它存在于到处有海洋鱼类的环境中高温期较易发生也就会导致海洋(热带)鱼类的皮肤溃烂或者有其他多样化的疾病产生例如肠胃道疾病进而导致渔业经济上的损失[17]。L. garvieae为链球菌的一种,属于革兰氏阳性菌,亦是人畜共通菌[18]。L. garvieae 最早由杜氏鰤Seriola dumerili中分离,罹病鱼只会有体色变暗、凸眼、腹部澎大及眼睛出血的症状,在鳃盖及鱼鳍的基部会有出血的现象,腹部有积水及出血等症状[19][20]。受L. garvieae感染的淡水长臂大虾(Macrobrachium rosenbergii),全身肌肉组织呈现会死病灶[21]。
抑菌肽普遍存在于动物和植物中的先天性免疫系统中[22][23]。抑菌肽对于细菌的抑菌效果显着,开发天然抑菌肽对于细菌抑制及新药开发具有相当帮助,并且可以大幅度降低对抗生素的依赖。结构相连的两个双硫键让鲎素可以在低pH及高温中仍然可以维持稳定[7],鲎素(tachyplesin I)在细菌的细胞膜上形成环形的孔洞,进而造成细菌死亡[24]。
鲎素浓度50 µg/mL之试验组中,经果24小时后,发现于V. alginolyticus及P. damselae之活存率只剩下5.8%及3.2%,显着低于A. hydrophila、L. garvieae的11.6%及18.9%,此一结果可发现鲎素对于V. alginolyticus及P. damselae之抑菌效果明显高于A. hydrophila及L. garvieae,此一结果可能与细菌之细胞壁与其细胞外产物之组成有关。
本研究中在低浓度的鲎素抑菌实验组(1 µg/mL及2 µg/mL),在四种细菌间没有显著的差异,鲎素对于V. alginolyticus、A. hydrophila、P. damselae及L. garvieae之24小时之半致死剂量分别为7.31 µg/mL、13.26 µg/mL、6.68 µg/mL及15.27 µg/mL,显示鲎素对格兰氏阴性菌之抑菌效果除产气单胞菌外较革兰氏阳性菌效果为大,但是其造成原因以及抑菌机制还需要进一步研究阐明。
参考文献
[1]Steiner, H., Hultmark, D., Engstrom, A., Bennich, H. and Boman, H.G., 1981. Sequence and specificity of two antibacterial proteins involved in insect immunity. Nature 292:246-248.
[2] Cole, A.M., Weis, P. and Diamond, G., 1997. Isolation and characterization of pleurocidin, an antimicrobial peptide in the skin secretions of winter flounder. Journal of Biological Chemistry. 272:12008-13.
[3] Fernandez de Caleya, R., Gonzalez-Pascual, B., Garcia-Olmedo, F. and Carbonero, P., 1972. Susceptibility of phytopathogenic bacteria to wheat purothionins in vitro. Applied Microbiology. 23:998-1000.
[4] Frohm, M., Agerberth, B., Ahangari, G., Stahle-Backdahl, M., Liden, S., Wigzell, H. and Gudmundsson, G.H., 1997. The expression of the gene coding for the antibacterial peptide LL-37 is induced in human keratinocytes during inflammatory disorders. Journal of Biological Chemistry. 272: 15258-63.
[5] Hultmark, D., Steiner, H., Rasmuson, T. and Boman, H.G., 1980. Insect immunity. Purification and properties of three inducible bactericidal proteins from hemolymph of immunized pupae of Hyalophora cecropia. European. Journal of Biochemistry. 106:7-16.
[6] Epand, R.M. and Vogel, H.J., 1999. Diversity of antimicrobial peptides and their mechanisms of action. Biochimica et Biophysica Acta. 1462:11-28.
[7] Nakamura, T., Furunaka, H., Miyata T., Tokunaga, F., Muta, T. and Iwanaga, S., 1988. Tachyplesin, a class of antimicrobial peptide from the hemocytes of the horseshoe crab (Tachypleus tridentatus). Isolation and chemical structure. Journal of Biological Chemistry. 263(32):16709-13.
[8] Chen, J., Xu, X.M., Underhill, C.B., Yang, S., Wang, L., Chen, Y., Hong, S., Creswell, J. and Zhang, L., 2005. Tachyplesin Activates the Classic Complement Pathway to Kill Tumor Cells. Cancer Research. 65:4614-4622.
[9] Egidius, E., 1987. Vibriosis: Pathogenicity and pathology. Aquaculture. 67:15-28.
[10]Liu, P.C., Lee. K.K., Chen, S.N., 1996. Pathogenicity of different I. galbanalates of Vibrio hareyi in tiger prawn (Penaeus monodon). Letters in Applied Microbiology. 22:413-416.
[11]Colorni, A., Paperna, I., Gordin, H., 1981. Bacterial infections in gilthead sea bream Saparus aurata cultured at Elat. Aquaculture. 23:257-267.
[12]Esteve, M., Herrera, F.C., 2000. Hepatopancreatic alterations in Litopenaeus vannamei (Boone, 1939)(Crustacea: Decapoda: Penaeidae) experimentally infected with a Vibrio alginolyticus strain. Journal of Invertebrate Pathology. 76:1-5.
[13]Hörmansdorfer, S., Wentges, H., Neugebaur-Büchler, K., and Bauer, J. 2000. Isolation of Vibrio alginolyticus from seawater aquaria. International Journal Hygiene and Environmental Health, 203(2):169-175.
[14]Jho, Y., Park, D., Lee, J.K., Cha, S. and Han, J., 2011. Identification of bacteria from the oral cavity and cloaca of snakes imported from Vietnam. Laboratory Animal Research. 27:213-217.
[15]Hudson, J.A., DeLacy, K.M., 1991. Incidence of motile Aeromonas in New Zealand retail foods. Journal of Food Prottection. 54:696-699.
[16]Janda, J.M., Abbort, S.L., 1998. Evolving concepts regarding the genus Aeromonas: an expanding panorama of species, disease presentation and unanswered questions. Infectious Diseases. 27:332-344.
[17]Thompson, F.L., Gevers, D., Thompson, C.C., Dawyndt, P., Naser, S., Hoste, B., Munn, C.B. and Swings, J., 2005. Phylogeny and molecular identification of vibrios on the basis of multilocus sequence analysis. Applied and Environmental Microbiology. 71:5107–5115.
[18]Vendrell, D., Balcázar, J.L., Ruiz-Zarzuela, I., de Blas, I., Gironés, O. and Múzquiz, J.L., 2006. Lactococcus garvieae in fish: a review. Comparative Immunology, Microbiology & Infectious Diseases. 29(4):177-198.
[19]Bartham, W. T., Schoonbee, H., Smit, G.L., 1979. The occurrence of Aeromonas and Streptococcus in rainbow trout (Salmo gairdneri). Journal of Fish Biology. 15:457-460.
[20]Bullock, G.L., 1981. Streptococcal infections of fishes. United States Department of the Interior, Fish and Wildlife Service, Fish Disease Leaflet. 63:1-7.
[21]Chen, S.C., Lin, Y.D., Liaw, L.L., Wang, P.C., 2001. Lactococcus garvieae infected in the giant freshwater prawn Macrobrachium rosenbergii confirmed by polymerase chain reaction and 16s rRNA sequencing. Diseases of Aquatic Organisms. 45:45-52.
[22]Boman, H.G., 2003. Antibacterial peptides: basic facts and emerging concepts. Journal of Internal Medicine. 254:197-215.
[23]Douglas, S.E., Gallant, J.W., Liebscher, R.S., Dacanay, A. and Tsoi, S.C., 2003. Identification and expression analysis of hepcidin-like antimicrobial peptides in bony fish. Developmental and Comparative Immunology. 27:589-601.
[24]Imura, Y., Nishida, M., Ogawa, Y., Takakura, Y., Matsuzaki, K., 2007. Action mechanism of tachyplesin I and effects of PEGylation. Biochimica et Biophysica Acta. 1768:1160-1169.
