注射热休克蛋白促进剂或抑制剂后异育银鲫感染CyHV-2时生理状态的响应
2019-09-10董华雨,陈胜峰,吴萍,税典章,许凡,高璐
董华雨,陈胜峰,吴萍,税典章,许凡,高璐
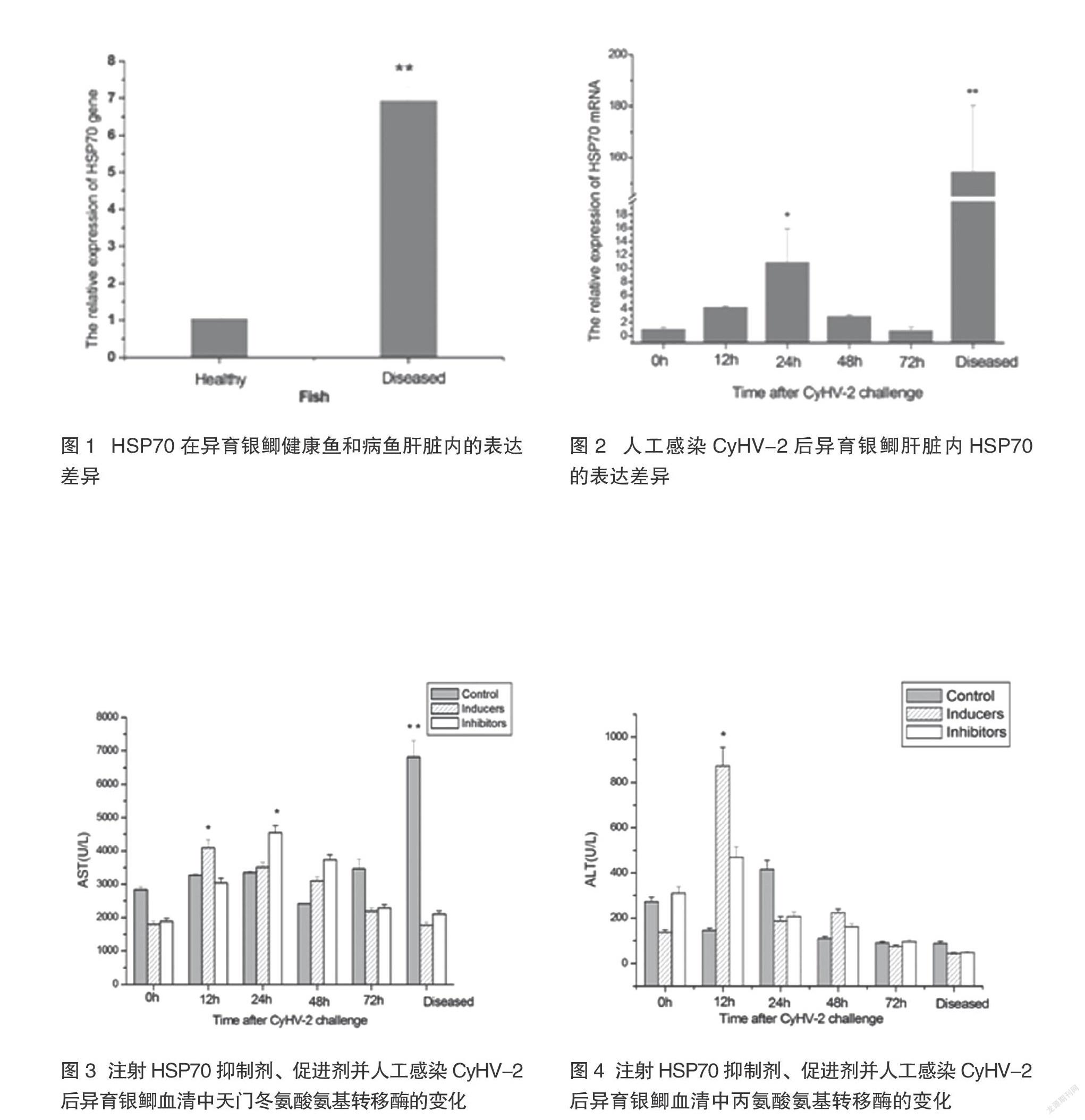
摘要:鉴于异育银鲫鳃出血病与温度相关的发病特征,分别对异育银鲫注射HSP70抑制剂和促进剂进行了其体内热休克蛋白的人工干预。研究发现,养殖池塘自然发病的具有鳃出血病典型症状的异育银鲫,其肝脏内HSP70基因的表达量与健康异育银鲫相比明显升高,人工感染CyHV-2病毒后,肝脏内HSP70表达量在24h后显著增加,当鱼体表现出发病症状时,HSP70表达量极显著上升。对照组在人工感染CyHV-2后,血清中天门冬氨酸氨基转移酶在鱼体发病时显著升高,且在发病时与注射促进剂和抑制剂组都有极显著差异;注射HSP70促进剂组在人工感染CyHV-2后,血清中天门冬氨酸氨基转移酶和丙氨酸氨基转移酶在12h时显著升高。注射HSP70抑制剂的异育银鲫体内病毒数在感染病毒后12h时,就达到最高点,明显高于对照组及注射促进剂组的同时间段病毒数。说明HSP70在抵御病毒的增殖中具有一定的积极作用。
关键词:异育银鲫,热休克蛋白,CyHV-2,谷氨酰胺,槲皮素
中图分类号:S94 文献标识码:A
鳃出血病是异育银鲫(Carassius auratus gibelio)因感染鲤Ⅱ型疱疹病毒(CyHV-2)而致的一种疾病,初期病鱼表现为食欲减退,离群独游,后期则表现为鳃部出血,胸部、腹部有出血点,腹部肿胀,尾鳍、背鳍明显发白。鳃出血病常在5月、6月、10月、11月水体温度在15℃~25℃时爆发,当水温高于30℃及低于15℃时都会停止发病[1],说明鱼体常可以携带病毒生存。因此,异育银鲫鳃出血病的发病过程,除了从病原体(病毒)角度考虑是否是因15℃~25℃温度适宜病毒增殖外,鱼体内自身与温度高低相关的蛋白质的表达也可作为关注的焦点。
热休克蛋白是生物体在应激条件下,如饥饿、高温、缺氧、感染等状态下在体内高效表达的一类蛋白质。其中,热休克蛋白70(HSP70)是一种细胞保护蛋白,也是主要的分子伴侣蛋白之一。HSP70还能参与免疫复合物的形成,加强抗原提呈[2],并能在体内诱导抗病毒免疫应答[3]。在对水生动物的研究中发现,凡滨对虾(Litopenaeus vannamei)的HSP70可与白斑综合征病毒(WSSV)的结构蛋白VP24、VP26相互作用,VP24、VP26可降低HSP70的ATPase活性[4]。我们的前期研究发现,鱼体内HSP70在感染CyHV-2后显著上调,说明HSP70在鳃出血病的发生中也起着一定的作用。由此可见,HSP70的研究,是一条很好地开展异育银鲫鳃出血病发生机制研究的途径。反之,如果通过人工干预,降低或增高鱼体内的热休克蛋白含量,是否也会对鱼体内的病毒作用产生抑制或促进效应。因此,基于这样的设想,本文通过给鱼体注射HSP70促进剂或抑制剂,然后人工感染CyHV-2,研究了鱼体在人为地提高或降低体内热休克蛋白、并感染CyHV-2情况下的生理响应,以期为阐明异育银鲫鳃出血病发生机制提供有效的基础资料,为异育银鲫抗CyHV-2的药物或饲料开发提供有力的依据。
1 材料与方法
1.1 材料
健康的异育银鲫购自苏州市南环批发市场,共225尾。运回实验室后暂养于曝气后的水中,经部分抽检,确证未感染CyHV-2病毒。发病的异育银鲫具有典型的鳃出血病症状,取自江苏大丰。病鱼的内脏取出后放于-80℃保存。斛皮素和谷氨酰胺分别购自上海士锋生物科技有限公司。
1.2 方法
1.2.1 异育银鲫CyHV-2的人工感染
将异育银鲫随机分为3组,分别为HSP70促进组、HSP70抑制组和对照组,每组设3个平行,每个平行放置30尾异育银鲫。HSP70抑制组每尾异育银鲫以5 mg/kg剂量于背鳍后方注射槲皮素,HSP70促进组每尾异育银鲫以0.75g/kg剂量于背鳍后方注射谷氨酰胺,对照组注射相同体积的0.65%的灭菌生理盐水。均分两次间隔4小时注射。取患病异育银鲫的内脏组织按1﹕6(w/v)0.65%灭菌生理盐水制作组织匀浆,-80℃至室温反复冻融3次,5000 rpm离心10 min,所得上清液过0.45 µm滤膜除菌后,收集滤液置于4℃备用[5]。将病毒液按每尾鱼0.3 mL/尾的剂量进行腹腔注射,对照组每尾注射0.3 mL生理盐水。病毒液于分别注射槲皮素和谷氨酰胺后24小时注射。注射槲皮素和谷氨酰胺后12小时采样,样品记为0 h,即为感染CyHV-2前样本。
分别于注射病毒液后12 h,24 h,48 h,72 h和异育银鲫已有明显腹部肿胀、鳃部出血的症状时采样。取肝脏、脾脏和肾脏组织,在DEPC水配制的PBS中漂洗后,经液氮冷冻后,于-80℃保存。
1.2.2 血清生化指标的测定
对实验组和对照组异育银鲫进行尾静脉采血,4℃ 3500 r/min离心10分钟,收集血清,于美国雅培c8000全自动生化分析仪进行天门冬氨酸氨基转移酶、丙氨酸氨基转移酶的测定。
1.2.3 异育银鲫不同生理状态下体内HSP70的表达差异
采集经过PCR鉴定检出CyHV-2阳性并具有明显鳃出血病症状的异育银鲫肝脏,在DEPC水配制的PBS中漂洗后,经液氮冷冻后,于-80℃保存。未检出CyHV-2的健康异育银鲫用同样的方法采集组织样品。各组织于液氮中研磨,進行总RNA的提取,并反转成cDNA第一链。以本实验室异育银鲫转录组测序所得的数据库中一条注释为HSP70的序列为基础,设计引物,以肝脏cDNA为模板进行克隆,以所获序列设计特异引物F:GGAGTCCTACGCCTTCAACA和R:TTGCAGACCTTCTCCAGCTC,以异育银鲫β-actin基因序列(MF463002)设计内参引物F: TGTCCCTGTATG CCTCTGGT和R: TGTAGCCTCTCTCGGTCAGG,以无菌水作为阴性对照。进行Real-time荧光定量PCR,反应结果用2-ΔΔCt的方法进行分析[6]。用SPSS软件进行数据处理。
1.2.4 注射HSP70抑制剂和促进剂的异育银鲫人工感染CyHV-2后体内病毒数的测定
根据CyHV-2病毒编码解旋酶序列(KM200722.1)设计引物F:ATGTGCAACGTGACGGCGAGT和 R:CTACCGTCTTTTAGGG,以病鱼DNA为模板进行PCR反应。将特异条带克隆入DH5α,经菌落PCR鉴定后提取质粒,并计算每毫升溶液中质粒拷贝数。根据所得序列设计Real-time荧光定量PCR引物F: TGGAATCAGTTCAACGCGTCAT和 R: CGTCAGTGCCTGGCAG TAATA,将所得质粒从102-108按10倍梯度稀释,结合荧光定量PCR数据得出标准曲线及线性回归方程[7]。
分别取一定量的注射生理盐水、槲皮素或谷氨酰胺并人工感染CyHV-2后的异育银鲫内脏,经快速提取DNA后,取2微升进行Real-time荧光定量PCR,根据Ct值计算组织中的病毒拷贝数。所得数据用SPSS16.0软件进行统计处理,在单因素方差分析的基础上,采用Duncan氏多重比较法检验组间差异(P=0.05)。
2 结果
2.1 异育银鲫感染CyHV-2后HSP70的表达变化
养殖池塘自然发病的具有鳃出血病典型症状的异育银鲫,其肝脏内HSP70基因的表达量与健康异育银鲫相比明显地升高(P<0.01)(图1)。人工感染CyHV-2病毒后,肝脏内HSP70表达量在24h后显著增加(P<0.05),随后趋于正常;而当鱼体表现出发病症状时,HSP70表达量极显著上升(P<0.01)(图2)。自然发病和人工感染CyHV-2发病的异育银鲫体内HSP70表达量的显著升高说明HSP70与鳃出血病之间存在着一定的关系。
2.2 注射HSP70抑制剂、促进剂并人工感染CyHV-2后异育银鲫血清中生化指标的变化
对照组在人工感染CyHV-2后,血清中天门冬氨酸氨基转移酶(AST)含量在72h内相对平稳,在鱼体发病时显著升高(P<0.05),且在发病时与注射促进剂和抑制剂组都有极显著差异(P<0.01)。注射HSP70促进剂组在人工感染CyHV-2后,血清中天门冬氨酸氨基转移酶含量在12时显著升高(P<0.05),后逐渐下降并趋于稳定,至发病时已和感染病毒前持平。注射HSP70抑制剂组在人工感染CyHV-2后,血清中天门冬氨酸氨基转移酶含量在12时开始升高,至24h达最高值(P<0.05),后逐渐下降并趋于稳定,至发病时已和感染病毒前持平(图3)。
对照组在人工感染CyHV-2后,血清中丙氨酸氨基转移酶(ALT)含量在12 h时略有下降,24 h时略升高,48 h后又下降直至发病都很平稳,但几个时间点的丙氨酸氨基转移酶含量和感染前相比都无显著差异。注射HSP70促进剂组在人工感染CyHV-2后,血清中丙氨酸氨基转移酶含量在12h时显著升高(P<0.05),后逐渐下降并趋于稳定,至发病时已和感染病毒前持平。注射HSP70抑制剂组在人工感染CyHV-2后,血清中丙氨酸氨基转移酶含量在12时开始升高并达最高值,后逐渐下降并趋于稳定,但和感染前相比同样无显著差异(图4)。
2.3 注射HSP70抑制剂、促进剂并人工感染CyHV-2后异育银鲫体内的CyHV-2病毒数量
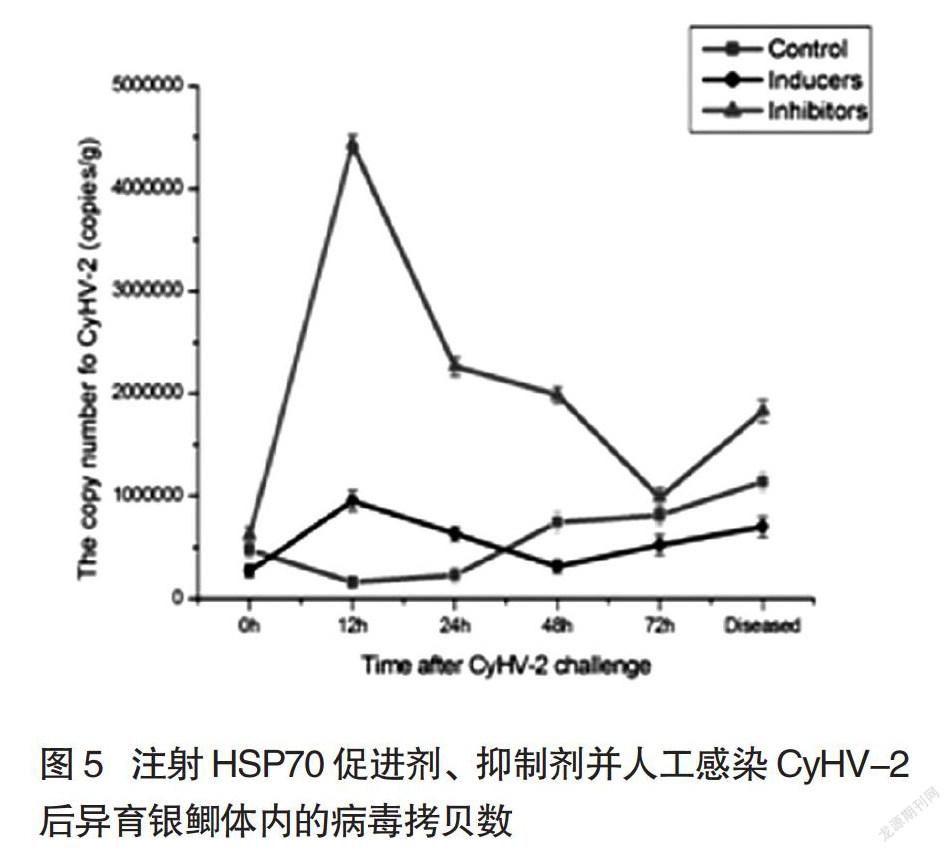
将含有病毒核酸的质粒从102-108按10倍梯度稀释后,进行实时荧光定量PCR,根据Ct值与质粒拷贝数的对数值获得了线性回归方程:y= -3.4789x +37.507,R2为0.99816。注射HSP70促进剂、抑制剂的异育银鲫人工感染CyHV-2后,对其体内的病毒拷贝数进行测定,发现注射HSP70抑制剂的异育银鲫体内病毒数在感染病毒后12 h时,就达到最高点,约为刚感染时的9倍(P<0.01),明显高于对照组及注射HSP70促進剂组的同时间段病毒数(P<0.01);随后病毒数有所下降,但是至发病时,仍然远远高于感染初期。而对照组和注射HSP70促进剂组,在病毒的增殖趋势及数量上,两者都没有明显差异(图5)。可见当异育银鲫体内的热休克蛋白被人为抑制时,鱼体对CyHV-2病毒的抵御能力大大下降,从而CyHV-2病毒得以在异育银鲫体内大量增殖,说明HSP70在抵御病毒的增殖中具有一定的积极作用。
3 讨论
热休克蛋白是生物体在应激条件下在体内高效表达的一类蛋白质,也是一种细胞保护蛋白。热休克蛋白能抑制产生氧自由基的关键酶,并且能直接释放或增加细胞内的超氧化物歧化酶等抗氧化剂,从而使生物体具有更好的抗应激能力[8,9]。在池塘自然感染CyHV-2病毒后患病的异育银鲫体内,HSP70在转录水平的表达量为正常值的7倍,而在人工感染CyHV-2后,在鳃出血病的急性爆发期,病鱼体内的HSP70 mRNA表达量更是惊人地高出对照组100多倍。说明异育银鲫在感染CyHV-2后,为增强机体的应激反应,体内HSP基因的表达大量增强,以减少机体因感染病毒受到的损害。由于HSP70还能参与免疫复合物的形成,在体内诱导抗病毒免疫应答[3]。因此,异育银鲫在感染CyHV-2并发病后,机体为了尽快产生免疫复合物来防御入侵的病原,调动了体内HSP70基因的大量表达。两者叠加,造成了HSP70在表达水平的显著升高。而人工感染后的发病鱼体,其体内的HSP70 mRNA 要远高于池塘自然发病的个体,推测因为人工感染与自然传播相比,用的剂量更大,病毒复制数目更多,发病的时间更短。
谷氨酰胺(Glutamine)是一种极有潜力的热休克蛋白诱导剂,因其可诱导增强HSP70的表达,已在药物开发中得到了一定的应用[10,11],而槲皮素(Quercetin)具有抑制热休克蛋白转录与翻译的功能[12-14]。在已知CyHV-2感染异育银鲫能提高鱼体内HSP70基因的表达后,分别通过给鱼体注射谷氨酰胺和槲皮素来提高或阻断体内的HSP70,并人工感染CyHV-2,通过不同时间点鱼体内病毒拷贝数的测定,发现HSP70与CyHV-2病毒的增殖间有密切的联系。发现注射槲皮素的异育银鲫体内病毒数在感染病毒后12h时,就达到最高点,约为刚感染时的9倍,明显高于对照组及注射谷氨酰胺组异育银鲫的同时间点病毒数;注射槲皮素组的异育银鲫,体内病毒数在12 h至最高峰后虽然接着有所下降,但是至发病时,仍然远远高于感染初期。可见当异育银鲫体内的热休克蛋白被人为减少时,鱼体对CyHV-2病毒的抵御能力大大下降,从而CyHV-2病毒得以在异育银鲫体内大量增殖,说明HSP70在抵御病毒的增殖中具有一定的积极作用。人工增加或减少鱼体内的HSP70,在相同的人工感染CyHV-2的条件下,鱼体内病毒的拷贝数有不同的呈现,这也解释了CyHV-2引起的疾病常在水温15℃~25℃发病的原因。水温15℃~25℃,是异育银鲫最适宜的生长温度,在此温度下,因温度刺激产生的应激最小,体内热休克蛋白的量处于一个相对低的水平,因此,当鱼体感染CyHV-2时,对病毒的抵御能力较差,病毒增殖迅速,打破了机体自身与病毒造成损伤之间的平衡,鳃出血病往往容易爆发。而当水温高于25℃或低于15℃时,水温本身对鱼体已经产生了刺激,鱼体内热休克蛋白量有所增加,从而促进鱼体免疫复合物的形成,对病毒的增殖起了一定的抑制作用。所以即使鱼体感染了CyHV-2,往往也能携带病毒生存,不会造成鳃出血病的大规模爆发。
血清中天门冬氨酸氨基转移酶(AST)和丙氨酸氨基转移酶(ALT)可反映肝细胞损伤的程度。肝脏承担着鱼体糖类、脂类、蛋白质和维生素等物质的代谢,当机体受到致病因子的侵害时,肝脏的结构和功能会受到不同程度的损害,并引起相应的代谢物紊乱[15]。刘文枝等的研究表明,异育银鲫在人工感染CyHV-2后,血清中AST的含量会有显著升高[5],本研究也得到了相似的结果。本实验中,对照组在人工感染CyHV-2后,血清中天门冬氨酸氨基转移酶在鱼体发病时显著升高,且在发病时与注射HSP70促进剂和抑制剂组都有极显著差异。注射HSP70促进剂和抑制剂组,血清中AST含量和感染CyHV-2前相比,并没有明显变化。说明人为地对异育银鲫体内的HSP70进行干预后,对因病毒造成的肝脏损伤产生了一定的拮抗,在一定程度上对机体起到了保护作用。相比之下,血清中丙氨酸氨基转移酶仅在注射HSP70促进剂组在人工感染CyHV-2后12 h时显著升高,其他均无显著差异。因此,血清中天门冬氨酸氨基转移酶的数值可作为异育银鲫鳃出血病辅助判别的血清指标。
参考文献
[1]吴霆,丁正峰,朱春艳,薛中仪,顾伟,孟庆国,王文。异育银鲫鳃出血病流行病学调查和研究。水产科学,2014,33(5):283-287.
[2] 杨瑞,冯作化,张桂梅,等,重组人HSP70的制备及其提呈抗原作用的研究,2001,药物生物技术,2001,8(5):244-247.
[3] Anne-marie T C , Max P, Carey L O, et al .Immunization with a lymphocytic choriomeningitis virus peptide mixed with heat shock protein 70 results in protective antiviral immunity and specific cytotoxic T lymphocytes[J]. J Exp Med, 1998 , 187:685
[4] 孙凡. 凡纳滨对虾热休克蛋白60、70和90与WSSV的相互作用[D]. 上海海洋大学硕士学位论文,2013:43-48.
[5] 刘文枝, 曾令兵, 张辉, 等. 2013. 异育银鲫感染鲤疱疹病毒Ⅱ型( Cy HV-2)后血液生理生化指标变化的研究[A]. 上海海洋大学学报, 22(6): 928-935.
[6] Livak K J, Schmittgen T D. 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2 (delta delta C(T)) method[J]. Methods, 25:402-408.
[7] 谢亚君,税典章,吴萍,等.基于不同PCR方法的Ⅱ型鲤疱疹病毒检测技术研究[J].基因组学与应用生物学,2019,38(3):1018-1025.
[8] 崔彦婷,刘波,谢骏,等。热休克蛋白研究进展及其在水产动物中的研究前景。[J].江苏农业科学,2011,39(3):303-306.
[9] 陈明帅,徐超,宋兴超,热休克蛋白的研究进展。经济动物学报,2016,20(1):44-53.
[10] 孙培明。谷氨酰胺对热休克蛋白70的诱导及其抗应激作用。山东畜牧兽医,2011,132(6):77-79
[11] Wischmeyer PE. Glutamine and heat shock protein expression [J]. Nutrition, 2002, 18 (3):225-228.
[12] Nakanoma T, M Ueno, M Iida, et al. Effects of quercetin on the heat-induced cytotoxicity of prostate cancer cells [J]. Int J Urol, 2001, 8:623-630.
[13] Nagai N, Nakai A, Nagata K, et al. Quercetin suppresses heat shock response by down regulation of HSF1 [J]. Biochem Biophys Res Commun, 1995, 208:1099-1105.
[14] Mitsuhiro F, Masami N, Mickio M, et al. Synegistic cytotoxic effect of quercetin and heart treatment in a lymphoid cell line (OZ) with low HSP70 expression [J]. Leukemia Res, 1997, 21 (2):139-143.
[15] 卓樹洪,叶晓光,冯桂玲,等。天门冬氨酸氨基转移酶-丙氨酸氨基转移酶比值与天门冬氨酸氨基转移酶-血小板比值在HBV感染相关疾病中的临床应用。中华生物医学工程杂志,2015,21 (5):432-435.
