化学调控对洞庭湖区不同群体夏玉米抗倒性及产量的影响
2019-09-10沙莎何闻静曹亚娟韩霜罗水清易镇邪陈平平
沙莎 何闻静 曹亚娟 韩霜 罗水清 易镇邪 陈平平
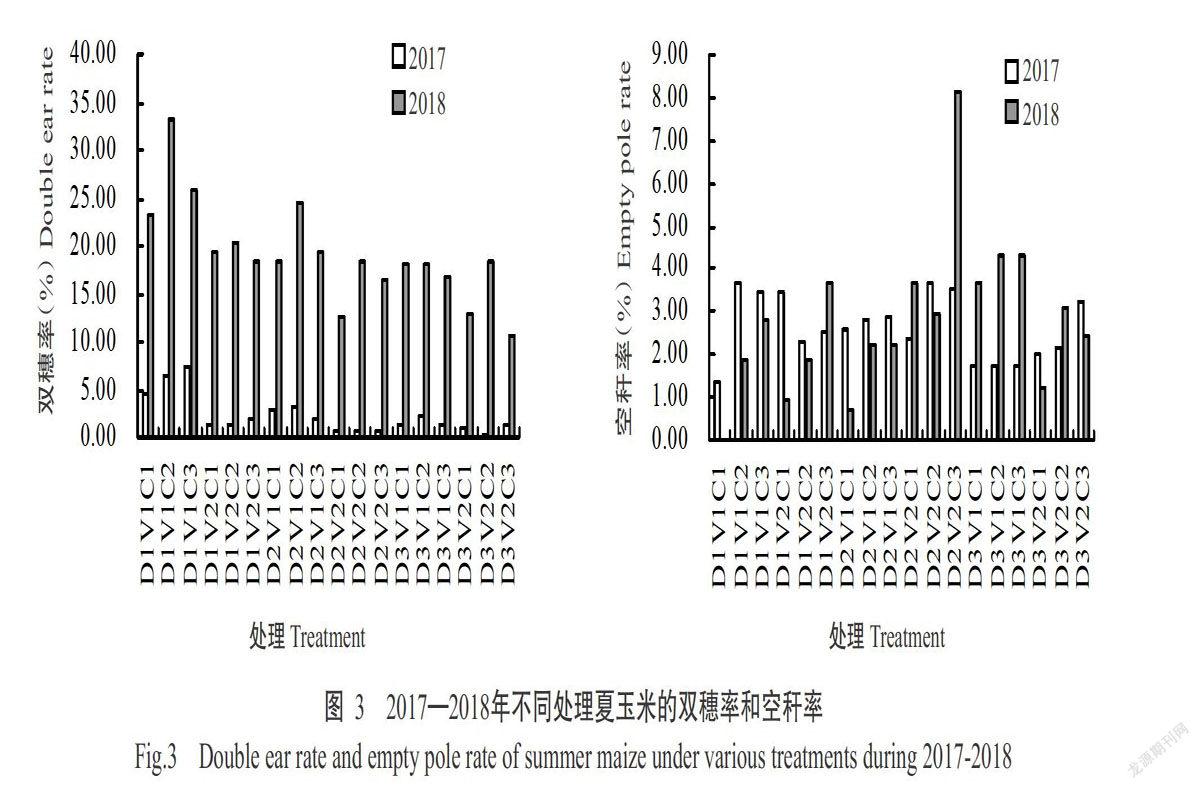
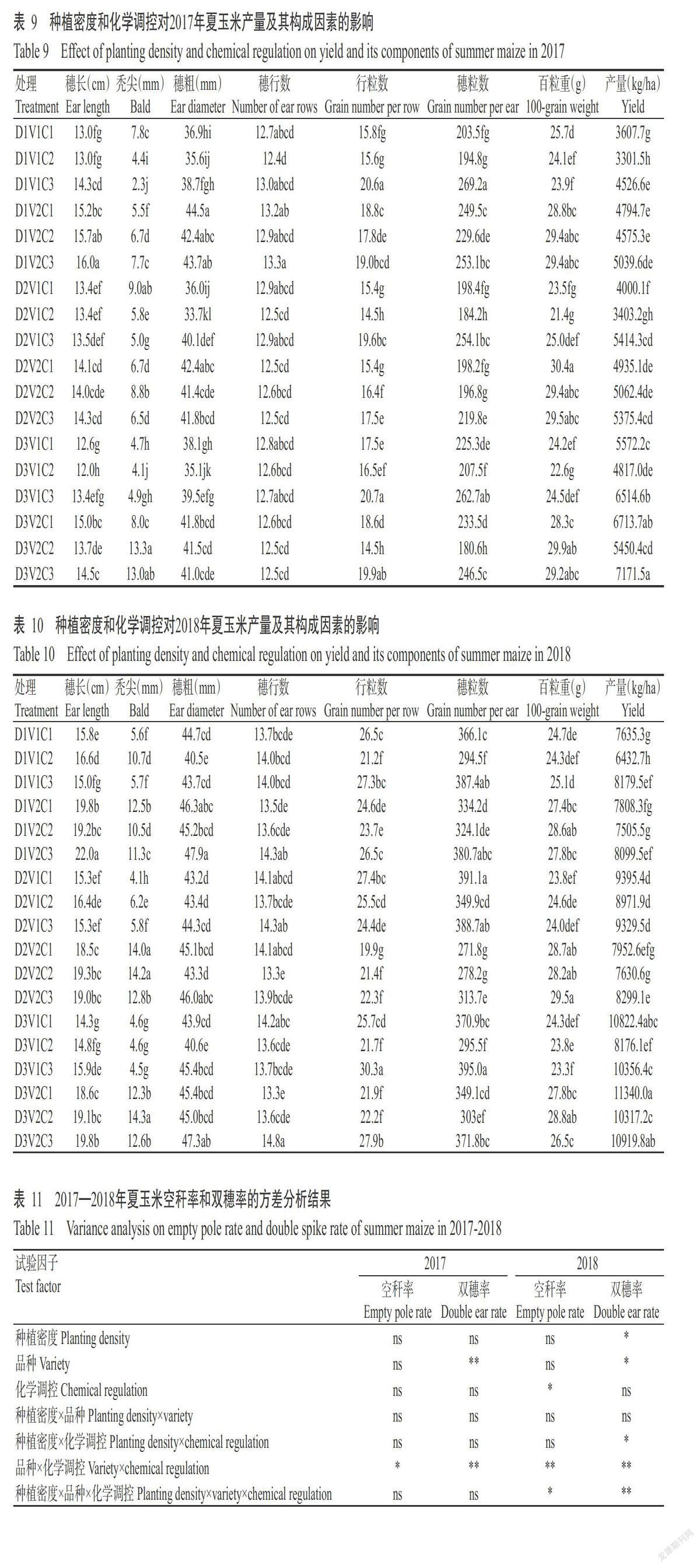
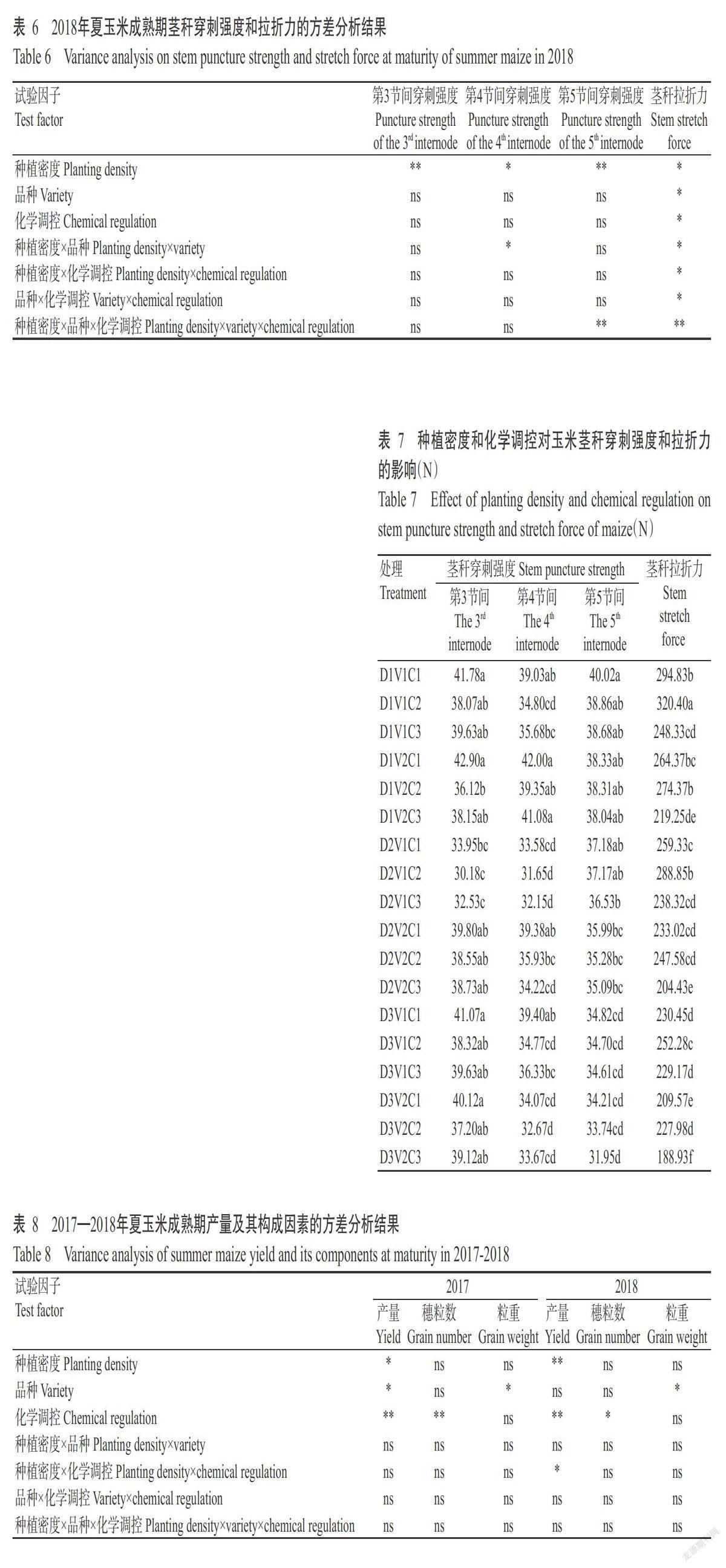
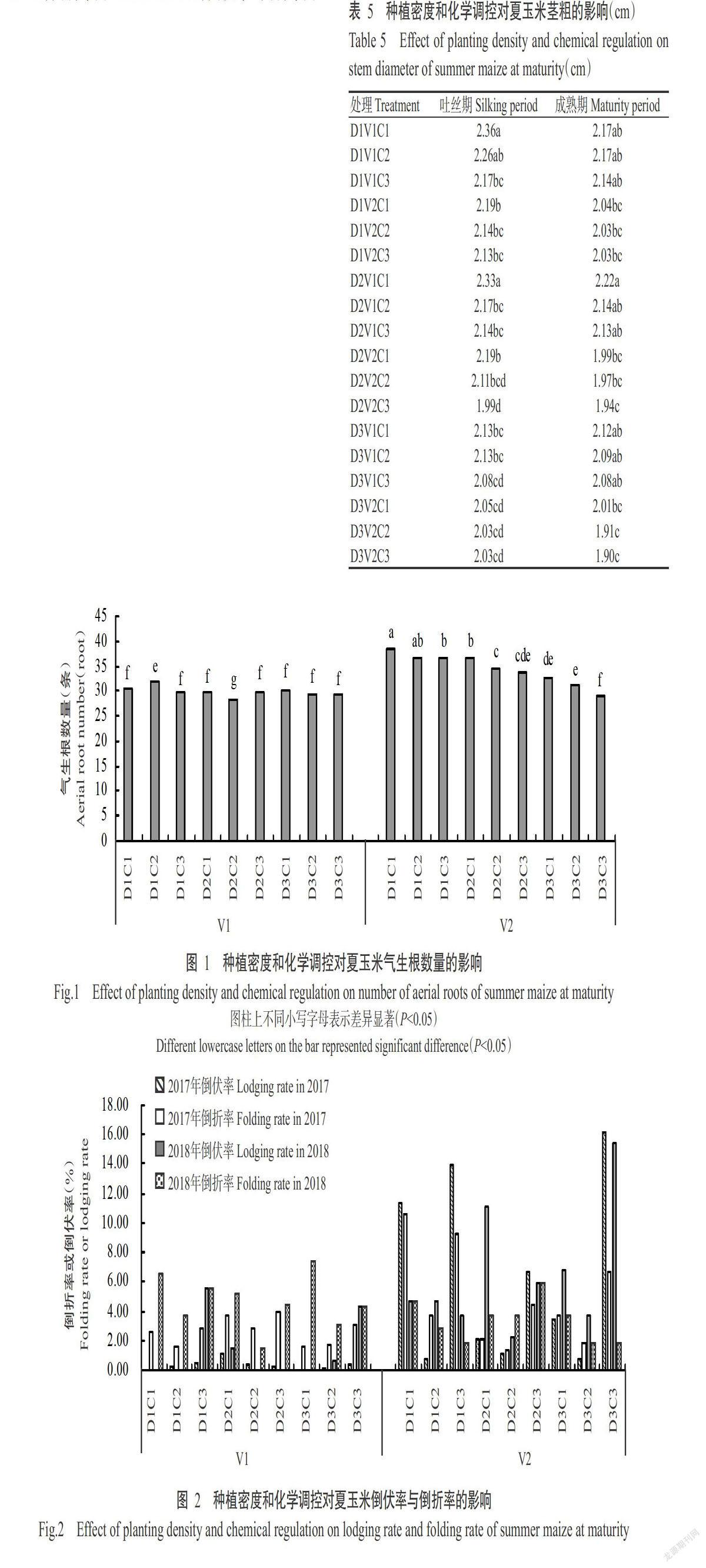
摘要:【目的】研究化學调控措施对洞庭湖区夏玉米抗倒性及产量的影响,明确不同群体夏玉米适宜的化学调控措施,为洞庭湖区机收夏玉米的高产高效栽培提供理论与技术支撑。【方法】以机收夏玉米品种郑单958和湘农玉27号为材料,于2017—2018年在湖南桃源县木塘垸镇进行大田试验,比较1次化学调控(拔节初期)、2次化学调控(拔节初期+大喇叭口期)和无化学调控(对照)对低、中、高不同种植密度(60000、75000和90000株/ha)夏玉米抗倒性及产量的影响。【结果】随种植密度增大,夏玉米的株高和穗位高增高、茎秆变细、气生根数量减少,但适宜的化学调控措施可增加气生根数量,增大茎粗和茎秆拉折力,降低玉米株高、穗位高、穗高系数及玉米重心,进而提高玉米的抗倒性能,降低倒伏率与倒折率。玉米产量随种植密度增加而提高,且两年度表现一致。化学调控对玉米产量的影响存在年际间差异,可能与2017年异常天气状况有关。2017年,玉米产量随化学调控次数增加而下降;2018年,低种植密度下以无化学调控处理的产量最高,中种植密度下不同化学调控次数间的玉米产量差异不显著(P>0.05),而高种植密度下表现为1次化学调控>对照>2次化学调控。两个品种最高产量均在高种植密度、1次化控条件下获得。【结论】化学调控可明显提高玉米的抗倒伏能力,不同群体条件下宜采取不同的化学调控措施。夏玉米群体较大、长势良好条件下,于拔节初期喷施1次化学调控剂有助于提高玉米产量。
关键词: 夏玉米;化学调控;抗倒性;产量
中图分类号: S513.05 文献标志码: A 文章编号:2095-1191(2019)04-0726-10
Abstract:【Objective】The effect of chemical regulation measurements on lodging resistance and yield of summer maize were studied to clarify the suitable chemical regulation measures for different mechanical harvesting summer maize populations in Dongting Lake area. It provided theoretical and technical support for high yield and high efficiency cultivation of summer maize harvested by machine in Dongting Lake area. 【Method】The field experiments were conducted in Mutangyuan,Taoyuan,Hunan in 2017-2018 to comparatively study none(CK),one time(at beginning of jointing stage)and two times(at early jointing period+big trumpet period) chemical regulation on the lodging resistance and yield of Zhengdan 958 and Xiangnongyu 27 under various plating population with low,medium and high planting densities(60000,75000 and 90000 plant/ha). 【Result】With the increasing of maize planting density,the lodging risk were increased due to higher plant height and ear height,thinner stem and decline of aerial roots number. However,the appropriate chemical control measures could increase the number of aerial roots,the stem diameter and stalk breaking force,reduce the plant height,ear height and ear height coefficient,reduce the gravity center of maize,ultimately improve the lodging resistance reducing the lodging rate and folding rate. Maize yield increased as planting density rose,and the performance in two years was consistent. The effects of chemical control measurements on yield varied in different years, and it could relate to the adverse weather in 2017. In 2017, maize yield dropped as chemical control measurements times enhanced. In 2018,yield in treatment of none chemical regulation was the highest under low density,and that of all treatments had no significant difference under medium density(P>0.05),while that showed the trend of one time chemical regulation treatment>control>two times chemical regulation treatment under high planting density. The highest yield of both varieties were obtained under high planting density and one chemical control. 【Conclusion】Chemical regulation can clearly improve lodging resistance of maize,while optical chemical regulation measurements vary from different planting populations. Spraying chemical regulator for one time at the beginning of jointing can improve the yield of summer maize under the condition of large population and good growth.
Key words: summer maize; chemical regulation; lodging resistance; yield
0 引言
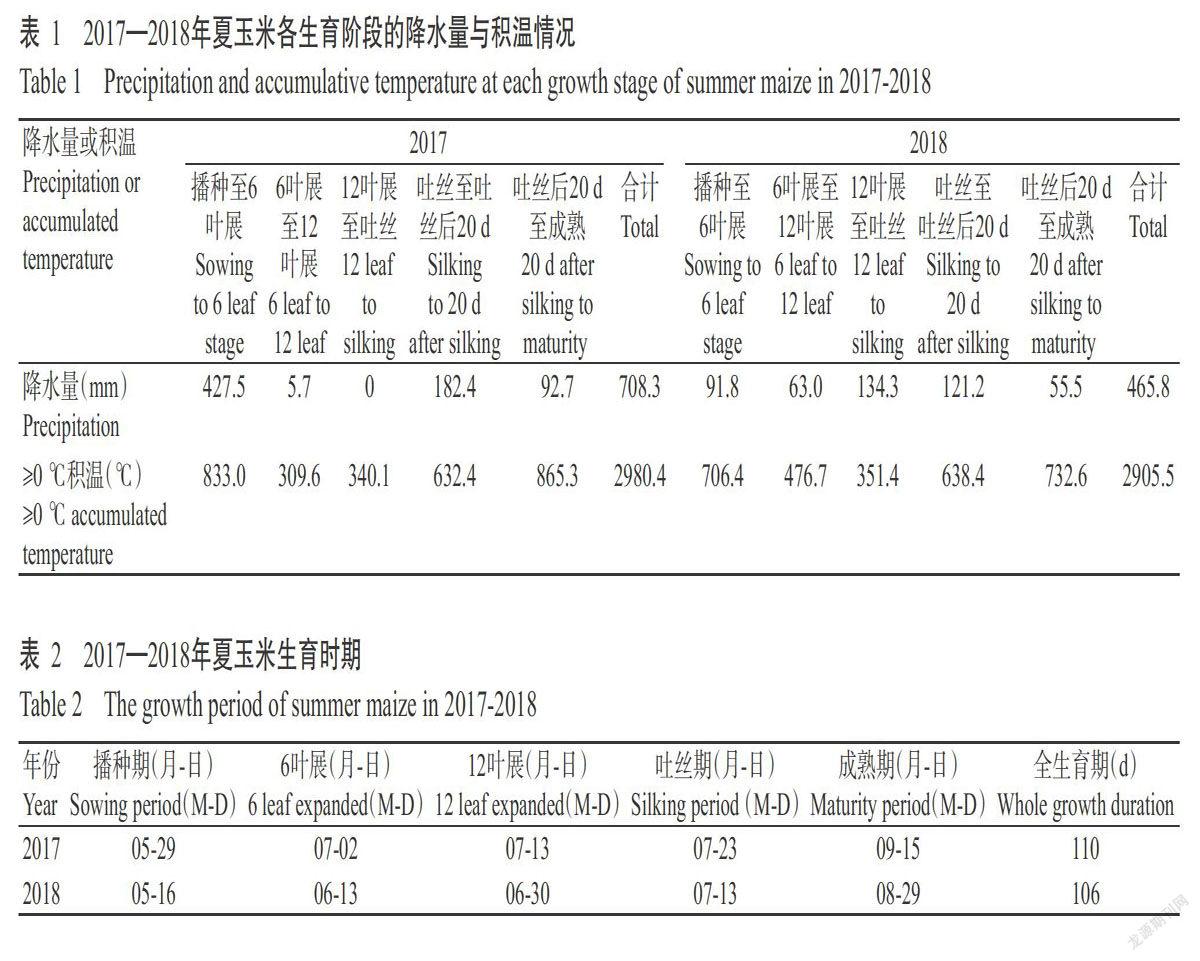
【研究意義】水稻是世界上的主要粮食作物之一。水稻常受各种恶劣环境因素的胁迫,如干旱胁迫、盐胁迫及寒冷胁迫等。盐碱胁迫是抑制作物生产力最主要的环境因素,土壤盐碱化不仅使土壤板结,还会限制农作物的生长发育,降低农作物产量。印度梨形孢(Piriformospora indica)由印度科学家Verma等从沙漠的灌木根上分离获得,其作用与丛枝菌根真菌极为相似,可在许多种作物的根部定殖(Varma et al.,1999;Singh et al.,2000),能促进植物生长(Varma et al.,1999;Waller et al.,2005),加快植物对氮、磷等矿物质的吸收,提高作物对逆境胁迫的忍耐性(Waller et al.,2005)。因此,研究印度梨形孢对水稻幼苗耐盐性的影响及作用机理,对盐碱土地改良及提高水稻产量有重要作用。【前人研究进展】孙超(2010)研究发现,在对印度梨形孢侵染的小白菜进行干早胁迫时,小白菜叶片中干旱相关基因DREB2A、CBLA1、ANAC072、RD29A的表达上调,类囊体膜钙离子相关敏感调节因子CAS mRNA水平和CAS蛋白的表达增加;马杰(2012)研究发现,接种印度梨形孢的烟苗在盐浓度为100和300 mmol/L的培养基上能重新生根发育,而未接种印度梨形孢的烟苗只能在盐浓度为100 mmol/L的培养基上生根发育,在盐浓度300 mmol/L时无法生长;陈佑源等(2013)研究发现,干旱胁迫下接种印度梨形孢的油菜叶片中编码合成脂质转运蛋白的基因575表达上调;惠非琼(2014)研究发现,盐胁迫下,接种和未接种印度梨形孢的烟草叶片中盐胁迫相关蛋白基因PR-1a、PR2、PR3、PR5均上调表达,但在接种印度梨形孢烟草中的表达量显著高于未接种印度梨形孢的烟草;李亮等(2015)研究发现,印度梨形孢能提高植物体内抗氧化物酶活性,增加游离脯氨酸含量并诱导BADH基因的表达;吴金丹等(2015)研究发现,印度梨形孢对水稻地上部生长的促进作用与叶绿素含量、硝酸还原酶活性、根系活力和生长相关调控基因的表达有关,印度梨形孢可能通过提高光合速率、增强水稻对矿质营养的吸收与利用和诱导生长素的分泌,促进水稻地上部的生长;李亮等(2016)研究发现,印度梨形孢可诱导脯氨酸合成酶基因(P5CS)的表达并增强紫花苜蓿的耐盐害能力;韦巧等(2017)研究表明,印度梨形孢能提高生菜对磷元素的吸收,促进生菜生长。【本研究切入点】目前,有关印度梨形孢在水稻耐盐作用中的研究较少,其对水稻耐盐性的影响尚不明确。【拟解决的关键问题】采用不同浓度的盐(NaCl)溶液处理水稻幼苗,再用印度梨形孢侵染水稻根部,20 d后测定水稻幼苗叶片的丙二醛(MDA)、脯氨酸(Pro)、叶绿素、可溶性糖和可溶性蛋白含量及抗氧化酶活性等生理指标,并利用实时荧光定量PCR(qPCR)检测耐盐相关基因的表达情况,探讨印度梨形孢提高水稻幼苗耐盐性的机理。
1 材料与方法
1. 1 试验材料
1. 1. 1 供试菌株与水稻品种 印度梨形孢菌种及水稻品种9311均由长江大学生命科学学院实验室保存提供。
1. 1. 2 印度梨形孢培养 挑取活化的菌丝块在恒温振荡培养箱内28 ℃、180 r/min下培养7 d。加入一定量的无菌水,用灭菌玻璃棒进行反复刮取得到孢子,经匀浆机打匀、超声波处理后,在血球计数板计数。
1. 1. 3 水稻幼苗准备 选择健康成熟的水稻种子,先置于70%乙醇溶液中8 min,以无菌水冲洗3次,再置于0.5%次氯酸钠溶液中10 min,以无菌水冲洗3次,然后置于装有200 mL无菌水的烧杯中,在30 ℃黑暗培养箱中浸种2 d。挑取破胸的种子并将其置于含有湿润双层滤纸的培养皿中,在30 ℃黑暗条件下催芽3 d。
1. 2 试验方法
1. 2. 1 水稻幼苗盐胁迫及印度梨形孢侵染 将发芽的水稻幼苗移入装有300 mL水培营养液的塑料杯(直径95 mm、高122 mm)中进行悬浮培养,待水稻幼苗生长10 d后进行盐胁迫处理,分别加入0、50、100、150 和200 mmol/L的NaCl溶液,72 h后将水稻幼苗根部析出的盐清洗干净后移栽到无菌土上培养,然后加入5×105个/mL的印度梨形孢孢子悬浮液10 mL侵染水稻根部(接种处理),以未侵染为对照(不接种,CK),每个浓度处理5次重复。
1. 2. 2 印度梨形孢定殖检测 印度梨形孢定殖观察采用台盼蓝染色法(Kumar et al.,2011),将印度梨形孢侵染20 d的水稻根部在自来水下冲洗干净,剪取根尖1 cm以上部分,剪成1 cm的小段。在10% KOH中浸泡12 h,取出后用1% HCl中和5 min,再用5%台盼蓝溶液染色1 min,之后用清水冲洗8~10次。在显微镜下观察印度梨形孢侵染情况。
1. 2. 3 相关生理指标测定 随机采集生长20 d的水稻幼苗,放入采样袋,-20 ℃冰箱保存备用。MDA含量采用硫代巴比妥酸比色法测定(邹琦,2007),Pro含量采用酸性茚三酮法测定(陈建勋和王晓峰,2006),叶绿素含量采用丙酮—乙醇提取法测定(赵世杰,2000),过氧化氢酶(CAT)活性采用紫外分光光度法测定(高俊凤,2006),过氧化物酶(POD)活性采用愈创木酚法测定(李合生,2000),超氧化物歧化酶(SOD)活性采用淡蓝四唑法测定(李合生,2000),可溶性糖含量采用蒽酮比色法测定(杨志敏,2015),可溶性蛋白含量采用考马斯亮蓝G-250染色法测定(邹琦,2007)。
1. 2. 4 RNA提取及qPCR检测 印度梨形孢处理水稻20 d后,从每盆水稻中随机取1株进行qPCR检测分析。用TransZol Up提取样品总RNA,用反转录试剂盒将RNA反转录成cDNA,qPCR反应体系10.0 μL:TransStar Tip Green qPCR SuperMix(2×)5.0 μL,上、下游引物(10 µmol/L)各0.2 μL,cDNA模板1.0 μL,ddH2O补足至10.0 μL。扩增程序:95 ℃预变性3 min;95 ℃ 10 s,55 ℃ 20 s,进行40个循环。
1. 3 统计分析
试验数据采用Excel 2007进行数据处理和制图,利用SPSS 13.0進行数据统计分析。
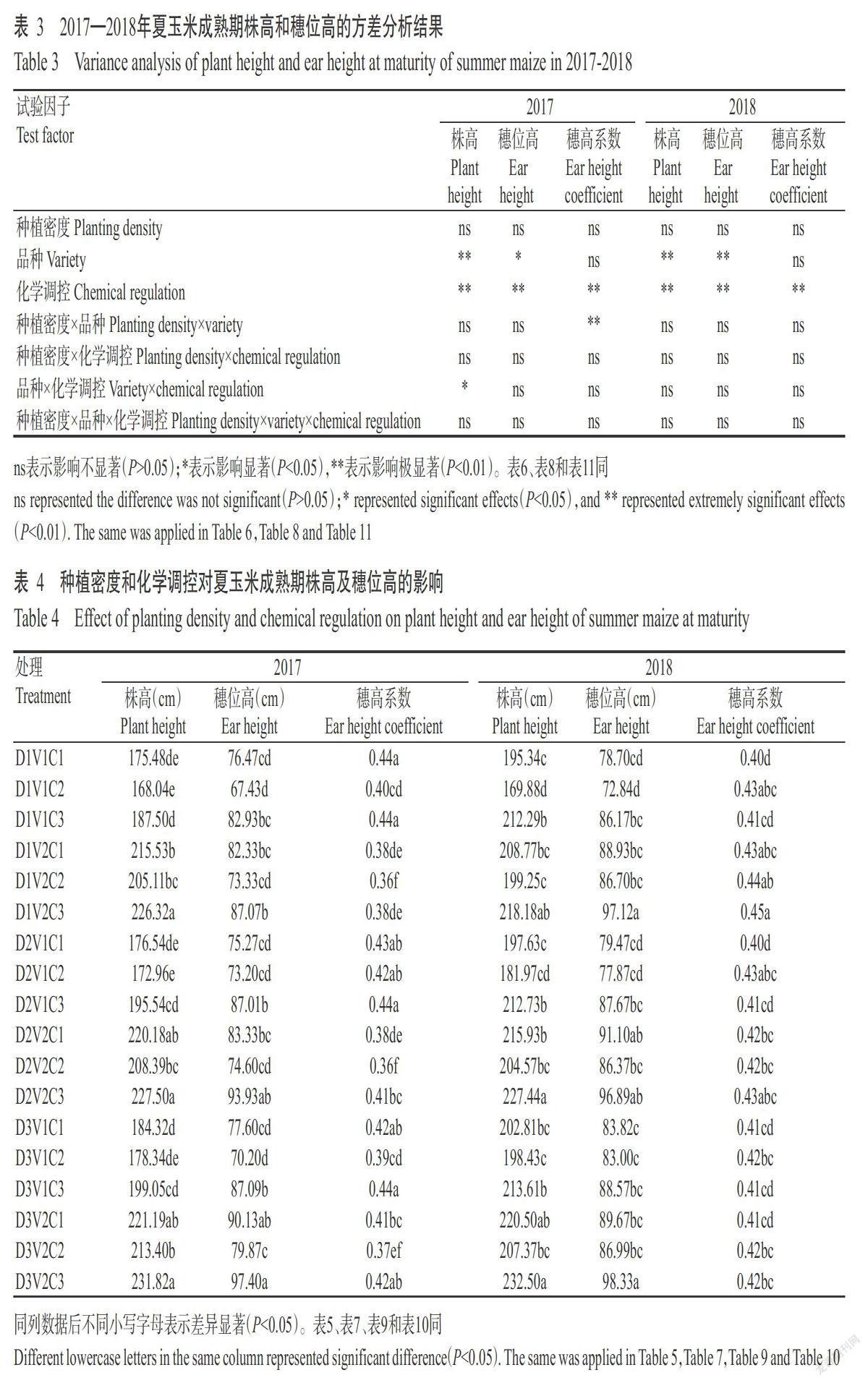
2 结果与分析
2. 1 印度梨形孢的侵染情况
由图1可看出,通过倒置显微镜观察水稻根部印度梨形孢的侵染情况,发现水稻的主根较侧根更易被侵染,即根部越粗,印度梨形孢越容易定殖。
2. 2 印度梨形孢侵染对盐胁迫后水稻幼苗生长及生理指标的影响
2. 2. 1 印度梨形孢侵染后水稻幼苗的生长状况 由图2可看出,盐胁迫浓度为0、50和100 mmol/L时,接种处理水稻幼苗的茎和根均比CK长;盐浓度为150和200 mmol/L时,接种处理水稻幼苗和CK的叶片均呈枯萎状态,但CK比接种处理水稻幼苗的叶片枯萎更严重。
2. 2. 2 印度梨形孢侵染后水稻幼苗MDA含量的变化 由图3可看出,经不同浓度NaCl胁迫后,接种处理水稻幼苗叶片中MDA含量相对较低,而CK水稻幼苗叶片中MDA含量在150和200 mmol/L处理下上升较快,分别是接种处理的1.5和2.8倍,二者差异显著(P<0.05,下同)。表明盐胁迫下接种印度梨形孢后水稻幼苗膜脂过氧化程度低,受盐害程度低,对盐胁迫的耐受能力相对增强。
2. 2. 3 印度梨形孢侵染后水稻幼苗Pro含量的变化 由图4可看出,经盐胁迫处理后,水稻幼苗叶片中Pro含量在0~100 mmol/L处理下变化不明显。与CK相比,接种处理的水稻叶片中Pro含量在150和200 mmol/L处理下较CK明显增加,其中150 mmol/L处理是CK的2.1倍,差异显著。表明印度梨形孢可促进盐胁迫下水稻幼苗叶片中Pro的积累。
2. 2. 4 印度梨形孢侵染后水稻幼苗SOD、POD和CAT活性的变化 由图5可看出,随盐胁迫浓度的增加,水稻幼苗叶片中SOD和POD活性整体上呈增加趋势,CAT活性则呈先增加后减小的变化趋势;与CK相比,接种处理水稻幼苗叶片的SOD、POD和CAT活性相对较高,且均在盐胁迫浓度为150 mmol/L时达最高值。说明接种印度梨形孢可提高盐胁迫后水稻幼苗叶片中的抗氧化酶活性,相对增强其耐盐胁迫的能力。
2. 2. 5 印度梨形孢侵染后水稻幼苗叶绿素含量的变化 由图6可看出,经盐胁迫后,水稻幼苗叶片的叶绿素含量均随盐胁迫浓度的增加持续下降。与CK相比,接种印度梨形孢各处理水稻幼苗叶片的叶绿素含量均相对较高,但差异未达显著水平(P>0.05,下同)。
2. 2. 6 印度梨形孢侵染后水稻幼苗可溶性糖和可溶性蛋白含量的变化 由图7可看出,随盐胁迫浓度的增加,水稻幼苗叶片的可溶性糖含量整体上呈增加趋势,可溶性蛋白含量则先增加后减少。接种处理的可溶性糖和可溶性蛋白含量均高于CK,其中200 mmol/L处理的可溶性糖含量与CK差异显著,是CK的1.8倍;接种处理不同盐胁迫浓度的可溶性蛋白含量与CK均未达显著差异水平。
2. 3 耐盐相关基因的表达分析结果
由图8可看出,经盐胁迫后,接种处理水稻幼苗叶片中耐盐相关基因SNAC1、OsNAC6、OsBZIP23和OsDREB2A的表达量均高于CK,各基因表达量均随盐胁迫浓度的增加呈先升高后降低的变化趋势,均在100 mmol/L处理下达最大值,其中接种处理水稻幼苗的SNAC1和OsNAC6基因表达量分别是CK的1.5和1.1倍,差异达显著水平。说明盐胁迫下,接种印度梨形孢能诱导水稻叶片中耐盐相关基因的表达。
3 讨论
当植物处于逆境胁迫时,体内活性氧的产生与清除平衡遭到破坏,活性氧大量积累引起膜脂过氧化,MDA含量增加。本研究结果表明,在进行不同程度的盐胁迫后,接种印度梨形孢水稻幼苗叶片中的MDA含量低于未接种印度梨形孢的水稻幼苗,与惠非琼(2014)对印度梨形孢提高烟草耐盐性的研究结果相似,未接种印度梨形孢的水稻幼苗叶片中MDA的含量呈上升趋势,特别是高盐胁迫下,MDA含量上升很快,说明水稻幼苗细胞抗氧化体系遭到破坏,活性氧含量增加,膜脂过氧化程度上升,细胞膜系统遭到破坏;而接种印度梨形孢的水稻幼苗叶片中MDA含量上升较慢,说明印度梨形孢可降低活性氧含量,减轻膜脂过氧化程度,进而提高水稻幼苗的抗氧化能力。
盐胁迫促使植物产生活性氧(Lee et al.,2001),如超氧化物自由基、羟基和过氧化氢等,可对植物造成氧化胁迫(Yamauchi et al.,2002)。植物自身可产生保护机制,如可清除活性氧的抗氧化酶体系,包括CAT、POD、SOD和谷胱甘肽还原酶等。当植物处于逆境条件下,抗氧化系统清除活性氧能力下降,造成活性氧大量积累对细胞造成伤害。本研究结果表明,水稻幼苗在受到盐胁迫时,SOD、POD和CAT活性随盐胁迫浓度的增加呈先上升后下降的变化趋势,接种印度梨形孢水稻幼苗叶片的SOD、POD和CAT活性比未接种印度梨形孢的水稻上升迅速且积累量高,表明印度梨形孢可有效激活水稻幼苗叶片中的活性氧清除系统,降低活性氧含量,减轻膜脂过氧化。
在正常条件下,植物体内游离脯氨酸含量很低,其积累指数与植物的抗逆性有关,是盐胁迫下最有效的渗透调节物质(Ashraf and Foodlad,2007;Flowers and Colmer,2008;Szabados and Savouré,2010;Boscaiu et al.,2013)。本研究中,经不同程度的盐胁迫后,接种印度梨形孢的水稻幼苗叶片中Pro积累量明显高于未接种印度梨形孢的水稻幼苗,说明印度梨形孢可能是通过增加细胞中Pro的积累来维持细胞膜完整性,从而提高水稻幼苗的耐盐性,与陈佑源等(2013)对印度梨形孢对油菜抗旱性影响的研究结果相似。
叶片叶绿素含量是植物生长时对环境较敏感的生理指标。本研究结果表明,接种和未接种印度梨形孢水稻幼苗叶片的叶绿素含量均随盐胁迫浓度的增加呈下降趋势。然而,在相同盐浓度处理下,接种印度梨形孢水稻幼苗的叶绿素含量高于未接种印度梨形孢的水稻幼苗,说明接种印度梨形孢可能降低了叶绿素的分解或促进了叶绿素的合成,从而降低水稻幼苗对环境的敏感性。
在盐胁迫下,植物为降低由胁迫造成的生理代谢不平衡,细胞会大量积累一些小分子有机化合物来维持其正常的生理功能。可溶性糖是盐胁迫诱导的小分子溶质之一,参与细胞的渗透调节;可溶性蛋白也是重要的渗透调节物质和营养物质。本研究结果表明,可溶性糖含量在高盐条件下急剧上升,此时接种印度梨形孢的水稻幼苗中可溶性糖含量高于未接种印度梨形孢的水稻幼苗,说明接种印度梨形孢能减缓水稻幼苗因胁迫造成的生理代谢不平衡,使细胞积累可溶性糖来参与渗透调节,以维持细胞的正常代谢功能。同时,接种印度梨形孢水稻幼苗各处理的可溶性蛋白含量均高于未接种印度梨形孢的水稻幼苗,说明接种印度梨形孢后可使水稻幼苗叶片的可溶性蛋白含量得到积累,进而提高细胞的保水功能。
水稻OsNAC6基因能在高盐胁迫下诱导表达,且OsNAC6基因在水稻受到伤害的情况下诱导能力非常强(Xie et al.,2000)。惠非琼(2014)研究表明,印度梨形孢能诱导盐胁迫下烟草中耐盐相关基因OPBP1、PR-1a、PR2、PR3和PR5大量表达。本研究发现,接种印度梨形孢的水稻叶片中SNAC1、OsNAC6、OsBZIP23和OsDREB2A基因的表达量高于未接种印度梨形孢的水稻,推测印度梨形孢提高水稻耐盐性是通过诱导某种逆境基因的协同表达而实现,但具体原因尚有待进一步研究。
4 结论
接种印度梨形孢可降低盐胁迫后水稻幼苗叶片的MDA含量,提高抗氧化酶活性、Pro、叶绿素、可溶性糖和可溶性蛋白含量,同时促使水稻叶片中耐盐胁迫相关基因的表达量上调,从而增强水稻幼苗对盐胁迫的耐受性。印度梨形孢作为生物菌肥在农业生产中有潜在的利用价值。
参考文献:
陈建勋,王晓峰. 2006. 植物生理实验指导[M]. 第2版. 广州:华南理工大学出版社. [Chen J X,Wang X F. 2006. Plant Physiological Experiment Guide[M]. The 2nd Edition. Guangzhou:South China University of Technology Press.]
陈佑源,楼兵干,高其康,林福呈. 2013. 印度梨形孢诱导油菜抗旱性机理的初步研究[J]. 农业生物技术学报,21(3):272-281. [Chen Y Y,Lou B G,Gao Q K,Lin F C. 2013. Preliminary study on mechanisms of drought resistance in Brassica napus L. conferred by Piriformospora indica[J]. Journal of Agricultural Biotechnology,21(3):272-281.]
高俊凤. 2006. 植物生理学实验指导[M]. 北京:高等教育出版社. [Gao J F. 2006. Plant Physiology Experiment Instruction[M]. Beijing:Higher Education Press.]
惠非琼. 2014. 印度梨形孢对烟草耐盐、抗旱及重金属作用及机理的初步研究[D]. 杭州:浙江大学. [Hui F Q. 2014. Preliminary study on the effect and mechanism of Piriformospora indica on salt tolerance,drought resistance and heavy metals in tobacco[D]. Hangzhou:Zhejiang University.]
李合生. 2000. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社. [Li H S. 2000. Principle and Technology of Plant Physiological and Biochemical Experiments[M]. Beijing:Higher Education Press.]
李亮,武洪庆,马朝阳,任亮,王璐欣,齐树亭. 2015. 印度梨形孢促进蒺藜苜蓿生长及其提高耐盐性研究[J]. 微生物学通报,42(8):1492-1500. [Li L,Wu H Q,Ma C Y,Ren L,Wang L X,Qi S T. 2015. Growth promotion and salt tolerance induction by Piriformospora indica colonization in Medicago truncatul[J]. Microbiology China,42(8):1492-1500.]
李亮,陈希,王奋,王晓阳,齐树亭. 2016. 印度梨形孢通过激活抗氧化物酶活性及诱导P5CS基因表达提高紫花苜蓿耐盐性[J]. 河北工业大学学报,45(4):29-36. [Li L,Chen X,Wang F,Wang X Y,Qi S T. 2016. Piriformospora indica confers salt tolerance in Medicago sativa by stimulating antioxidant enzymes activities and the expression of P5CS genes[J]. Journal of Hebei University of Technology,45(4):29-36.]
馬杰. 2012. 印度梨形孢诱导烟草促生、抗病、抗逆作用及其机理的初步研究[D]. 杭州:浙江大学. [Ma J. 2012. Preliminary study on Piriformospora indica induced tobacco growth,disease resistance,stress resistance and its mechanism[D]. Hangzhou:Zhejiang University.]
孙超. 2010. 印度梨形孢诱导小白菜抗病、促生、抗逆的作用及其机理的初步研究[D]. 杭州:浙江大学. [Sun C. 2010. Preliminary study on the effect of Piriformospora indica on disease resistance,growth promotion and stress resistance of Chinese cabbage[D]. Hangzhou:Zhejiang University.]
吴金丹,陈乾,刘晓曦,林福呈,高其康,楼兵干. 2015. 印度梨形孢对水稻的促生作用及其机理的初探[J]. 中国水稻科学,29(2):200-207. [Wu J D,Chen Q,Liu X X,Lin F C,Gao Q K,Lou B G. 2015. Preliminary study on me-chanisms of growth promotion in rice colonized by Piriformospora indica[J]. Chinese Journal of Rice Science,29(2):200-207.]
韦巧,武美燕,张文英. 2017. 不同磷水平下印度梨形孢对生菜生长及磷素吸收利用的影响[J]. 河南农业科学,46(1):100-104. [Wei Q,Wu M Y,Zhang W Y. 2017. E-ffects of Piriformospora indica on growth and phosphorus absoption of lettuce under different phosphorus levels[J]. Journal of Henan Agricultural Sciences,46(1):100-104.]
杨志敏. 2015. 生物化学实验[M]. 北京:高等教育出版社. [Yang Z M. 2015. Biochemical Experiment[M]. Beijing:Higher Education Press.]
赵世杰. 2000. 植物生理学实验指导[M]. 北京:中国农业科学技术出版社. [Zhao S J. 2000. Guidance of Plant Phy-siology Experiments[M]. Beijing:China Agricultural Scien-ce and Technology Press.]
邹琦. 2007. 植物生理学实验指导[M]. 北京:中国农业出版社. [Zou Q. 2007. Plant Physiology Experiment Guide[M]. Beijing:China Agriculture Press.]
Ashraf M,Foodlad M R. 2007. Roles of glycine betain and proline in improving plant abiotic stress resistance[J]. Environmental and Experimental Botany,59:206-216.
Boscaiu M,Bautista I,Lidón A,Llinares J,Lull C,Donat P,Mayoral O,Vicente O. 2013. Environmental-dependent pro-line accumulation in plants living on gypsum soils[J]. Acta Physiologiae Plantarum,35(7):2193-2204.
Flowers T J,Colmer T D. 2008. Salinity tolerance in halophytes[J]. The New phytologist,179(4):945-963.
Kumar V,Sahai V,Bisaria V S. 2011. High-density spore production of Piriformospora indica,a plant growth-promo-ting endophyte,by optimization of nutritional and cultural parameters[J]. Bioresource Technology,102(3):3169-3175.
Lee D H,Kim Y S,Lee C B. 2001. The inductive responses of the antioxidant enzymes by salt stress in the rice(Oryzasativa L.)[J]. Journal of Plant Physiology,158(6):737-745.
Singh A,Sharma J,Rexer K H,Varma A. 2000. Plant productivity determinants beyond minerals,water and light:Piriformospora indica,a revolutionary plant growth promo-ting fungus[J]. Current Science,79(11):1548-1554.
Szabados L,Savouré A. 2010. Proline:A multifunctional amino acid[J]. Trends in Plant Science,15(2):89-97.
Varma A,Verma S,Sudha,Sahay N,Butehorn B,Franken P. 1999. Piriformospora indica,a cultivable plant-growth-promoting root endophyte[J]. Applied & Environmental Microbiology,65(6):2741-2744.
Waller F,Achatz B,Baltruschat H,Fodor J,Becker K,Fischer M,Heier T,Huckelhoven R,Neumann C,Wettstein D,Franken P,Kogel K H. 2005. The endophytic fungus Piri-fomospora indica reprograms barley to salt-stress toleran-ce,disease resistance,and higher yield[J]. Proceedings of the National Academy of Sciences of the United States of America,102(38):13386-13391.
Xie Q,Frugis G,Colgan D,Chua N H. 2000. Arabidopsis NAC1 transduces auxin signal downstream of TIR1 to promote lateral root development[J]. Genes & Development,14(23):3024-3036.
Yamauchi T,Kamon J,Minokoshi Y,Ito Y, Waki H,Uchida S,Yamashita S,Noda M,Kita S,Ueki K,Eto K,Akanuma Y,Froguel P, Foufelle F, Ferre P,Carling D,Kimura S,Nagai R,Kahn B B,Kadowaki T. 2002. Adiponectin stimulates glucose utilization and fatty-acid oxidation by activating AMP-activated protein kinase[J]. Nature Medicine,8(11):1288-1295.
(責任编辑 王 晖)
