乳酸菌复合制剂对盐碱地改良及土壤微生物群落的影响
2019-09-10侯景清王旭陈玉海刘逸群商庆祥张文羿孟和毕力格
侯景清 王旭 陈玉海 刘逸群 商庆祥 张文羿 孟和毕力格



摘要:【目的】探討乳酸菌复合制剂对盐碱地改良、植物生长及土壤微生物群落变化的影响,为利用耐盐碱的乳酸菌研发新型微生物制剂及其大面积应用提供参考依据。【方法】以西红柿为供试作物进行田间试验,设菌剂组(含乳酸菌的菌剂)和对照组(不含乳酸菌的菌剂),两个处理菌剂用量均为15 L/ha,加水稀释10倍,在西红柿种植前1 d喷施于土壤中,并在种植西红柿后每30 d喷施一次;西红柿成熟期测定其农艺性状;种植3个月后采集0~30 cm土样测定土壤的物理性质、养分含量及酸碱度,并对土壤样品进行宏基因组测序,分析土壤微生物的多样性及功能基因的变化。【结果】与对照组相比,菌剂组的土壤pH显著下降0.42(P<0.05,下同),铵态氮、硝态氮及有效磷的含量显著提高,但土壤物理性质无显著变化(P>0.05);供试西红柿的各项农艺性状均有所提高。土壤微生物多样性分析结果表明,在门分类水平上,共检测分类122个菌门,其中变形菌门(Proteobacteria)占有明显优势,相对丰度在50.00%以上,其次为拟杆菌门(Bacteroidetes)和绿弯菌门(Chloroflexi),菌剂组中厚壁菌门(Firmicutes)和放线菌门(Actinobacteria)的相对丰度显著增加;在属分类水平上,菌剂组中乳杆菌属(Lactobacillus)的相对丰度(4.25%)较对照组(0.01%)明显增加。功能基因分析结果表明,菌剂组和对照组的碳水化合物活性酶(CAZy)中,糖苷水解酶(Glycoside hydrolases)的功能基因所占比例最高,分别为35.12%和34.16%,菌剂组6种碳水化合物活性酶基因序列数目均高于对照组;KEGG功能注释结果显示,菌剂组的碳水化合物代谢、氨基酸代谢、能量代谢及辅因子与维他命代谢的基因序列数目均高于对照组;此外,菌剂组土壤中毒素的基因序列数目较对照组明显降低。【结论】乳酸菌复合制剂能有效降低盐碱地的pH并增加养分含量,同时可增加土壤中的放线菌数量,降低病原微生物数量,对盐碱地的改良具有良好效果。
关键词: 盐碱地;乳酸菌;微生物菌剂;微生物多样性;宏基因组学
中图分类号: S154.3 文献标志码: A 文章编号:2095-1191(2019)04-0710-09
Abstract:【Objective】The effects of lactic acid bacteria compound preparation on the improvement of saline-alkali soil,crop growth and soil microbial community change were explore. It provide theoretical basis for the development of new microbial preparations and its large-area application by using salt-tolerant lactic acid bacteria. 【Method】Field experiment was carried out,and the test crops were tomatoes. The tomatoes were divided into treatment group(bacterial agent containing lactic acid bacteria) and control group(bacterial agent without lactic acid bacteria). The dosage of the two treatment agents was 15 L/ha, diluted 10 times with water, sprayed on the soil 1 d before the planting, and sprayed once every 30 d after planting tomatoes. The agronomic traits were determined at the maturity stage of the tomatoes. After three months of planting, 0-30 cm soil samples were collected to determine the physical properties, nutrient content and pH of the soil, and the soil samples were subjected to metagenomic sequencing to analyze soil microbial diversity and functional gene changes. 【Result】Compared to control, in the treatment group,the pH value of the soil decreased significantly by 0.42(P<0.05, the same below),and the contents of available phosphorus,ammonium nitrogen and nitrate nitrogen were all increased,and the physical properties of the soil were not significantly changed(P>0.05). The agronomic traits of the tested tomatoes have improved. The soil microbial diversity analysis indicated that, at phylum level,there were 122 bacteria phylum detected and classified,among these,Proteobacteria had a clear superiority with 50.00% relative abundance,and followed by Bacteroidetes and and Chloroflexi. Significant increase in relative abundance of Firmicutes and Actinobacteria in treatment group was observed. At genus level,the relative abundance of Lactobacillus(4.25%) in the treatment group increased significantly compared to control(0.01%). The functional gene analysis showed that, as for carbohydrates active enzyme(CAZy) in treatment group and control group,the proportion of functional genes of glycoside hydrolases were the highest, and were 35.12% and 34.16% in the two groups respectively. The number of six carbohydrate active enzyme gene sequences in the treatment group was higher than the control group. In the KEGG functional annotation results,the number of gene sequences for carbohydrate metabolism,amino acid metabolism,energy metabolism,metabolism of cofactors and vitamins in the treatment group was higher than the control group. In addition,the number of gene sequences of toxin in the soil was significantly reduced in treatment group. 【Conclusion】The lactic acid bacteria compound preparation can effectively reduce the pH value of the saline-alkali soil and increase the nutrient content. At the same time,it can increase the number of actinomycetes in the soil,reduce the number of pathogenic microorganisms. It has a good effect on the improvement of saline-alkali soil.
Key words: saline-alkali soil; lactic acid bacteria; microbial agents; microbial diversity; metagenomics
0 引言
【研究意义】土壤盐碱化作为我国较严峻的农业问题已受到广泛关注,我国盐碱地面积约9.91×107 ha,约占全国土地面积的十分之一(朱建峰等,2018)。大面积的盐碱化土壤不仅严重浪费土地资源,还会带来水土流失、土地荒漠化等一系列环境问题。长期以来,盐碱地的改良主要通过物理、水利及化学改良剂等传统改良方法(马晨等,2010;吕建东等,2018)。随着人们对生态平衡和可持续发展的重视,生物改良措施成为盐碱地改良的重点与热点,其中微生物复合制剂在盐碱地改良中发挥较大作用。微生物复合制剂可有效降低盐碱地的pH及含盐量,提高土壤有机质和养分含量,还可提高农作物的成活率与产量(Bossuyt et al.,2001;Singh and Reddy,2011)。乳酸菌复合制剂作为一种新型微生物制剂,在提高土壤肥力、促进植物生长及预防土传病害等方面具有巨大潜力(高鹏飞等,2014)。因此,探讨乳酸菌复合制剂对盐碱地改良与土壤微生物群落的影响,对农业生产中缓解土壤盐碱化、减少使用化肥、提高农产品质量及农业的可持续发展均具有重要意义。【前人研究进展】目前,土壤中施用的微生物复合制剂菌种主要以放线菌、固氮菌、芽孢杆菌、酵母菌、乳酸菌及光合菌为主,诸多研究表明乳酸菌在农业生产中具有良好效果。Chen等(2005)从果树土壤中分离鉴定出植物乳杆菌、乳酸乳球菌乳酸亚种、副干酪乳杆菌及短乳杆菌,并证明其对土壤致病菌的防治有积极作用。Bhakta等(2012)发现乳酸菌对土壤中的重金属(铅、镉)具有良好的吸附作用。Gajbhiy等(2012)从石榴中分离出200株乳酸菌,发现其中有142株对禾谷镰刀菌有较好的抑制特性。Wang等(2012)研究发现,植物乳杆菌IMAU10014能产生苯乳酸等并抑制炭疽病菌、桔青霉菌、尖孢镰刀菌等常见的果蔬腐败菌与病害菌。Zlotnikov等(2013)从不同地区不同季节的莳萝叶面分离出4株乳酸菌,并证明这些乳酸菌可有效溶解土壤中的磷类矿物质。周游等(2017a,2017b)研究发现,乳酸菌制剂可有效增加草莓的株高、茎粗及叶面积,并显著改善草莓品质;对茶树的生长及茶叶品质也具有良好的促进作用。黄诗宸等(2018)研究发现,使用植物乳杆菌产生的胞外多糖浸种可显著提高水稻幼苗的生长特性及叶绿素含量。【本研究切入点】乳酸菌是一种非致病性、安全级的微生物,农业生产中乳酸菌复合制剂主要用于降解重金属和农药残留,以及抑制致病菌和腐败菌的增殖,但目前关于乳酸菌复合制剂在改良盐碱地方面的相关研究相对较少。【拟解决的关键问题】将乳酸菌复合制剂喷施于蔬菜叶面及根部土壤,结合土壤理化指标及土壤微生物宏基因组学数据,分析乳酸菌复合制剂对土壤成分及土壤微生物群落结构变化的影响,以期为抗盐碱乳酸菌制剂在生产中的应用提供参考依据。
1 材料与方法
1. 1 试验材料
试验菌剂组使用的乳酸菌复合制剂为益生源生物科技公司(山东青岛)生产的农丰园微生物菌剂,主要成分为乳酸菌(干酪乳杆菌Zhang、植物乳杆菌P-8和植物乳杆菌PC30301)及其代谢产物(乳酸、甲酸、乙酸、胞外多糖及细菌素等),活菌数≥2×108 CFU/mL,同时含有少量的铁、锰、锌、铜及黄腐酸。对照组使用不含乳酸菌的菌剂,其中仅有少量的铁、锰、锌、铜及黄腐酸,无乳酸菌及其代谢产物,由益生源生物科技公司(山东青岛)提供。供试作物为西红柿。
1. 2 试验地概况
试验地位于内蒙古呼和浩特市土默特左旗海流图试验种植基地(东经111°22′30″、北纬40°41′30″)。年降水量200~400 mm,年平均气温7~8 ℃,土壤盐分类型以硫酸钠、氯化钠和碳酸钠为主,土壤质地为黏土,土壤的三相比(气相、固相和液相)分别为56.85%、29.45%和13.70%,土壤pH 9.25,有效磷45.3 mg/kg,铵态氮1.4 mg/kg,硝态氮23.4 mg/kg,属于盐化碱土壤。
1. 3 试验方法
试验设2个处理:菌剂组,含乳酸菌的菌劑15 L/ha;对照组,不含乳酸菌的菌剂15 L/ha。两处理均对水10倍稀释后喷施。每处理重复6次。小区为长方形,长宽比约3∶1,面积60 m2。随机区组排列,共12个小区。
乳酸菌复合制剂在西红柿种植前1 d喷施于土壤中,并在种植西红柿后每30 d喷施一次(根据产品说明),喷施于西红柿根部土壤与叶面。土壤采样时间为西红柿种植3个月后,采用S形布点采取植株根部土壤,用土钻采集0~30 cm的土样,每小区取5个点的土样,过筛除去根系及杂物。约500 g的土样置于灭菌袋,4 ℃冰箱保存,用于土壤三相比测定及土壤DNA提取;300 g土样进行风干,用于土壤养分与酸碱度测定。
1. 4 测定项目及方法
1. 4. 1 土壤理化性质测定 土壤pH采用5∶1的水土比悬液,使用pH计测定;土壤三相比和土壤总孔隙度使用土壤三相仪测定;土壤养分(铵态氮、硝态氮和有效磷)使用连续流动分析仪测定。
1. 4. 2 西红柿农艺性状测定 在西红柿成熟后测量各小区西红柿的农艺性状,包括株高、茎粗、叶面积、单株果实数及单株产量。株高和茎粗分别用卷尺和游标卡尺测量,其中,株高为地面到顶端心叶的植株高度,茎粗为距离地面5 cm处主茎的直径;叶面积为每株西红柿完全展开的未枯黄叶片面积。
1. 4. 3 宏基因组测序 使用试剂盒(PowerSoil® DNA Isolation Kit)提取土壤宏基因组DNA,在提取过程中将相同处理的土样合并为一个DNA样品,利用1%琼脂糖凝胶电泳检测提取的基因组DNA。合格的DNA样品进行测序,测序平台为Illumina Hiseq。
数据分析从下机原始序列开始,首先对原始序列进行拆分、质量剪切及去除污染等优化处理,然后使用优化序列进行拼装组装和基因预测。测序数据上传至NCBI,核苷酸序列登录号为PRJANA494987。
1. 4. 4 土壤微生物多样性分析 应用QIIME (V1.7.0)平台对高质量序列进行生物信息学分析。首先采用PyNAST将序列校准排齐后,在97%相似性下进行Uclust归类并划分分类操作单元(Operational taxonomic units,OUT);从各OTU中选取1条代表性序列,使用RDP(Ribosomal database project)、Greengenes(V13.8)和Silva(Livingtree project)数据库对其进行序列同源性比对,整合3个数据的比对结果确定各OTU的分类学地位;根据OTU列表中的各样品物种丰度情况,应用QIIME中的Summarize_taxa.py命令计算各样品在门、纲、目、科、属、种水平的物种组成,根据研究内容需求只绘制门与属水平上的分类柱状图。
1. 4. 5 宏基因组功能预测 对得到的基因进行功能上的注释及分类,所用到的数据库包括KEGG、CAZy和VFDB,并对比对结果绘制功能基因的分类柱状图。
1. 5 统计分析
使用Excel 2016进行数据计算,利用Origin 2018进行方差分析及制图。
2 结果与分析
2. 1 乳酸菌复合制剂对土壤理化性质的影响
2. 1. 1 乳酸菌复合制剂对土壤结构的影响 如图1所示,菌剂组土壤的气、固、液三相比分别为57.74%、28.90%和13.36%,对照组土壤的气、固、液三相比分别为58.46%、29.71%和11.83%,二者的土壤总孔隙度分别为71.10%和70.28%,各指标在两处理间均未达显著差异水平(P>0.05,下同)。
2. 1. 2 乳酸菌复合制剂对土壤酸碱度的影响 如图2所示,菌剂组土壤pH为8.48,较对照组土壤pH下降0.42,二者差异显著(P<0.05,下同)。说明施用乳酸菌复合制剂能明显缓解土壤的盐碱化程度。
2. 1. 3 乳酸菌复合制剂对土壤有效氮、磷含量的影响 由表1可知,施用乳酸菌剂后,土壤硝态氮、铵态氮及有效磷含量较对照组显著提高,尤其是有效磷含量较对照组增加187.78%。
2. 2 乳酸菌复合制剂对植物生长的影响
待西红柿植株成熟后,分别测量两组西红柿植株的农艺性状。由表2可知,菌剂组西红柿成熟期的株高、茎粗、叶面积及单株产量均较对照组显著增加,增幅分别为14.6%、22.2%、27.3%和25.4%;单株果实数也较对照组有所增加,但差异未达显著水平。
2. 3 土壤微生物群落多样性分析结果
2. 3. 1 门分类水平分析 由图3可看出,在门分类水平上,共检测分类122个菌门,其中相对丰度最高的是变形菌门(Proteobacteria),在50.00%以上,表明变形菌门细菌为优势菌群,在各样本微生物群落结构中占主导地位;其次是拟杆菌门(Bacteroidetes),相对丰度在12.00%~15.00%;绿弯菌门(Chloroflexi)的相对丰度在5.00%~7.00%;其余如酸杆菌门(Aci-dobacteria)、芽单胞菌(Gemmatimonadetes)、浮霉菌门(Planctomycetes)的相对丰度均小于5.00%。菌剂组中厚壁菌门(Firmicutes)和放线菌门(Actinobacteria)的相对丰度明显增加,分别为6.12%和6.59%,而对照组厚壁菌门和放线菌门的相对丰度仅为1.59%和3.45%。
2. 3. 2 属分类水平分析 从图4可看出,不同土壤样品中相对丰度占60.00%以上的均为未知菌属;菌剂组中乳杆菌属(Lactobacillus)的相对丰度达4.25%,而对照组中乳杆菌属的相对丰度较低,仅为0.01%,说明施用乳酸菌复合制剂可增加土壤中乳杆菌属的相对丰度;藤黄单细胞菌属(Luteimonas)的相对丰度也发生变化,对照组为1.68%,而菌剂组为0.84%,降低了50.00%;对照组交替赤杆菌属(Altererythrobacter)的相对丰度为2.56%,菌剂组较对照组有所下降,为1.54%;菌剂组和对照组黏细菌中堆囊菌属(Sorangium)的相對丰度均在3.00%~5.00%,其余菌属的相对丰度无明显变化。
2. 4 功能基因分析结果
2. 4. 1 碳水化合物活性酶(CAZy)分析 将宏基因组序列比对结果输入到CAZy数据库,共获得6种碳水化合物活性酶基因类群(图5),分别为糖苷水解酶(Glycoside hydrolases)、糖基转移酶(Glycosyl transferases)、多糖裂解酶(Polysaccharide lyases)、碳水化合物酯酶(Carbohydrate esterases)、辅助酶(Auxiliary activities)和碳水化合物结合模块(Carbohydrate-binding modules)。其中,糖苷水解酶的功能基因序列所占比例最高,菌剂组与对照组分别为35.12%和34.16%;其次是糖基转移酶和碳水化合物结合模块,菌剂组与对照组分别为25.98%、19.69%和22.95%、21.28%;菌剂组中6种碳水化合物活性酶的基因序列数目均高于对照组。
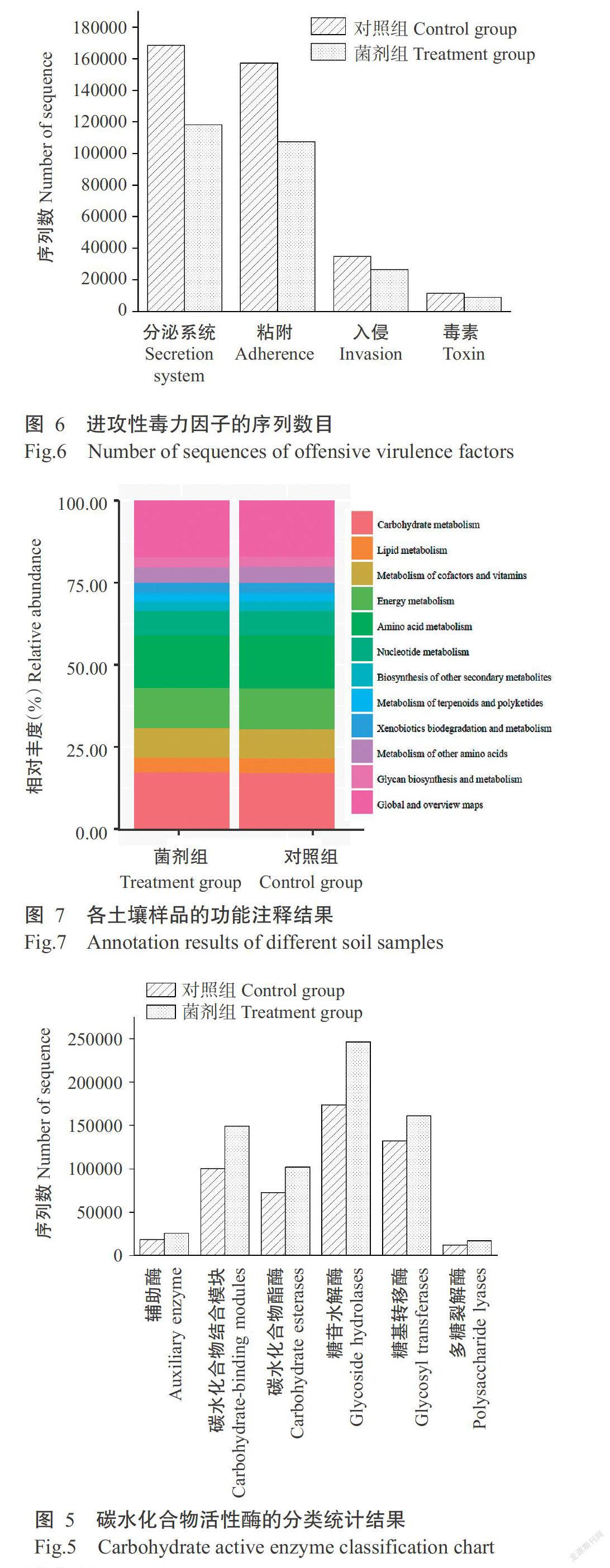
2. 4. 2 VFDB毒力因子分析 为确定乳酸菌复合制剂对病原微生物的影响,通过VFDB数据库比对得到4种进攻性毒力因子(图6),分别为分泌系统(Secretion system)、粘附(Adherence)、入侵(Invasion)和毒素(Toxin)。其中,分泌系统的基因序列所占比例最高,菌剂组和对照组分别为45.32%和45.28%;其次是粘附,菌剂组和对照组分别为41.17%和42.28%。菌剂组所预测到毒力因子的基因序列数均少于对照组,对照组中的毒素基因序列数为11574,而菌剂组的毒素基因序列数为8820,即土壤的毒力因子有所降低。
2. 4. 3 KEGG功能分析 使用BLASTP将非冗余基因集序列与KEGG的基因数据库进行比对,根据比对结果使用KOBAS 2.0进行功能注释,预测到12种代谢功能的基因序列(图7)。其中,碳水化合物代谢(Carbohydrate metabolism)的功能基因序列占比最高,菌剂组和对照组分别为17.31%和17.12%;其次是氨基酸代谢(Amino acid metabolism)、能量代谢(Energy metabolism)和辅因子与维他命代谢(Metabolism of cofactors and vitamins)。对4种基因序列占比最高的代谢功能基因绘制柱状图,如图8所示,可发现菌剂组中4种代谢功能的基因序列数目均较对照组有明显增加。
3 讨论
3. 1 乳酸菌复合制剂对土壤理化性质及植物生长的影响
土壤三相比和总孔隙度作为决定土壤结构的重要指标,在保水保肥、提高土壤养分方面具有重要意义(Vogel and Roth,2001)。研究发现,可通过施用活性炭、秸秆还田及深耕等理化方法改善土壤物理性质,但微生物改良措施对土壤的物理性质无显著影响(丁奠元等,2018;张聪等,2018)。本研究结果同样表明,施用乳酸菌复合制剂后,土壤的三相比和总孔隙度等物理性质与对照组无显著差异;但与对照组相比,菌剂组土壤pH显著降低,与王维华(2018)的研究结果一致,表明乳酸菌可通过产生有机酸等代谢产物来降低土壤pH,进而改善土壤盐碱化的情况。
铵态氮和硝态氮均是可直接被植物吸收利用的速效性氮素。本研究结果表明,施用乳酸菌剂后,土壤中两种速效性氮源均显著增加,可能是菌剂提高了土壤中脲酶的活性(艾童非等,2016),脲酶将土壤中的尿素分解为CO2、H2O和NH[+4],NH[+4]通过细菌作用转化为NO[-3]并释放出H+,在降低土壤pH的同时可提供氮源。土壤中的有效磷是一种可被植物吸收利用的磷成分,包括所有水溶性磷、部分吸附态磷及有机态磷,有的土壤中还包括某些沉淀态磷(Selles et al.,2011)。本研究结果表明,乳酸菌复合制剂具有良好的解磷效果,可使土壤速效磷含量大幅度增加,与马海林等(2013)的研究结果相同。乳酸菌在发酵过程中产生多种有机酸,主要包括乳酸、乙酸、柠檬酸及苯乳酸等,这些酸在降低土壤pH的同时与铁、铝、钙、镁等离子结合,从而使难溶性磷酸盐溶解。也有研究认为,微生物解磷机制是磷酸盐与质子的交换作用,乳酸菌在代谢活动中产生大量质子,使介质酸度升高从而溶解磷酸盐。乳酸菌在解磷过程中可能存在酶促作用,Harishankar等(2013)发现L. fermentum和L. lactis均能产生有机磷磷酸酶(OPP),该酶可水解有机磷化合物释而放出磷酸盐。本研究中施用菌剂后,西红柿的各项农艺性状均有所提高,也证明乳酸菌复合制剂能在有效增加土壤养分含量的同时,改善盐碱地的不良环境并促进植物生长,与周游等(2017a)的研究结果一致。
3. 2 乳酸菌复合制剂对土壤微生物多样性的影响
本研究中,在门分类水平上,土壤微生物群落的优势菌门与Shen等(2013)研究结果相似。有研究表明,变形菌门的相对丰度与土壤有机质含量呈显著正相关,其较高的相对丰度可能与土壤中有机质含量增加有关(Zeng et al.,2016)。放線菌门的相对丰度也有明显提高,放线菌适合在弱碱性土壤中生存,菌剂能有效降低土壤pH,因此放线菌的数量有所提升;赵卉琳等(2008)研究认为土壤中有效氮和有效磷含量与放线菌的数量和种类呈显著正相关。因此,土壤养分含量提高也可能是放线菌数量增加的原因之一。此外,盐碱土壤样品中含有酸杆菌门,这是一类广泛存在于各种生境内的菌,在碳循环中发挥重要作用(Lladó et al.,2016),其相对丰度可随演替时间的增长而增加(Lozano et al.,2014)。
在属分类水平上,乳杆菌属的相对丰度有明显提升,可能是由于菌剂中大量乳杆菌的引入增加了土壤中乳杆菌含量。此外,藤黄单细胞菌属、交替赤杆菌属的相对丰度显著减少。交替赤杆菌属是属于红细菌科的一个菌属,张建峰等(2017)的研究表明该菌属具有耐盐碱的能力,适宜在碱性条件下生存,乳酸菌复合剂具有降低土壤pH的效果,推测乳酸菌抑制了交替赤杆菌属的生长,因此其相对丰度降低。藤黄单细胞菌属是2000年首次发现的一种菌属(Finkmann et al.,2000),属于黄单细胞科,Narihiro等(2004)发现从固体肥料堆肥混合物中分离得到的Luteimonas sp. strain TUT1238具有较强的蛋白水解活性,因此推测施用乳酸菌复合制剂对其具有一定抑制生长的作用。
3. 3 乳酸菌复合制剂对土壤微生物功能基因的影响
碳水化合物作为土壤中重要成分之一,主要来源于植物和土壤微生物。不仅是有氧呼吸的主要能源物质,还具有重要的生理功能(郭景恒等,2000)。本研究结果表明,施用乳酸菌剂后,土壤中碳水化合物活性酶的含量均显著升高,既意味着土壤中碳元素的利用率升高,也标志着土壤微生物代谢活动的增强,与Andrade等(2017)的研究结果相似。其中,基因序列数最高的为糖苷水解酶,该酶具有水解碳水化合物之间糖苷键或碳水化合物与非碳水化合物之间糖苷键的功能(Davies and Henrissat,1995),糖苷水解酶含量的增加有助于提高土壤中单糖的含量,从而为土壤微生物的活动提供更多的能量。
土传病害一直是农业生产中不可忽视的问题,目前生物防治手段已成为防控土传病害的研究热点。本研究结果表明,施用乳酸菌菌剂后,毒素的基因序列数目由原来的11574下降到8820,证明土壤中的病原微生物含量有所降低,说明乳酸菌复合制剂具有抑制病原微生物的作用,与许筱等(2012)发现乳酸菌对黄瓜炭疽病菌、烟草赤星病菌、玉米大斑病菌及黄瓜灰霉病菌具有良好的抑菌效果,Shrestha等(2009)发现乳酸菌KLF01对青枯病菌具有良好抑制作用的研究结果相似。
微生物参与自然界的物质与能量循环,在土壤形成及肥力改善上有至关重要的作用。对测序结果进行KEGG功能注释分析发现,盐碱地土壤微生物具有较高丰度的碳水化合物代谢、氨基酸代谢、能量代谢的功能基因类群,与Souza等(2015)的研究结果类似。众所周知,微生物在碳循环过程中既是生产者也是分解者,施用菌剂后微生物的碳水化合物代谢强度明显提升,有利于分解土壤中腐败植物的纤维素、半纤维素、淀粉等,加快碳循环为微生物与农作物的生长提供更多的碳源。其次,预测到的能量代谢基因序列数目也有明显增加,说明施用菌剂后土壤中微生物的分解与合成代谢更旺盛,有助于土壤中有机质分解速度加快并释放出更多养分,同时微生物对逆境胁迫和干扰环境有较强的适应性(Fierer et al.,2012;Tripathi et al.,2017)。此外,微生物代谢旺盛能产生更多的分泌物,降低土壤pH并与金属离子结合,活化更多的磷、钾养分元素。吴雪楠等(2016)研究发现土壤微生物的能量代谢与土壤理化性质显著相关,土壤微生物旺盛的能量代谢可提高土壤养分含量;同时发现农药用量与土壤微生物的能量代谢呈负相关。本研究中所用乳酸菌复合制剂是一种绿色健康的新型微生物制剂,因此无该副作用。
综上所述,乳酸菌复合制剂可有效增加土壤养分、降低土壤pH并改变微生物群落的组成和多样性。Samad等(2016)的研究结果表明,土壤pH可控制N2O还原酶的组装并改变一般表达模式及选择性,在影响微生物群落组成变化的同时,间接影响土壤中功能基因的丰度和类型。但乳酸菌作为微生物复合制剂中的菌种,其作用还较单一。因此,今后还应选择配合其他常用菌种进行更深入的研究。
4 结论
乳酸菌复合制剂可有效增加土壤养分、降低土壤pH并改变微生物群落的组成和多样性,适宜在盐碱地改良中施用,该结论可为利用耐盐碱的乳酸菌研发新型微生物复合制剂及大面积应用提供参考依据,也为使用生物措施改良盐碱地提供了新思路。
参考文献:
艾童非,杨鹏九,费洪波,王紫滢,郭振楠. 2016. 微生物菌剂有机肥对植烟土壤环境及烤烟产质量的影响[J]. 安徽农业科学,44(18):99-102. [Ai T F,Yang P J,Fei H B,Wang Z Y,Guo Z N. 2016. Effect of applying microbial inoculum organic fertilizer on tobacco growing soil environment and yield,quality of flue-cured tobacco[J]. Journal of Anhui Agricultural Sciences,44(18):99-102.]
丁奠元,赵英,方圆, 冯浩. 2018. 活性炭对农田土壤孔隙结构的影响[J]. 干旱地区农业研究,36(1):36-42. [Ding D Y,Zhao Y,Fang Y,Feng H. 2018. Effect of addition of activated carbon on soil pore structure[J]. Agricultural Research in the Arid Areas,36(1):36-42.]
高鵬飞,姚国强,赵树平,王晓伟,崔景丽,张和平. 2014. 乳酸菌在农产品种植及其质量安全中的研究进展[J]. 中国农业科技导报,16(6):143-148. [Gao P F,Yao G Q,Zhao S P,Wang X W,Cui J L,Zhang H P. 2014. Research progress on lactic acid bacteria in agricultural product production and quality safety[J]. Journal of Agricultural Science and Technology,16(6):143-148.]
郭景恒,朴河春,刘启明. 2000. 碳水化合物在土壤中的分布特征及其环境意义[J]. 地质地球化学,28(2):59-64. [Guo J H,Piao H C,Liu Q M. 2000. The distribution and environmental effect of carbohydrate in soil[J]. Geo-logy-Geochemistry,28(2):59-64.]
黄诗宸,王清,张文平. 2018. 乳酸菌多糖对水稻种子萌发及幼苗生长的影响[J]. 江西农业学报,30(4):59-62. [Huang S C,Wang Q,Zhang W P. 2018. Effect of lactic acid bacteria polysaccharide on rice seed germination and seedling growth[J]. Journal of Jiangxi Agricultural Scien-ces,30(4):59-62.]
吕建东,马帅国,田蓉蓉,田蕾,胡慧,王娜,陈亚萍,普正菲,董艳,王彬. 2018. 脱硫石膏改良盐碱土对水稻产量及其相关性状的影响[J]. 河南农业科学,47(12):20-27. [Lü J D,Ma S G,Tian R R,Tian L,Hu H,Wang N,Chen Y P,Pu Z F,Dong Y,Wang B. 2018. Effects of desulfuri-zed gypsum on rice yield and its related traits in saline-alkali soil[J]. Journal of Henan Agricultural Sciences,47(12):20-27.]
马晨,马履一,刘太祥,左海军,张博,刘寅. 2010. 盐碱地改良利用技术研究进展[J]. 世界林业研究,23(2):28-32. [Ma C,Ma L Y,Liu T X,Zuo H J,Zhang B,Liu Y. 2010. Research progress on saline land improvement technology[J]. World Forestry Research,23(2):28-32.]
马海林,杜秉海,邢尚军,丁延芹,刘方春,姚良同,马丙尧,杜振宇. 2013. 解磷、解钾根际促生菌的筛选与鉴定[J]. 山东林业科技,43(6):1-4. [Ma H L,Du B H,Xing S J,Ding Y Q,Liu F C,Yao L T,Ma B Y,Du Z Y. 2013. Screening and identification of plant growth-promoting rhizobacteria with the ability of phosphate-dissolving or potassium-dissolving[J]. Journal of Shandong Forestry Science and Technology,43(6):1-4.]
王维华,赵金山,刘华伟,李海梅,邹晓霞. 2018. 乳酸菌肥对不同盐胁迫下土壤微生物的影响[J]. 山东农业科学,50(4):48-51. [Wang W H,Zhao J S,Liu H W,Li H M,Zou X X. 2018. Effects of lactic acid bacteria fertilizer on soil microorganisms under different salt stress[J]. Shandong Agricultural Sciences,50(4):48-51.]
吴雪楠,孙菁菁,罗园园,刘文娟,姚俊. 2016. 草甘膦对土壤微生物能量代谢的影响[J]. 化学与生物工程,33(4):18-21. [Wu X N,Sun J J,Luo Y Y,Liu W J,Yao J. 2016. Effect of glyphosate on energy metabolism of soil microorganisms[J]. Chemistry & Bioengineering,33(4):18-21.]
许筱, 施艳, 高书峰,王振跃. 2012. 拮抗乳酸菌的筛选及其对黄瓜炭疽病的防治效果[J]. 河南农业科学,41(5):87-91. [Xu X,Shi Y,Gao S F,Wang Z Y. 2012. Screening of antagonistic lactic acid bacteria and its control effect on collectotrchum orbiculare[J]. Journal of Henan Agricultural Science,41(5):87-91.]
张聪,慕平,尚建明. 2018. 长期持续秸秆还田对土壤理化特性、酶活性和产量性状的影响[J]. 水土保持研究,25(1):92-98. [Zhang C,Mu P,Shang J M. 2018. Effects of long-term continuous straw returning on soil physical and chemical properties,enzyme activities and yield traits[J]. Research of Soil and Water Conservation,25(1):92-98.]
张建峰,吉丽,王佳琦,田磊,孔钰凤,田春杰. 2017. 盐碱胁迫对大豆根际细菌群落多样性的影响[J]. 吉林农业大学学报,39(3):262-269. [Zhang J F,Ji L,Wang J Q,Tian L,Kong Y F,Tian C J. 2017. Effects of saline alkali stress on diversity of bacterial community inrhizosphere soil of soybean[J]. Journal of Jilin Agricultural University,39(3):262-269.]
赵卉琳,来航线,冯昌增,田浩. 2008. 新疆部分地区盐碱荒漠化土壤养分及放线菌区系组成[J]. 西北农业学报,17(1):161-166. [Zhao H L,Lai H X,Feng C Z,Tian H. 2008. Nutrient contents and actinomycetes populations of desert saline-alkali soil in parts regions of Xinjiang[J]. Acta Agriculturae Boreali-occidentalis Sinica,17(1):161-166.]
周游,李海梅,赵金山,李士美,邹晓霞. 2017a. 乳酸菌对草莓生长和品质性状的影响[J]. 江蘇农业学报,33(5):1124-1128. [Zhou Y,Li H M,Zhao J S,Li S M,Zou X X. 2017a. Effects of lactic acid bacteria on the growth and quality characters of strawberry[J]. Jiangsu Journal of A-gricultural Sciences,33(5):1124-1128.]
周游,趙金山,李海梅,李士美. 2017b. 乳酸菌对茶树生长和品质性状的影响[J]. 江西农业学报,29(10):31-34. [Zhou Y,Zhao J S,Li H M,Li S M. 2017b. Effects of lactic acid bacteria on growth and quality characters of tea(Camellia sinensis)[J]. Acta Agriculturae Jiangxi,29(10):31-34.]
朱建峰,崔振荣,吴春红,邓丞,陈军华,张华新. 2018. 我国盐碱地绿化研究进展与展望[J]. 世界林业研究,31(4):70-75. [Zhu J F,Cui Z R,Wu C H,Deng C,Chen J H,Zhang H X. 2018. Research advances and prospect of saline and alkali land greening in China[J]. World Forestry Research,31(4):70-75.]
Andrade A C,Fróes A,Lopes F Á C,Thompson F L,krüger R H,Dinsdale E,Bruce T. 2017. Diversity of microbial carbohydrate-active enZYmes(CAZYmes) associated with freshwater and soil samples from Caatinga Biome[J]. Microbial Ecology,74(1):89-105.
Bhakta J N,Ohnishi K,Munekage Y,Iwasaki K,Wei M Q. 2012. Characterization of lactic acid bacteria-based probio-tics as potential heavy metal sorbents[J]. Journal of Applied Microbiology,112(6):1193-1206.
Bossuyt H,Denef K,Six J,Frey S D,Merchx R,Paustian K. 2001. Influence of microbial popu-lations and residue quality on aggregate stability[J]. Applied Soil Ecology,16(3):195-208.
Chen Y S, Yanagida F, Shinohara T. 2005. Isolation and identification of lactic acid bacteria from soil using an enrichment procedure[J]. Letters in Applied Microbiology,40(3):195-200.
Davies G,Henrissat B. 1995. Structures and mechanisms of glycosyl hydrolases[J]. Structure,3(9):853-859.
Fierer N, Leff J W, Adams B J,Nielsen U N,Bates S T,Lauber C L,Owens S,Gilbert J A,Wall D H,Caporaso J G. 2012. Cross-biome metagenomic analyses of soil microbial communities and their functional attributes[J]. Pro-ceedings of the National Academy of Sciences of the Uni-ted States of America,109(52):21390-21395.
Finkmann W, Altendorf K, Stackebrandt E,Lipski A. 2000. Characterization of N2O-producing Xanthomonas-like isolates from biofilters as Stenotrophomonas nitritireducens sp. nov.,Luteimonas mephitis gen. nov.,sp. nov. and Pseudoxanthomonas broegbernensis gen. nov.,sp. nov.[J]. International Journal of Systematic & Evolutionary Microbiology,50(1):273-282.
Gajbhiye M,Prakash D,Jagdale S,Ahiwale S,Patil N,Kapadnis B. 2012. Pomegranate borne fungicidal lactic acid bacteria and their biodiversity[J]. Proceedings of the National Academy of Sciences,India Section B:Biological Sciences,82(3):413-419.
Harishankar M K,Sasikala C,Ramya M. 2013. Efficiency of the intestinal bacteria in the degradation of the toxic pesticide,chlorpyrifos[J]. 3 Biotech,3(2):137-142.
Lladó S,Žifčáková L,Větrovský T,Eichlerova I,Baldrian P. 2016. Functional screening of abundant bacteria from acidic forest soil indicates the metabolic potential of Acido-bacteria subdivision 1 for polysaccharide decomposition[J]. Biology & Fertility of Soils,52(2):251-260.
Lozano Y M,Hortal S,Armas C,Pugnaire F I. 2014. Interactions among soil,plants,and microorganisms drive secon-dary succession in a dry environment[J]. Soil Biology & Biochemistry,78:298-306.
Narihiro T, Takebayashi T, Hiraishi A. 2004. Activity and phylogenetic composition of proteolytic bacteria in mesophilic fed-batch garbage composters[J]. Microbes and Environments,19(4):292-300.
Samad M S,Biswas A,Bakken L R,Clough T J,de klein C A M,Richards K G,Lanigan G J,Morales S E. 2016. Phylogenetic and functional potential links pH and N2O emissions in pasture soils[J]. Scientific Reports,6:35990.
Selles F,Campbell C A,Zentner R P,Curtin D,James D C,Basnyat P. 2011. Phosphorus use efficiency and long-term trends in soil available phosphorus in wheat production systems with and without nitrogen fertilizer[J]. Canadian Journal of Soil Science,91(1):39-52.
Shen C C,Xiong J B,Zhang H Y,Feng Y Z,Lin X G,Li X Y,Liang W J,Chu H Y. 2013. Soil pH drives the spatial distribution of bacterial communities along elevation on Changbai Mountain[J]. Soil Biology & Biochemistry,57:204-211.
Shrestha A,Choi K,Lim C K,Hur J H. 2009. Antagonistic effect of Lactobacillus sp. strain KLF01 against plant pathogenic bacteria ralstonia solanacearum[J]. Pesticide Science(Korea),13(1):45-53.
Singh H,Reddy M S. 2011. Effect of inoculation with phosphate solubilizing fungus on growth and nutrient uptake of wheat andmaize plants fertilized with rock phosphate in alkaline soils[J]. European Journal of Soil Biology,47(1):30-34.
Souza R C,Hungria M,Cantão M E,Vasconcelos A T R,Nogueira M A,Vicente V A. 2015. Metagenomic analysis reveals microbial functional redundancies and specifici-ties in a soil under different tillage and crop-management regimes[J]. Applied Soil Ecology,86:106-112.
Tripathi B M, Moroenyane I,Sherman C,Lee Y K,Adams J M,Steinberger Y. 2017. Trends in taxonomic and functional composition of soil microbiome along a precipitation gradient in israel[J]. Microbial Ecology,74(1):1-9.
Vogel H J,Roth K. 2001. Quantitative morphology and network representation of soil pore structure[J]. Advances in Water Resources,24(3-4):233-242.
Wang H K,Yan Y H,Wang J M,Zhang H P,Qi W. 2012. Production and characterization of antifungal compounds produced by Lactobacillus plantarum IMAU10014[J]. PLoS One,7(1):e29452.
Zeng Q C,Dong Y H,An S S. 2016. Bacterial community responses to soils along a latitudinal and vegetation gradient on the loess plateau,China[J]. PLoS One,11(4):e0152894.
Zlotnikov K M, Zlotnikov A K, Kaparullina E N,Doronina N V. 2013. Phylogenetic position and phosphate solubilization activity of lactic acid bacteria associated with different plants[J]. Microbiology,82(3):393-396.
(責任编辑 王 晖)
