中华绒螯蟹羧酸酯酶基因克隆及其在农药胁迫下的表达变化
2019-09-10臧亚南张晓黄鹏丹KassimuHashimAme沈怀舜
臧亚南 张晓 黄鹏丹 KassimuHashimAme 沈怀舜


摘要:【目的】明確中华绒螯蟹羧酸酯酶基因(ES-CXEs)在中华绒螯蟹不同组织及在农药胁迫下的应激表达模式,为揭示其代谢解毒机制打下理论基础。【方法】采用RACE克隆ES-CXEs基因全长序列,并进行生物信息学分析;以实时荧光定量PCR检测中华绒螯蟹不同组织及在农药胁迫下ES-CXEs基因的表达变化。【结果】从中华绒螯蟹肝胰腺中克隆获得两段ES-CXEs基因cDNA序列(ES-CXE5和ES-CXE6),其中,ES-CXE5基因序列全长1889 bp(GenBank登录号MH201558),包括132 bp的5'端非编码区(5'UTR)、122 bp的3'端非编码区(3'UTR)和1635 bp的开放阅读框(ORF),推测其编码544个氨基酸序列;ES-CXE6基因序列全长3089 bp(GenBank登录号MH201555),包括282 bp的5'UTR、779 bp的3'UTR和2028 bp的ORF,推测其编码675个氨基酸序列。多序列比对分析结果显示,ES-CXE5和ES-CXE6基因均具有CXEs家族的特征序列,即催化三联体结构(S-E-H)和N-糖基化位点。ES-CXE5氨基酸序列与三疣梭子蟹、日本长额虾等甲壳类CXEs聚为一簇,而ES-CXE6氨基酸序列与水蚤类和芜菁叶蜂的CXEs聚为一簇。组织特异性表达分布显示,ES-CXEs基因在雌、雄性中华绒螯蟹不同组织中的相对表达量无显著差异(P>0.05),且在肝胰腺、肌肉、精巢和副性腺中均有表达,以肝胰腺中的相对表达量最高。在安全浓度的阿维菌素、敌百虫和高效氯氰菊酯胁迫下,ES-CXEs基因在中华绒螯蟹肝胰腺中的相对表达量呈明显诱导表达趋势,且ES-CXE5基因的相对表达量高于ES-CXE6基因。【结论】从中华绒螯蟹肝胰腺中克隆获得的ES-CXE5和ES-CXE6基因属于CXEs基因家族,在肝胰腺中高表达,且在农药胁迫下这两个基因的表达呈明显诱导表达趋势而参与杀虫剂的代谢解毒过程。
关键词: 中华绒螯蟹;羧酸酯酶(CXEs);克隆;杀虫剂;代谢解毒
中图分类号: S966.16 文献标志码: A 文章编号:2095-1191(2019)05-1093-11
Abstract:【Objective】Expression patterns of Eriocheir sinensis carboxylesterase gene(ES-CXEs)in various tissues and under pesticide tress were studied to provide theoretical basis for revealing its metabolic detoxification mechanism. 【Method】The full sequence of the ES-CXEs gene was cloned by using rapid-amplification of cDNA ends(RACE) technolo-gy and bioinformatics analysis was also conducted. Real-time fluorescence quantitative PCR was used for its expression analysis in various tissues and after pesticide treatment. 【Result】Two cDNA full-length sequences of ES-CXEs genes were cloned from E. sinensis hepatopancreas(named ES-CXE5 and ES-CXE6). Full-length sequence of ES-CXE5 was 1889 bp(GenBank accession number:MH201558), consisting of a 5'-untranslated region(UTR) of 132 bp, a 3'-UTR of 122 bp and an open reading frame(ORF) of 1635 bp. The deduced protein had 544 amino acids sequences. Full-length sequence of ES-CXE6 was 3089 bp(GenBank accession number:MH201555), consisting of a 5'-UTR of 282 bp, a 3'-UTR of 779 bp and an ORF of 2028 bp. The deduced protein had 675 amino acids sequences. Multiple alignments revealed that both ES-CXE5 andES-CXE6 contained typical sequence of the CXEs family, which was catalytic triad structure and N-glycosylation site. Amino acid sequence of ES-CXE5 were clustered with Portunus trituberculatus,Pandalopsis japonica and other crustaceans. Amino acid sequence of ES-CXE6 were clustered with Daphnia magna and Athalia rosae. Tissue speci-fic-expression analysis showed that the relative expression level of two ES-CXEs genes were not significantly different in different tissue of female and male E. sinensis(P>0.05) and they were expressed in gill, hepatopancreas, muscle, testis and accessory gonads, with the highest relative expression in hepatopancreas. The expression levels of the two ES-CXEs genes in the hepatopancreas of E. sinensis exposed to low doses of avermectin,trichlorfon and β-cypermethrin were greatly induced, and the relative expression of ES-CXE5 were higher than that of ES-CXE6. 【Conclusion】ES-CXE5 and ES-CXE6 genes, cloning from the hepatopancreas of E. sinensis,belong to CXEs family,highly express in hepatopancreas, and their expression levels under pesticide stress are induced,thus they involve in the detoxification of the pesticides.
Key words: Eriocheir sinensis; carboxylesterases(CXEs); cloning; pesticide; metabolic detoxification
0 引言
【研究意义】中华绒螯蟹(Eriocheir sinensis)俗称河蟹,隶属于节肢动物门(Arthropoda)甲壳纲(Crustacen)十足目(Decapoda),是我国水产养殖最重要的甲壳物种之一(Shen et al.,2014)。近年来,中华绒螯蟹市场需求量日益增加,养殖密度及规模不断扩大,加之杀虫剂和除藻剂的普遍使用,导致其养殖环境越来越恶劣,各种病害频发(耿雪冰,2010)。同时,在农业生产中常使用农药防控农作物害虫,部分农药通过地表径流、雨水冲刷、生活废水等途径进入水体环境,或造成养殖水源污染(徐春娟等,2017;韩松等,2018),进而引起甲壳类动物暴发各种病害。羧酸酯酶(Carboxylesterases,CXEs)作为一种多功能家族酶系,能代谢多种药物、环境毒物及致癌物,有效防止病原菌的致病作用(滕霞和孙曼霁,2003;张敏文等,2012),但关于其在甲壳类中的代谢解毒研究较少,因此,克隆CXEs基因并明确其分子生物学特性,可为进一步研究中华绒螯蟹CXEs代谢解毒机制打下理论基础。【前人研究进展】CXEs又称脂族酯酶,在动物、植物和微生物体内均有存在,具有催化三联体结构和近N端的糖基化位点,能维持酶活性和活性位点的稳定(Bornscheuer,2002)。CXEs作为昆虫体内三大解毒酶系之一,其抗药机理已得到广泛研究,如酯酶E4结构基因扩增假说(Devonshire and Sawicki,1979)、酯酶A1基因扩增理论(Georghiou and Saito,1983)和最早在铜绿蝇(Lucilia cuprina)中发现G317D突变使其对有机磷农药产生抗性(Newcomb et al.,1997)。目前的研究表明,昆蟲对有机磷、氨基甲酸酯和溴氰菊酯类农药产生抗药性与其体内CXEs解毒代谢活性的增强有关,而CXEs代谢活性的增强主要是通过昆虫CXEs基因扩增、基因表达调控及基因突变来实现(Small and Hemingway,2000;Li et al.,2007)。Cui等(2007)通过定点诱变,从尖音库蚊(Culex pipiens)突变体中筛选出一个能提高马拉硫磷代谢活力的突变体;Pou-pardin等(2014)对埃及伊蚊(Aedes aegypti)的研究发现,基因扩增是CCEae3a在抗性品系中上调表达的主要方式;王芮等(2017)在灰飞虱(Laodelphax striatellus)抗毒死蜱品系、抗吡虫啉品系和抗溴氰菊酯品系中筛选导致总酯酶活力升高的酯酶基因,结果发现灰飞虱CXEs基因过量表达与灰飞虱对毒死蜱和吡虫啉的抗性相关。有关甲壳类CXEs活性的研究,来有鹏等(2008)研究认为,CXEs可作为一种生物标志物,通过测定其活性可反映农药对河虾的安全性;Solé和Sanchez-Hernandez(2015)通过体外酶试验探讨水生生物CXEs活性对14种药物和个人护理用品(PPCPs)的敏感性,结果表明,100 μmol/L脂类调节剂Simvastatin和Fenofibrate能有效抑制所有靶种的CXEs活性;Shen等(2017)研究证实,当中华绒螯蟹患有肝胰腺坏死病(HPND)时,其体内CXEs基因表达水平较健康蟹呈显著上调趋势;Zhu等(2018)研究表明,当罗氏沼虾受嗜水气单胞菌和副溶血性弧菌侵染时,其肝胰腺中CXEs基因mRNA水平显著升高。【本研究切入点】基于CXEs基因的昆虫农药代谢解毒研究已有较多报道,但有关中华绒螯蟹CXEs基因(ES-CXEs)的研究鲜见报道。【拟解决的关键问题】在克隆ES-CXEs基因全长序列的基础上进行生物信息学分析,并探讨该基因在中华绒螯蟹不同组织及在农药胁迫下的应激表达模式,为揭示其代谢解毒机制打下理论基础。
1 材料与方法
1. 1 试验材料
中华绒螯蟹取自江苏省盐城市某养殖场,在玻璃缸内(97 cm×48 cm×63 cm)暂养,并使用泵氧系统模拟自然生长环境,水温保持在(20.0±1.0)℃,分早晚两次投喂饲料。在试验开始前先暂养1周以适应养殖缸环境。挑选有活力的成熟中华绒螯蟹,雌、雄性各3只,解剖后用液氮速冻其心脏、鳃、肝胰腺、肌肉、肠道、精巢、卵巢和副性腺等组织, -80 ℃保存备用。TRIzol Reagent、HiFiScript cDNA Synthesis Kit和ULtraSYBR Mixture购自北京康为世纪生物科技有限公司;SMARTer® RACE 5' Kit User Manual and 3'-Full RACE Core Set v.2.0、Gel Extraction Kit、pMD19-T载体和大肠杆菌DH5α感受态细胞购自TaKaRa公司;氯仿、异丙醇、无水乙醇、DEPC水、NaCl、琼脂、氨苄青霉素和San Prep柱式DNA胶回收试剂盒购自生工生物工程(上海)股份有限公司。主要仪器设备:低温离心机(湘仪TGL-16M高速台式冷冻离心机)、凝胶成像系统(Beckman Coulter CEQ 8000)、PCR仪(Eppendorf Autheri-zed Thermal Cycler)、荧光定量PCR仪(Applied Biosystems,New York,USA)和摇床(华利达 HZ-9511K恒温振荡器)。
1. 2 农药胁迫
随机挑取中华绒螯蟹(5.5±0.5 g/只)分成4组,每组3个平行,放养于玻璃缸内,各组分别添加0.002 μL/L阿维菌素、0.0050 g/L敌百虫和0.001 μL/L高效氯氰菊酯(表1),并设空白对照。以蒸馏水将3种杀虫剂(表1)稀释到半致死浓度试验得到的安全浓度,其中,阿维菌素安全浓度4.08×10-4μg/L,高效氯氰菊酯安全浓度8.52×10-5 μg/L,敌百虫安全浓度5.00×10-4 g/L。然后分别在添加杀虫剂后0、3、6、12、24和48 h从各玻璃缸中随机挑出3只中华绒螯蟹,解剖后用液氮速冻其肝胰腺组织,-80 ℃保存备用。
1. 3 总RNA提取
取0.1 g中华绒螯蟹肝胰腺组织置于液氮中充分研磨,参照TRIzol Reagent操作说明进行总RNA提取,经1.5%琼脂糖凝胶电泳检测其完整性及微量紫外分光光度计检测其纯度后,-80 ℃保存备用。
1. 4 ES-CXEs基因克隆
根据转录组获取的部分CXEs基因保守序列(Shen et al.,2017),设计扩增ES-CXE5和ES-CXE6序列的引物(表2),并委托苏州金唯智生物科技有限公司合成。参照SMARTer® RACE 5' Kit User Manual and 3'-Full RACE操作说明将中华绒螯蟹肝胰腺总RNA反转录成cDNA第一链,以3'-RACE cDNA和5'-RACE cDNA为模板、3'GSP和5'GSP为引物,分别进行3'端和5'端序列的快速扩增。
PCR反应体系20.0 μl:3'-RACE(5'-RACE)cDNA模板1.0 μL,10 μmol/L 3'GSP(5'GSP)引物0.4 μL,10 mmol/L dUPM通用引物2.0 μL,SeqAmp DNA聚合酶0.4 μL,2×SeqAmp Buffer 10.0 μL,PCR-Grade H2O 6.2 μL。扩增程序:94 ℃ 30 s,72 ℃ 3 min,进行5个循环;94 ℃ 30 s,70 ℃ 30 s,72 ℃ 3 min,进行5个循环;94 ℃ 30 s,68 ℃ 30 s,72 ℃ 3 min,进行25个循环。RACE-PCR产物经DNA胶回收后,将其连接至pMD19-T载体,37 ℃连接4 h,然后转化DH5α感受态细胞,培养箱37 ℃恒温培养12 h。从蓝白斑菌落中挑选白斑,并接种至LBA液体培养基中继续振荡培养至菌液浑浊(约6 h),经PCR鉴定筛选后,阳性菌液送至蘇州金唯智生物科技有限公司测序及拼接。
1. 5 生物信息学分析
测序结果利用NCBI VecsCXEen(https://www.ncbi.nlm.nih.gov/tools/vecsCXEen/)进行分析后去除载体,使用DNAMAN v.5.2.2将各片段进行拼接,以获得cDNA全长序列;利用ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)分析其开放阅读框;采用Net NGlyc(http://www.cbs.dtu.dk/services/NetNGlyc/)预测N-糖基化位点;利用NCBI进行两序列的蛋白相似性分析,并以DNAMAN v.5.2.2进行序列翻译;使用Compute pI/Mw(http://web.expasy.org/compute_pi/)计算其相对分子量和理论等电点(pI);运用DNAMAN v.5.2.2及多序列对比工具(http://www.biosoft.net/sms/)进行氨基酸多序列比对;并以MEGA 7.0的最大似然法(Maximum likelihood,ML)构建系统发育进化树。
1. 6 实时荧光定量PCR检测
采集中华绒螯蟹不同组织及3种杀虫剂处理后6个时间点的肝胰腺样品,分别提取总RNA后进行RNase-free DNase处理,以消除基因组DNA的影响。以RNA为模板反转录合成cDNA第一链,再以cDNA为模板进行实时荧光定量PCR检测。依据克隆得到的ES-CXEs基因全长序列设计实时荧光定量PCR扩增引物(表2)。以中华绒螯蟹β-actin基因(GenBank登录号HM053699)为内参基因,设计引物β-actin-F和β-actin-R,并验证各内参样品的表达稳定性,根据Schmittqen和Livak(2008)提出的2−∆∆Ct法计算各样品中ES-CXEs基因相对表达量。每个样品设3个重复,内参基因设2个重复。实时荧光定量PCR反应体系20.0 μL:SYBR Premix Ex TaqTM(2×)10.0 μL,上、下游引物各1.0 μL,cDNA模板2.0 μL,以ddH2O补足至20.0 μL。扩增程序:95 ℃ 预变性3 min;95 ℃ 10 s,60 ℃ 20 s,72 ℃ 34 s,进行35个循环。利用SPSS 18.0进行显著性分析。
2 结果与分析
2. 1 ES-CXEs基因全长cDNA序列分析结果
以中华绒螯蟹肝胰腺总RNA为模板进行RACE扩增,克隆得到两段ES-CXEs基因cDNA序列(图1和图2)。其中,ES-CXE5基因序列全长1889 bp(GenBank登录号MH201558),包括132 bp的5'端非编码区(5'UTR)、122 bp的3'端非编码区(3'UTR)和1635 bp的开放阅读框(ORF),推测其编码544个氨基酸序列,编码蛋白的相对分子量为60.55 kD,pI为4.54;ES-CXE6基因序列全长3089 bp(GenBank登录号MH201555),包括282 bp的5'UTR、779 bp的3'UTR和2028 bp的ORF,推测其编码675个氨基酸序列,编码蛋白的相对分子量为75.06 kD,pI为4.57。两个ES-CXEs基因序列末端均有加尾信号poly(A)结构(AATAAA),二者对应的推导氨基酸序列一致性为32%。
2. 2 ES-CXEs氨基酸多序列比对及其系统发育进化树
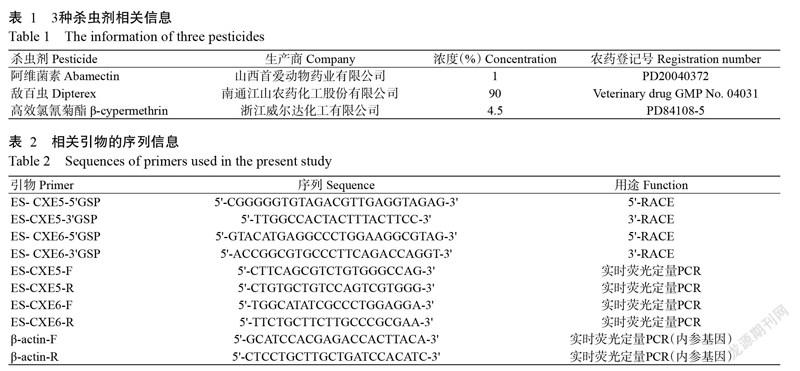
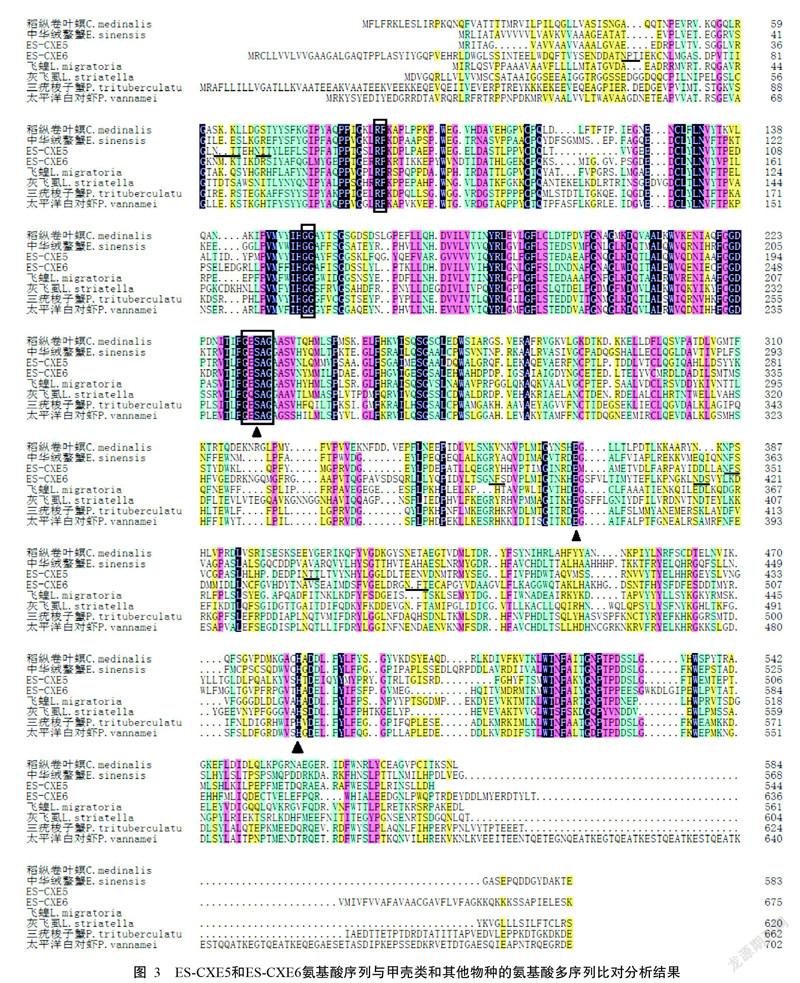
氨基酸多序列比对分析结果(图3)表明,两段ES-CXEs氨基酸序列(ES-CXE5和ES-CXE6)均具有CXEs家族的特征序列,即催化三联体结构(S-E-H)、RF和GG结构及N-糖基化位点。聚类分析结果(图4)也显示,ES-CXE5氨基酸序列与三疣梭子蟹和日本长额虾的CXEs聚为一簇,对应的氨基酸序列相似性分别为43%和41%;而ES-CXE6氨基酸序列与水蚤类和芜菁叶蜂的CXEs聚为一簇,对应的氨基酸序列相似性分别为34%和39%。
2. 3 ES-CXEs基因在中华绒螯蟹不同组织中的表达情况
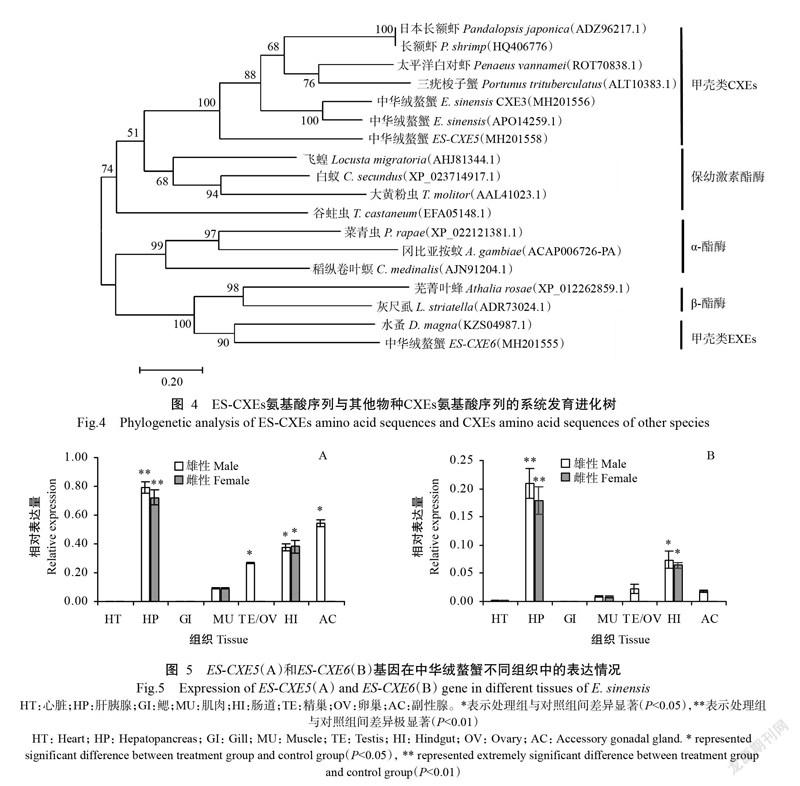
采用实时荧光定量PCR检测ES-CXEs基因在中华绒螯蟹心脏、鳃、肝胰腺、肌肉、肠道、卵巢、精巢和副性腺等组织中的表达情况,结果表明,ES-CXEs基因在雌、雄性中华绒螯蟹不同组织中的相对表达量无显著差异(P>0.05),且在肝胰腺、肌肉、精巢和副性腺中均有表达(图5)。ES-CXEs基因在中华绒螯蟹肝胰腺中的相对表达量最高,而在心脏、鳃和卵巢中几乎不表达。
2. 4 农药胁迫下ES-CXEs基因的表达模式
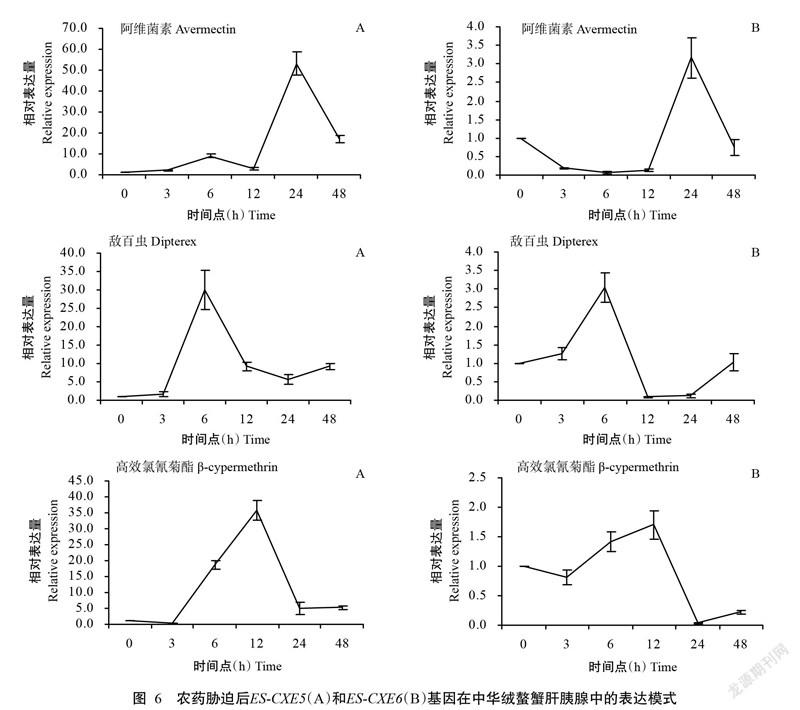
在未经农药胁迫的中华绒螯蟹肝胰腺中,ES-CXEs基因(ES-CXE5和ES-CXE6)在6个时间点的相对表达量几乎没有变化。在阿维菌素、敌百虫和高效氯氰菊酯的胁迫下,ES-CXEs基因在中华绒螯蟹肝胰腺中的相对表达量呈明显波动趋势(图6),表现为诱导表達模式。其中,经阿维菌素胁迫24 h后,中华绒螯蟹肝胰腺中的ES-CXE5和ES-CXE6相对表达量最高,约是对照组的53.2和3.2倍;经敌百虫胁迫6 h后,中华绒螯蟹肝胰腺中的ES-CXE5和ES-CXE6相对表达量最高,约是对照组的29.9和3.0倍;经高效氯氰菊酯胁迫12 h后,中华绒螯蟹肝胰腺中的ES-CXE5和ES-CXE6相对表达量最高,约是对照组的35.6和3.2倍。
3 讨论
CXEs作为生物体内重要的初级代谢酶系,对杀虫剂等内外源物质的代谢、激素降解及神经系统发育起重要作用(Li et al.,2007;Yan et al.,2009;朱晓晔等,2018)。目前,已从昆虫和甲壳类物种中克隆获得多个CXEs基因序列(Lee et al.,2011;Tao et al.,2017;Xu et al.,2017;白微微等,2018)。其中,昆虫类CXEs的代谢解毒、激素降解等功能研究已较深入,但在甲壳类中关于CXEs的功能研究以激素代谢为主(Lee et al.,2011;白微微等,2018)。本研究通过RACE克隆获得两段ES-CXEs基因序列(ES-CXE5和ES-CXE6),其氨基酸多序列比对分析结果显示,ES-CXE5和ES-CXE6氨基酸序列均含有CXEs家族的保守区域——催化三联体结构(S-E-H),表明二者具有酯酶活性。此外,存在4个不同的N-糖基化位点。N-糖基化位点可维持哺乳动物CXEs的稳定性及其催化效率(Kroetz et al.,1993)。聚类分析结果表明,ES-CXE5氨基酸序列与太平洋白对虾、三疣梭子蟹等甲壳类的氨基酸序列具有较高相似性,优先聚为一支,再与飞蝗等保幼激素聚为一支;而ES-CXE6氨基酸序列与芜菁叶蜂和水蚤等的氨基酸序列相似度较高,优先聚为一支,再与α-酯酶和β-酯酶聚为一支。已有研究表明,α-酯酶在异源物质解毒如有机磷杀虫剂抗性中发挥重要作用,β-酯酶也能介导多种杀虫剂及其他异源物质的代谢,而保幼激素酯酶可参与杀虫剂代谢解毒(Ranson et al.,2002;任娜娜等,2014)。由此推测,ES-CXE5和ES-CXE6也与杀虫剂的代谢解毒有关。
为了解ES-CXEs基因的分子特性,本研究采用实时荧光定量PCR检测其在中华绒螯蟹雌雄不同组织中的表达情况,结果显示ES-CXEs基因多组织分布与CXEs在昆虫及甲壳类多组织部位分布(Lee et al.,2011;任娜娜等,2014;Tao et al.,2017;Xu et al.,2017)的观点一致。昆虫脂肪体的主要功能是负责能量储存和有毒物质代谢及解毒(Arrese and Soulages,2010)。在甲壳类物种中,其肝胰腺与昆虫的脂肪体相似,也是各类物质新陈代谢的主要部位(Lee et al.,2011;Tao et al.,2017;Xu et al.,2017)。本研究中,ES-CXEs基因在中华绒螯蟹肝胰腺中的相对表达量明显高于其他组织,进一步验证该观点。CXEs基因在日本长额虾、三疣梭子蟹和中华绒螯蟹的卵巢中也呈高表达(Lee et al.,2011;Tao et al.,2017;Xu et al.,2017),但本研究结果显示ES-CXE5和ES-CXE6基因在中华绒螯蟹卵巢中几乎不表达。此外,与ES-CXE6基因相比,ES-CXE5基因的组织表达分布更广泛,故推测ES-CXE5具有更广泛的功能。
CXEs介导害虫抗药性主要是通过提高对杀虫剂的水解活性,增强对杀虫剂的阻隔或改变酶与底物的亲和力而发挥作用(Lima et al.,2013;徐春娟等,2017)。CXEs基因表达量的增加会促使其解毒酶活性提高,进而增强昆虫的抗药性(黄水金等,2010;杨帅等,2012;Zhang et al.,2014;刘苏等,2015;来守国等,2018)。在本研究中,经阿维菌素、敌百虫和高效氯氰菊酯3种农药胁迫后,ES-CXE5和ES-CXE6基因在中华绒螯蟹肝胰腺中的相对表达量明显增加,表明这两个CXEs基因参与了阿维菌素、敌百虫和高效氯氰菊酯的解毒过程,具有代谢解毒作用。
昆虫在受外源药剂胁迫下,其体内相应的防御解毒体系因受刺激而产生效应以降低毒害作用(Chevillon et al.,1999;张建琴等,2014;白薇薇等,2018)。在本研究的空白对照组中,两个ES-CXEs基因在6个时间点的相对表达量几乎没有变化;而在阿维菌素、敌百虫和高效氯氰菊酯的胁迫下,表现出明显的诱导表达趋势,说明阿维菌素、敌百虫和高效氯氰菊酯对ES-CXEs基因的表达具有一定影响,据此推测低浓度的杀虫剂可刺激ES-CXEs基因表达,使其参与杀虫剂的解毒代谢过程。此外, ES-CXE5基因的相对表达量明显高于ES-CXE6基因,意味着ES-CXE5对杀虫剂的胁迫更敏感,而在杀虫剂代谢解毒方面发挥更大的作用。自2015年以来,肝胰腺坏死综合症已成为中华绒螯蟹养殖中的主要病害,而环境毒物是引起肝胰腺坏死综合症的主要原因之一。Shen等(2017)研究发现,与未患病的中华绒螯蟹相比,患有肝胰腺坏死综合症中华绒螯蟹的CXEs家族基因表达量显著上调。本研究结论进一步验证中华绒螯蟹肝胰腺坏死综合症的发生与其养殖水体中杀虫剂的污染情况密切相关。
4 结论
从中华绒螯蟹肝胰腺中克隆获得的ES-CXE5和ES-CXE6基因属于CXEs基因家族,在肝胰腺中高表达,且在农药胁迫下这两个基因的表达量均呈明显诱导表达趋势而参与杀虫剂的代谢解毒过程。
参考文献:
白微微,高海峰,张航,杨安沛,李广阔. 2018. 麦长管蚜羧酸酯酶基因cDNA片段克隆及吡虫啉胁迫对其表达的影响[J]. 生物技术通报,34(6):109-114. [Bai W W,Gao H F,Zhang H,Yang A P,Li G K. 2018. Cloning of carboxylesterase gene cDNA fragments in Sitobion avenae(Fabricius) and its expression analysis under imidacloprid stress[J]. Biotechnology Bulletin,34(6):109-114.]
耿雪冰. 2010. 溴氰菊酯残留的检测方法及对河蟹的毒性研究[D]. 南京:南京农业大学. [Geng X B. 2010. Studies on detection method and toxicity of deltamethrin in river crabs,Eriocheir sinensis[D]. Nanjing:Nanjing Agricultural University.]
韩松,张扬,郭小奇,梁九进,刘爱芝. 2018. 小麦播量和吡虫啉用量对麦蚜防治效果及安全性的影响[J]. 河南农业大学学报,52(5):728-732. [Han S,Zhang Y,Guo X Q,Liang J J,Liu A Z. 2018. Effects and safety of sowing rate and imidacloprid dosage on control efficacy against wheat aphids[J]. Journal of Henan Agricultural University,52(5):728-732.]
黄水金,秦文婧,陈琼. 2010. 斜纹夜蛾羧酸酯酶基因的克隆、序列分析及表达水平[J]. 昆虫学报,53(1):29-37. [Huang S J,Qin W J,Chen Q. 2010. Cloning,sequence analysis and expression levels of a craboxylesterase gene from Spodoptera litura(Fab.)(Lepidoptera:Noctuidae)[J]. Acta Entomologica Sinica,53(1):29-37.]
来守国,高欢欢,翟一凡,陈浩,刘倩,党海燕,于毅,郑方强. 2018. 3种杀虫剂亚致死浓度对斑翅果蝇和黑腹果蝇体内解毒酶的影响[J]. 环境昆虫学报,40(3):676-683. [Lai S G,Gao H H,Zhai Y F,Chen H,Liu Q,Dang H Y,Yu Y,Zheng F Q. 2018. Effect of sublethal concentrations of three pesticides on the activity of detoxifying enzymes in Drosophila melanogaster and Drosophila suzukii[J]. Journal of Environmental Entomology,40(3):676-683.]
來有鹏,刘贤进,余向阳,王冬兰. 2008. 羧酸酯酶和谷胱甘肽转移酶在农药安全性评价中的应用初探[J]. 江苏农业学报,24(6):944-947. [Lai Y P,Liu X J,Yu X Y,Wang D L. 2008. Application of the CarE and GSTs in safety assessment of insecticides[J]. Jiangsu Journal of Agricultural Sciences,24(6):944-947.]
刘苏,冯明峰,何梦竹. 2015. 稻纵卷叶螟羧酸酯酶基因的鉴定与表达谱分析[J]. 应用昆虫学报,25(3):662-670. [Liu S,Feng M F,He M Z. 2015. Identification and expre-ssion profiles of Cnaphalocrocis medinalis craboxylestera-se genes[J]. Chinese Journal of Applied Entomology,52(3):662-670.]
任娜娜,谢苗,尤燕春,尤民生. 2014. 羧酸酯酶及其介导昆虫抗药性的研究进展[J]. 福建农林大学学报(自然科学版),43(4):337-344. [Ren N N,Xie M,You Y C,You M S. 2014. An overview on the study of insect carboxylesterases(COEs) and the COE-mediated resistance to insecticides[J]. Journal of Fujian Agriculture and Forestry University(Natural Science Edition),43(4):337-344.]
滕霞,孙曼霁. 2003. 羧酸酯酶研究进展[J]. 生命科学学报,15(1):31-35. [Teng X,Sun M J. 2003. Advanees on carboxylesterase research[J]. Chinese Bulletiu of Life Scien-ces,15(1):31-35.]
王芮,张浩淼,邓蕾,肖倩倩,王秋霞,刘广娜,韩绍军,吴敏. 2017. 灰飞虱羧酸酯酶LsCarE1介导杀虫剂抗性[J]. 昆虫学报,60(9):1006-1012. [Wang R,Zhang H M,Deng L,Xiao Q Q,Wang Q X,Liu G N,Han S J,Wu M. 2017. Carboxylesterase LsCarE1 mediates insecticide resistance in Laodelphax striatellus(Hemiptera:Delphaci-dae)[J]. Acta Entomologica Sinica,60(9):1006-1012.]
徐春娟,刘永涛,艾晓辉,杨秋红,宋雅琪,胥宁. 2017. 溴氰菊酯在团头鲂体内的富集消除规律研究[J]. 西北农林科技大学学报(自然科学版),45(12):31-37. [Xu C J,Liu Y T,Ai X H,Yang Q H,Song Y Q,Xu N. 2017. Accumlation and elimination of deltamethrin in Megalobramaa amblycephala[J]. Journal of Northwest A & F University(Natural Science Edition),45(12):31-37.]
杨帅,王玲,赵奎军,韩岚岚. 2012. 大豆蚜羧酸酯酶基因AgCarE的克隆、表达及活性分析[J]. 中国农业科学,45(18):3755-3763. [Yang S,Wang L,Zhao K J,Han L L. 2012. Cloning,expression and activity analysis of carboxylesterase gene from Aphis glycines(Hemiptera:Aphididae)[J]. Scientia Agricultura Sinica,45(18):3755 -3763.]
张建琴,王燕,李大琪,杨美玲,张建珍,马恩波. 2014. 溴氰菊酯对飞蝗羧酸酯酶基因表达的影响[J]. 应用昆虫学报,51(2):418-424. [Zhang J Q,Wang Y,Li D Q,Yang M L,Zhang J Z,Ma E B. 2014. Effect of deltamethrin on carboxylesterase gene expression in Locusta migratoria[J]. Chinese Journal of Applied Entomology,51(2):418-424.]
张敏文,刘悦,李荷. 2012. 微生物酯酶的研究进展[J]. 广东第二师范学院学报,32(3):66-71. [Zhang M W,Liu Y,Li H. 2012. The research progress of microbial esterases[J]. Journal of Guangdong University of Education,32(3):66-71.]
朱曉晔,丁天波,许抗抗,周江,李灿,杨文佳. 2018. 烟草甲两个羧酸酯酶基因的克隆及表达模式[J]. 中山大学学报(自然科学版),57(4):136-144. [Zhu X Y,Ding T B,Xu K K,Zhou J,Li C,Yang W J. 2018. Cloning and expression analysis of two carboxylesterase genes in the cigarette beetle,Lasioderma serricorne(Coleoptera:Anobiidae)[J]. Acta Scientiarum Naturalium Universitatis Sunyatseni,57(4):136-144.]
Arrese E L,Soulages J L. 2010. Insect fat body:Energy,metabolism,and regulation[J]. Annual Review of Entomology,55:207-225.
Bornscheuer U T. 2002. Microbial carboxyl esterases:Classification,properties and application in biocatalysis[J]. FEMS Microbiology Reviews,26:73-81.
Chevillon C H,Raymond M I,Guillemaud T H,Lenormand T H,Pasteur N I. 1999. Population genetics of insecticide resistance in the mosquito Culex pipiens[J]. Biological Journal of the Linnean Society,68(1-2):147-157.
Cui F,Qu H,Cong J,Liu X L,Qiao C L. 2007. Do mosquitoes acquire organophosphate resistance by functional changes in carboxylesterases?[J]. FASEB Journal,21(13):3584-3591.
Devonshire A L,Sawicki R M. 1979. Insecticide-resistant Myzus persicae as an example of evolution by gene duplication[J]. Nature,280(5718):140-141.
Georghiou G P,Saito T. 1983. Pest Resistance to Pesticides[M]. New York:Plenum Press.
Kroetz D L,McBride O W,Gonzalez F J. 1993. Glycosyla-tion-dependent activity of baculoviru sexpressed human liver carboxylesterases:cDNA cloning and characterization of two highly similar enzyme forms[J]. Biochemistry,32(43):11606-11617.
Lee S O,Jeon J M,Oh C W,Kim Y M,Kang C K,Lee D S,Mykles D L,Kim H W. 2011. Two juvenile hormone esterase-like carboxylesterase cDNAs from a Pandalus shrimp(Pandalopsis japonica):Cloning,tissue expression,and effects of eyestalk ablation[J]. Comparative Biochemistry and Physiology(Part B:Biochemistry and Molecular Biology),159:148-156.
Li X C,Schuler M A,Berenbaum M R. 2007. Molecular mechanisms of metabolic resistance to synthetic and natural xenobiotics[J]. Annual Review of Entomology,52(1):231-253.
Lima A V B,Guerra A L,Almeida E A D,Gazzi T F,Castiglioni L. 2013. Characterization of esterase patterns in hepatopancreas of three species of Macrobrachium(Palaemonidae)[J]. Biochemical Systematics & Ecology,47:132-138.
Newcomb R D,Campbell P M,Ollis D L,Cheah E,Russell R J,Oakeshott J G. 1997. A single amino acid substitution converts a carboxylesterase to an organophosphorus hydrolase and confers insecticide resistance on a blowfly[J]. Proceedings of the National Academy of Sciences of the United States of America,94(14):7464-7468.
Poupardin R,Srisukontarat W,Yunta C,Ranson H. 2014. Identification of carboxylesterase genes implicated in temephos resistance in the dengue vector Aedes aegypti[J]. PLoS Neglected Tropical Diseases,8(3):e2743.
Ranson H,Claudianos C,Ortelli F,Abgrall C,Hemingway J,Sharakhova M V,Unger M F,Collins F H,Feyereisen R. 2002. Evolution of multigenee families associated with insectcide resistance[J]. Science,298(5591):179-181.
Schmittgen T D,Livak K J. 2008. Analyzing real-time PCR data by the comparative C(T) method[J]. Nature Protocols,3(6):1101-1108.
Shen H S,Hu Y C,Zhou X. 2014. Sex-lethal gene of the Chinese mitten crab Eriocheir sinensis:cDNA cloning,induction by eyestalk ablation,and expression of two splice variants in males and females[J]. Development Genes & Evolution,224(2):97-105.
Shen,H S,Zang,Y N,Song K,Ma Y C,Dai T H,Serwadda A. 2017. A meta-transcriptomics survey reveals changes in the microbiota of the Chinese mitten crab Eriocheir sinensis infected with hepatopanatic necrosis disease[J]. Frontiers in Microbiology,8:732. doi:10.3389/fmicb. 2017.00732.
Small G J,Hemingway J. 2000. Molecular characterization of the amplified craboxylesterase gene associated with organophosphorus insecticide resistance in the brown planthopper,Nilaparvata lugens[J]. Insect Molecular Biology,9(6):647-653.
Solé M,Sanchez-Hernandez J C. 2015. An in vitro screening with emerging contaminants reveals inhibition of carboxylesterase activity in aquatic organisms[J]. Aquatic Toxi-cology,169:215-22.
Tao T,Xie X,Liu M X,Jiang Q H,Zhu D F. 2017. Cloning of two craboxylesterase cDNAs from the swimming crab Portunus trituberculatus:Molecular evidences for their putative roles in methyl farnesotae degradation[J]. Comparative Biochemistry and Physiology(Part B:Biochemistry & Molecular Biology),203:100-107.
Xu Y,Zhao M Z,Deng Y F,Yang Y J,Li X G,Lu Q P,Ge J Ch,Pan J L,Xu Z Q. 2017. Molecular cloning,characteri-zation and expression analysis of two juvenile hormone esterase-like carboxylesterase cDNAs in Chinese mitten crab,Eriocheir sinensis[J]. Comparative Biochemistry & Physiology(Part B:Biochemistry & Molecular Biology),205:46-53.
Yan S,Cui F,Qiao C. 2009. Structure,function and applications of carboxylesterases from insects for insecticide resistance[J]. Protein and Peptide Letters,16(10):1181-1188.
Zhang J Q,Li D Q,Ge P T,Guo Y P,Zhu K Y,Ma E B,Zhang J Z. 2014. Molecular and functional characterization of cDNAs putatively encoding carboxylesterases from the migratory locust,Locusta migratoria[J]. PLoS One,9(4):e94809.
Zhu X J,Xiong Y,He W,Jin Y,Qian Y Q,Liu J,Dai Z M. 2018. Molecular cloning and expression analysis of a prawn(Macrobrachium rosenbergii) juvenile hormone esterase-like carboxylesterase following immune challenge[J]. Fish Shellfish Immunology,80:10-14.
(責任编辑 兰宗宝)
