玉米小斑病抗病鉴定接种体培养技术探讨
2019-09-10蒙成梁庆平黄艳花吴地蒋益敏吴烈
蒙成 梁庆平 黄艳花 吴地 蒋益敏 吴烈

摘要:【目的】研究不同谷物粒培养基配方及其培养条件对玉米小斑病菌产孢量的影响,为玉米小斑病大面积抗病鉴定工作提供保障。【方法】以玉米小斑病菌野生型菌株HX5为试材,探索18种植物组织培养基、9个温度梯度、9个培养时间段、7种高低温诱导和5种不同光照等条件对玉米小斑病菌分生孢子产量的影响。【结果】培养基的成分组合对玉米小斑病菌分生孢子产生起决定性作用,配方为高粱粒100 g+玉米叶15 g+MgSO4 0.2 g+Na3PO4 0.2 g的7号培养基产孢量最多,为16.8×104 个/g;24 ℃条件下培养产孢量最多;在20和24 ℃黑暗条件下,培养35 d时的产孢量最多;35 ℃高温、4 ℃低温诱导对玉米小斑病菌产孢量均有一定的促进作用,但经高、低温诱导后产生的部分分生孢子一端连接1节分生孢子梗;光暗交替各12 h、光照强度为2000 lx的产孢量最多,为4.6×105个/g。【结论】高粱粒100 g+玉米叶15 g+MgSO4 0.2 g+Na3PO4 0.2 g为玉米小斑病菌产孢最佳培养基,该培养基可显著促进病菌产生分生孢子;在24 ℃、光照强度2000 lx光暗交替各12 h的培养条件下,病菌的产孢量最多;在35 d内培养病菌,培养时间与产孢量成正比;35 ℃高温和4 ℃低温诱导对产孢量均有一定的促进作用。
关键词: 玉米;小斑病菌;接種体;产孢技术
中图分类号: S432.4 文献标志码: A 文章编号:2095-1191(2019)05-1001-06
Abstract:【Objective】The aim was to investigate the effects of different grain medium formulations and culture conditions on sporulation of Bipolaria maydis, and provide a guarantee for large-scale identification of resistance to southern corn leaf blight. 【Method】The effects of eighteen plant tissue-based media, nine temperature gradients, nine culture times, seven high and lowtemperature inductions and five different light intensities on conidium formation of wild-type strain HX5 of B. maydis were studied. 【Result】Component combinations of media played a decisive role in conidium formation. Medium No.7 containing 100 g sorghum grains + 15 g corn leaves + 0.2 g MgSO4 + 0.2 g Na3PO4 showed the highest sporulation(16.8×104 spore/g). Under 24 ℃, the sporulation was the highest. Under darkness at 20 and 24 ℃, sporulation reached the peak on day 35. Induction at 35 and 4 ℃ promoted sporulation of B. maydis to a certain extent. However, after high and lowtemperature induction, one end of partial formed conidia connected to a conidial peduncle. Under light-dark 12 h alternation and light intensity of 2000 lx, sporulation was the highest(4.6×105 spore/g). 【Conclusion】The optimal medium for sporulation of B. maydis is 100 g sorghum grains+15 g corn leaves+0.2 g MgSO4+0.2 g Na3PO4, which can significantly promote the conidium formation of B. maydis. Under 24 ℃, light intensity of 2000 lx and light-dark 12 h alternation, the sporulation is the highest. Within 35 d, the culture time is proportional to sporulation. Induction at 35 and 4 ℃ promote sporulation of B. maydis to a certain extent.
Key words: corn; Bipolaria maydis; inoculums; sporulation technology
0 引言
【研究意义】玉米小斑病(Southern corn leaf blight,SCLB)是世界玉米主产区的重要病害(陈利峰,2002),是我国温暖潮湿玉米产区的主要叶部病害(赵聚莹等,2010),在玉米全生育期均可发生,发病高峰期在植株抽雄后。自20世纪60年代以来,随着我国感病玉米杂交品种的推广应用,玉米小斑病危害日趋严重,感病品种在一般发病年份可减产10%以上,严重发生年份减产20%~30%(龚现丽,2010)。因此,选育抗病自交系和杂交种是防治玉米小斑病最经济有效的措施(李洪连和徐敬友,2001;董怀玉等,2005;艾堂顺等,2018)。在选育与利用抗病品种过程中,开展玉米小斑病抗病性鉴定是常规工作,其常用方法是将培养好的带菌接种体植入玉米喇叭口中或用病菌孢子悬浮液对玉米植株进行喷雾。因此,进行大田抗病性鉴定接种需要大量的接种体,而获得带大量分生孢子的接种体或获得大量分生孢子是顺利开展玉米小斑病抗病性接种鉴定的基础条件。【前人研究进展】在不同营养及培养环境条件下,病菌分生孢子产孢效果存在明显差异。陈颖等(2003)采用燕麦、玉米、查理、彼查、PDA及PDA+宿主叶片、PDA+VB1等7种固体培养基培养玉米小斑病菌C小种,结果表明,PDA+VB1和PDA+宿主叶片2种培养基培养的菌株,其菌丝生长速度、产孢量和致病力均显著高于其他培养基。谢红辉(2010)研究不同培养温度、不同培养pH和不同营养条件对玉米小斑病病菌菌丝生长量及产孢量的影响,结果表明,以PDA+VB1为固体培养基培养的菌丝生长速率及产孢量最大,在30 ℃下培养菌丝生长速率快且产孢量大,在25 ℃下培养病菌孢子萌发速度最快,病菌菌丝在pH为8的条件下生长速度最快且生长量最大。杨丽敏(2012)采用不同保存方法测定玉米小斑病菌产孢量、菌丝生长速度及对菌株致病力的影响,结果表明,保存玉米小斑病菌菌株时,用大麦作固体培养基,湿度为10%左右,置于5 ℃冰箱短时间(1个月)或长时间(7个月)保存,菌丝生长速度和产孢量最佳,均优于玉米培养基和小麦培养基,且菌株致病力得到较好地保持。代玉立等(2016)以福建省建瓯、沙县和福州地区的3株玉米小斑病菌菌株为对象,研究温度、湿度、pH、光照、营养对病菌菌丝生长、产孢量和孢子萌发的影响,结果表明,菌丝生长最适温度和pH为30 ℃和pH 6、产孢最适温度和pH为25 ℃和pH 6~7、孢子萌发最适温度和pH为25~28 ℃和pH 6,光照能显著抑制病菌产孢,在相对湿度为85%和95%条件下或在水琼脂培养基表面上,孢子萌发率分别为50%、88%和90%;葡萄糖、乳糖、甘露醇、可溶性淀粉适宜病菌菌丝生长和产孢,而尿素、硫酸铵、硝酸铵和氯化铵能显著抑制菌丝生长、产孢和孢子萌发;菌丝体的致死温度为65 ℃ 10 min或60 ℃ 30 min,分生孢子的致死温度为60 ℃ 10 min或55 ℃ 30 min;3株菌株的产孢特性、菌丝致死温度和致病力均存在明显差异。以高粱粒为主料配制成的固体培养基是目前玉米小斑病菌繁殖常用的培养基(王晓鸣等,2010)。冯胜泽等(2017)用高粱粒外的其他固体培养基进行病菌产孢试验,结果发现产孢量最大的培养条件为玉米叶葡萄糖琼脂培养基,碳源为乳糖,培养温度25 ℃、pH 8、光照强度6000 lx、光照条件光暗交替各12 h;此外,发现在培养基中添加 KNO3可显著提高产孢量。杨秀娟等(2018)发明“一种玉米小斑病菌产孢培养基及其制备方法和应用”专利,该方法利用马铃薯、甘露醇、琼脂粉和水为固体培养基进行产孢试验,其病菌产孢量是等量PDA培养基产孢量的1.2~3.6倍。【本研究切入点】前人开展玉米小斑病接种鉴定时,接种体繁殖通常采用固体培养基进行培养,操作过程繁琐,不能直接用带病菌的接种体进行接种;同时,开展大面积抗病性鉴定时工作量大,操作过程制备的接种体通常存在污染率高、滋长小昆虫、制备慢且产孢效果不理想等缺点。目前,利用谷物粒培养基培养玉米小斑病菌及产孢因素的研究报道较少。【拟解决的关键问题】以高粱粒、小麦粒和玉米粒为主要材料,以玉米叶、甘露醇(C6H14O6)、碳酸钾(K2CO2)、硫酸镁(MgSO4)和磷酸钠(Na3PO4)等为配料,单因素组配18种培养基为供试培养基,同时对培养时间、温度、光照、高低温诱导等影响玉米小斑病菌产孢因素进行探讨,明确影响玉米小斑病菌产孢最佳谷物粒培养基配方及其培养方法,为玉米小斑病抗病性鉴定工作的简化性、时效性、准确性提供保障。
1 材料与方法
1. 1 试验材料
1. 1. 1 供试菌株 玉米小斑病菌野生型菌株HX5采集于广西农业职业技术学院作物研究所玉米试验地感病病株并分离获得,采用常规方法进行病原菌分离与培养,用单细胞进行纯化,参照柯赫氏法则进行病菌验证,最终获得纯化菌株(方中达,1998)。
1. 1. 2 供试培养基 以玉米粒、小麦粒和高粱粒为主料,以玉米叶、C6H14O6、K2CO2、MgSO4、Na3PO4等为配料,单因素组配18种培养基为供试培养基(表1)。制作方法步骤:(1)挑选大小一致、无病虫的玉米粒、小麦粒和高粱粒。(2)玉米粒浸泡12~15 h,大火煮沸温火熬制1 h,水洗沥干备用;小麦粒浸泡20 min,大火煮沸再温火煮15 min,水洗沥干备用;高粱粒大火煮沸再温火煮25 min,水洗沥干备用;新鲜玉米叶切成约1 cm2大小备用。(3)按配方称取原料并混匀,湿度以培养基湿润手握无滴水为度。(4)用300 mL三角瓶分装配好的培养基,每瓶定量分装100 g。(5)将制作好的培养瓶121 Pa高压灭菌45 min。
1. 2 不同培养条件对产孢量的影响
1. 2. 1 培养基对产孢量的影响 供试培养基为单因素组配的18种培养基,每种培养基配方为一个处理,3次重复。供试菌种在培养皿(直径9 cm)中的马铃薯葡萄糖琼脂培养基(PDA)上繁殖,待菌丝长满培养皿后,用镊子把带菌丝的培养基割成小粒,每皿菌种平均分别接种到2份供试培养基上(下同)。接种并摇均后的培养瓶置于全黑暗、24 ℃恒温人工气候箱中培养11 d,测定产孢量。
1. 2. 2 培养温度对产孢量的影响 供试培养基为7号培养基(高粱粒100 g+玉米叶15 g+MgSO4 0.2 g+Na3PO4 0.2 g),设9个温度梯度(12、16、20、24、26、28、32、36和40 ℃),黑暗培养11 d(刘静等,2014),3次重复。设A、B两个因素:A因素为接种后带培养基瓶直接分别放入各温度培养11 d后测定产孢量;B因素为接种后带培养基瓶放入26 ℃全黑暗下培养5 d,菌丝长满培养基后转入各温度中继续培养,6 d后测定产孢量。
1. 2. 3 培养时间对产孢量的影响 供试培养基为7号培养基,接种处理后的培养瓶分别置于20和24 ℃黑暗条件培养箱中培养,依次于第5、7、9、11、15、20、25、30和35 d 9个培养时间段测定产孢量,3次重复。
1. 2. 4 高、低温诱导对产孢量的影响 供试培养基为7号培养基,把接种后的培养基瓶放入26 ℃全黑暗下培养5 d,菌丝长满培养基后转入各高、低温进行诱导处理,处理结束后置于24 ℃黑暗条件,诱导时间加继续培养共11 d,测定产孢量。设7个处理:4 ℃ 12 h、4 ℃ 24 h、4 ℃ 48 h、35 ℃ 12 h、35 ℃ 24 h、35 ℃ 48 h和对照(26 ℃全黑暗下培养5 d后直接转入24 ℃黑暗培養6 d)(张立杰等,2015),3次重复。
1. 2. 5 光照对产孢量的影响 供试培养基为7号培养基,设5种不同光照处理,分别为:24 h光照(光照强度3000 lx)、12 h光照(3种不同光照强度梯度1500、2000和3000 lx )12 h黑暗和24 h黑暗,病菌在不同光照处理下24 ℃恒温培养11 d(冯胜泽等,2017)。
1. 3 产孢量测定方法
各处理随机取带病菌接种体2 g,置于50 mL的烧杯中,加无菌水10 mL,为确保带病菌接种体所产生的分生孢子脱落水里,用坚固勺子连续搅拌约100次,纱布过滤即得到玉米小斑病菌孢子悬浮液,用血球计数法测定孢子悬浮液浓度,计算产孢量,每个培养瓶取样3次,每个样本读数3次,取平均值进行比较。
1. 4 统计分析
试验数据用Excel 2007和DPS 7.55进行整理与分析。
2 结果与分析
2. 1 培养基对玉米小斑病菌产孢量的影响
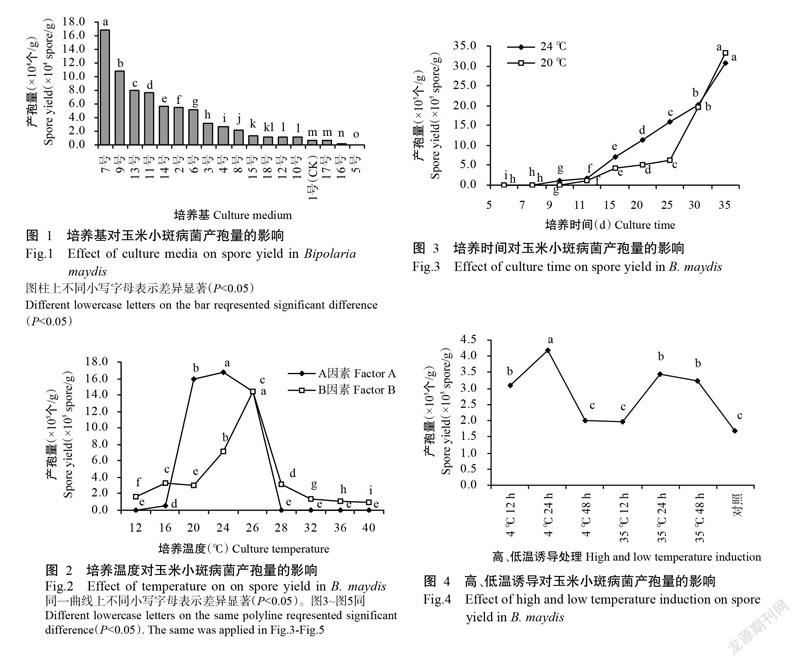
由图1可知,除17、16和5号培养基产胞量低于1号培养基(CK)外,其余培养基的产胞量均显著高于CK(P<0.05,下同),其中,7号培养基(高粱粒100 g+玉米叶15 g+MgSO4 0.2 g+Na3PO4 0.2 g)的产孢量最多,为16.8×104个/g;9号培养基(玉米粒100 g+玉米叶15 g+MgSO4 0.2 g+ Na3PO4 0.2 g)次之,产孢量为10.8×104个/g;其后依次为13、11、14、2、6、3、4、8、15、18、12和10号培养基;常用高粱粒培养基(CK)的产孢量为6.8×103个/g,17号培养基的产孢量与CK相当,差异不显著(P>0.05,下同),而16和5号培养基的产孢量显著少于CK,分别为2.2×103和5.4×102个/g。可见,玉米小斑病菌在7号培养基上培养产孢量最多。
2. 2 培养温度对玉米小斑病菌产孢量的影响
由图2可知,不同培养温度对玉米小斑病菌产孢量具有明显影响,过高或过低均不利于玉米小斑病菌分生孢子的产生,其中,A因素多集中于20~26 ℃产孢,24 ℃时产孢量最多,且显著多于其他温度处理,≤12 ℃或≥32 ℃均不产孢;B因素在温度为12~40 ℃下均可产生分生孢子,26 ℃时产孢量显著高于其他温度处理,24 ℃时的产孢量次之。可见,玉米小斑病菌分生孢子产生的最适宜温度为24 ℃,最佳方法是将接种后的培养瓶直接置于24 ℃下培养。
2. 3 培养时间对玉米小斑病菌产孢量的影响
从图3可看出,培养时间对玉米小斑病菌产孢具有明显影响。玉米小斑病菌在20 ℃黑暗条件下培养11 d开始产孢,在11~35 d内,产孢量随培养时间的延长而显著增加;在24 ℃黑暗条件培养9 d开始产孢,在9~35 d内,产孢量随培养时间的延长而显著增加。可见,在20和24 ℃黑暗条件下培养,培养时间与产孢量成正比,该病菌连续培养35 d产孢量最多。
2. 4 高、低温诱导对玉米小斑病菌产孢量的影响
由图4可知,4 ℃冷冻24 h处理的产孢量显著高于其他处理,为4.2×105个/g;35 ℃热激24 h处理的效果次之,产孢量为3.5×105个/g;35 ℃热激48 h和4 ℃冷冻12 h处理的产孢量与35 ℃热激24 h处理的产孢量相当,差异不显著;4 ℃冷冻48 h和35 ℃热激12 h处理的产孢量与对照差异不显著。试验还发现,经高、低温诱导后产生的部分分生孢子一端有连接1节分生孢子梗现象。
2. 5 光照对玉米小斑病菌产孢量的影响
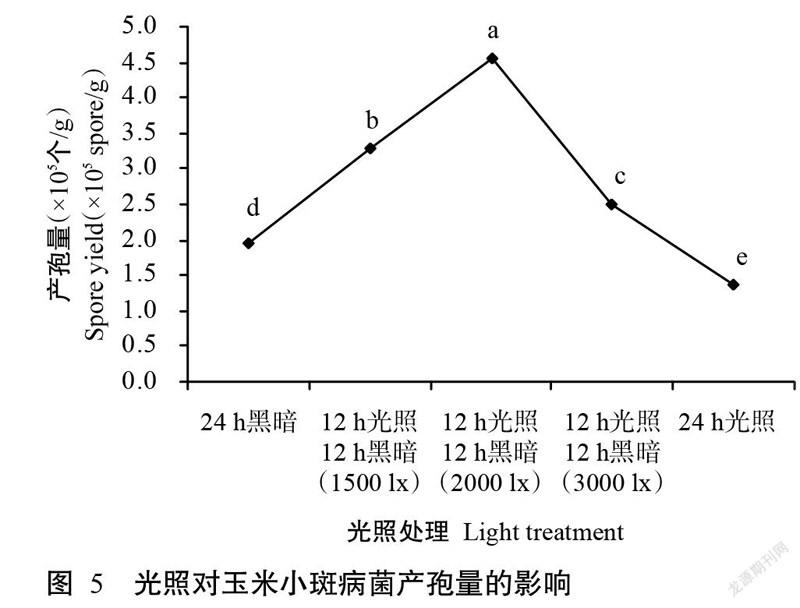
从图5可看出,适量光照对玉米小斑病菌产孢具有促进作用,过暗或过亮均不利于该病菌产孢。其中,高强度光照即连续24 h光照最不利于产孢,产孢量仅为1.4×105个/g;连续24 h黑暗亦不利于产孢,产孢量为1.9×105个/g;12 h光照(光照强度2000 lx)12 h黑暗条件下的产孢量最多,为4.6×105个/g;12 h光照(光照强度1500 lx)12 h黑暗条件下的产孢量次之,为3.3×105个/g;12 h光照(光照强度3000 lx)12 h黑暗条件会抑制病菌分生孢子产孢,产孢量为2.5×105个/g。
3 讨论
方中达(1998)认为培养基是影响病菌产孢的最重要因素,促进分生孢子产生的最主要途径是采用不同培养基或改变培养基成分;刘丽丽等(2014)认为培养基不同会明显影响多数茄链格孢产孢量。为此,前人开展了大量有关培养基促进产孢量的研究工作。庄义庆等(2008)研究表明,促进蕉斑镰刀菌液体摇瓶产孢的最佳培养液为绿豆汤培养液,该培养液在适宜条件下的产孢量达1×106个/mL;赵红等(2012)研究发现,苹果腐烂病菌在加蜂蜜水和蛋白胨的带壳大麦上能大量产孢;兰成忠等(2013)认为胡萝卜培养基是促进辣椒疫霉菌产生孢子囊数量最多的培养基。本研究通过18种不同配方的谷物粒培养基对玉米小斑病菌进行产孢诱导筛选,结果表明,产孢量最多的培养基是配方为高粱粒100 g+玉米叶15 g+MgSO4 0.2 g+Na3PO4 0.2 g的7号培养基,产孢量为16.8×104个/g,其次是配方为玉米粒100 g+玉米叶15 g+MgSO4 0.2 g+Na3PO4 0.2 g的9号培养基,产孢量为10.8×104 个/g,说明7和9号培养基配方适宜玉米小斑病菌产孢。王晓梅等(2007)研究表明,玉米小斑病菌产孢适宜温度为20~30 ℃,最适温度为26 ℃,5 ℃以下或35 ℃以上均不能产孢;代玉立等(2016)研究表明,玉米小斑病菌产孢最适温度为25 ℃。本研究发现,在12 ℃以下或32 ℃以上时玉米小斑病病原菌菌丝体生长缓慢,不能产孢;16~28 ℃时病原菌菌丝生长速度快,能产孢;20~26 ℃时病原菌产孢量迅速增加,24 ℃下产孢量最多;长菌丝后的培养基转入各温度中进行继续培养均可产孢,26 ℃产孢量最高,24 ℃次之。说明玉米小斑病菌的菌丝生长温度条件高于分生孢子产生的条件,菌丝一但生成,在較高和较低温度条件下均能产生分生孢子,可能是玉米小斑病菌能在全世界玉米产区发生的重要原因。
本研究发现,培养时间对玉米小斑病菌产孢量具有明显影响,在7号培养基上,病菌在20和24 ℃黑暗条件下的产孢量与培养时间成正比,该病菌连续培养35 d时产孢量最多。玉米小斑病菌在其余配方的培养基上培养,培养时间与产孢量是否也成正比尚有待进一步研究。此外,本研究发现培养35 d后容易滋生杂菌,因此未继续培养。这是否与培养时间过长或生长环境等因素有关,尚有待进一步探究。
本研究发现35 ℃高温和4 ℃低温诱导对玉米小斑病菌产孢量均有一定的促进作用,但经过高、低温诱导后产生的部分分生孢子一端连接1节分生孢子梗,对分生孢子的活性是否产生影响也有待进一步探究。此外,适量光照对玉米小斑病菌产孢具有促进作用,过暗或过亮均不利于该病菌产孢。7号培养基在12 h光照12 h黑暗交替且光照强度为2000 lx时的产孢量最多,与前人研究认为光照能显著抑制病菌产孢的结果(陈利峰,2002)存在差异,需进一步通过试验验证。
4 结论
玉米小斑病菌产孢的最佳组织培养基配方为高粱粒100 g+玉米叶15 g+MgSO4 0.2 g+Na3PO4 0.2 g,该培养基可显著促进病菌产生分生孢子;该培养基在24 ℃、光照强度2000 lx光暗交替各12 h时产孢量最多;在35 d内培养病菌,培养时间与产孢量成正比;35 ℃高温、4 ℃低温诱导对病菌产孢量均有一定的促进作用,但诱导后产生的部分分生孢子形态发生改变。
参考文献:
艾堂顺 ,田志强,李会敏,邓策,丁俊强,张学林,刘海富,朱伟岭,李志敏. 2018. 玉米南方锈病抗病QTL鉴定和效应分析[J]. 河南农业大学学报,52(4):514-518. [Ai T S,Tian Z Q,Li H M,Deng C, Ding J Q,Zhang X L,Liu H F,Zhu W L,Li Z M. 2018. Mapping and effectiveness analysis for resistance genes of southern corn rust in maize[J]. Journal of Henan Agricultural University,52(4):514-518.]
陈利峰. 2002. 农业植物病理学[M]. 北京:中国农业出版社:189. [Chen L F. 2002. Agricultural Phytopathology[M]. Beijing: China Agriculture Industry Press:189.]
陈颖,郝丽梅,王立安. 2003. 不同培养基对玉米小斑病菌生长繁殖及致病力的影响[J]. 河北师范大学学报(自然科学版),27(2):192-194. [Chen Y,Hao L M,Wang L A. 2003. Effects of different media on the growth reproduction
and pathogenicity of Bipolaris maydis race C[J]. Journal of
Hebei Normal University(Natural Science Edition),27(2):
192-194.]
代玉立,甘林,阮宏椿,廖蕾,石妞妞,杜宜新,陈福如,杨秀娟. 2016. 福建省玉米小斑病菌的生物学特性研究[J]. 中国农学通报,32(31):131-137. [Dai Y L,Gan L,Ruan H C,Liao L,Shi N N,Du Y X,Chen F R,Yang X J. 2016. Biological characteristics of Bipolaris maydis in Fujian Province[J]. Chinese Agricultural Science Bulletin,32(31):131-137.]
董怀玉,姜钰,王丽娟,徐秀德. 2005. 玉米种质资源抗灰斑病鉴定与评价[J]. 植物遗传资源学报,6(4):441-443. [Dong H Y,Jiang Y,Wang L J,Xu X D. 2005. Evaluation on maize germplasm resources for resistanceto gray leaf spot[J]. Journal on Plant Genetic Resources,6(4):441-443.]
方中达. 1998. 植病研究法[M]. 第3版. 北京:中国农业出版社. [Fang Z D. 1998. Plant Disease Study[M]. The 3rd Edition. Beijing: China Agriculture Press.]
冯胜泽,刘星晨,王海祥,赵洁,赵立卿,鄭亚男,巩校东,韩建民,谷守芹,董金皋. 2017. 玉米大斑病菌分生孢子形成的影响因素及GATA转录因子家族的表达分析[J]. 中国农业科学,50(7):1234-1241. [Feng S Z,Liu X C,Wang H X,Zhao J,Zhao L Q,Zheng Y N,Gong X D,Han J M,Gu S Q,Dong J G. 2017. Influencing factors of conidiospore and expression analysis of GATA transcription factor gene family in Setosphaeria turcica[J]. Scientia Agricultura Sinica,50(7):1234-1241.]
龚现丽. 2010. 夏玉米小斑病的发生与防治[J]. 河南农业,(17):19. [Gong X L. 2010. Occurrence and prevention of small spot disease in summer maize[J]. Agriculture of Henan,(17):19.]
兰成忠,刘裴清,李本金,陈庆河,翁启勇. 2013. 辣椒疫霉菌产孢培养基及诱导方法筛选[J]. 热带作物学报,34(9):1776-1780. [Lan C Z,Liu P Q,Li B J,Chen Q H,Weng Q Y. 2013. Screening of medium and induction method for sporangia production of Phytophthora capsici[J]. Chinese Journal of Tropical Crops,34(9):1776-1780.]
李洪连,徐敬友. 2001. 农业植物病理学实验实习指导[M]. 北京: 中国农业出版社. [Li H L,Xu J Y. 2001. Agricultural Plant Pathology Experiment Practice Guidance[M]. Beijing: China Agriculture Press.]
刘静,李国华,周明,许丽月,肖春云. 2014. 橡胶树白粉菌分生孢子萌发条件及存活时间的研究[J]. 西南农业学报,27(1):151-155. [Lui J,Li G H,Zhou M,Xu L Y,Xiao C Y. 2014. Study on conditions of conidial germination and survival time of Oidium heveae[J]. Southwest China Jour-nal of Agricultural Sciences,27(1):151-155.]
刘丽丽,朱杰华,崔亚婧,杨志辉,徐进,路文雅. 2014. 培养条件对茄链格孢产孢的影响[J]. 菌物学报,33(3): 659-667. [Lui L L,Zhu J H,Cui Y J,Yang Z H,Xu J,Lu W Y. 2014. Effects of culture conditions on sporulation of Alternorio soloni[J]. Mycosystema,33(3): 659-667.]
王晓梅,吕平香,李莉莉,见德宝,杨信东. 2007. 玉米小斑病重要流行环节的初步定量研究Ⅱ病斑产孢、孢子飞散、杀菌剂筛选[J]. 吉林农业大学学报,29(2):128-132. [Wang X M,Lü P X,Li L L,Jian D B,Yang X D. 2007. Preliminary quantitative studies on important epidemic links of
Bipolaris maydis Ⅱ. lesion spomlation,spore dispersion
and fungicide screening[J]. Journal of Jilin Agricultural U-
niversity,29(2):128-132.]
王晓鸣,石洁,晋齐鸣,李晓,孙世贤. 2010. 玉米病虫害田间手册:病虫害鉴别与抗性鉴定[M]. 北京:中国农业科技出版社. [Wang X M,Shi J,Jin Q M,Li X,Sun S X. 2010. Field Manual of Maize Diseases and Insect Pests: Identification of Pests and Diseases and Identification of Resistance[M]. Beijing: China Agricultural Science and Technology Press.]
谢红辉. 2010. 玉米小斑病菌生物学特性研究[J]. 广西热带农业,(6):1-4. [Xie H H. 2010. Study on the biological cha-racteristics of Bipolaris maydis[J]. Guangxi Tropical Agriculture,(6):1-4.]
杨丽敏. 2012. 影响玉米小斑病抗性鉴定的因子分析及病菌生物学特性研究[D]. 合肥:安微农业大学. [Yang L M. 2012. Impact factor of resistance identification to slb and the biological characteristics of pathogenic fungi[D]. Hefei:Anhui Agricultural University.]
楊秀娟,陈福如,甘林,阮宏椿,杜宜新,石妞妞. 2018. 一种玉米小斑病菌产孢培养基及其制备方法和应用:中国,104962510B[P]. 2018-04-24. [Yang X J,Chen F R,Gan L,Ruan H C,Du Y X,Shi N N. 2018. The invention relates to a spore-producing culture medium of corn-spot bacteria and its preparation method and application:China,104962510B[P]. 2018-04-24.]
张立杰,张慧玲,哈矿武,王建设. 2015. 甜瓜蔓枯病病原菌分离与分生孢子的产孢诱导[J]. 宁夏大学学报(自然科学版),36(4):382-385. [Zhang L J,Zhang H L,Ha K W,Wang J S. 2015. Isolation and identification of pathogen of didymellabryoniae and spore production induction of condium[J]. Journal of Ningxia University(Natural Science Edition),36(4):382-385.]
赵红,王彩霞,陈晓忍,王海艳,李保华. 2012. 苹果腐烂病菌诱导产孢方法[J]. 中国农学通报,28(10): 151-154.[Zhao H,Wang C X,Chen X R,Wang H Y,Li B H. 2012. Methods of promoting sporulation of Valsa ceratosperma[J]. Chinese Agricultural Science Bulletin,28(10):151-154.]
赵聚莹,屈振刚,贾海民,陈丹,李术臣. 2010. 不同玉米品种对小斑病强致病力菌的抗病性检测[J]. 河北农业科学,14(9):66-67. [Zhao J Y,Qu Z G,Jia H M,Chen D,Li S C. 2010. Detection of resistance of maize varieties to virulent strain of southern leaf blight[J]. Journal of Hebei Agricultural Sciences,14(9):66-67.]
庄义庆,乔广行,王源超,何东兵,郑小波. 2008. 蕉斑镰刀菌3-26菌株产孢条件研究[J]. 南京农业大学学报,31(4):77-81. [Zhuang Y Q,Qiao G X,Wang Y C,He D B,Zheng X B. 2008. Conditions for mass production of Fusarium stoveri isolate 3-26 spore in liquid and solid culture[J]. Journal of Nanjing Agricultural University,31(4):77-81.]
(责任编辑 麻小燕)
