产几丁质酶菌株的分离鉴定及产酶条件探究
2019-09-10左一萌石晓玲潘晓梅王欢尹永得董雪滢王超
左一萌 石晓玲 潘晓梅 王欢 尹永得 董雪滢 王超

[摘要]在甘肃省兰州市黄河沿岸的土壤中分离出一株产几丁质酶的菌株1-1-1,对其进行生理生化特征鉴定、菌落形态鉴定,提取其基因组DNA,扩增16SrDNA,经对比分析,建立系统进化树。研究结果显示,菌株1-1-1与标准地衣芽孢杆菌为一个类群,同源性高达99%,将其鉴定为地衣芽孢杆菌。再以2%几丁质胶体作为唯一碳源,对其产几丁质酶的特性进行探究,结果表明,在培养温度为35℃、pH值为8.0、最佳接种量为5%、2%几丁质胶体为唯一碳源时,该菌株产酶量最大,酶活力最大值为1.15U/mL。
[关键词]几丁质酶;产酶工艺优化;鉴定
中图分类号:S917.1 文献标识码:A DOI:10.16465/j.gste.cn431252ts.20190518
几丁质是N-乙酰氨基葡萄糖聚合成的高分子多糖,大量存在于虾壳、蟹壳和其它节肢动物外壳、低等植物(藻类)中。相关统计表明,每年在天然聚合物与含氮有机物中,几丁质产量均为第2,位于第1的分别是纤维素和蛋白质[1]。Benecke[2]在研究几丁质芽孢杆菌时发现了几丁质酶(Chitinase),可水解几丁质产生N-乙酰葡糖胺或单体糖苷。几丁质酶有着良好的抗菌与抑制肿瘤的作用,在医药行业被广泛地应用,在食品、农业、环境保护等诸多领域几丁质酶也有良好的应用。目前,酶解法是几丁质的最佳利用途径,然而由于其多样复杂、自然界纯化得到的几丁质酶活性低等因素,几丁质酶并未真正实现大规模工业化[3]。想要高效利用几丁质这一丰富的资源,分离筛选出高效产几丁质酶的菌株显得十分重要。
本试验拟在甘肃省兰州市黄河沿岸区域的表层土壤中筛选几丁质酶的产生菌株,并对其进行生理生化分析和分子鉴定,对菌株产酶条件进行研究,以期为几丁质进一步的研究与应用提供理论基础。
1 材料与方法
1.1 材料
1.1.1 土壤样品
兰州市黄河沿岸区域表层5~10cm的土壤。
1.1.2 培养基
(1)分离培养基。1.5 g的NaCl、0.3 g的KH2PO4、0.7 g的K2HPO4、0.02 g的FeSO4·H2O、0.5 g的MgSO4、20 g的琼脂、250 mL的2%几丁质胶体,添加蒸馏水至1 000 mL,pH值调整为中性[4]。(2)发酵培养基。5.0 g的NaCl、10.0 g的蛋白胨、500 mL的2%几丁质胶体,其他成分及用量同分离培养基,添加蒸馏水至1 000 mL,pH值调整为中性。(3)其他:牛肉膏蛋白胨培养基(种子培养)和LB培养基(菌种活化)。
1.2 方法
1.2.1 胶体几丁质的制备
将预先冷却的300 mL浓盐酸缓慢倒入含有20 g几丁质粉末的干燥烧杯中,用100 mL蒸馏水搅拌成糊状,放入4 ℃冰箱中溶胀24 h后将混合液倒入大烧杯,加入蒸馏水搅匀[4]。在转速为5 000 r/min的离心机中离心10 min,弃上清液,水洗沉淀,反复离心、水洗至中性,蒸馏水定容至1 000 mL即可。
1.2.2 产酶菌株的筛选
(1)初筛。取10 g样品与90 mL无菌水混合制成土壤悬液,经高温处理后进行梯度稀释,涂布在几丁质胶体为唯一碳源的平板上,在35 ℃恒温箱中培养。当几丁质被水解后,挑取周围产生透明圈的菌落,划线纯培养。(2)复筛。将上述纯培养菌落接入种子培养基,将振动筛转速调整到180 r/min,并在35 ℃条件下培养1 d后,转入发酵培养基(接种量5%),同条件下继续培养,每隔一定时间取上清测定酶活力并记录[5]。
1.2.3 标准曲线的绘制
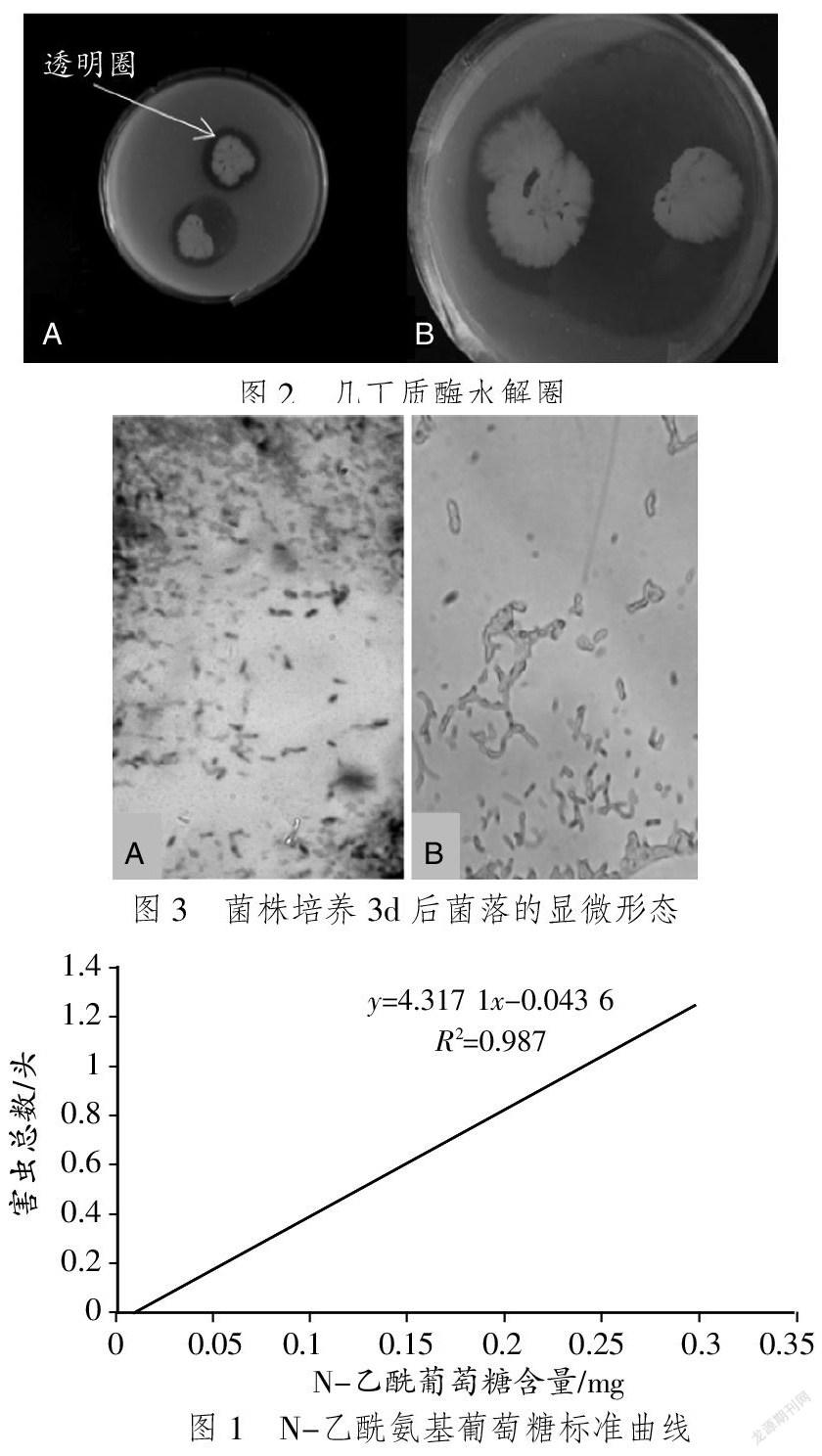
蔡莉[6]研究了DNS试剂的制备。制备等浓度梯度的N-乙酰氨基葡萄糖溶液,各取1 mL,50 ℃保温1 h,加入1 mL的DNS,煮沸显色5 min,在冰水浴中冷却后,测量540 nm波长处样品的吸光值并绘制标准曲线。N-乙酰氨基葡萄糖标准曲线见图1。
1.2.4 酶活力的测定
酶活力是指在50 ℃水浴中,每小时1 mL培养液分解几丁质生成1 mg的N-乙酰氨基葡萄糖所需的酶量。
DNS法:样品以5 000 r/min的转速离心5 min,所得上清液即為粗酶液,取粗酶液0.5 mL,加入0.5 mL的pH值为6.81的磷酸缓冲液,再加入等体积的2%几丁质胶体,置于50 ℃水浴中静置1 h,以5 000 r/min的速度离心10 min,在上清液中加入1 mL的DNS试剂,煮沸5 min[7]。冰水浴迅速冷却后稀释5倍,对照组是同条件下的灭活10 min的酶液,分别测量并记录540 nm波长下各个样品的吸光度,并根据图1转换酶活力。
1.3 菌种鉴定
1.3.1 结构与形态特征
参照《微生物学实验手册》[8],对1-1-1菌株的形态特征进行详细观察。
1.3.2 16SrDNA基因扩增
使用细菌16SrDNA通用引物(上游5'-agaggtttg atggctag-3',下游5'-gttaccttgttacgactt-3')进行聚合酶链反应,循环30次,获得菌株16SrDNA,通过凝胶电泳分离扩增到的DNA片段,用试剂盒回收纯化后送至专门机构测序[9]。
1.3.3 序列分析及系统发育树的构建
利用序列对比工具BLAST对其进行同源性分析、系统发育分析,并用MEGA 7.0软件制作系统发育树。
2 结果与分析
2.1 产几丁质酶菌种的筛选
在35 ℃条件下,以胶体几丁质为唯一碳源的平板上培养2~5 d后,用透明圈法从样品中初步分离出3株目标菌。其中1-1-1菌株的几丁质酶活性最高,选其为研究对象。几丁质酶水解圈见图2。
2.2 菌落的形态特征
该菌株在LB培养基上培养3d后,菌株的菌落粗糙、不透明、黏附且延展。显微观察到该菌呈杆状,细胞宽约为0.7 μm、长约为2.0 μm,革兰氏染色呈阳性,有芽孢,且菌体形状呈椭圆形或柱形。菌株培养3 d后菌落的显微形态见图3。
2.3 1-1-1菌株与病原真菌的对峙实验
番茄早疫病、棉花枯萎病、灰霉病均属于真菌病害。现研究1-1-1菌株对上述病原菌的抑制能力,分别接种1-1-1菌株与番茄早疫病菌、棉花枯萎病菌、灰霉病菌对峙培养,取3种病原菌单独培养的平板为对照,35 ℃培养3 d后观察其抑菌情况[10]。1-1-1菌株与病原真菌的对峙实验见图4,结果显示,该几丁质酶产生菌株对三种病原真菌均有抑制作用,其中对灰霉病菌的抑制作用最强。
2.4 1-1-1 16SrDNA扩增与序列分析
2.4.1 菌株基因组DNA序列测定
用1%的琼脂糖电泳法分离1-1-1菌株的基因组DNA,作为16SrDNA扩增的模板,测序得到1-1-1菌株的基因组DNA序列,具体见图5。
2.4.2 系统发育树的构建
取Gen Bank数据库中与1-1-1菌株基因序列相似度较高的种属16SrDNA序列进行BLAST比较,用MEGA 7.0软件建立系统发育树,具体见图6[11]。发育树是无根树,重复次数为1 000。序列对比后得知该序列与地衣芽孢杆菌序列相似度最高,为99.0%。按照16SrDNA在菌种鉴定中的要求,可以将本菌株与地衣芽孢杆菌视为同一个种,最终将1-1-1菌株鉴定为Bacillus licheniformis。
2.5 菌株产酶条件探究
2.5.1 接种量对酶活力的影响
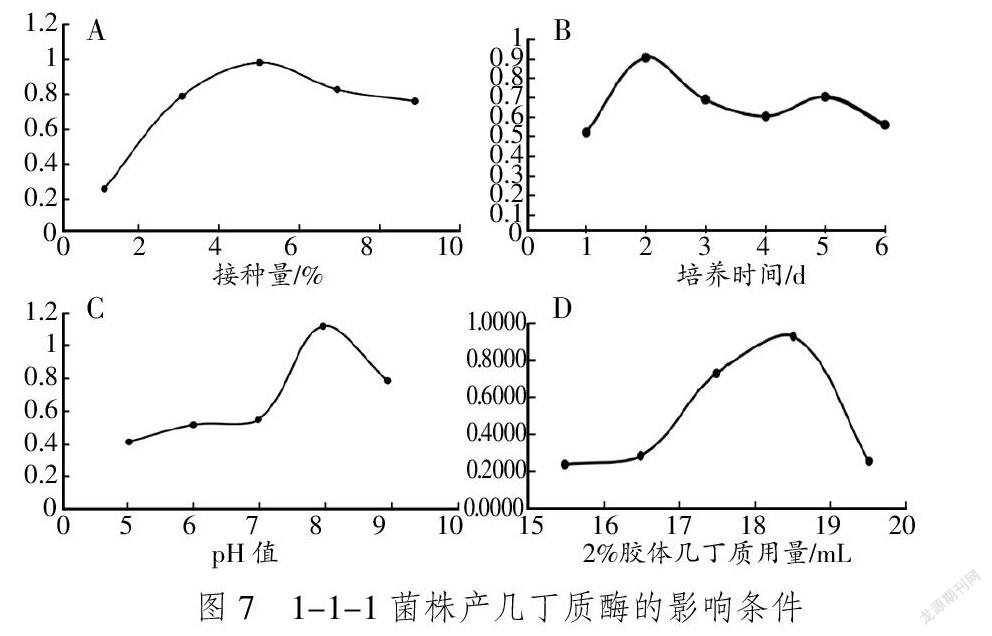
单一变量法研究1%、3%、5%、7%和9%的接种量对酶活性的变化,结果显示,酶的活性随接种量的增加先增加后降低,最佳接种量为5%。
2.5.2 培养时间对酶活力的影响
发酵培养基以最佳接种量接入菌悬液。培养1 d后每隔24 h测一次酶活力[12]。结果显示,1-1-1菌株产酶活力在培养48 h时达到最大值,后随着培养时间先下降在第5 d时有缓慢回升又下降。
2.5.3 产酶的最适pH值
当温度为35 ℃、接种量为5%时:在pH值为5.0~7.0时,几丁质酶活力缓慢上升;pH值为7.0~8.0时,几丁质酶活力迅速上升;pH值为8.0以后,几丁质酶活力迅速下降;pH值在8.0处,几丁质酶活力达到最大值1.15 U/mL。
2.5.4 胶体几丁质用量对产酶的影响
以胶体几丁质用量为变量,分别取15.5、16.5、17.5、18.5、19.5 mL,其他成分不变配培养基。接种后培养至48h测定其酶活力,使用Excel作图。结果显示,随着胶体几丁质用量的增加,酶活力逐渐上升,在18.5 mL时上升至最大值,随后迅速下降。1-1-1菌株产几丁质酶的影响条件见图7。
3 结 论
几丁质在自然界大量存在,在几丁质酶的分解作用下产生的N-乙酰葡糖胺有多种生物活性,不仅可以促进肠道益生菌的繁殖、强化机体免疫力,还可以降血压、降血脂,应用前景十分广阔[13]。但其生产成本颇高、价格贵,目前常用的浓盐酸水解制备法对环境影响大、得率低。几丁质的酶解法作用条件温和、环保,是制备几丁寡糖的发展方向。
本试验通过透明圈法分离出了一株高产几丁质酶的细菌,经过生理生化鉴定1-1-1菌株为地衣芽孢杆菌。在其与多种病原真菌的对峙实验中,该菌株表现出了对病原真菌良好的抑制作用,可用于生物防治,为农业方面几丁质酶的应用提供借鉴。后采用单因素实验探讨了1-1-1菌株产几丁质酶的影响因素,研究发现pH值、碳源、接种量是影响菌株产酶性能的主要因素。尹璐等[14]研究表明,几丁质酶活力到达最大值的时间为4~8 d,本文筛选的1-1-1菌株从培养1 d后開始大量产酶,在48 h时达到最大值,说明该菌株有良好的产酶性能,可以提高产酶效率。产酶条件优化结果表明,地衣芽孢杆菌1-1-1菌株在温度为35 ℃时,最佳接种量为5%、2%胶体几丁质最佳用量为18.5 mL、最适pH值为8.0,耐碱性,有良好的潜在利用价值。
参考文献
[1]李美玉,曹洪玉,张庆芳,等.几丁质结合蛋白基因克隆、表达与纯化[J].中国酿造,2015(11):41-43.
[2]BENECKE U. Bacillus chitinovorous einen chitin zersetzenden Spaltpilz[J].Bot Ztg,1905(8):227-242.
[3]刘朋,叶波平.微生物几丁质酶研究进展及应用现状[J].科学技术创新,2018(12):57.
[4]程德勇.几丁质酶高产芽孢杆菌的筛选及基因克隆与表达[D].武汉:武汉轻工大学,2016.
[5]连文浩,林娟,王国增,等.产几丁质酶微生物的筛选鉴定及酶学性质研究[J].中国食品学报,2017(3):82-89.
[6]蔡莉.几丁质酶高产菌株HF-3的筛选及发酵条件研究[J].黑龙江畜牧兽医,2016(8):136-137.
[7]杨绍青,张舒平,闫巧娟,等.高产几丁质酶高温紫链霉菌的筛选和发酵条件优化[J].中国农业大学学报,2013(2):167-173.
[8]周德庆.微生物学实验手册[M].上海:上海科学技术出版社,1986.
[9]乔贝贝,裘梁,董德刚,等.1株产几丁质酶菌株的鉴定[J].贵州农业科学,2013(7):132-134.
[10]ROBERTS W K,SELITRENNIKOFF C P.Isolation and prtial characterization of two antifungal proteins from barley[J].Biochimica et Biophysica acta,1986(8):161-170.
[11]孟利强,沙长青,张先成,等.粘质沙雷氏菌几丁质酶基因ChiA克隆及生物信息学分析[J].微生物学杂志,2016(1):62-68.
[12]舒玉凤,李婵娟,张丽.产几丁质酶细菌的筛选?鉴定及酶学性质研究[J].湖北农业科学,2016(15):3887-3890.
[13]龚福明,何彩梅,唐小艳,等.微生物几丁质酶的研究进展及应用现状[J].中国酿造,2017(8):20-25.
[14]尹璐,祖国仁,孙浩,等.一株海洋细菌产几丁质酶培养条件研究[J].中国酿造,2010(9):101-102.
收稿日期:2019-04-26
基金项目:兰州交通大学国家级创新训练项目(201810732008)。
作者简介:左一萌,女,本科在读,研究方向为生物工程。
