除草活性成团泛菌ZLSY20菌株发酵条件的优化
2019-09-10吴志美兰明先高熹李梦月袁远郭子俊殷兴华吴国星
吴志美 兰明先 高熹 李梦月 袁远 郭子俊 殷兴华 吴国星
摘要:【目的】明确除草活性成团泛菌ZLSY20菌株的最佳发酵条件,为应用成团泛菌对紫茎泽兰进行生物防治打下基础。【方法】采用单因素试验,对一株来自泽兰实蝇幼虫消化道的成团泛菌ZLSY20菌株进行基础发酵培养基[YSP培养基、营养琼脂培养基(NA)、LB培养基、细菌基本培养基(CM)、NYBD培养基和紫茎泽兰琼脂培养基(EAS)]和发酵条件(温度16~40 ℃、初始pH 4~9、接菌量0.05%~2.50%、通气量20~160 mL/250 mL、发酵时间0~72 h、转速140~240 r/min)筛选, 并用正交试验对培养基组分及培养条件进行优化。【结果】ZLSY20菌株在YSP培养基上生长最快,细菌浓度最大;在葡萄糖、蔗糖、麦芽糖、乳糖、淀粉和甘露醇6种不同碳源中,蔗糖最有利于ZLSY20菌株生長;在甘氨酸、蛋白胨、硝酸铵、胰蛋白胨和谷氨酸作氮源时,蛋白胨最有利于ZLSY20菌株生长,其次为胰蛋白胨;YSP培养基中蛋白胨1.5%、酵母膏2.0%和蔗糖2.0%时ZLSY20菌株生长最快。在不同的发酵条件下,以发酵时间24 h、培养温度32 ℃、pH 8、接菌量0.05%、通气量20 mL/250 mL、转速200 r/min的菌株生长最好。【结论】优化方案下可有效提高ZLSY20菌株的发酵产量,建立的方案可用于快速、大批量地发酵ZLSY20菌悬液。
关键词: 紫茎泽兰;成团泛菌;ZLSY20菌株;发酵条件
中图分类号: S476.11 文献标志码: A 文章编号:2095-1191(2019)09-1990-08
Abstract:【Objective】The optimum fermentation conditions of Pantoea agglomerans ZLSY20 strain were clarified, which laid a foundation for the biological control of the Eupatorium adenophorum Spreng by using P. agglomerans. 【Me-thod】A single factor experiment was used to optimize the fermentation conditions of a P. agglomerans strain ZLSY20 from the digestive tract of the Procecidochares utilis larvae. The experiments included different media[YSP media, nu-trient agar media(NA), LB media, bacterial basal media(CM), NYBD media and Ageratina adenophoraagar media(EAS)], fermentation conditions(temperature16-40 ℃, initial pH 4-9, inoculation quantity 0.05%-2.50%, ventilation volume 20-160 mL/250 mL, fermentation time 0-72 h, rotational speed 140-240 r/min). Orthogonal test was used to optimize the media components and culture conditions. 【Result】Strain ZLSY20 grew the fastest on YSP media with the lar-gest bacteria concentration. Among the six carbon sources(glucose, sucrose, maltose, lactose, starch and mannitol), sucrose was the most favorable to the growth of ZLSY20. When glycine, peptone, ammonium nitrate, tryptone and glutamic acid were used as nitrogen sources, peptone was the best for the growth of strain ZLSY20, followed by tryptone. In YSP media, when peptone was 1.5%, yeast cream 2.0% and sucrose 2.0%, the growth of ZLSY20 strain was the fastest. Under different fermentation conditions, when fermentation time was 24 h, temperature was 32 ℃, pH=8, inoculation amount was 0.05%, ventilation volume was 20-160 mL/250 mL, rotational speed was 200 r/min, the strain ZLSY20 grew the best. 【Conclusion】The optimized fermentation conditions can effectively increase the fermentation yield of ZLSY20 strain, which can be applied in rapid and large-scale fermentation of ZLSY20 bacterial suspension.
Key words: Eupatorium adenophorum Spreng; Pantoea agglomerans; ZLSY20 strain; fermentation conditions
0 引言
【研究意义】紫茎泽兰(Eupatorium adenophorum Spreng)隶属于菊科泽兰属,是一种入侵性极强的多年生恶性杂草。紫茎泽兰于20世纪40年代经中缅边境传入我国,因其生命力强、繁殖快而迅速蔓延至四川、贵州和西藏等地。紫茎泽兰可破坏生态系统,影响土壤理化性质,严重阻碍入侵地农林牧业的发展,是我国外来入侵物种中危害最严重的植物之一(杨国庆等,2008;王翀等,2014;兰明先等,2017)。泽兰实蝇是紫茎泽兰的重要专食性天敌,可有效控制紫茎泽兰的蔓延(鲁武峰等,2018)。本课题组前期研究发现,从泽兰实蝇幼虫肠道分离获得的成团泛菌ZLSY20菌株具有一定的除草活性,对紫茎泽兰叶片具有侵害作用(兰明先等,2018),因此,明确除草活性成团泛菌ZLSY20菌株的最佳发酵条件,可为成团泛菌应用于紫茎泽兰的生物防治提供依据。【前人研究进展】目前,人们对控制入侵植物紫茎泽兰的危害有防治和利用两种思路,一方面是试图将紫茎泽兰变废为宝以减少侵害,但尚未成熟;另一方面,对防除紫茎泽兰进行大量研究,包括机械防除、化学防除、生物防治和替代控制等(欧国腾等,2012;李霞霞等,2017;朱文达等,2018),但对紫茎泽兰发生严重的区域,如单纯采用机械或化学方法防治效果并不理想,且成本高、污染重(朱文达等,2013;王亚麒等,2016)。利用泽兰实蝇控制紫茎泽兰是生物防治的一项重要措施。张某等(2016)采用16S rDNA基因文库技术和Illumina Hi Seq测序技术检测自然种群泽兰实蝇幼虫肠道内的细菌,发现细菌多样性丰富,但未作进一步的活性研究。【本研究切入点】本课题组前期研究从泽兰实蝇幼虫中分离纯化得到22株共生菌,且发现有6株菌(分别属于芽孢杆菌属和泛菌属等)对紫茎泽兰叶片有侵害作用(兰明先等,2018),目前仅初步进行了泽兰实蝇幼虫共生细菌的活性探究,尚缺乏详细的发酵条件研究。【拟解决的关键问题】采用单因素试验和正交设计试验,对1株来自泽兰实蝇幼虫消化道的成团泛菌ZLSY20菌株的基础发酵培养基和发酵条件(温度、初始pH、接种量、通气量、发酵时间、转速)进行优化,明确其最佳发酵条件,为利用细菌防治紫茎泽兰打下一定的实验基础。
1 材料与方法
1. 1 试验材料
1. 1. 1 供试菌种 成团泛菌属(Pantoea agglome-rans)ZLSY20菌株为本课题组前期分离所得,系泽兰实蝇幼虫内生细菌,保存于云南农业大学昆虫毒理学实验室。
1. 1. 2 供试培养基 营养琼脂培养基(NA):牛肉膏0.60 g,蛋白胨2.00 g,NaCl 1.00 g,瓊脂18.00 g,水200 mL;121 ℃灭菌20 min。LB培养基:蛋白胨2.00 g,酵母提取物1.00 g,氯化钠2.00 g,琼脂3.00 g,蒸馏水200 mL;121 ℃灭菌20 min。细菌基础培养基(CM):葡萄糖1.00 g,(NH4)2SO4 0.40 g,柠檬酸钠0.20 g,MgSO4·7H2O 0.04 g,K2HPO4 0.80 g,KH2PO4 1.20 g,琼脂3.00 g,蒸馏水200 mL;121 ℃灭菌20 min。NYBD培养基:牛肉浸膏1.60 g,酵母浸粉1.00 g,葡萄糖2.00 g,蒸馏水200 mL;121 ℃灭菌20 min。YSP培养基:蛋白胨2.00 g,酵母膏1.00 g,蔗糖4.00 g,蒸馏水200 mL;121 ℃灭菌20 min。紫茎泽兰琼脂培养基(EAS):选取幼嫩的紫茎泽兰茎、叶、花等50 g,洗净,加水200 mL,在匀浆机中捣碎10 min,煮沸30 min,用4层纱布过滤,将滤液定容至200 mL,加入琼脂3.00~4.00 g;121 ℃灭菌20 min。
1. 2 试验方法
1. 2. 1 培养基对细菌生长速度的影响 分别向含有100 mL YSP、NA、NYBD、CM、EAS和LB培养基的250 mL三角瓶中加入50 μL ZLSY20菌悬液,于220 r/min的摇床中25 ℃下分别振荡培养24、48和72 h,采用分光光度法测定菌液在600 nm波长处的OD,以确定菌液浓度(高伟等,2009)。
1. 2. 2 培养基组分优化
1. 2. 2. 1 不同碳源对细菌生长速度的影响 以1.2.1中筛选出的适宜ZLSY20菌株生长的培养基为基础培养基,分别加入葡萄糖、蔗糖、麦芽糖、乳糖、淀粉和甘露醇作碳源,配制不同发酵培养基进行ZLSY20菌株发酵培养,24 h后分别测定不同碳源培养基下菌液在600 nm波长处的OD,比较不同碳源对细菌生长速度的影响,确定最佳碳源(高伟等,2009)。
1. 2. 2. 2 不同氮源对细菌生长速度的影响 以1.2.1中筛选出的适宜ZLSY20菌株生长的培养基为基础培养基,分别加入甘氨酸、蛋白胨、硝酸铵、胰蛋白胨和谷氨酸作氮源,配制不同发酵培养基进行ZLSY20菌株发酵培养,24 h后分别测定不同氮源培养基下菌液在600 nm波长处的OD,比较不同氮源对细菌生长速度的影响(高伟等,2009),确定最佳氮源。
1. 2. 2. 3 碳、氮源最佳浓度单因素试验 分别将1.2.2.1和1.2.2.2筛选出的最佳碳、氮源设置不同浓度(碳源质量浓度分别为1.0%、2.0%、3.0%、4.0%和5.0%),氮源质量浓度分别为0.5%、1.0%、1.5%、2.0%和2.5%),配制成不同浓度的发酵液进行ZLSY20菌株发酵培养。试验重复3次,测定发酵液在600 nm波长处的OD(陈哲等,2016)。
1. 2. 2. 4 培养基浓度正交试验 采用L9(33)对碳、氮源浓度的组合进行优化。试验重复3次,测定发酵液的OD(陈哲等,2016)。
1. 2. 3 发酵条件优化
1. 2. 3. 1 温度对细菌生长速度的影响 在优化培养基组分的基础上,将ZLSY20菌株接种于最佳培养基中,在不同的温度条件下(16、20、24、28、32、36和40 ℃)置于转速为220 r/min的摇床中培养,24 h后测定各温度下菌液在600 nm波长处的OD,从而判断温度对细菌生长速度的影响(张根伟,2005)。
1. 2. 3. 2 初始pH对细菌生长速度的影响 制备优化的培养基,调节初始pH分别为 4、5、6、7、8和9,将ZLSY20菌株接种于不同pH的培养基中,置于转速为220 r/min的摇床中培养,24 h后测定不同pH条件下菌液在600 nm波长处的OD,以此判断pH对细菌生长速度的影响(张根伟,2005)。
1. 2. 3. 3 发酵时间对细菌生长速度的影响 制备优化的培养基,采用上述优化的温度和pH,分别发酵0、12、24、36、48、60和72 h,测定不同发酵时间对ZLSY20菌株生长速度的影响(高伟等,2009)。
1. 2. 3. 4 时间、温度和pH正交试验 按优化的培养基组分配制培养液,分别选择3个水平进行试验,筛选ZLSY20菌株的最佳发酵时间、温度和pH(陈哲等,2016)。
1. 2. 3. 5 初始接菌量对细菌生长速度的影响 将经摇床培养24 h的ZLSY20菌悬液按100 mL装液量的0.05%、0.10%、0.50%、1.00%、2.00%和2.50%分别接入优化培养基中,测定在不同接菌量条件下菌液在600 nm波长处的OD,测定不同初始接菌量对ZLSY20菌株生长速度的影响(张根伟,2005)。
1. 2. 3. 6 通气量对细菌生长速度的影响 在250 mL三角瓶中分别放入优化发酵培养基20、40、80、120和160 mL,在220 r/min的摇床中培养24 h后测定不同通气量下菌液在600 nm波长处的OD(张根伟,2005)。
1. 2. 3. 7 转速对细菌生长速度的影响 将ZLSY20菌株接种到优化培养基中,培养条件采用1.2.3.4中的优化条件,设摇床转速分别为140、160、180、200、220和240 r/min,测定不同转速下菌液在600 nm波长处的OD(张根伟,2005)。
1. 2. 3. 8 接菌量、通气量、转速正交试验 按优化的培养基组分配制培养液,分别选择3个水平进行试验,筛选ZLSY20菌株的最佳接菌量、通气量和转速(陈哲等,2016)。
1. 3 细菌生长曲线测定
按最优方案配制发酵液,并在最适发酵条件下进行发酵培养,在0~24 h内每隔2 h测一次OD,24 h后每隔12 h測一次OD,并制作生长曲线图。
1. 4 统计分析
运用SPSS 18.0对试验数据进行统计及差异显著性分析。
2 结果与分析
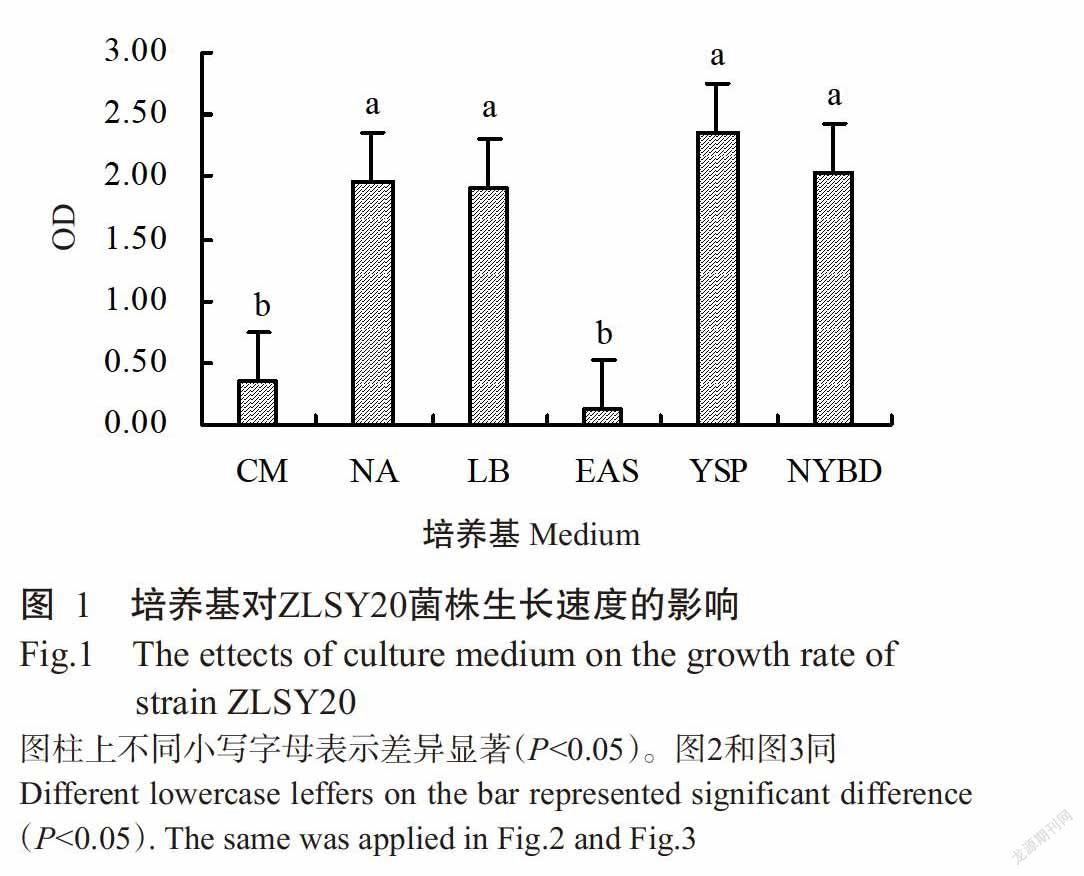
2. 1 培养基对细菌生长速度的影响
由图1可看出,ZLSY20菌株在不同培养基上的生长速度存在差异,其中在YSP培养基上生长最快,细菌浓度最大,OD为2.35,其次为NA和LB培养基;ZLSY20菌株在EAS培养基上生长最慢,且显著慢于除CM外的其他培养基处理(P<0.05,下同),表明该菌不适宜在EAS培养基上生长。
2. 2 培养基优化结果
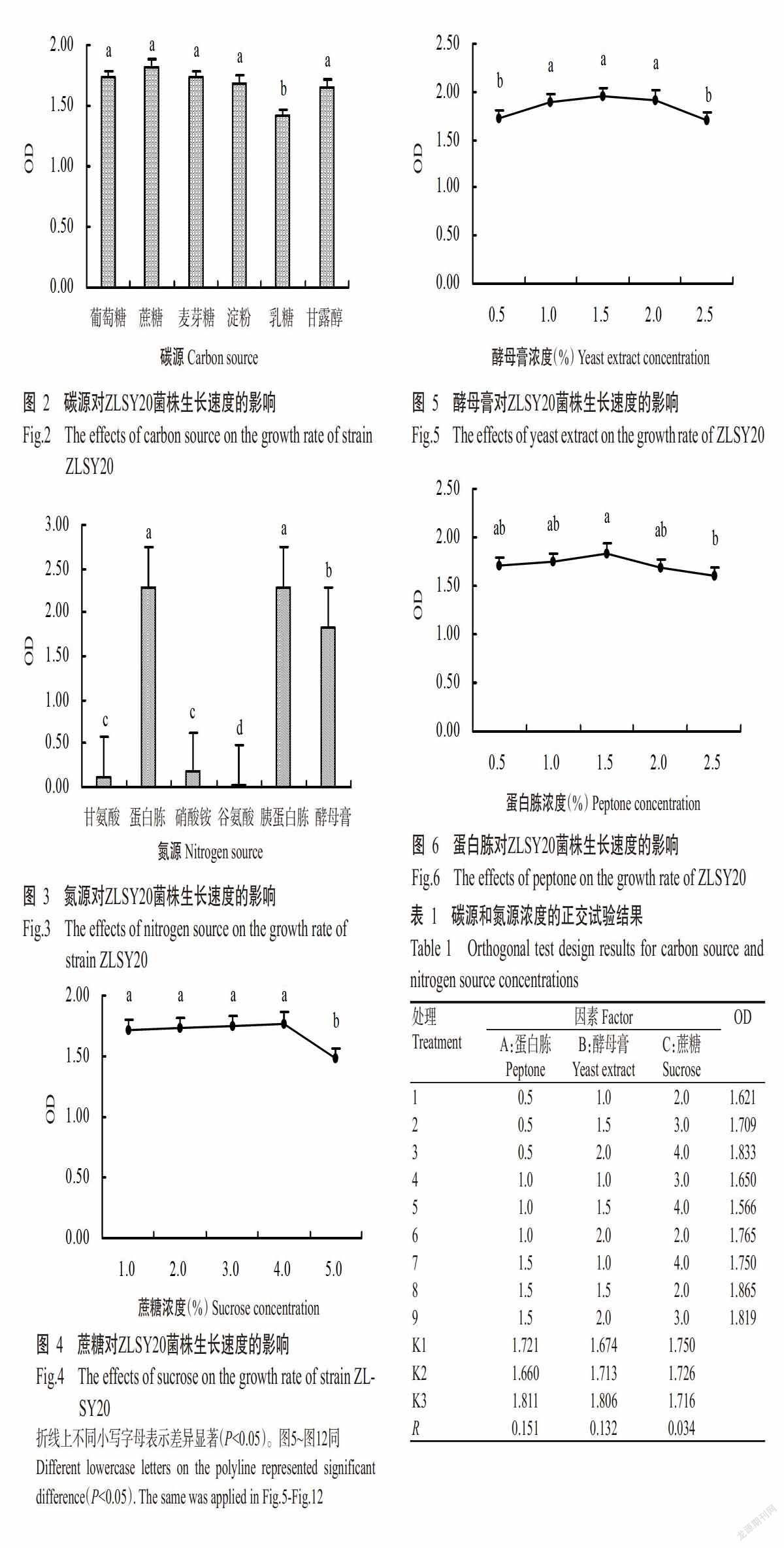
2. 2. 1 碳源对ZLSY20菌株生长速度的影响 由图2可知,ZLSY20菌株在以葡萄糖、蔗糖、麦芽糖、乳糖、淀粉和甘露醇为碳源的培养基上其生长速度存在一定差异,但总体上差异不明显,其中以蔗糖为碳源时细菌的浓度最大,OD为1.82。
2. 2. 2 氮源对ZLSY20菌株生长速度的影响 由图3可知,ZLSY20菌株在以甘氨酸、谷氨酸、硝酸铵、蛋白胨、胰蛋白胨和酵母膏为氮源的培养基上其生长速度存在明显差异,其中在蛋白胨和胰蛋白胨上的生长速度较快,细菌浓度较大,OD分别为2.29和2.28,均显著高于其他氮源处理。
2. 2. 3 碳源和氮源浓度单因素试验结果 由图4~图6可知,蔗糖采用2.0%、3.0%和4.0% 3个水平,酵母膏采用1.0%、1.5%和2.0% 3个水平,蛋白胨采用0.5%、1.0%和1.5% 3个水平进行正交试验较合理。
2. 2. 4 碳、氮源浓度正交试验结果 碳、氮源浓度正交试验结果(表1)显示,RA>RB>RC,即氮源蛋白胨(A)对细菌总数的影响最大,其次为酵母膏(B)和蔗糖(C),表明蛋白胨(A)含量变化对ZLSY20菌株生长速度的影响最大,而蔗糖(C)含量变化对ZLSY20菌株生长的影响相对较小,对应的最佳组合为A3B3C1,即蛋白胨1.5%、酵母膏2.0%和蔗糖2.0%。方差分析结果(表2)显示,3种营养物质对ZLSY20菌株生长的影响无显著差异(P>0.05,下同)。
2. 3 ZLSY20菌株发酵条件优化结果
2. 3. 1 培养基初始pH 由图7可知,最适ZLSY20菌株生长的pH在6~8,其中pH 6时生长较快,而pH 4和pH 5时基本不生长,因此选择pH 6、7和8进行正交试验。
2. 3. 2 培养温度 由图8可知,在24~32 ℃温度范围内ZLSY2菌株生长较好,20 ℃及以下不适合该细菌生长,因此选择24、28 和32 ℃进行正交试验。
2. 3. 3 培养时间 由图9可知,ZLSY20菌液浓度随着培养时间的延长逐渐增加,但培养48 h后趋于稳定,为提高细菌产量并在发酵培养时能接入活性好、功效强的菌株,选择12、24和48 h进行正交试验。
2. 3. 4 培养时间、温度和初始pH正交试验 培养时间、温度和初始pH的正交试验结果(表3)显示,RC>RB>RA,即初始pH(C)对ZLSY20菌株产量的影响最大,其次为培养温度(B)和培养时间(A),对应的最佳组合为A2B3C3,即最佳培养时间24 h、最佳培养温度32 ℃、最适pH 8。方差分析结果(表4)显示,3种发酵条件对ZLSY20菌株生长的影响无显著差异。
2. 3. 5 初始接菌量、通气量和转速优化 由图10~图12可看出,接菌量选择0.05%、0.10%和0.50% 3个水平,通气量选择20、40和80 mL 3个水平,转速选择160、180和200 r/min 3个水平进行正交试验较适宜。
2. 3. 6 初始接菌量、通气量和转速正交试验 初始接菌量、通气量和转速的正交试验结果(表5)显示,RB>RC>RA,即通气量(B)对ZLSY20菌株生长的影响最大,其次是转速(C)和接菌量(A),对应的最佳组合是A1B1C3,即接菌量0.05%、通气量20 mL、转速200 r/min。方差分析结果(表6)显示,通气量对ZLSY20菌株的生长速度影响显著。
2. 4 ZLSY20菌株生长曲线测定结果
按最优方案配制发酵液,并在最适发酵条件下进行发酵培养,结果(图13)显示,菌株接种后0~2 h为生长延迟期,2~24 h其生长曲线接近直线,细菌生长速度最快,为生长对数期,在24~48 h内细菌缓慢增长,随后进入生长稳定期,最高产菌量为48 h时,OD为2.14;84 h后ZLSY20菌株的OD开始缓慢下降。
3 讨论
目前,大部分细菌采用LB培养基培养,因为在LB培养基上生长的细菌类群相对单一,存在单一类群优势或抑制其他类群生长的现象(代先祝等,2010;吴海波等,2018)。本研究分别采用YSP、NA、NYBD、CM、EAS和LB培养基对除草活性成团泛菌ZLSY20菌株进行摇床培养,发现该菌在YSP培养基上生长最好,其次为LB培养基。为提高细菌产量并在发酵培养时能接入活性好、功效强的菌株,对ZLSY20菌株进行生长曲线测定,结果发现在发酵2~24 h为其对数生长期,因此后续可在该对数生长期的中后期时发酵和取样。
影响微生物发酵的因子较多,主要包括碳源、氮源、温度和初始pH等,但不同的微生物对碳源、氮源和温度等条件的选择存在差异(梁艳琼等,2011;邹立飞等,2018)。本研究结果表明,各碳源对ZLSY20菌株生长速度的影响差异不明显,说明ZLSY20菌株的发酵培养基对碳源的选择范围较广,其中对蔗糖的利用效果较好;对于氮源,发现蛋白胨和胰蛋白胨均有利于菌体生长,而铵态氮源硝酸铵等难以被利用,且铵态氮作氮源时在一定程度上抑制了ZLSY20菌株的生长。在发酵条件优化方面,通过正交试验,对培养基初始pH、培养温度、接种量、通气量和转速进行优化,发现ZLSY20菌株最适pH为8,说明该菌适合在中性或略偏碱性的环境中生长;ZLSY20菌株在16~40 ℃内均能正常生長,说明其对温度环境的适应能力较强,在32 ℃下生长最好,但在24 ℃以下生长较慢,表明低温不适合用于该菌的发酵培养。转速和通气量均与培养液中的氧气溶解量有关,正交试验结果表明,通气量对ZLSY20菌株的生长效果影响显著;通气量20 mL、转速200 r/min时的菌液浓度最大;接菌量为0.05%时ZLSY20菌株生长最好,细菌能充分利用养分和空间,接菌量过大则因养分和空间有限而抑制细菌生长。
张晓宇(2014)研究报道成团泛菌XM2发酵的最优培养基配方为酵母膏15 g、麦芽糖5 g、NaC1 5 g、蒸馏水1000 mL、初始pH 7.0;最优培养条件为温度20 ℃、装液量40 mL/250 mL、接种量10%、发酵时间24 h。柯红娇等(2014)制备成团泛菌Ljb-2发酵培养液的条件为温度30 ℃、转速200 r/min、接种量1%、培养时间48 h。上述研究结果表明,不同菌株的最佳发酵条件不同,可能与其遗传特征和生理特性不同有关,也与所获取菌株的特定生境有关。
本研究对ZLSY20菌株的发酵条件进行优化并确定了最佳条件,提高其发酵产量,有望从中分离得到有益的活性物质,为利用细菌防治紫茎泽兰打下一定的实验基础。但对于发酵液的活性成分尚不清楚,后续将对菌株的除草活性成分进行深入探究。
4 结论
通过对除草活性成团泛菌ZLSY20菌株的发酵培养基成分和发酵条件进行优化,发现最适合ZLSY20菌株生长的培养基及组分为YSP培养基(蛋白胨1.5%、酵母膏2.0%、蔗糖2.0%),最适合ZLSY20菌株生长的发酵条件为培养时间24 h、培养温度32 ℃、初始pH 8、接菌量0.05%、通气量20 mL/250 mL、转速200 r/min。优化方案下可有效提高ZLSY20菌株的发酵产量,建立的方案可用于快速、大批量地发酵ZLSY20菌悬液。
参考文献:
陈哲,梁宏,黄静,赵佳. 2016. 解淀粉芽孢杆菌CM3培养基及发酵条件优化[J]. 山西农业科学,44(11):1577-1583. [Chen Z,Liang H,Huang J,Zhao J. 2016. Optimization of medium and fermentation condition for Bacillus amyloliquefaciens CM3[J]. Journal of Shanxi Agricultural Sciences,44(11): 1577-1583.]
代先祝,梁晓丽,邱勤. 2010. 低营养浓度培养基分离培养生物膜中的细菌及其鉴定[J]. 微生物学通报,37(7): 951-955. [Dai X Z,Liang X L,Qiu Q. 2010. Isolation and identification of bacteria from biofilm with culture me-dium of low medium concentration[J]. Microbiology China,37(7): 951-955.]
高伟,魏松红,王翀,胡沙,苏翠萍,李丽. 2009. 除草活性细菌SY9的筛选与发酵条件研究[J]. 杂草科学,(1): 20-23. [Gao W,Wei S H,Wang C,Hu S,Su C P,Li L. 2009. Screening and fermentation conditions of herbicidal active bacteria SY9[J]. Weed Science,(1): 20-23.]
柯红娇,王勇,卫甜,谷春,刘红霞,郭坚华. 2014. 成团泛菌Ljb-2对番茄黄化曲叶病毒病的田间防效初步研究[J]. 园艺学报,41(5): 985-993. [Ke H J,Wang Y,Wei T,Gu C,Liu H X,Guo J H. 2014. Suppression of tomato yellow leaf curl virus disease by the Pantoea agglomerans strain Ljb-2 in the field[J]. Acta Horticulturae Sinica,41(5): 985-993.]
兰明先,马沙,张某,郝克强,鲁武峰,吴国星,高熹. 2017. 泽兰实蝇的研究进展[J]. 南方农业学报,48(3): 459-464. [Lan M X,Ma S,Zhang M,Hao K Q,Lu W F,Wu G X,Gao X. 2017. Procecidochares utilis Stone: A review[J]. Journal of Southern Agriculture,48(3): 459-464.]
兰明先,张某,李建一,鲁武锋,李召波,夏涛,李丽芳,吴国星,高熹. 2018. 泽兰实蝇幼虫内生细菌的分离鉴定及除草活性研究[J]. 江西农业学报,30(1):59-64. [Lan M X,Zhang M,Li J Y,Lu W F,Li Z B,Xia T,Li L F,Wu G X,Gao X. 2018. Isolation,identification and herbicidal activity of symbiotic bacteria in Procecidochares utilis larvae[J]. Acta Agriculturae Jiangxi,30(1):59-64.]
李霞霞,张钦弟,朱珣之. 2017. 近十年入侵植物紫茎泽兰研究进展[J]. 草业科学,34(2): 283-292. [Li X X,Zhang Q D,Zhu X Z. 2017. Progress of the research on invasive plant species Eupatorium adenophorum over the last decade[J]. Pratacultural Science,34(2): 283-292.]
梁艳琼,雷照鸣,贺春萍,郑肖兰,郑服丛. 2011. 解磷菌株黑曲霉PSFM发酵条件优化研究[J]. 南方农业学报,42(3): 240-245. [Liang Y Q,Lei Z M,He C P,Zheng X L,Zheng F C. 2011. Optimization of fermentation condition for phosphate-solubilizing fungi(Aspergillus niger)[J]. Journal of Southern Agriculture,42(3): 240-245.]
鲁武峰,兰明先,夏涛,李召波,廖贤斌,李梦月,高熹,吴国星. 2018. 泽兰实蝇幼虫和虫瘿空间分布型及抽样技术[J]. 南方农业学报,49(5): 844-890. [Lu W F,Lan M X,Xia T,Li Z B,Liao X B, Li M Y,Gao X,Wu G X.2018. Spatial distribution pattern and sampling technique for larvae and galls of Procecidochares utilis Stone[J]. Journal of Southern Agriculture,49(5): 844-890.]
欧国腾,赵宇翔,江赢,韩勇,徐德全,蔡卫东. 2012. 贵州南部山区紫茎泽兰的替代控制研究[J]. 中国森林病虫,31(2): 23-26. [Ou G T,Zhao Y X,Jiang Y,Han Y,Xu D Q,Cai W D. 2012. Biological substitution control of Eupatorium adenophorum Spreng in the southern mountai-nous regions of Guizhou Province[J]. Forest Pest and Di-sease,31(2): 23-26.]
王翀,林慧龙,何兰,曹坳程. 2014. 紫茎泽兰潜在分布对气候变化响应的研究[J]. 草业学报,23(4): 20-30. [Wang C,Lin H L,He L,Cao A C. 2014. Research on responses of Eupatorium adenophorum's potential distribution to climate change[J]. Acta Prataculturae Sinica,23(4):20-30.]
王亞麒,焦玉洁,陈丹梅,袁玲,黄玥,吴叶宽,杜如万. 2016. 紫茎泽兰浸提液对牧草种子发芽和幼苗生长的影响[J]. 草业学报,25(2): 150-159. [Wang Y Q,Jiao Y J,Chen D M,Yuan L,Huang Y,Wu Y K,Du R W. 2016. Effects of Eupatorium adenophorum extracts on seed germination and seedling growth of pasture species[J]. Acta Prataculturae Sinica,25(2): 150-159.]
吴海波,王樱潼,叶维雁,刘惠民. 2018. 4株番木瓜根际解磷细菌发酵条件优化研究[J]. 西南林业大学学报(自然科学),38(2): 117-125. [Wu H B,Wang Y T,Ye W Y,Liu H M. 2018. Optimization of fermentation conditions of 4 Rhizosphere phosphate-solubilizing bacteria of Carica papaya[J]. Journal of Southwest Forestry University(Natural Sciences),38(2): 117-125.]
杨国庆,万方浩,刘万学. 2008. 入侵杂草紫茎泽兰的化感作用研究进展[J]. 植物保护学报,35(5): 463-468. [Yang G Q,Wan F H,Liu W X. 2008. Alleopathy research pro-gress on an invasive weed,Ageratina adenophora Sprengel[J]. Acta Phytophylacica Sinica,35(5): 463-468.]
张根伟. 2005. 枯草芽孢杆菌BS-6液体发酵条件的研究[J]. 河北省农科院学报,22(1): 54-57. [Zhang G W. 2005. Studies on liquid fermentation conditions of Bacillus subtilis BS-6[J]. Journal of the Hebei Academy of Sciences,22(1): 54-57.]
张某,杨璞,朱家颖,袁远,桂富荣,高熹,吴国星. 2016. 基于16S rDNA基因序列的泽兰实蝇幼虫肠道细菌多样性分析[J]. 昆虫学报,59(2): 200-208. [Zhang M,Yang P,Zhu J Y,Yuan Y,Gui F R,Gao X,Wu G X. 2016. Ana-lysis of the bacterial diversity in the intestine of larval Procecidochares utilis(Diptera: Trypetidae) based on 16S rDNA gene sequence[J]. Acta Entomologica Sinica,59(2): 200-208.]
张晓宇. 2014. 黄金梨采后病害生防菌的分离筛选及抗菌蛋白研究[D]. 太谷: 山西农业大学. [Zhang X Y. 2014. Study on isolating,screening and actibiotic protein of biological controlling bacteria against gold pear postharvest disease[D]. Taigu: Shanxi Agricultural University.]
朱文达,曹坳程,颜冬冬,李林,刘晓燕,郭章碧,陈耕. 2013. 除草剂对紫茎泽兰防治效果及开花结实的影响[J]. 生态环境学报,22(5): 820-825. [Zhu W D,Cao A C,Yan D D,Li L,Liu X Y,Guo Z B,Chen G. 2013. Evaluation the efficacy and influence of herbicides on flowering and fruitification of Eupatorium adenophorum Spreng[J]. Eco-logy and Environmental Sciences,22(5): 820-825.]
朱文达,颜冬冬,何燕红,李林,欧阳灿彬,曹坳程. 2018. 石榴替代控制紫茎泽兰的种植模式研究[J]. 江西农业学报,30(1): 65-69. [Zhu W D,Yan D D,He Y H,Li L,Ou-yang C B,Cao A C. 2018. Study on cultivation pattern of pomegranate(Punica granatum) for replacement and control of Eupatorium adenophorum[J]. Acta Agriculturae Jiangxi,30(1): 65-69.]
邹立飞,余小蘭,邹雨坤,李光义,李晓亮,郑鹏,李勤奋. 2018. 拮抗甜瓜枯萎病链霉菌D2菌株发酵条件的优化[J]. 南方农业学报,49(5): 905-911. [Zou L F,Yu X L,Zou Y K,Li G Y,Li X L,Zheng P,Li Q F. 2018. Opti-mition of fermentation conditions of streptomyces strain D2,an antagonistic strepomyces against muskmelon fusarium wilt[J]. Journal of Southern Agriculture,49(5): 905-911.]
(责任编辑 麻小燕)
