2型糖尿病患者颈动脉内膜中层厚度与尿微量白蛋白肌酐比值、脂蛋白相关磷脂酶A2水平的关系
2019-09-10谭淑英卢咏峰姚培伟广东省佛山市第二人民医院内分泌科B超科广东佛山58000
谭淑英,卢咏峰,姚培伟 (广东省佛山市第二人民医院 . 内分泌科;. B超科,广东佛山 58000)
2型糖尿病(Type 2 diabetes mellitus,T2DM)为常见内分泌疾病,多发于中老年人,超过90%糖尿病属于T2DM[1]。T2DM患者早期多无明显症状,随病程进展可出现大血管病变、微血管病变。大血管病变指较大血管发生动脉粥样硬化,颈动脉为全身重要动脉,且硬化程度与脑梗死、冠心病等疾病的发生有密切关系。动脉内膜中层厚度(IMT)能反映早期动脉粥样硬化病理改变,有助于了解T2DM患者早期大血管病变。此外,动脉粥样硬化可能与尿微量白蛋白(UMA)、脂蛋白相关磷脂酶A2(LP-LPA2)等多种因素有关。2012年美国肾脏病与透析患者生存质量(KDOQI)指南推荐用尿微量白蛋白肌酐比值(ACR)筛查UMA[2]。本研究以我院60例T2DM患者为研究对象,检测IMT、ACR、LP-LPA2的水平,旨在了解IMT与ACR、LP-LPA2水平的关系。
1 资料和方法
1.1 病例和分组
选取2017年1月-2017年12月在我院住院的60例T2DM患者,均符合以下纳入标准和排除标准,纳入标准:符合《内科学》中T2DM诊断标准[3];患者签署知情同意书。排除标准:其他类型糖尿病、原发性肾病、血液系统疾病、严重感染性疾病、脑血管疾病史、免疫系统疾病、泌尿系统疾病患者。根据T2DM患者IMT分为IMT(<0.09 cm)正常组(n=28)、IMT(≥0.09 cm)增厚组(n=32)。IMT正常组中,男15例,女13例;年龄33~75岁,平均(54.15±9.42)岁;病程1~13 a,平均(6.89±2.32) a。IMT增厚组中,男17例,女15例;年龄34~76岁,平均(55.43±9.38) 岁;病程1~14 a,平均(7.55±2.41) a。两组患者的性别、年龄、病程等差异无统计学意义(P>0.05),具可比性。
1.2 方法
1.2.1 IMT测量 患者取仰卧位,头颈仰伸,暴露颈部,选用荷兰Philips iE33彩色多普勒超声诊断仪进行测量,探头频率为7.5 MHz,检查双侧颈动脉,横断扫描、纵向扫描,颈总动脉近端1、2、3 cm处测量前壁、侧壁IMT,以其平均值为颈IMT。IMT<0.09 cm为正常,IMT≥0.09 cm为增厚。
1.2.2 临床生化检测 留取患者清晨第1次尿液,使用美国贝克曼库尔特公司的AU5400全自动生化分析仪进行检测,采用免疫比浊法测定尿ACR,试剂盒购自宁波美康生物科技股份公司。抽取患者清晨空腹静脉血5 mL,离心(3 000 r/min)取血清,-80 ℃冰箱保存,使用PW-960洗板机,采用酶联免疫法测定血清LP-LPA2,试剂盒购自天津康尔克生物科技有限公司。采用雅培C16000生化仪检测空腹血糖(FPG)、甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL)、低密度脂蛋白胆固醇(LDL);日本东曹G8及配套试剂检测糖化血红蛋白(HbA1c)。
比较两组尿ACR、血清LP-LPA2、FPG、HbA1c、TG、TC、HDL、LDL的水平,分析T2DM患者颈IMT与相关生化指标的关系、T2DM患者颈IMT增厚的危险因素。
1.3 统计学处理
以SPSS 22.0软件进行统计学处理,计量资料以±s表示,采用Spearman进行相关性分析,采用Logistic进行多因素回归分析,P<0.05为差异有统计学意义。
2 结果
IMT增厚组尿ACR、血清LP-LPA2、HbA1c、TC水平均高于IMT正常组(P<0.01或0.05),两组的血清FPG、TG、HDL、LDL水平差异无统计学意义(P>0.05),详见表1。
表1 两组生化指标水平的对比 (±s)
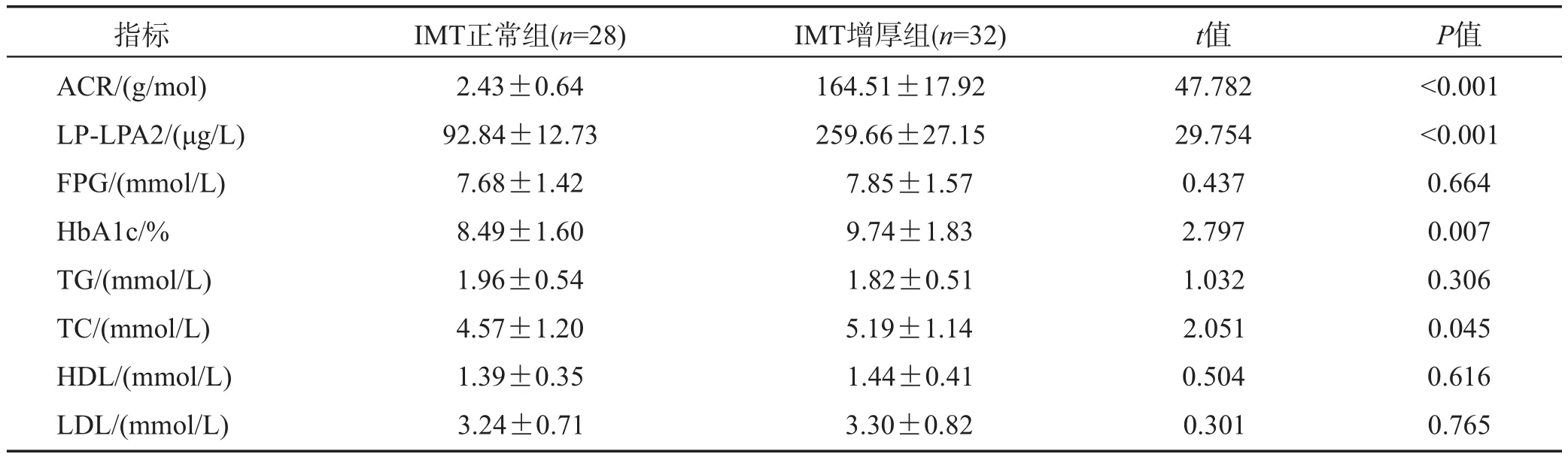
表1 两组生化指标水平的对比 (±s)
指标ACR/(g/mol)LP-LPA2/(μg/L)FPG/(mmol/L)HbA1c/%TG/(mmol/L)TC/(mmol/L)HDL/(mmol/L)LDL/(mmol/L)IMT正常组(n=28)2.43±0.64 92.84±12.73 7.68±1.42 8.49±1.60 1.96±0.54 4.57±1.20 1.39±0.35 3.24±0.71 IMT增厚组(n=32)164.51±17.92 259.66±27.15 7.85±1.57 9.74±1.83 1.82±0.51 5.19±1.14 1.44±0.41 3.30±0.82 t值47.782 29.754 0.437 2.797 1.032 2.051 0.504 0.301 P值<0.001<0.001 0.664 0.007 0.306 0.045 0.616 0.765
T2DM患者颈IMT与尿ACR、血清LP-LPA2水平呈正相关(P<0.01),详见表2。
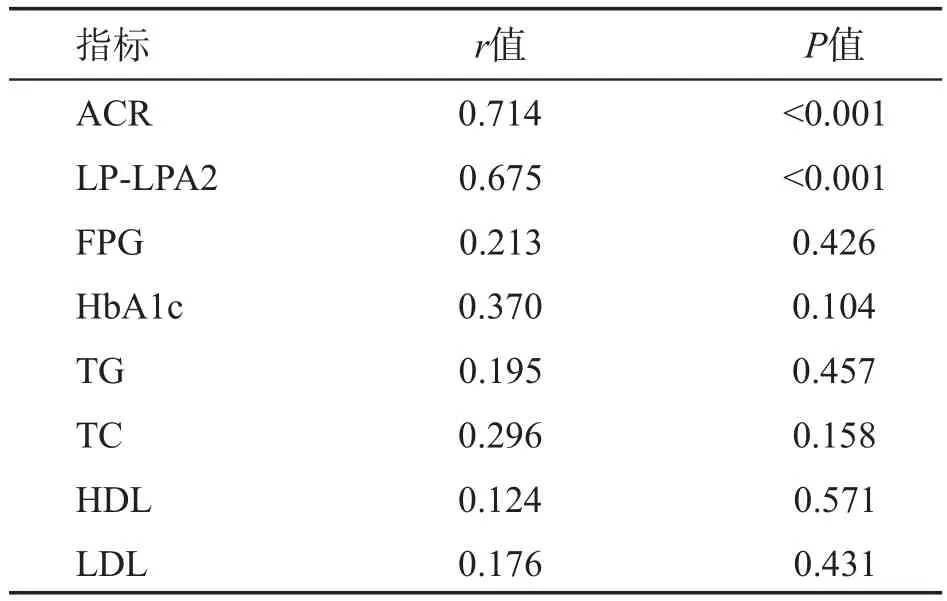
表2 T2DM患者颈IMT与相关生化指标的相关性
经Logistic回归分析,尿ACR、血清LP-LPA2水平升高是T2DM患者颈IMT增厚的危险因素(P<0.01或0.05),详见表3。
3 讨论
随着T2DM病程的延长,大血管病变发生风险逐渐升高。而动脉粥样硬化是大血管病变发生的基础,其在心脑血管疾病发生过程中具有重要作用。大血管病变早期症状不明显,存在IMT增厚或斑块形成等表现。颈总动脉位置表浅,无其他脏器遮挡,易于暴露。采用超声诊断仪测量颈IMT,操作方便,图像清晰,可明确颈IMT,鉴别颈总动脉是否存在动脉粥样硬化,预测心脑血管疾病的发生风险[4]。有研究依据2003年欧洲高血压治疗指南确定的IMT≥0.09 cm表示增厚为标准,对冠状动脉粥样硬化性心脏病进行诊断,敏感度为84.62%,诊断符合率为73.74%,说明IMT增厚可作为预测动脉粥样硬化性疾病的重要指标[5]。但由于颈IMT测量需要诊断设备及专业诊断技术,且花费较大,限制其广泛应用。
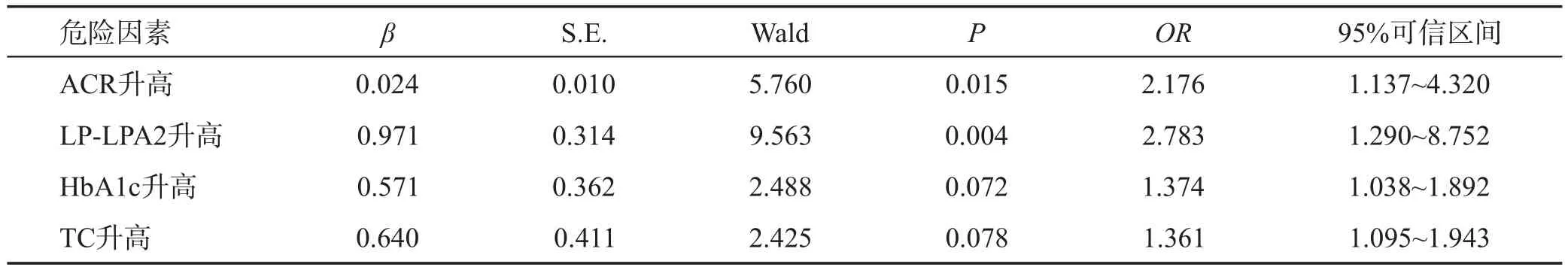
表3 T2DM患者颈IMT增厚的危险因素
血浆蛋白于颈受损血管的内皮细胞渗透至内膜下,可引发动脉粥样硬化。血管表层内皮细胞是血液与组织间代谢交换屏障,并可分泌活性物质,调节血管通透性、紧张性,维持血管正常功能[6]。血管内皮功能损伤后,血管通透性升高,白蛋白出现泄漏,且动脉壁对脂质微粒通透性升高,引起动脉粥样硬化。微量白蛋白尿是肾脏微血管内皮损伤的重要标志,同时也可提示大血管病变。张荣先等[7]发现,老年T2DM患者颈IMT与微量白蛋白尿有密切关系,检测微量白蛋白尿有助于心脑血管病变早期诊断。尿蛋白排泄率(UAE)是诊断UMA的金标准,但检测费时、费力,尿液及尿量测量的准确性难以保障,而尿ACR稳定性好,与尿UAE检查具有较高的一致性,KDOQI指南推荐用ACR筛查。本文结果显示,IMT增厚组尿ACR高于IMT正常组(P<0.01),提示尿ACR水平升高可能引起颈IMT增厚。
LP-LPA2是一种血管炎性因子,由淋巴细胞、单核-巨噬细胞分泌,参与细胞内磷脂转运,修复细胞膜,并可促进神经元转移因子释放。研究发现,机体出现炎症反应后,LP-LPA2水平呈现升高趋势,加快血小板活性物质释放,产生黏附、聚集作用,引起动脉粥样硬化[8]。LP-LPA2可水解LDL分子中氧化卵磷脂,产生非酯化脂肪酸与溶血磷脂酰胆碱,增强炎症反应,并可促进吞噬细胞生成,增加泡沫细胞,聚集形成斑块。本文结果显示,IMT增厚组血清LP-LPA2、HbA1c、TC水平高于IMT正常组(P<0.01或0.05),表明LP-LPA2、HbA1c、TC水平升高可能引起颈IMT增厚。本文结果还显示,T2DM患者颈IMT与尿ACR、血清LP-LPA2水平呈正相关,尿ACR、血清LP-LPA2水平升高是观察组T2DM患者颈IMT增厚的危险因素(P<0.01或0.05),可见,尿ACR、血清LP-LPA2水平与T2DM患者颈IMT有关,其水平升高是颈IMT增厚的危险因素。
综上所述,尿ACR、血清LP-LPA2水平与T2DM患者颈IMT有关,其水平升高是颈IMT增厚的危险因素。
