Prohibitin在结直肠癌组织中表达及其与预后的关系
2019-09-10南方科技大学第一附属医院暨南大学第二临床医学院深圳市人民医院广东深圳58020广东药科大学病理学与病理生理学系广东广州50006
唐 娜,周 略*,袁 健 (. 南方科技大学第一附属医院、暨南大学第二临床医学院、深圳市人民医院,广东深圳 58020;2. 广东药科大学病理学与病理生理学系,广东广州 50006)
结直肠癌居全世界恶性肿瘤发病率及病死率的第3位[1-4]。Prohibitin(PHB)隶属于SPFH家族,维持线粒体蛋白的稳定性,调节细胞发育、增生、转录及凋亡等生物学功能,在肿瘤的发病机制研究中发挥重要作用[5-11]。本研究主要运用免疫组化方法观察PHB在人结直肠癌标本中的表达,研究其与患者性别、年龄、部位、分期、预后等的关系,为更好评估预后、寻找新治疗靶点提供理论依据。
1 材料和方法
1.1 临床材料
2001年1月至2005年12月南方医科大学附属南方医院临床确诊的结直肠癌,蜡块400例。入组标准:所有患者术前均未接受放疗或化疗。收集患者相关的临床资料,包括年龄、性别、肿瘤大小及部位、淋巴结转移、血管侵犯、分化程度和临床分期(参照美国《AJCC癌症分期手册》第7版),并附完整的随访资料(0~132个月)。对其中的388例标本进行CD31免疫组化检测,分析有无血管侵犯。
1.2 方法
标本经10%中性甲醛固定,常规石蜡包埋的结直肠癌组织蜡块,连续切片,片厚2 μm,常规HE染色。操作步骤按照试剂说明书进行,在0.01 mol/L柠檬酸钠缓冲液中高压修复加热3 min进行抗原修复,PHB一抗(1:500)、CD31一抗(1:100)室温孵育60 min,试剂盒A液室温孵育30 min,上述各步骤间用PBS洗片3次。二氨基联苯胺(DAB)显色,苏木精复染,光镜观察。阴性对照以PBS代替一抗。兔抗人PHB单克隆抗体购自Eptomics公司;鼠抗人CD31单克隆抗体购自中杉金桥公司;二步法抗兔/抗鼠通用性免疫组化检测试剂盒购自基因公司。
1.3 结果判断
阳性结果判定以细胞浆内出现棕黄色染色或棕色颗粒为阳性细胞。由2名有经验的病理科医师双盲阅片,采取之前文献的评估方法[12],分别随机计数1 000 个细胞,计算不同表达强度癌细胞表达的百分率。阳性强度就看胞质染色的染色强度,阴性、淡黄色、黄色、棕褐色,分别标记为阴性(-)、弱阳性(+)、中度阳性(++)和强阳性(+++),分别乘以0、1、2、3,相加得到该病例的阳性表达计分。
1.4 统计学处理
用SPSS 19.0软件进行数据分析,蛋白表达与临床病理学参数的比较用Pearson卡方检验。免疫组化检测结果与患者术后生存时间的比较采用生存分析的Log-Rank检验。P<0.05表示差异有统计学意义。
2 结果
2.1 PHB在结直肠癌组织中的表达
PHB在个别正常结肠腺体的基底部单个细胞表达,定位于细胞核内,类似干细胞分布特征(图1 A、B)。结直肠原发癌组织中仅少量癌细胞表达PHB,未发生转移的高分化腺癌,部分癌细胞腺腔缘表达PHB(朝向腺腔中心区域),呈向心性表达方式(图1 C)。伴有淋巴结转移、远隔器官转移的结直肠癌患者原发癌组织内PHB呈离心性表达(朝向间质区域),表现为癌巢周边部突出于癌性腺腔的个别癌细胞、侵入间质的癌细胞和侵入脉管内的癌细胞表达PHB(图1 D~F);PHB阳性的癌细胞面对间质区域细胞浆内PHB强表达,而朝向癌巢中心区域细胞浆内PHB弱表达(图1 D),PHB表达模式与癌组织侵袭的临床标本和癌组织侵犯血管的检测证据(图2、3),浸润间质的单个癌细胞、簇状癌细胞与脉管内浸润的癌细胞一侧强表达PHB。
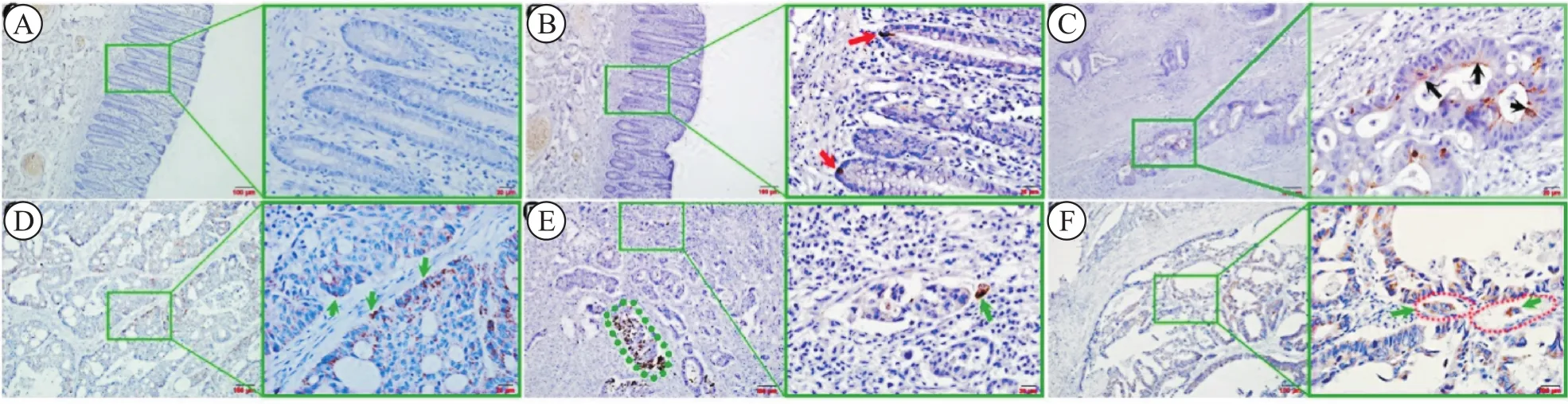
图1 Prohibitin在结直肠正常黏膜与癌组织内的表达

图2 PHB表达模式与癌组织侵袭的临床标本检测证据

图3 PHB侵袭血管的临床标本检测证据
2.2 免疫组化结果与患者临床资料的关系分析
2.2.1 PHB表达与患者性别、年龄、分化程度、临床分级及淋巴结转移等临床特征的关系 本组400例结直肠癌组织中,248例PHB呈阳性表达,152例PHB呈阴性表达。不同性别、年龄(<60岁与≥60岁)、肿瘤分化程度、肿瘤大小(<4 cm与≥4 cm)、临床分期、有/无淋巴结转移患者PHB蛋白表达的差异无统计学意义(P>0.05);不同肿瘤部位(结肠、直肠)及有或无血管侵犯患者PHB蛋白表达的差异则有统计学意义(P<0.01或0.05)。详见表1。
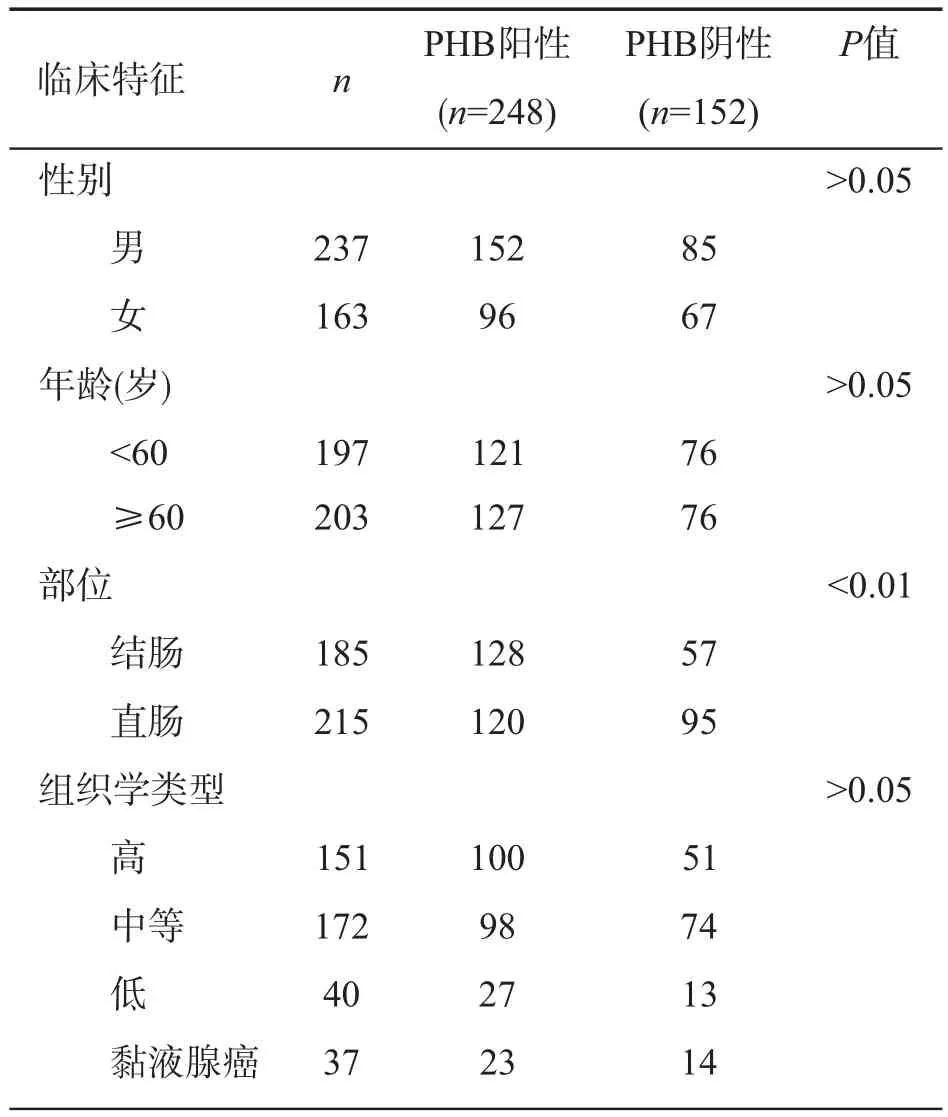
表1 PHB蛋白表达与结直肠癌患者临床特征的关系 (例)
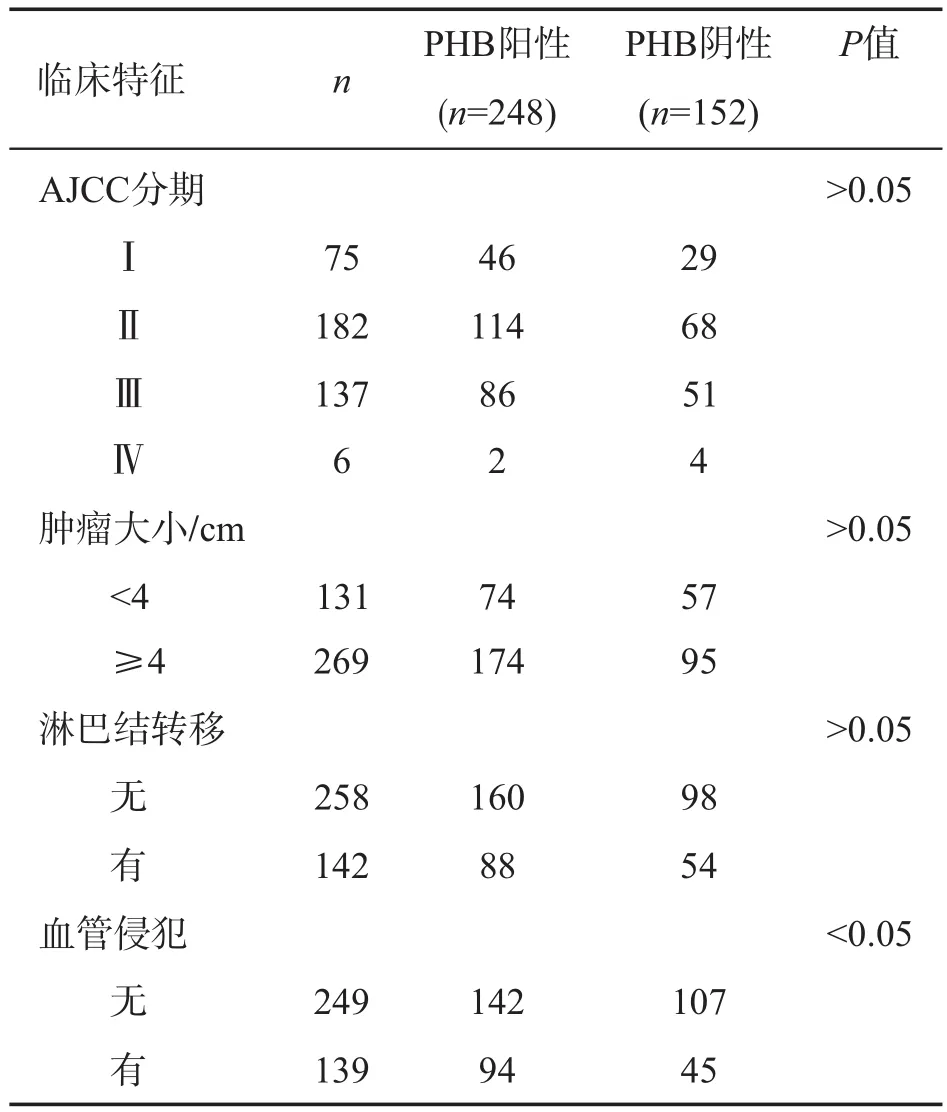
接上表
2.2.2 PHB蛋白表达与结直肠癌患者术后生存时间的关系 应用Log-Rank生存分析法分析PHB蛋白的表达与结直肠癌患者术后生存时间,PHB阳性与阴性的患者中位生存期分别为90.9和87.7个月,两者比较差异无统计学意义(P>0.05)。
2.2.3 PHB向心性分布、离心性分布与结直肠癌预后的关系 PHB阳性表达的结直肠癌组织中,呈离心性表达84例,呈向心性表达164例,离心性分布较向心性分布患者中位生存时间短,分别为64.1个月和108.6个月,PHB向心性表达的结直肠癌患者中位生存期明显长于离心性表达方式的患者(P<0.01)。

图4 结直肠癌PHB表达方式临床随访分析
3 讨论
PHB与肿瘤发生、增殖与转移的相关性不同研究结论不同。大多数研究认为Ras激活后,与定位于细胞质膜下的PHB直接结合,导致C-Raf激活,Ras-Raf途径促进细胞增殖、转化和迁移,在宫颈癌、胃癌、食管癌、乳腺癌、肺癌、甲状腺癌、膀胱癌、前列腺癌、鼻咽癌和卵巢癌中PHB高表达[5-6,13-16];另有研究认为PHB阻止细胞从G1期向S期转变,阻断细胞转录而抑制癌细胞增殖[5]。高转移潜能的肝癌细胞系PHB表达明显增强,癌细胞迁移能力显著增高[17],Ras-Raf激活诱导宫颈癌细胞转移,依赖于PHB的介导[18-19]。
本研究显示,PHB在正常结肠黏膜腺体与间质内几乎不表达,仅在个别患者正常结肠腺体的基底部见单个细胞表达,定位于细胞核内,与正常干细胞数量和分布位置类似。结直肠原发癌中发现仅有少量癌细胞表达(与CSC占肿瘤细胞群的1/1000~1/100相一致)PHB,而朝向癌巢中心区域细胞浆内PHB弱表达,癌巢周边部突出于癌性腺腔的个别癌细胞、侵入间质的癌细胞和侵入脉管内的癌细胞表达PHB,表明PHB的表达与癌细胞将要逃离原发灶和侵袭行为有关。PHB在结直肠癌组织内表达具有向心性与离心性两种表达方式,且在同一细胞内呈极性表达,提示PHB参与CSC的增殖分化和迁移的调节,PHB表达区域可能促进CSC迁移相关的前导缘形成。更有趣的是,我们发现浸润间质的单个癌细胞、簇状癌细胞与脉管内浸润的癌细胞一侧强表达PHB,提示PHB诱导迁移癌细胞的细胞骨架形成,细胞外基质、血管内皮细胞可能对迁移癌细胞产生趋化作用。这些结果提示,PHB在结直肠癌癌细胞迁移过程中起重要作用。
本文结果显示,不同性别、年龄(<60岁与≥60岁)、肿瘤分化程度、肿瘤大小(<4 cm与≥4 cm)、临床分期、有/无淋巴结转移患者PHB蛋白表达的差异无统计学意义(P>0.05),不同肿瘤部位(结肠、直肠)及有/无血管侵犯患者PHB蛋白表达的差异有统计学意义(P<0.01或0.05)。PHB向心性与离心性的两种表达模式与患者预后密切相关,离心性表达者预后明显差于向心性表达者(P<0.001)。
综上所述,PHB的表达模式可作为结直肠癌患者预后的有效指标,PHB离心性表达是结直肠癌患者预后不良特征之一。这些发现为PHB在结直肠癌中转移机制中的作用提供了新方向,其相关分子机制有待于进一步研究。
