血清蛋白酶原联合胃泌素-17检测在胃癌早期诊断中的临床价值
2019-09-10温国辉袁锡欣广东省东莞市莞城医院检验科病理科广东东莞53000
温国辉,李 麟,袁锡欣 (广东省东莞市莞城医院 . 检验科;. 病理科,广东东莞 53000)
胃癌是我国常见的恶性肿瘤之一,其发病率、死亡率在消化系统癌症中排列第二[1-3]。由于早期肿瘤仅限于黏膜层及黏膜下层,无明显临床表现,而当出现消化道症状时已是中、晚期,患者往往错失了最佳的治疗时机。目前胃癌诊断方法主要为内窥镜和病理学诊断,由于内窥镜检查的有创性及X线检查的辐射伤害,导致患者检查依从性较差,对于亚临床患者尚不能作为普查方式。血清蛋白酶原(PG)在调节消化和维持黏膜整合中有重要功能,是反映胃黏膜功能和状态的良好指标。胃泌素-17(G-17)是良好的血清胃窦生物标志物,近年已逐渐应用于胃癌早筛。PG、PGR(PG I/ PG II)及G-17水平在早期阶段中会发生显著变化,有较高的灵敏度和特异性,且具有无创、操作简单等优点。研究发现,胃癌早期患者的血清PG和G-17水平均有显著变化[4]。本研究通过探讨PG联合G-17在胃癌早期诊断中的临床价值,旨为临床早期诊断胃癌提供依据。
1 资料和方法
1.1 一般资料
选取2015年9月-2018年9月本院收治的胃癌患者65例(早期胃癌35例,进展期胃癌30例),普通胃病患者53例(轻度浅表性胃炎13例,消化性溃疡10例,萎缩性胃炎30例),体检健康者43例作为研究对象。胃癌诊断以病理结果为金标准。胃癌患者主要表现为腹胀痛、恶心呕吐、消瘦贫血等。所有研究对象的性别、年龄、体质量等一般资料比较差异无统计学意义(P>0.05),详见表1。
胃癌、普通胃病组纳入标准:(1)临床诊断为胃病且既往无十二指肠疾病史者;(2)肝肾功能正常者;(3)入组前未使用质子泵抑制剂或H2受体拮抗剂等药物者;(4)患者知情并签署知情同意书;(5)病例资料完整者。
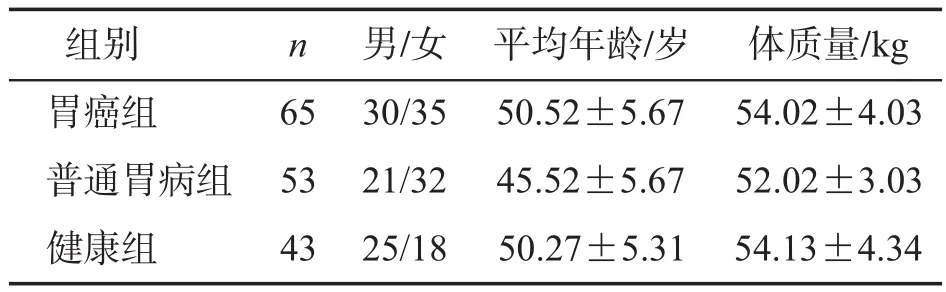
表1 3组一般资料的比较
健康组纳入标准:(1)临床诊断均无胃及十二指肠疾病史者;(2)肝肾功能正常者;(3)积极配合检查者;(4)研究对象知情并签署知情同意书。
入选组均排除:(1)伴有其他恶性肿瘤、肝肾功能异常等病症者;(2)伴有急性上消化道出血者;(3)既往有幽门螺杆菌根除史者;(4)处于妊娠或哺乳期的女性。
1.2 方法
所有患者取空腹静脉血3 mL,分离血清后待测,采用酶联免疫法(试剂盒购自必欧瀚生物技术有限公司)测定血清PGⅠ、PGⅡ及G-17水平,并计算得出PGR值(PGR=PGⅠ/PGⅡ)。
1.3 观察指标
(1)统计对比患者的PGⅠ、PGⅡ、G-17水平及PGR值;(2)记录胃癌早期与进展期患者的PGⅠ、PGⅡ、G-17水平及PGR值;(3)受试者工作特征曲线(简称ROC曲线)分析PGⅠ、G-17及PGR联合检测与单独检测在筛选早期胃癌中的诊断效果。
1.4 统计学处理
采用SPSS22.0软件进行分析。计量资料以±s表示,采用单因素方差分析及q检验;计数资料用率表示,采用χ2检验;采用ROC曲线分析PGⅠ、G-17及PGR在检测早期胃癌中的价值,曲线下面积(AUC) 越接近1,说明诊断效率越高。P<0.05表示差异有统计学意义。
2 结果
2.1 PGⅠ、PGⅡ、G-17水平及PGR值的比较
胃癌组患者的PGⅠ水平及PGR值均低于普通胃病组和健康组(P<0.01),G-17水平则高于普通胃病组和健康组(P<0.01)。PGⅡ水平与普通胃病组和健康组比较差异无统计学意义(P>0.05)。详见表2。
2.2 胃癌不同临床分期患者的PGⅠ、PGⅡ、G-17水平和PGR值的比较
早期胃癌患者的PGⅠ水平及PGR值均明显高于进展期患者(P<0.05),G-17水平低于进展期患者(P<0.05),PGⅡ水平与进展期相比差异无统计学意义(P>0.05)。详见表3。
2.3 PGⅠ、G-17及PGR在检测早期胃癌中的ROC曲线分析
PGⅠ、G-17及PGR联合检测与单独检测胃癌结果的ROC曲线分析见图1。PGⅠ、G-17及PGR联合检测胃癌的AUC和敏感度均明显高于单独检测,详见表4。
3 讨论
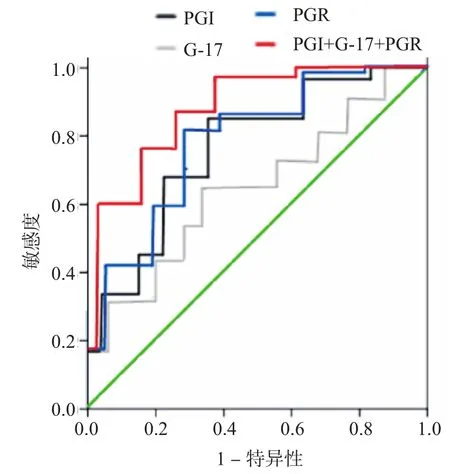
图1 PGⅠ、G-17及PGR联合检测与单独检测胃癌的ROC曲线分析的比较
PG是胃蛋白酶的无活性前体,由胃黏膜细胞分泌,其主要分为两个亚群,即PGⅠ和PGⅡ。血清PG水平变化不仅反映胃黏膜腺体和细胞的数量,也可反映胃黏膜的萎缩程度和胃疾病的恶性程度。而萎缩性胃炎是胃癌的主要癌前病变,当胃基底腺萎缩及相关功能丧失时可导致PGⅠ分泌明显减少,而PGⅡ水平不受影响,PGR值下降。研究表明,胃癌患者的血清PG和PGR水平明显低于健康人群,是胃癌前兆的亚临床指标[5]。程桐花等[6]认为,90%以上的血清PG异常患者的胃黏膜可见明显癌前病变。血清PG可作为胃癌和癌前病变高危人群的血清筛查指标[7],临床上用于检测早期胃癌不仅具有较高的敏感度,还可避免因X线检查所带来的辐射暴露及内镜检查的疼痛,具有非常重要的临床应用价值。PGⅠ和PGR检查胃癌具有较高的灵敏度和特异度[8]。
表2 PGⅠ、PGⅡ、G-17水平及PGR值的比较 (±s)

表2 PGⅠ、PGⅡ、G-17水平及PGR值的比较 (±s)
与健康组比较:aP<0.01;与普通胃病组比较:bP<0.01
G-17/(pmol/L)n PGⅠ/(μg/L)PGR组别胃癌组普通胃病组健康组65 53 43 65.34±6.36ab 4.24±0.42ab 12.26±2.25ab 91.28±14.72 110.69±15.23 a PGⅡ/(μg/L)11.48±3.56 10.82±2.15 10.57±2.46 9.12±1.74 10.07±2.12 a 5.03±1.21 4.46±0.85 a
表3 胃癌不同临床分期患者的PGⅠ、PGⅡ、G-17水平及PGR值的比较(±s)

表3 胃癌不同临床分期患者的PGⅠ、PGⅡ、G-17水平及PGR值的比较(±s)
与进展期胃癌比较:aP<0.01
组别早期胃癌进展期胃癌n PGⅠ/(μg/L)PGR G-17/(pmol/L)35 30 72.16±6.87 55.24±6.36 a PGⅡ/(μg/L)11.04±3.01 11.67±3.79 5.82±0.83 3.14±0.32 a 8.24±1.67 14.86±2.45 a
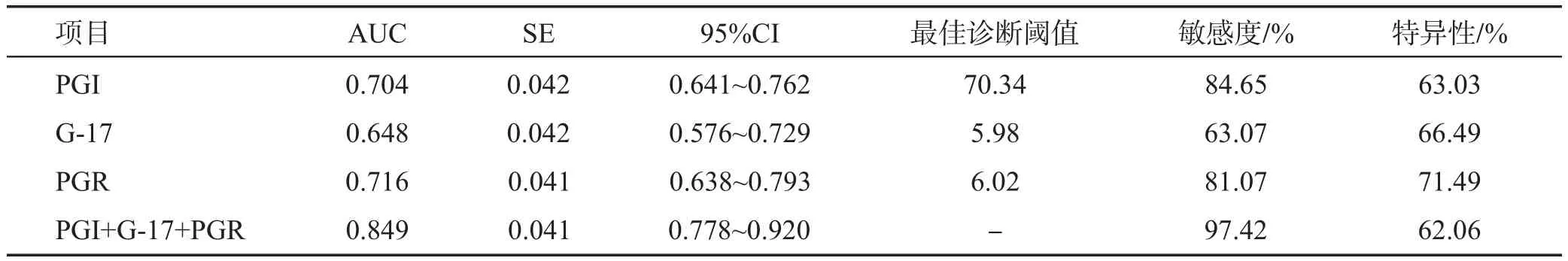
表4 PGⅠ、G-17及PGR联合检测与单独检测胃癌结果
本研究结果表明,胃癌组患者的PGⅠ和PGR水平均显著降低,PGⅡ水平无明显变化,且进展期患者的PGⅠ和PGR水平更低,提示胃癌患者体内的PGⅠ和PGR水平较低,而PGⅡ所受影响较小,且随着病情加重其PG Ⅰ和PGR值逐渐下降。这可能是因为致癌因子使PG Ⅰ基因受损突变,失去分泌PG Ⅰ的能力,且胚细胞又持续更新黏膜腺细胞,从而导致血清PGⅠ水平不断下降。赵建业等[9]研究结果表明,胃癌患者PG Ⅰ的分泌显著下降。高洪亮等[10]发现,PG表达产物的缺乏可能是胃黏膜细胞恶性转化的结果,随着胃疾病加重,血清PGⅠ含量逐渐减少。但患者血清PGⅡ水平无明显变化,可能是因为PGⅡ主要由成熟腺细胞生成,负责分泌的胃黏膜细胞分布较广,因此PGⅡ分泌未受太大影响。由于PGⅠ降低,PGⅡ变化不大,最终导致PGR值不断降低,且随着病情加重,PGR值呈逐步下降趋势,说明PG的水平变化与胃癌进展相关性较高。PG的组织表达是胃癌危险度和胃黏膜状态的指征[11]。
G-17是胃窦G细胞分泌的一种肽类激素,主要通过激活肠嗜铬样细胞刺激胃酸分泌,促进组织胺释放,从而刺激胃肠道上皮细胞增殖。有研究发现,G-17通过激活丝裂原活化蛋白激酶及JNKI信号途径,从而促进胃癌细胞的浸润与转移[12]。本研究结果表明,胃癌组患者的G-17水平较普通胃病组和健康组升高,且进展期水平高于早期胃癌患者,说明胃癌患者随着病情加重机体内G-17含量逐渐升高。这可能是因为癌细胞浸润破坏B淋巴细胞引起胃酸分泌减少,从而反馈性导致G-17分泌增多。刘文佳等[13]研究表明,G-17会影响胃癌细胞的生长和恶性转化。
本研究中,ROC曲线分析结果也显示PGⅠ、G-17及PGR联合检测的敏感度明显优于单独检测,说明PGⅠ、G-17及PGR检测胃癌与病理结果的一致性较高,可敏感检测早期胃癌。血清PG水平可敏感反映胃部状态及变化,当胃部病变时,其细胞功能发生了质的变化,PGⅠ与PGR值也发生显著改变。而高水平的G-17是检测胃癌发生的危险因素。研究发现,由非萎缩性胃炎进展至萎缩性胃炎,再到胃癌,G-17的含量逐渐增多[14]。因此,血清PGⅠ与PGR测定可作为早期胃癌筛査的可靠指标。
