中、美、欧、日4种药典人参含量测定方法比较
2019-09-10曹丽娟姜恒丽屈文佳耿晓康李向日
曹丽娟,姜恒丽,张 旭,屈文佳,耿晓康,李向日*
(1.盛实百草药业有限公司,天津市中药饮片炮制技术企业重点实验室,天津 300301; 2.北京中医药大学中药学院,北京 102488)
人参为五加科植物人参(PanaxginsengC A Mey)的干燥根和根茎。人参大补元气,复脉固脱,补脾益肺,生津养血,安神益智,功能显著,用于体虚欲脱,肢冷脉微,脾虚食少,肺虚喘咳,津伤口渴,内热消渴,气血亏虚,久病虚羸,惊悸失眠,阳痿宫冷[1]。明代名医张景岳将人参与附子、地黄、大黄列为药中四维,药中四维者,乃治病保命之要药也。其作为传统中药材,已有数千年的历史,在世界各国得到广泛的应用。人参在历版《中国药典》中均有收载,此外,在《美国药典》、《欧洲药典》、《日本药局方》中也有收载。人参的含量测定一般以其主要活性成分人参皂苷为分析指标,主要有人参皂苷Rb1、Rg1、Re等。
作者在长期的研究和生产实践中发现,在按照《中国药典》(2015年版)方法对人参进行含量检测时,指标成分人参皂苷Rb1含量合格率低。与此同时,由于企业人参大量出口日本,在按照《日本药局方》(第17版)方法检测人参含量时,发现人参皂苷Rb1含量合格率很高。在上述基础上,同时选取国际具有代表性的《美国药典》及《欧洲药典》进行比较研究。《美国药典》、《欧洲药典》、《日本药局方》是世界主要药典,应用地区广泛,影响力大,建立的检测方法水平较高。本文主要比较了中、美、欧、日4种药典人参检测前处理方法及分析方法对人参皂苷类成分Rb1和Rg1的影响。为人参含量测定方法的优化奠定基础,也为人参质量标准的完善提供参考。如何更合理、科学地制定人参的质量标准,既可以提高国内参类产品的技术水平,又能够参与国际市场竞争,加速国内参类产品进入国际市场,是值得认真考虑的问题。
1 仪器与试药
1.1仪器 Agilent Technology 1260 Series 高效液相色谱仪;色谱柱:YMC-Park ODS-A(150 mm×4.6 mm,5 μm),《中国药典》(2015年版);YMC-Park ODS-A(150 mm×4.6 mm,5 μm),《美国药典》(第40版);TSK-GEL ODS-80TS(250 mm×4.6 mm,5 μm),《欧洲药典》(9.0版本);YMC-Park ODS-A(150 mm×4.6 mm,5 μm)、TSK-ODS-80TS(150 mm×4.6 mm,5 μm),《日本药局方》(第17版);Agilent ChemStation 化学工作站(美国Agilent公司)。
1.2试药 《中国药典》对照品:人参皂苷Rb1(批号110704-201726,质量分数:91.1%)、人参皂苷Re(批号110754-281626,质量分数:97.4%)、人参皂苷Rg1(批号110703-281731,质量分数:93.6%),均由中国食品药品检定研究院提供。《日本药局方》对照品:人参皂苷Rb1(批号Rb1007,质量分数:91.59%)、人参皂苷Re(批号GRE006,质量分数:100%)、人参皂苷Rg1(批号Rg1003,质量分数:93.26%),均由津村株式会社提供。人参(批号A1800290、A1800450、A1800640、C-JH-103、C-JH-112、C-JH-113、C-JH-166、C-JH-117,产地:吉林,白山林村中药开发有限公司),经北京中医药大学李向日教授鉴定为五加科人参PanaxginsengC A Meg。乙腈为色谱纯(Merck),水为双蒸水,其余试剂均为分析纯。
2 药典方法比较分析
2.1中、美、欧、日4种药典供试品制备方法比较 中、美、欧、日4种药典中,人参含量检测过程中供试品制备方法如表1所示。各国药典的供试品前处理过程在提取溶剂、具体处理过程中存在一定的差异。从表中可以看出,对提取时效进行分析,《日本药局方》最高,《中国药典》次之,《美国药典》和《欧洲药典》中减压干燥操作较为耗时,提取效率最低。对提取试剂进行分析,《美国药典》仅使用乙醇作为提取溶剂,最为环保。对提取设备进行分析,《日本药局方》仅使用振荡机、离心机,操作简单,可同时提取多批样品,《美国药典》、《欧洲药典》使用旋转蒸发仪,多批次同时提取时需多台设备,成本较高。对提取原理进行分析,《中国药典》方法除杂效果最好,《日本药局方》对人参皂苷Rb1的提取率较高。

表1 中、美、欧、日4种药典供试品制备方法
2.2中、美、欧、日4种药典对照品制备方法比较 中、美、欧、日4种药典中,人参含量检测过程中对照品制备方法如表2所示。《中国药典》(2015版)中对照品人参皂苷Rg1、Re、Rb1各为0.2 mg/ml;《美国药典》(第40版)中对照品人参皂苷Rg1为0.2 mg/ml;《欧洲药典》(9.0版本)中对照品人参皂苷Rg1、Re、Rf、Rb1为0.3 mg/ml;《日本药局方》(第17版)中对照品人参皂苷Rg1、Rb1为0.1 mg/ml。

表2 中、美、欧、日4种药典对照品制备方法
2.3中、美、欧、日4种药典色谱分析条件对比 中、美、欧、日4种药典中,主要是流动相、洗脱条件等方面存在差异,检测波长一致,均为203 nm。4种药典人参含量检测色谱分析条件如下。
2.3.1《中国药典》(2015年版)色谱分析条件 流动相A为乙腈、B为水,梯度洗脱,洗脱条件见表3。检测波长为203 nm。理论板数按人参皂苷Rg1峰计算应不低于6 000。分别精密吸取对照品溶液10 μl与供试品溶液10~20 μl,注入液相色谱仪,测定,即得。

表3 《中国药典》(2015年版)梯度洗脱条件
2.3.2《美国药典》(第40版)色谱分析条件 流动相A为水、B为乙腈-水(4∶1),梯度洗脱,洗脱条件见表4。流速:1.5 ml/min,柱温:25 ℃,检测波长为203 nm。系统适用性应符合要求。分别精密吸取对照品溶液与供试品溶液各10 μl,注入液相色谱仪,测定,即得。

表4 《美国药典》(第40版)梯度洗脱条件
2.3.3《欧洲药典》(9.0版)色谱分析条件 流动相A为调pH至2的磷酸溶液、B为乙腈,梯度洗脱,洗脱条件见表5。流速:1.0 ml/min,柱温:35 ℃,检测波长为203 nm。系统适用性:对照溶液人参皂苷Rg1与人参皂苷Re分离度≥1.0。分别精密吸取对照品溶液与供试品溶液各20 μl,注入液相色谱仪,测定,即得。

表5 《欧洲药典》(9.0版)梯度洗脱条件
2.3.4《日本药局方》(第17版)色谱分析条件
2.3.4.1人参皂苷Rg1流动相:水-乙腈(4∶1),流速:自行调整至人参皂苷Rg1保留时间为25 min左右,柱温:30 ℃,检测波长为203 nm。系统性能:分别取1 mg人参皂苷Rg1对照品与人参皂苷Re对照品,用稀甲醇(3∶5)溶解并定容至10 ml。在上述条件以对照品溶液10 μl进样,人参皂苷Rg1与人参皂苷Re的分离度不得低于1.5。系统重复性:RSD≤1.5%。
2.3.4.2人参皂苷Rb1流动相:水-乙腈(7∶3),流速:自行调整至人参皂苷Rb1保留时间为20 min左右,柱温:40 ℃,检测波长为203 nm。系统性能:分别取1 mg人参皂苷Rb1对照品与人参皂苷Re对照品,用稀甲醇(3∶5)溶解并定容至10 ml。在上述条件以对照品溶液10 μl进样,人参皂苷Rb1与人参皂苷Re的分离度不得低于3。系统重复性:RSD≤1.5%。分别精密吸取对照品溶液与供试品溶液各10 μl,注入液相色谱仪,测定,即得。
2.4中、美、欧、日4种药典人参含量限定标准比较 中、美、欧、日4种药典对人参含量的限定标准要求如表6所示。各国药典虽然对人参含量限值标准要求有所区别,但是集中体现在对人参皂苷Rb1、人参皂苷Rg1提出要求,《中国药典》对人参皂苷Re也提出了要求。

表6 中、美、欧、日4种药典人参含量限定标准比较
3 方法与结果
3.1供试品处理方法对人参含量指标的影响
3.1.1方法 选取3批次人参样品(A1800290、A1800450、A1800640),对照品溶液按照《中国药典》(2015年版)中要求进行制备,供试品处理方法分别依照中、美、欧、日4种药典要求,检测时按照《中国药典》色谱分析条件进行,收集试验数据。
3.1.2结果及分析 采用《中国药典》对照品及分析方法,按照中、美、欧、日4种药典的供试品处理方法后检测得到的人参含量指标情况如表7所示。人参皂苷Rg1含量结果差异不明显,而人参皂苷Rb1含量差异较大,日本方法检出含量相对较高,其他3国相近。可以看出人参皂苷Rb1检出高低,在一定程度上受前处理方法影响比较明显,《日本药局方》前处理方法操作简单省时,检出Rb1含量高。Rg1和Re的分离度为2.79,Rb1和Re分离度32.85,均符合要求。
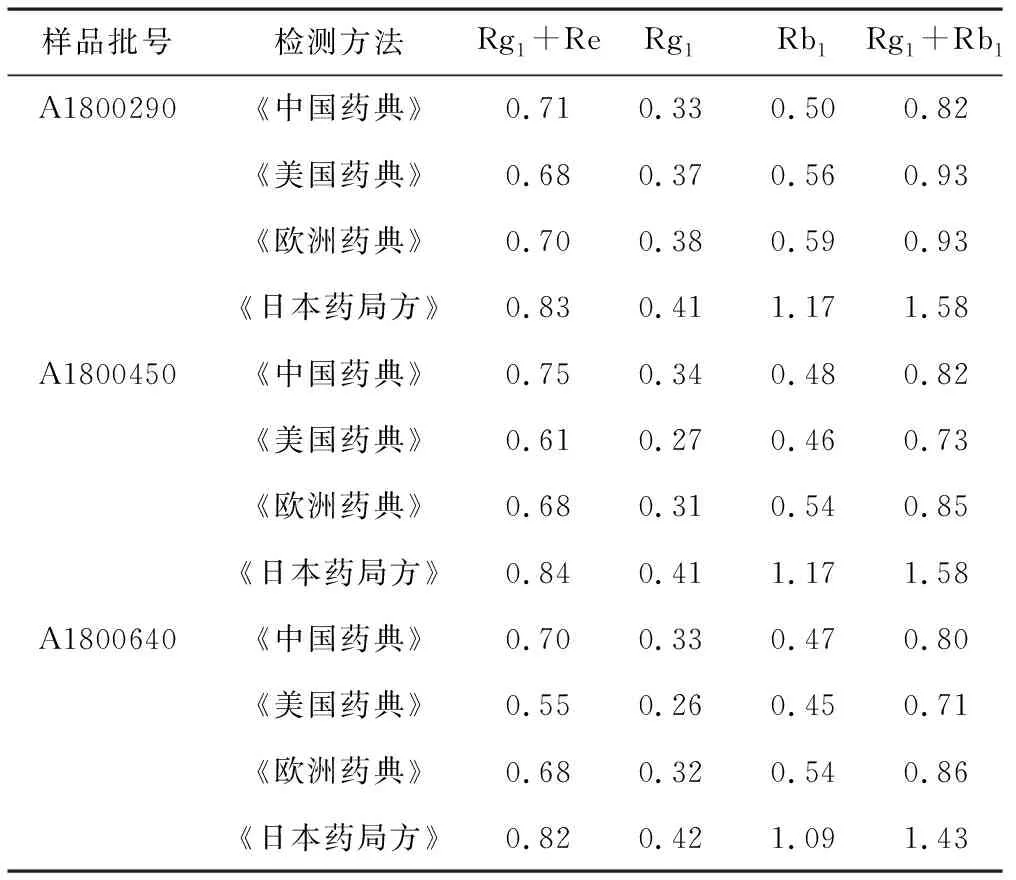
表7 供试品处理方法对人参百分含量指标的影响(n=3)
3.2中、日对照品差异对人参含量指标的影响
3.2.1方法 选取3批次人参样品(A1800290、A1800450、A1800640),选用中国食品药品检定研究院及日本津村株式会社提供的人参皂苷Rb1、人参皂苷Re、人参皂苷Rg1对照品,按照《日本药局方》(第17版)要求进行供试品溶液制备,并按其色谱条件进行检测。收集试验数据进行比较分析。
3.2.2结果及分析 对照品差异对人参含量指标的影响结果如表8所示。3个批次同一样品分别采用中国食品药品检定研究院以及日本津村株式会社提供的人参皂苷对照品,按照《日本药局方》方法制备供试品溶液以及进行分析检测,发现人参皂苷Rb1及Rg1结果差异都不大。供试品制备方法及检测方法相同时,不同权威机构提供的对照品对人参含量测定结果影响不明显。

表8 对照品差异对人参百分含量指标的影响(n=3)
3.3不同药典检测方法对人参含量指标的影响
3.3.1方法 选取上述3批次人参样品(A1800290、A1800450、A1800640),选用中国食品药品检定研究院及日本津村株式会社提供的人参皂苷Rb1、人参皂苷Re、人参皂苷Rg1对照品,分别按照中、美、欧、日4种药典要求制备供试品溶液及按照4种药典色谱分析条件进行检测,收集试验数据。选取5批次人参样品(C-JH-103、C-JH-112、C-JH-113、C-JH-166、C-JH-117),统一选用中国食品药品检定研究院提供的对照品,分别按照中、美、欧、日4种药典要求制备供试品溶液并分别按照上述药典色谱分析条件进行检测,收集试验数据,通过上述数据对中、美、欧、日的分析方法对人参含量结果影响进行重复验证。
3.3.2结果及分析 按照中、美、欧、日4种药典前处理方法及分析方法检测8批次人参各含量指标,结果如表9所示。人参皂苷Rb1,日本方法检出含量最高,其余3国差异不明显;人参皂苷Rg1,日本、欧洲方法检出含量偏高,中国、美国方法次之。人参皂苷Rb1含量检测结果趋势与单独考查4国药典前处理方法时结果趋势具有一定相似性,分析推测不同药典检测方法对人参皂苷Rb1含量检出高低的影响以前处理方法影响最为明显。各国方法分离度均符合要求。

表9 不同药典检测方法对人参百分含量指标的影响(n=8)
4 小结
人参作为最常用的中药滋补品之一,几十年来,对其质量控制方法的研究从未停止过。本文比较分析了《中国药典》(2015年版)、《美国药典》(第40版)、《欧洲药典》(9.0版本)及《日本药局方》(第17版)中人参含量检测方法的异同点,重点开展试验考查中、美、欧、日4种药典前处理方法、中日对照品及中、美、欧、日4种药典分析方法对人参含量的影响。结果表明,4种测定方法均能很好地对3种皂苷成分进行提取和测定,但在人参含量检测过程中,前处理方法对人参含量指标影响明显,4国药典前处理方法各有优势,《中国药典》方法除杂效果好,《美国药典》方法最为环保,《日本药局方》成本最低,使用有毒试剂较少,且人参皂苷Rg1、Rb1的提取率高,为后期人参含量标准提升提供一定的参考。
