肝片吸虫CatB4蛋白分子特征及其免疫原性分析
2019-09-10王熙凤孟庆玲乔军张凯张国武
王熙凤 孟庆玲 乔军 张凯 张国武




摘要:【目的】明确肝片吸虫组织蛋白酶B4(CatB4)的分子特征及其免疫原性,为研究肝片吸虫CatB4蛋白的生物学特性及揭示其致病机理提供科学依据。【方法】通过RT-PCR扩增肝片吸虫CatB4基因,利用在线分子生物信息学软件对CatB4基因及其编码蛋白进行分子特征分析;构建原核表达载体pET-CatB4,经IPTG诱导获得融合蛋白后进行SDS-PAGE和Western blotting检测分析;并以融合蛋白CatB4免疫小鼠制备多克隆抗体,利用免疫组化对融合蛋白在肝片吸虫体内的表达进行定位分析。【结果】肝片吸虫CatB4基因片段为699 bp,其编码蛋白等电点(pI)7.95,理论分子质量25.89 kD,无信号肽和跨膜区,属于非分泌性蛋白;CatB4蛋白存在10个潜在的磷酸化位点、2个N-糖基化位点和 7个N-肉豆蔻酰化位点,有9个抗原决定簇,具有高度保守的CatB结构域,是由无规则卷曲连接9个α-螺旋和8个β-折叠构成其空间结构。基于CatB4基因核苷酸序列同源性构建的系统发育进化树显示,肝片吸虫和大片吸虫聚为一支,二者的同源性为83.98%。SDS-PAGE检测和Western blotting分析结果均显示在41.80 kD处能检测到目的条带。以纯化融合蛋白CatB4与弗氏佐剂乳化后免疫的小鼠均可产生特异性抗体,证实融合蛋白CatB4具有较强的免疫原性;免疫组化定位分析结果显示,在肝片吸虫的卵黄腺腺体细胞、排泄管上皮细胞、肠道上皮细胞和卵黄腺管上皮细胞均发生特异性的抗原抗体反应,呈深棕色。【结论】诱导表达获得的融合蛋白CatB4可特异性识别绵羊肝片吸虫阳性血清,具有较强的免疫原性,且主要在肝片吸虫分泌排泄组织器官中表达,说明CatB4蛋白具有作为肝片吸虫候选抗原的潜力。
关键词: 肝片吸虫;组织蛋白酶B4(CatB4);原核表达;免疫原性
中图分类号: S852.735 文献标志码: A 文章编号:2095-1191(2019)01-0158-07
0 引言
【研究意义】片形吸虫病是一种在全球范围内广泛分布的人兽共患寄生虫病(Mas-Coma et al.,2009),主要由肝片吸虫(Fasciola hepatica)、大片吸虫(F. gigantica)及其中间型引起,不仅给畜牧业生产带来巨大经济损失,还威胁人类健康(何山红等,2010;Ashrafi et al.,2015)。其中,肝片吸虫主要分布在温带地区,需要中间宿主淡水螺才能完成其生活史,家畜常因在放牧过程中吞食含囊蚴的牧草而被感染(王熙凤等,2018)。肝片吸虫病在我国四川、新疆、青海、黑龙江和云南等地区广泛流行,草食动物(牛、羊)的感染率可高达80%,是对我国畜牧业危害最严重的寄生虫病(黎万奎等,2003)。因此,加强肝片吸虫致病机理研究及其疫苗开发,对有效防控肝片吸虫病和促进畜牧业健康发展具有重要意义。【前人研究进展】肝片吸虫在宿主体内移行过程中会产生大量排泄分泌产物(Excretory-srcretory pro-duct,ESP),ESP主要由肝片吸虫的盲肠分泌,经口或体表排出。按照其功能,ESP主要分为能量代谢相关蛋白、应激相关蛋白和蛋白水解酶(田艾灵等,2017)。组织蛋白酶(Cathepsin,Cat)是蛋白水解酶中的一种,属于半胱氨酸蛋白酶家族,占ESP总量的80%,包含组织蛋白酶L(CatL)和组织蛋白酶B(CatB)两个亚型(Robinson et al.,2008),且二者在肝片吸虫感染过程中起协同作用。其中,CatL在肝片吸虫各发育阶段均可分泌,而CatB主要在童虫阶段表达分泌。肝片吸虫囊蚴脱囊后高度表达的CatB有3种(CatB1、CatB2和CatB3),但也有部分蛋白可在成虫阶段大量表达,如CatB4、CatB6、CatB7、CatB8、CatB9和CatB10(Cancela et al.,2008;Cwiklinski et al.,2015)。CatB主要存在于肝片吸虫的体表,可与宿主免疫系统直接接触而破坏其免疫功能,实现免疫逃避,同时参与囊蚴的脱囊过程(Beckham et al.,2009)。因此,CatB在肝片吸虫的成熟、入侵、移行和寄生过程中发挥着至关重要的作用。Robinson等(2009)对肝片吸虫的蛋白组学进行研究,结果在新脱囊幼虫期检测到CatB4;Cwiklinski等(2015)对肝片吸虫基因组和转录组进行分析,发现CatB家族只有1个亚型,但可表达7种不同的蛋白,其中CatB4蛋白在肝片吸虫各生长阶段均可表达,以成虫阶段的特异表达量最高。【本研究切入点】CatB4具有半胱氨酸肽酶活性位点,起到调节催化活性的作用,主要在肝片吸虫成虫期分泌表达(Meemon and Sobhon,2015),但目前未对CatB4进行任何分子及生物学方面的研究,其致病机理也尚未明确。【拟解决的关键问题】对肝片吸虫CatB4基因进行克隆及原核表达,制备抗肝片吸虫CatB4多克隆抗体,并利用免疫组化对CatB4蛋白在肝片吸虫体内的表达进行定位分析,为研究肝片吸虫CatB4蛋白的生物学特性及揭示其致病机理提供科学依据。
1 材料与方法
1. 1 试验材料
肝片吸虫阳性血清由中国农业科学院兰州兽医研究所惠赠提供,肝片吸虫成虫采自新疆乌鲁木齐市活畜屠宰场绵羊的肝脏;4~6周昆明系小鼠购自石河子大学实验动物中心;pET-32a(+)质粒、大肠杆菌DH5α和BL21(DE3)感受态细胞由石河子大学寄生虫实验室保存提供;限制性核酸内切酶(BamH I和Xho I)、pMD19-T载体、T4 DNA连接酶、IPTG和反转录试剂盒购自TaKaRa公司;PCR Mixture購自广州东盛生物科技有限公司;DNA Marker、蛋白分子量标准和辣根过氧化物酶(HRP)标记的羊抗鼠IgG购自北京全式金生物技术有限公司;HRP标记的兔抗绵羊IgG和NC膜购自北京康为世纪生物科技有限公司;枸橼酸缓冲液和苏木素购自上海索莱宝生物科技有限公司;绵羊肝片吸虫IgG抗体ELISA检测试剂盒购自上海北诺生物科技有限公司。
1. 2 肝片吸虫CatB4基因RT-PCR扩增
根据GenBank中的肝片吸虫CatB4基因序列(登录号KM099340.1,cDNA长1020 bp,编码339个氨基酸),利用ABCpred和DNASTAR等在线软件分析CatB4基因的优势抗原表位,选择编码亲水性较强、优势抗原表位集中的区域(255~954 bp)设计一对特异性引物用于扩增CatB4基因,引物由华大基因生物科技有限公司合成,预期扩增长度699 bp。上游引物:5'-CGGGATCCATGCCGGAGTCTTTTGAT-3'(下划线部分为BamH I酶切位点),下游引物:5'-CCCT
CGAGTCAAAAGTATCCATTCTCACC-3'(下划线部分为Xho I酶切位点)。参照TRIzol法提取肝片吸虫总RNA(李晓娟,2009),采用反转录试剂盒将RNA反转录为cDNA。以cDNA为模板,利用上、下游引物扩增CatB4基因。PCR反应体系20.0 μL:cDNA模板2.0 μL,PCR Mixture 9.0 μL,上、下游引物各0.5 μL,ddH2O 8.0 μL。扩增程序:94 ℃预变性4 min;94 ℃ 40 s,62 ℃ 40 s,72 ℃ 1 min,进行35个循环;72 ℃延伸l0 min,4 ℃保存。PCR扩增产物以1.0%琼脂糖凝胶电泳进行检测,切胶回收目的片段连接至pMD19-T载体,经菌液PCR和双酶切鉴定筛选出阳性质粒,并送至新疆昆泰锐生物技术有限公司测序,将测序正确的质粒命名为pMD-CatB4。
1. 3 肝片吸虫CatB4基因及其编码蛋白分子特征分析
采用DNAMAN和DNASTAR对CatB4基因测序结果进行分析;利用ProtPram预测CatB4蛋白的理化性质、ProtScal分析蛋白的亲/疏水性、SignalP分析有无信号肽、TMHMM-2.0预测蛋白的跨膜区、Motif Scan预测蛋白潜在的糖基化位点、Antigen Prediction Tool预测其抗原决定簇、CDS分析其结构域、SOPMA和Swiss-model预测蛋白的二、三级结构;并以MEGA 5.0对肝片吸虫CatB4基因进行系统发育进化分析。
1. 4 原核表达载体pET-CatB4构建
将pMD-CatB4质粒和pET-32a(+)载体分别用BamH I/Xho I进行双酶切,酶切产物经1.0%琼脂糖凝胶电泳鉴定,切胶回收目的片段并与T4 DNA连接酶4 ℃过夜连接,然后转化DH5α感受态细胞,挑取单菌落,经菌液PCR和BamH I/Xho I双酶切鉴定,将测序正确的重组质粒命名为pET-CatB4。
1. 5 融合蛋白CatB4诱导表达、纯化及鉴定
以重组质粒pET-CatB4转化BL21(DE3)感受态细胞中,挑取单菌落,通过菌液PCR筛选出阳性菌接种至含氨苄青霉素(Amp+)的LB液体培养基中,过夜培养至OD600 nm达0.6~0.8时,以IPTG(终浓度1.0 mmol/L)诱导2、4、6和8 h后,分别收集1.0 mL菌液,12000 r/min离心2 min,收集上清液和菌体;并以pET-32a(+)空载体IPTG诱导6 h为对照。SDS-PAGE检测融合蛋白CatB4的表达形式,并采用镍离子亲和层析柱进行纯化。纯化融合蛋白CatB4在不同梯度尿素(8、6、4、2和1 mol/L)中分别透析7 h,用蔗糖浓缩至终浓度1.0 mg/mL。同时将纯化融合蛋白CatB4印迹到NC膜上,以绵羊肝片吸虫阳性血清(1∶1000稀释)为一抗、HRP标记的兔抗绵羊IgG(1∶3000稀释)为二抗,进行Western blotting分析。
1. 6 融合蛋白CatB4在肝片吸虫体内表达定位分析
纯化的融合蛋白CatB4与弗氏佐剂乳化后免疫小鼠,制备抗肝片吸虫CatB4多克隆抗体,用绵羊肝片吸虫IgG抗体ELISA检测试剂盒检测免疫小鼠后产生的特异性抗体。制备好的肝片吸虫成虫石蜡组织切片在枸橼酸缓冲液中煮沸修复10 min,冷却后置于3.0%的H2O2-PBS中孵育10 min,以小鼠抗肝片吸虫多克隆抗体(1∶150稀释)为一抗、HRP标记的羊抗鼠IgG(1∶1000稀释)为二抗,进行免疫组化定位分析,经苏木素染色后在显微镜下观察结果。阴性对照组以未免疫的阴性小鼠血清为一抗。
2 结果与分析
2. 1 肝片吸虫CatB4基因克隆结果
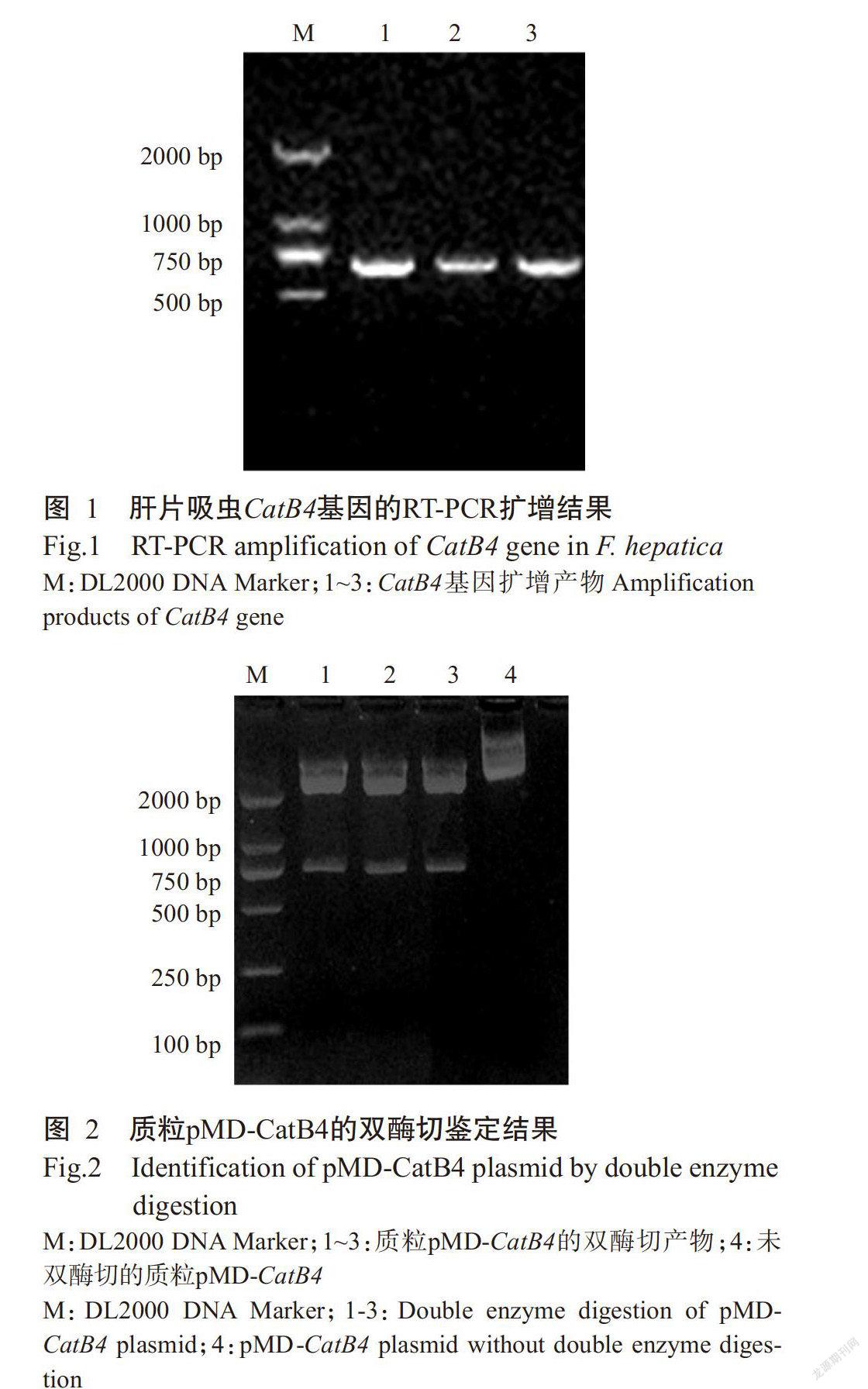
采用RT-PCR扩增肝片吸虫CatB4基因,经1.0%琼脂糖凝胶电泳检测获得一条约700 bp的目的条带(图1),与预期结果相符。切胶回收目的基因片段,克隆至pMD19-T载体上,经双酶切鉴定分别得到一条2692 bp的载体片段和一条699 bp的CatB4基因片段(图2),表明肝片吸虫CatB4基因已成功插入pMD19-T载体。
2. 2 肝片吸虫CatB4基因及其编码蛋白的分子特征分析结果
将测序得到的肝片吸虫CatB4基因cDNA序列与GenBank中的肝片吸虫CatB4基因序列进行比对分析,发现其核苷酸序列同源性为99.43%。在线分子生物信息学软件分析结果显示,CatB4蛋白等电点(pI)7.95,理论分子质量25.89 kD;CatB4蛋白无信号肽和跨膜区,属于非分泌性蛋白。Motif Scan预测发现,CatB4蛋白存在10个潜在的磷酸化位点、2个N-糖基化位点和7个N-肉豆蔻酰化位点;Antigen Prediction Tool預测结果显示,CatB4蛋白有9个抗原决定簇。CatB4蛋白具有高度保守的CatB结构域,是由无规则卷曲连接9个α-螺旋和8个β-折叠构成其空间结构。基于CatB4基因核苷酸序列同源性构建的系统发育进化树(图3)显示,肝片吸虫和大片吸虫聚为一支,二者的亲缘关系最近,同源性为83.98%;而与其他寄生虫的亲缘性相对较远。
2. 3 原核表達载体pET-CatB4的双酶切鉴定结果
重组质粒pET-CatB4用BamH I和Xho I进行双酶切,酶切产物经1.0%琼脂糖凝胶电泳检测,分别得到一条699 bp的目的条带和一条5900 bp的载体片段(图4),与预期结果相符,表明CatB4基因已成功插入pET-32a(+)表达载体。
2. 4 融合蛋白CatB4的诱导表达、纯化及鉴定结果
SDS-PAGE检测结果显示,IPTG诱导获得的融合蛋白在41.80 kD处有一条特异性条带,与预期的蛋白分子质量大小一致;而以IPTG诱导的pET-32a(+)空载体和重组菌上清液均未获得特异性条带(图5),表明CatB4蛋白主要以包涵体的形式表达。经镍离子亲和层析柱纯化后仅检测到单一的目的条带,与理论值大小相符。Western blotting分析结果也显示,在41.80 kD处检测到目的条带,与预期结果相符,表明诱导表达获得的融合蛋白CatB4可与绵羊肝片吸虫阳性血清发生特异性反应。
2. 5 融合蛋白CatB4的免疫组化定位分析结果
绵羊肝片吸虫IgG抗体ELISA检测试剂盒检测发现,以纯化融合蛋白CatB4与弗氏佐剂乳化后免疫的小鼠均可产生特异性抗体,证实融合蛋白CatB4具有较强的免疫原性。免疫组化定位分析结果显示,在肝片吸虫的卵黄腺腺体细胞(图6-A)、排泄管上皮细胞(图6-B)、肠道上皮细胞(图6-C)和卵黄腺管上皮细胞(图6-D)均发生特异性的抗原抗体反应,呈深棕色;而阴性对照组未发生反应(图6-E和图6-F),证实CatB4蛋白主要在肝片吸虫的分泌组织细胞内高度表达。
3 讨论
肝片吸虫病是人畜共患寄生虫病,感染宿主范围较广,人类、家畜及啮齿动物均可被感染(何山红等,2010)。牛、羊等草食动物是肝片吸虫感染的重要宿主,特别是在我国一些牧区肝片吸虫病的感染率和发病率较高,其化学药物治疗效果不理想,因此加强家畜肝片吸虫病疫苗研发至关重要。近年来,国内外已开展大量肝片吸虫亚单位疫苗候选抗原的相关研究,并分析了不同抗原对宿主的保护作用。研究证实,肝片吸虫硫氧还蛋白—谷胱甘肽还原酶可使兔体内肝片吸虫量降低96.7%(Maggioli et al.,2011),CatL可对牛产生47%~63%的免疫保护(Wesołowska et al.,2018),而脂肪酸结合蛋白对犊牛和绵羊的免疫保护率分别为23.0%和43.0%(López-Abán et al.,2007;Kumar et al.,2012)。
目前,已有研究证实ESP对肝片吸虫在宿主体内的寄生具有多种调节作用。一方面,ESP可对宿主淋巴细胞产生免疫刺激和毒性作用,引起肝细胞凋亡,还可诱导单核细胞抑制抗蠕虫过敏反应(Cervi et al.,1996;Bąska et al.,2013);另一方面,ESP能抑制宿主分泌NO和腹腔吞噬细胞对虫体的黏附、吞噬作用,帮助虫体实现免疫逃避(Flynn and Mulcahy,2008),增强宿主Th2反应的同时抑制Th1反应(Hillyer,2005)。CatB作为肝片吸虫产生的一种重要ESP,其生物学特性和功能至今尚未得到深入研究。CatB在虫体内的表达具有时空性,可能是通过切割宿主抗体或阻止免疫效应分子使肝片吸虫逃避宿主免疫应答(Creaney et al.,1996)。同时,CatB家族成员具有良好的免疫原性,可诱导感染宿主产生特异性免疫应答反应。Jayaraj等(2009)以肝片吸虫CatB和CatL5分别免疫大鼠,结果发现CatB可获得60.0%的减虫率,当两个蛋白联合免疫时保护率可达83.0%,说明CatB和CatL单独免疫或联合免疫均可对大鼠产生免疫保护作用,但联合免疫的保护效果更佳。Chantree等(2013)研究发现,小鼠免疫大片吸虫CatB2和CatB3蛋白2周后,其体内总IgG含量显著升高,且在感染囊蚴后IgG总量高水平保持4周。Wesołowska等(2018)以rFhCatL3-1和rFhCatL3-2分别免疫大鼠,结果使大鼠的肝片吸虫量分别降低47.0%和63.0%,用rFhCatL3-1/CatL3-2/CatB3制成的三价疫苗与rFhCatL3-2相比,其保护作用未见明显提高,但可有效降低肝片吸虫对大鼠肝脏的损伤;同时证实通过滴鼻免疫CatL5和CatB2二价重组蛋白亚单位疫苗能降低绵羊体内的载虫量,即肝片吸虫CatB具有作为亚单位疫苗候选抗原的潜力。本研究对肝片吸虫CatB4基因进行克隆表达后经免疫组化分析,结果发现CatB4蛋白主要在肝片吸虫成虫分泌组织细胞内大量表达,表明CatB4是肝片吸虫成功入侵和寄生过程中的一种重要蛋白。
CatB家族的大部分成员主要在肝片吸虫童虫阶段分泌表达,但也有部分CatB蛋白可在成虫阶段表达,与CatL在虫体的寄生过程中起协同作用(李晓娟,2009),提示CatB蛋白可能在成虫虫体移行、寄生和免疫逃避过程中发挥重要作用。为此,本研究对肝片吸虫CatB4基因进行克隆及原核表达,结果证实诱导表达获得的融合蛋白CatB4可与肝片吸虫阳性血清发生特异性反应,即有较强的免疫原性,且CatB4蛋白主要在肝片吸虫成虫卵黄腺及肠管上皮细胞中表达,该结论为进一步研究肝片吸虫CatB4蛋白的生物学特性及其致病机理打下基础。
4 结论
诱导表达获得的融合蛋白CatB4可特异性识别绵羊肝片吸虫阳性血清,具有较强的免疫原性,且主要在肝片吸虫分泌排泄组织器官中表达,说明CatB4蛋白具有作为肝片吸虫候选抗原的潜力。
参考文献:
何山红,班克满,郭亚芬,杨丰利,韦英明. 2010. 广西钦州市郊区水牛大片吸虫感染情况调查分析[J]. 广西农业科学,41(11):1237-1239. [He S H,Ban K M,Guo Y F,Yang F L,Wei Y M. 2010. Status of Fasciola gigantica infection in buffaloes in Qinzhou suburb of Guangxi[J]. Guangxi Agricultural Sciences,41(11):1237-1239.]
黎萬奎,陈幼竹,周宇,徐恒. 2003. 肝片吸虫抗原基因转基因苜蓿再生的研究[J]. 四川大学学报(自然科学版),40(1):144-147. [Li W K,Chen Y Z,Zhou Y,Xu H. 2003. Regeneration of F. hepatica protective antigenic gene transgenic alfalfa plants by agrobacterium mediated gene transfer[J]. Journal of Sichuan University(Natural Science Edition),40(1):144-147.]
李晓娟. 2009. 肝片吸虫重组GST、CatL蛋白及其DNA核酸联合免疫初步研究[D]. 大庆:黑龙江八一农垦大学. [Li X J. 2009. Preliminary study on combination immunization with recombinant proteins and DNA nucleicacids of GST and CatL genes of Fasciola hepatica[D]. Daqing:Heilongjiang Bayi Agricultural University.]
田艾灵,朱兴全,黄思扬. 2017. 片形吸虫排泄分泌产物的研究进展[J]. 畜牧兽医学报,48(2):201-206. [Tian A L,Zhu X Q,Huang S Y. 2017. Research advance in excretory-secretory products of Fasciola spp[J]. Acta Veterina-ria et Zootechnica Sinica,48(2):201-206.]
王熙凤,孟庆玲,乔军,陈英,钟文强,贡莎莎,黄运福,才学鹏. 2018. 肝片吸虫Ftn-1蛋白分子特征、抗原性及其抗体制备[J]. 河南农业科学,47(2):119-124. [Wang X F,Meng Q L,Qiao J,Chen Y,Zhong W Q,Gong S S,Huang Y F,Cai X P. 2018. Molecular characterization,antigenicity and antibody preparation of Ftn-1 protein of Fasciola hepatica[J]. Journal of Henan Agricultural Scien-ces,47(2):119-124.]
Ashrafi K,Valero M A,Peixoto R V,Artigas P,Panova M,Mas-Coma S. 2015. Distribution of Fasciola hepatica and F. gigantica in the endemic area of Guilan,Iran:Relationships between zonal overlap and phenotypic traits[J]. Infection,Genetics and Evolution,31:95-109.
Bąska P,Norbury L J,Wiśniewski M,Januszkiewicz K,Wędrychowicz H. 2013. Excretory/secretory products of Fasciola hepatica but not recombinant phosphoglycerate kinase induce death of human hepatocyte cells[J]. Acta Parasitologica,58(2):215-217.
Beckham S A,Piedrafita D,Phillips C I,Samarawickrema N,Law R H,Smooker P M,Quinsey N S,Irving J A,Greenwood D,Verhelst S H,Bogyo M,Turk B,Coetzer T H,Wijeyewickrema L C,Spithill T W,Pike R N. 2009. A major cathepsin B protease from the liver fluke Fasciola hepatica has atypical active site features and a potential role in the digestive tract of newly excysted juvenile para-sites[J]. The International Journal of Biochemistry & Cell Biology,41(7):1601-1612.
Cancela M,Acosta D,Rinaldi G,Silva E,Durán R,Roche L,Zaha A,Carmona C,Tort J F. 2008. A distinctive repertoire of cathepsins is expressed by juvenile invasive Fasciola hepatica[J]. Biochimie,90(10):1461-1475.
Cervi L,Rubinstein H,Masih D T. 1996. Involvement of excretion-secretion products from Fasciola hepatica indu-cing suppression of the cellular immune responses[J]. Ve-terinary Parasitology,61(1-2):97-111.
Chantree P,Phatsara M,Meemon K,Chaichanasak P,Changklungmoa N,Kueakhai P,Lorsuwannarat N,Sangpairoj K,Songkoomkrong S,Wanichanon C,Itagaki T,Sobhon P. 2013. Vaccine potential of recombinant cathepsin B against Fasciola gigantica[J]. Experimental Parasitology,135(1):102-109.
Creaney J,Wilson L,Dosen M,Sandeman R M,Spithill T W,Parsons J C. 1996. Fasciola hepatica:Irradiation-induced alterations in carbohydrate and cathepsin-B protease expression in newly excysted juvenile liver fluke[J]. Experi-mental Parasitology,83(2):202-215.
Cwiklinski K,Dalton J P,Dufresne P J,La Course J,Wi-lliams D J,Hodgkinson J,Paterson S. 2015. The Fasciola hepatica genome:Gene duplication and polymorphism reveals adaptation to the host environment and the capacity for rapid evolution[J]. Genome Biology,16:71.doi:10. 1186/s13059-015-0632-2.
Flynn R J,Mulcahy G. 2008. Possible role for Toll-like receptors in interaction of Fasciola hepatica excretory/secretory products with bovine macrophages[J]. Infection and Immunity,76(2):678-684.
Hillyer G V. 2005. Fasciola antigens as vaccines against fascioliasis and schistosomiasis[J]. Journal of Helminthology,79(3):241-247.
Jayaraj R,Piedrafita D,Dynon K,Grams R,Spithill T W,Smooker P M. 2009. Vaccination against fasciolosis by a multivalent vaccine of stage-specific antigens[J]. Veterinary Parasitology,160(3-4):230-236.
Kumar N,Anju V,Gaurav N,Chandra D,Samanta S,Gupta S C,Adeppa J,Raina O K. 2012. Vaccination of buffaloes with Fasciola gigantica recombinant glutathione S-transferase and fatty acid binding protein[J]. Parasitology Research,110(1):419-426.
López-Abán J,Casanueva P,Nogal J,Arias M,Morrondo P,Diez-Baños P,Hillyer G V,Martínez-Fernández A R,Muro A. 2007. Progress in the development of Fasciola hepatica vaccine using recombinant fatty acid binding protein with the adjuvant adaptation system ADAD[J]. Vete-rinary Parasitology,145(3-4):287-296.
Maggioli G,Silveira F,Martín-Alonso J M,Salinas G,Carmona C,Parra F. 2011. A recombinant thioredoxin-glutathione reductase from Fasciola hepatica induces a protective response in rabbits[J]. Experimental Parasitology,129(4):323-330.
Mas-Coma S,Valero M A,Bargues M D. 2009. Chapter 2. Fasciola,lymnaeids and human fascioliasis,with a global overview on disease transmission,epidemiology,evolutionary genetics,molecular epidemiology and control[J]. Advances in Parasitology,69:141-146.
Meemon K,Sobhon P. 2015. Juvenile-specific cathepsin proteases in Fasciola spp.:Their characteristics and vaccine e-fficacies[J]. Parasitology Research,114(8):2807-2813.
Robinson M W,Menon R,Donnelly S M,Dalton J P,Ranganathan S. 2009. An integrated transcriptomics and proteomics analysis of the secretome of the helminth pathogen Fasciola hepatica:Proteins associated with invasion and infection of the mammalian host[J]. Molecular & Cellular Proteomics,8(8):1891-1907.
Robinson M W,Tort J F,Lowther J, Donnelly S M,Wong E,Xu W,Stack C M,Padula M,Herbert B,Dalton J P. 2008. Proteomics and phylogenetic analysis of the cathepsin L protease family of the helminth pathogen Fasciola hepatica:Expansion of a repertoire of virulence-associated factors[J]. Molecular & Cellular Proteomics,7(6):1111-1123.
Wesołowska A,Basałaj K,Norbury L J,Sielicka A,Wędrychowicz H,Zawistowska-Deniziak A. 2018. Vaccination against Fasciola hepatica using cathepsin L3 and B3 proteases delivered alone or in combination[J]. Veterinary Parasitology,250:15-21. doi:10.1016/j.vetpar.2017.12.007.
(責任编辑 兰宗宝)
