2015—2017年广西鸡源沙门氏菌耐药性与致病性的相关性分析
2019-09-10张珍施开创王孝德黎宗强尹彦文屈素洁陆文俊
张珍 施开创 王孝德 黎宗强 尹彦文 屈素洁 陆文俊




摘要:【目的】明確鸡源致病性沙门氏菌耐药表型与致病性的相关性,为有效防控鸡沙门氏菌病提供科学依据。【方法】采用玻片凝集试验对55株鸡源沙门氏菌广西分离株进行血清型鉴定,以纸片扩散(K-B)法和PCR分别测定其耐药表型及耐药基因,通过小鼠攻毒试验检测其致病性,并分析鸡源沙门氏菌广西分离株耐药表型与致病性的相关性。【结果】55株沙门氏菌广西分离株以鼠伤寒沙门氏菌和鸡白痢沙门氏菌为主,对青霉素G、阿莫西林、苯唑西林、头孢噻吩、红霉素和利福平的耐药率均达100.00%,而对庆大霉素和大观霉素较敏感(耐药率在10.00%以下)。55株沙门氏菌广西分离株中有1株(占1.82%)携带7种耐药基因、6株(占10.91%)携带6种耐药基因、20株(占36.36%)携带5种耐药基因、12株(占21.82%)携带4种耐药基因、13株(占23.64%)携带3种耐药基因、3株(占5.45%)携带2种耐药基因;16种耐药基因中,blaTEM、tetX、sul3和aadA1基因检出率较高,qepA、blaCMY和tetB基因检出率较低,而qnrA、qnrB、Aph(3)-IIa、blaPSE和aadA2基因等未被检出。55株沙门氏菌广西分离株对昆明小白鼠均具有致病性,致死率为20%~100%;随机选取10株分离株对昆明小白鼠的半数致死量(LD50)为4.00×107~3.18×108 CFU/mL。沙门氏菌分离株耐药种类数量与LD50对数值的线性回归方程为y=-0.086x+8.971(R2=0.9329),耐药基因数量与LD50对数值的线性回归方程为y=-0.148x+8.673(R2=0.5748),即沙门氏菌的耐药性与其致病性呈正相关。【结论】2015—2017年从广西发病鸡分离获得的致病性沙门氏菌以鼠伤寒沙门氏菌和鸡白痢沙门氏菌为主,普遍存在耐药性,且多重耐药现象严重。鸡源致病性沙门氏菌的耐药表型与其致病性间呈正相关,因此,生产上要加强临床用药管理,加大细菌耐药监测与防范。
关键词: 鸡;沙门氏菌;耐药表型;耐药基因;致病性;相关性
中图分类号: S858.31 文献标志码: A 文章编号:2095-1191(2019)10-2350-09
Correlation between antimicrobial resistance and pathogenicity of Salmonella from chicken in Guangxi during 2015-2017
ZHANG Zhen1, SHI Kai-chuang2*, WANG Xiao-de3, LI Zong-qiang1,
YIN Yan-wen2, QU Su-jie2, LU Wen-jun2
(1College of Animal Science and Technology, Guangxi University, Nanning 530004, China; 2Guangxi Animal Disease Prevention and Control Center, Nanning 530001, China; 3Hezhou Animal Disease Prevention and Control Center,
Hezhou, Guangxi 542800, China)
Abstract:【Objective】The correlation between antimicrobial resistance and pathogenicity of Salmonella isolates from chicken were analyzed for supporting scientific bases of effective prevention and control of poultry Salmonella disease. 【Method】The serotypes of 55 Salmonella Guangxi isolates from chicken were determined by tablet agglutination test. The paper diffusion K-B agar method was used to determine their resistant phenotype and PCR was used to detect the resistance genes. The pathogenic experiment in mice was used to determine their pathogenicity. The correlation between resistant phenotype of Salmonella Guangxi isolates from chicken and pathogenicity was also analyzed. 【Result】The 55 Salmonella Guangxi isolates mainly consisted of S. typhimurium and S. pullorum. All of them were 100.00% resistant to penicillin G, amoxicillin, oxacillin, cefalotin, erythromycin and rifampicin,but were sensitive to entamicin and spectinomycin(resistance rate less than 10.00%). Of the 55 Salmonella Guangxi isolates,one strain(1.82%) contained seven resistant genes,six strains(10.91%) contained six resistant genes, twenty strains(36.36%) contained five resistant genes, twelve strains(21.82%) contained four resistant genes, thirteen strains(23.64%) contained three resistant genes and three strains (5.45%) contained two resistant genes. Of 16 kinds of resistant genes,blaTEM, tetX, sul3 and aadA1 had high positive rate,qepA, blaCMY and tetB had low positive rate,while qnrA, qnrB, Aph(3)-IIa, blaPSE and aadA2 were negative. All the 55 Salmonella Guangxi isolates were pathogenic to Kunming mice, and the mortality rate of them was 20%-100%. The median lethal dose(LD50) of 10 randomly selected isolates to Kunming mice was 4.00×107-3.18×108 CFU/mL. The linear regression equation between the numbers of drug resistant types and the logarithm values of LD50 was y=-0.086x+8.971(R2=0.9329), and the linear regression equation between the numbers of resistant genes and the logarithm values of LD50 was y=-0.148x+8.673(R2=0.5748), which indicated that there existed positive relationship between antimicrobial resistance and pathogenicity of salmonella isolates. 【Conclusion】The pathogenic Salmonella isolates from Guangxi diseased chicken during 2015-2017 mainly consist of S. Typhimurium and S. pullorum, and they commonly show resistance to antimicrobials and their multi-drug resistance is serious. There exists positive correlation between resistance phenotype and pathogenicity of the chicken Salmonella isolates, so it is necessary to strengthen clinical drug administration and increase bacterial drug resistance monitoring and prevention.
Key words: chicken; Salmonella; antimicrobial resistance phenotype; antimicrobial resistance gene; pathogenicity; correlation
0 引言
【研究意义】沙门氏菌(Salmonella)血清型有2600种以上,且部分血清型可造成人畜共患病,严重威胁公共卫生安全(李帆等,2018)。在养禽业中,不同血清型沙门氏菌可引起鸡白痢、鸡伤寒和禽副伤寒,且危害严重,给养殖户带来巨大经济损失(王嘉炜等,2017)。抗菌药物在防治沙门氏菌病方面发挥着重要作用,但由于长期使用和滥用,沙门氏菌对抗菌药物的耐药性呈逐年上升趋势,尤其是多重耐药现象始终困扰着养禽业的健康发展。因此,研究鸡源沙门氏菌耐药性与致病性的相关性,明确其致病机理,对临床科学用药及促进养禽业持续健康发展具有重要意义。【前人研究进展】随着抗菌药物在畜牧业生产中的广泛使用,病原菌在抗菌药物的压力下诱发产生多种耐药机制,并通过染色体和质粒等多种方式传播,其中,来自染色体的耐药性可稳定传给子代,来自质粒的耐药性可垂直传播给子代和水平传播给不同细菌,致使耐药菌的数量及其范围不断扩大(Lima et al.,2013;Ali et al.,2018)。此外,临床上长期超范围乱用和滥用抗菌药物,导致耐药问题日趋严重,极大危害畜牧业生产和公共卫生安全(Hur et al.,2012;Michael and Schwarz,2016)。Breui等(2000)曾报道,1994—1997年来自法国的25526株沙门氏菌分离株(人源5086株,动物源20440株)对阿莫西林—克拉维酸的耐药率由45%上升至66%,且人源分离株对氨苄西林的耐药率由61%上升至73%、动物源分离株对萘啶酸的耐药率由3%上升至72%。由于各地用药种类、频率和习慣不同,故沙门氏菌耐药性也存在一定的地域和时间差异(Foley and Lynne,2008;Lai et al.,2014)。Ren等(2016)研究报道,102株鸡源沙门氏菌广东分离株中38.2%对链霉素、36.3%对四环素、35.3%对磺胺异恶唑、34.3%对庆大霉素耐药,且有31.4%分离株表现出多重耐药。Zishiri等(2016)研究表明,南非鸡源沙门氏菌对抗菌药物的耐药率表现为四环素93.0%、甲氧氨苄嘧啶—磺胺甲恶唑84.0%、甲氧氨苄嘧啶78.4%、卡那霉素74.0%、庆大霉素48.0%、青霉素47.0%、阿莫西林和氯霉素31.0%、红霉素18.0%、链霉素12.0%;而同期来自巴西的沙门氏菌分离株耐药率表现为青霉素和阿莫西林100.0%、四环素83.0%、甲氧氨苄嘧啶66.7%、红霉素62.5%、甲氧氨苄嘧啶—磺胺甲恶唑50.0%、卡那霉素16.7%、庆大霉素和链环素12.5%、氯霉素4.2%。关于细菌产生耐药性是否影响其致病性的问题已引起广泛关注。Huehn等(2010)通过检测沙门氏菌携带毒力基因及其对抗菌药物的耐药情况,发现沙门氏菌获得耐药性后毒力增强,即适应环境的生存能力有所增强。Dione等(2011)在检测沙门氏菌分离株的毒力基因和耐药表型时发现,分离株毒力岛及质粒携带的毒力基因与其耐药性存在显著正相关。【本研究切入点】广西是我国的养鸡大省(区),年饲养量超过10亿羽,尤其是黄羽鸡作为广西优势鸡种,因饲养周期长,加上当前疫情复杂,生产中常使用大量抗菌药物预防和治疗各种疫病,致使沙门氏菌流行株产生耐药和多重耐药的概率增加(施开创等,2018),因而亟需掌握其耐药现状及其对鸡群致病性的影响。【拟解决的关键问题】采用玻片凝集试验对55株鸡源沙门氏菌广西分离株进行血清型鉴定,以纸片扩散(K-B)法和PCR分别测定其耐药表型及耐药基因,通过小鼠攻毒试验检测其致病性,并分析鸡源沙门氏菌广西分离株耐药表型与致病性的相关性,为有效防控鸡沙门氏菌病提供科学依据。
1 材料与方法
1. 1 试验材料
大肠埃希氏菌、鼠伤寒沙门氏菌、鸡白痢沙门氏菌等质控菌株购自中国兽医菌种保藏中心;4周龄左右的SPF级昆明小白鼠(20~25 g/只)购自广西中医药大学实验动物中心。试验过程中昆明小白鼠饲养在实验室动物房内,室温控制在22~25 ℃、相对湿度控制在40%~60%,用广西中医药大学实验动物中心提供的无抗生素全价专用饲料饲喂,自由饮用灭菌双蒸水。亚硒酸盐胱氨酸(SC)增菌液、胆盐硫乳(DHL)、木糖赖氨酸过氧胆盐(XLD)、营养(NA)和三糖铁(TSI)琼脂购自北京陆桥技术股份有限公司;Rapid ID 32E肠杆菌检测试剂条购自法国生物梅里埃股份有限公司;沙门氏菌属诊断血清购自宁波天润生物药业有限公司;18种药敏纸片购自杭州滨和微生物试剂有限公司;细菌DNA提取试剂盒购自天根生化科技(北京)有限公司。
1. 2 沙门氏菌分离鉴定
2015—2017年,采集来自广西各地1544只病死鸡的组织样品(心脏、肝脏、脾脏和肺脏等),参照施开创等(2015)的方法分离鉴定沙门氏菌。具体操作:将组织悬液增菌后分别接种至XLD培养基、DHL培养基和显色培养基培养,挑选疑似沙门氏菌典型菌落纯化培养,然后进行革兰氏染色镜检、生化鉴定和血清型鉴定。同时,设计特异性引物对(invA-F:5'-GTGAAATTATCGCCACGTTCGGGCAA-3'和invA-R:5'-TCATCGCACCGTCAAAGGAACC-3')用于扩增沙门氏菌属特异性基因片段invA(285 bp),对生化鉴定和血清型鉴定呈阳性的沙门氏菌分离株进行PCR鉴定。
1. 3 药敏性试验
采用纸片扩散(K-B)法对沙门氏菌分离株进行18种抗菌药物的药敏试验,参照美国临床和实验室标准协会(CLSI)制定的标准对药敏试验结果进行判定(CLSI,2014)。
1. 4 耐药基因检测
参照GenBank已发表的耐药基因序列和相关文献(Nde and Logue,2008;廖成水等,2011;Lu et al.,2011;刘芳萍等,2013),设计16对特异性引物(表1)用于扩增β-内酰胺类、氨基糖苷类、四环素类、磺胺类和氟喹诺酮类共16种代表性耐药基因。挑取沙门氏菌分离株纯化培养的单菌落,在LB培养液中37 ℃培养12 h,提取细菌总DNA。PCR反应体系20.0 μL:Premix TaqTM 10.0 μL,25 pmol/μL的上、下游引物各0.5 μL,DNA模板2.0 μL,灭菌双蒸水7.0 μL。扩增程序:94 ℃预变性5 min;94 ℃ 30 s,52~57 ℃ 30 s,72 ℃ 45 s,进行35个循环;72 ℃延伸10 min。PCR扩增产物经1.0%琼脂糖凝胶电泳后,采用凝胶成像系统观察拍照。
1. 5 致病性试验
对获得的55株鸡源沙门氏菌广西分离株进行致病性试验。将280只昆明小白鼠随机分成56组(55个试验组和1个对照组,5只/组),试验组昆明小白鼠每只腹腔注射细菌液0.2 mL(4×108 CFU/mL),对照组每只腹腔注射0.2 mL灭菌营养肉汤。接种后各组昆明小白鼠分笼饲养,每隔6 h观察一次,连续观察168 h(7 d)。记录昆明小白鼠的发病及死亡情况,对死亡的昆明小白鼠及时进行剖检及细菌分离鉴定。
1. 6 半数致死量(LD50)测定
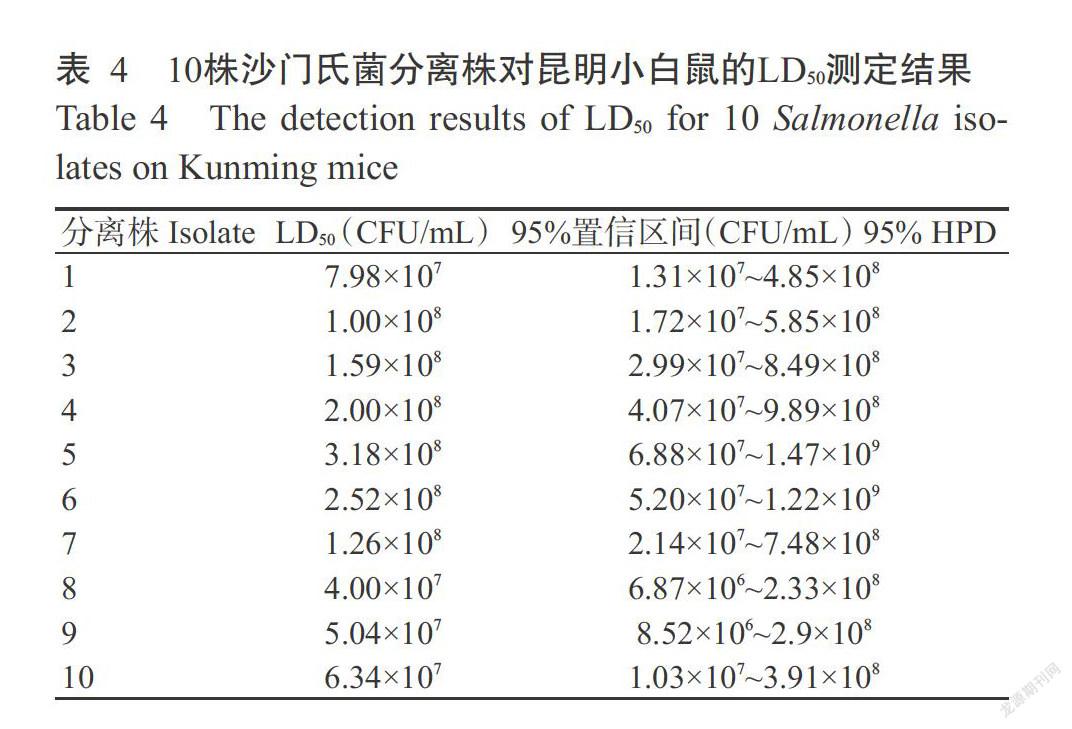
随机选取10株鸡源沙门氏菌广西分离株,测定其对昆明小白鼠的LD50。将205只昆明小白鼠随机分成41组(40个试验组和1个阴性对照组,5只/组),每株沙门氏菌分离株设4个剂量组,分别为4×109、4×108、4×107和4×106 CFU/mL。经腹腔注射攻毒后,每6 h观察一次,连续观察168 h(7 d)。记录昆明小白鼠的死亡情况,并应用改良的寇氏法计算LD50。
2 结果与分析
2. 1 沙门氏菌的分離及生化鉴定结果
无菌采集病死鸡的组织样品,经SC增菌培养后平行接种于鉴别培养基上。菌落挑选标准:圆形、边缘整齐、表面光滑,同时在DHL培养基上呈无色半透明、有或无黑色中心,在XLD培养基上呈粉红或黄色、有或无黑色中心,在显色培养基上呈紫红色,在TSI培养基上呈红色、底部有或无黑色中心;革兰氏染色为阴性短杆菌。将初筛获得的分离株接种至Rapid ID 32E肠杆菌试剂条上,采用ATB细菌自动鉴定仪进行鉴定,结果显示所有分离株的氰化钾、尿素、靛基质和β-半乳糖苷酶试验均呈阴性,赖氨酸脱羧酶反应呈阳性或阴性,符合沙门氏菌的生化特性。通过上述分离鉴定,共获得55株疑似沙门氏菌。
2. 2 沙门氏菌分离株的PCR鉴定结果
采用特异性引物对(invA-F/invA-R),以55株分离株的总DNA为模板进行PCR鉴定,扩增沙门氏菌属特异性基因invA,结果均扩增获得与目的片段大小(285 bp)一致的条带,表明55株分离株均属于沙门氏菌。部分疑似沙门氏菌分离株的PCR鉴定结果见图1。
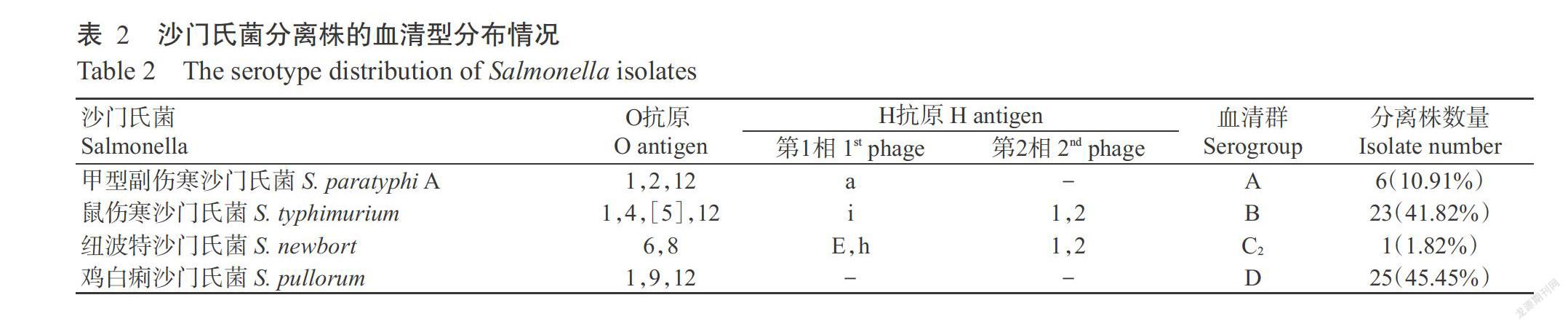
2. 3 沙门氏菌分离株的血清型鉴定结果
采用沙门氏菌“O”多价血清(A群~F群)进行玻片凝集试验,参照GB 4789.4—2016《食品安全国家标准 食品微生物学检验 沙门氏菌检验》,根据O抗原及H抗原第一相和第二相反应结果进行血清分群和定型。同时,参照涂玉蓉等(2011)的方法,采用PCR进行鸡白痢沙门氏菌和鸡伤寒沙门氏菌鉴定。结果表明,55株分离株包含4个血清群(A群6株、B群23株、C2群1株和D群25株),其中,B群鼠伤寒沙门氏菌(41.82%)和D群鸡白痢沙门氏菌(45.45%)是广西当前流行的优势菌株(表2)。
2. 4 沙门氏菌分离株的药敏试验结果
采用K-B法进行药敏试验,结果(表3)显示,55株鸡源沙门氏菌广西分离株对青霉素G、阿莫西林、苯唑西林、头孢噻吩、红霉素和利福平的耐药率均达100.00%,对多粘菌素E、林可霉素、复方新诺明和呋喃妥因的耐药率在90.00%以上,对强力霉素、链霉素和诺氟沙星的耐药率在50.00%~90.00%,而对大观霉素和庆大霉素的耐药率在10.00%以下,表明沙门氏菌广西分离株普遍存在耐药和多重耐药现象。
2. 5 沙门氏菌分离株耐药基因的检测结果
采用设计的16对特异引物对55株鸡源沙门氏菌广西分离株进行耐药基因检测,结果显示,55株沙门氏菌分离株中有1株(占1.82%)携带7种耐药基因、6株(占10.91%)携带6种耐药基因、20株(占36.36%)携带5种耐药基因、12株(占21.82%)携带4种耐药基因、13株(占23.64%)携带3种耐药基因、3株(占5.45%)携带2种耐药基因。16种耐药基因中,blaTEM基因(81.82%)、tetX基因(78.18%)、sul3基因(74.55%)和aadA1基因(65.45%)检出率较高,qepA基因(5.45%)、blaCMY基因(3.64%)和tetB基因(1.82%)检出率较低,而qnrA基因、qnrB基因、Aph(3)-IIa基因、blaPSE基因和aadA2基因等未被检出(表3)。
2. 6 沙门氏菌分离株的致病性试验结果
以55株鸡源沙门氏菌广西分离株的菌液分别腹腔注射昆明小白鼠后,48 h内均出现典型临床症状,表现为精神萎靡,皮毛松乱,时有颤抖,且粪便带黏液;而对照组昆明小白鼠在整个试验过程中均无异常表现。各试验组昆明小白鼠的累计死亡率为20%~100%,剖检死亡昆明小白鼠发现其肝脏和脾脏肿大且呈青铜色,肝脏表面有针尖大小、灰白的坏死点,重新取样进行病原菌分离鉴定,结果证实均为沙门氏菌。随机选取10株沙门氏菌分离株,每株分离株设4个剂量组(4×109、4×108、4×107和4×106 CFU/mL)分别腹腔注射昆明小白鼠(0.2 mL/只),每组5只。参照黄晓冬等(2012)的方法,应用改良的寇氏法计算LD50,结果见表4。10株沙门氏菌分离株对昆明小白鼠的LD50介于4.00×107~3.18×108 CFU/mL,表明不同分离株间的致病性存在一定差异。
2. 7 沙门氏菌分离株耐药表型与耐药基因的相关性
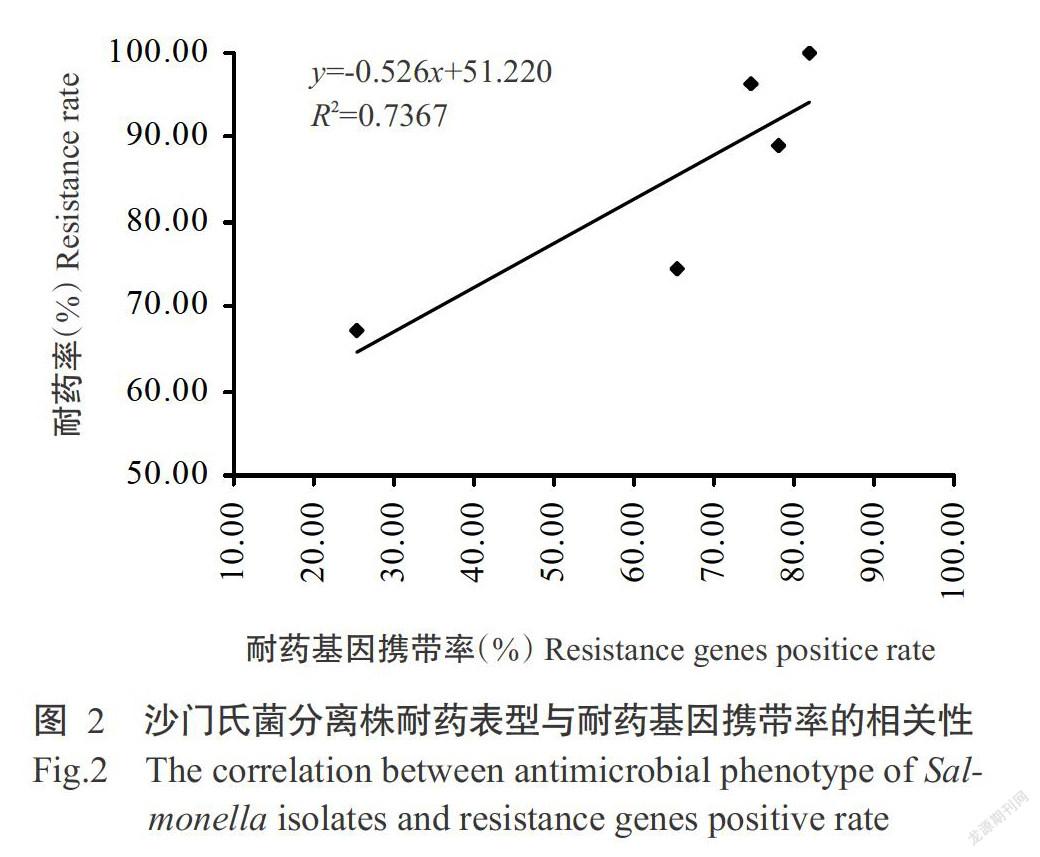
药敏试验和耐药基因检测结果(表3)显示,55株鸡源沙门氏菌广西分离株的耐药率分别为:β-内酰胺类100.00%、氨基糖苷类74.55%、四环素类89.09%、磺胺类96.36%、氟喹诺酮类67.27%;耐药基因携带率分别为:β-内酰胺类81.82%、氨基糖苷类65.45%、四环素类78.18%、磺胺类74.55%、氟喹诺酮类25.45%。经一元回归分析拟合得到沙门氏菌分离株耐药表型与耐药基因携带率的线性回归方程为y=-0.526x+51.220(R2=0.7367),即耐药表型与耐药基因呈正相关(图2),沙门氏菌分离株携带耐药基因越多,其耐药性越严重。
2. 8 沙门氏菌分离株耐药性与其致病性的相关性
综合沙门氏菌分离株的药敏试验和致病性试验结果可知,耐药性越强的菌株其致病性越强。采用一元回归分析拟合得到沙门氏菌分离株耐药性与其致病性的相关性(图3),其中,沙门氏菌分离株耐药种类数量与LD50对数值的线性回归方程为y=-0.086x+8.971(R2=0.9329),耐药基因数量与LD50对数值的线性回归方程为y=-0.148x+8.673(R2=0.5748)。说明沙门氏菌分离株的耐药种类数量及耐药基因种类越多,其对昆明小白鼠的LD50对数值越小,分离株毒力越强,即沙门氏菌的耐药性与其致病性呈正相关。
3 讨论
细菌耐药性危害日趋严重,已引起世界各国的高度重视,并普遍加强细菌耐药性的监测和防控。Fardsanei等(2018)研究表明,44株人源沙门氏菌伊朗分离株对环丙沙星的耐药率为90.9%、对硝基二氧酸的耐药率为77.3%、对头孢洛辛的耐药率为72.2%,对其他9种抗菌药物的耐药率为2.3%~40.9%,且68.2%的分离株表现出三重以上的耐药性。Thung等(2018)研究报道,23株牛源沙门氏菌马来西亚分离株对青霉素、红霉素和万古霉素均已产生耐药性,且所有分离株至少表现为三重耐药,最严重者达九重耐药。在国内,沈学怀等(2017)研究表明,42株鸡源沙门氏菌安徽分离株对阿米卡星、左氧氟沙星和环丙沙星的耐药率均低于20.00%,但对氨苄西林、呋喃唑酮、链霉素、复方新诺明、大观霉素和多西环素的耐药率在50.00%以上,其中对氨苄西林的耐药率高达97.62%,且97.62%的分离株存在多重耐药,最多达十二重耐药。孙璐等(2017)研究报道,233株鸡源沙门氏菌山东分离株对庆大霉素的耐药率最高(100.00%),对多西环素、氨苄西林、大观霉素、四环素、氟苯尼考和磺胺甲恶唑耐药率分别为84.94%、75.73%、67.78%、56.00%、52.00%和50.00%,且72.00%的分离株呈多重耐药。王嘉炜等(2017)研究发现,432株鸡源沙门氏菌陕西分离株对磺胺异恶唑的耐药率(89.81%)最普遍,对磺胺甲恶唑、萘啶酸、四環素、氨苄西林、氯霉素和阿莫西林—克拉维酸等抗菌药物的耐药率均在50.00%以上。在本研究中,55株鸡源沙门氏菌对青霉素G、阿莫西林、苯唑西林、头孢噻吩、红霉素和利福平的耐药率达100.00%,对多粘菌素E、复方新诺明、林可霉素和呋喃妥因的耐药率在90.00%以上,对链霉素、强力霉素和诺氟沙星的耐药率为50.00%~90.00%,且多重耐药现象非常严重。可见,沙门氏菌耐药及多重耐药现象在世界各国普遍存在,给畜牧业生产和公共卫生安全带来严峻挑战。究其原因主要是各鸡场长期超量、超范围使用,甚至乱用和滥用抗菌药物,且缺乏针对耐药细菌的监测和防范措施,导致耐药细菌和耐药种类越来越多。此外,由于各鸡场的经营理念和饲养管理水平不同,用药习惯、用药种类、用药剂量及用药时长的不同均可导致细菌耐药情况存在差异。
细菌产生耐药性的机制很多,其中耐药基因的作用最重要(董杰,2015)。耐药基因经染色体及质粒等不同载体介导,可垂直传播给子代,以及在不同菌株间进行水平传播,促使菌株产生耐药性,即细菌耐药性与其携带的耐药基因存在密切关系(刘芳萍等,2013;黎宗强等,2016;Unlu et al.,2018)。刘芳萍等(2013)研究表明,沙门氏菌耐药性与相关耐药基因的携带率一致,所检测的29株鸡源沙门氏菌耐药率分别为:氨苄西林31.0%,头孢唑啉10.3%,四环素44.8%,复合磺胺41.4%,环丙沙星37.9%,氧氟沙星37.9%,诺氟沙星37.9%,氯霉素3.4%;而耐药基因检出率分别为:blaTEM-1基因31.0%,tetA基因37.9%,tetB基因44.8%,sul1基因41.3%,sul2基因41.3%,aadA1基因3.4%,dfrA1基因10.3%,qnr基因37.9%。黎宗强等(2016)研究报道,29株鸡源沙门氏菌对16种抗菌药物的耐药性最高可达十四重耐药,以六重耐药和七重耐药为主(占51.73%);耐药基因以同时携带4~6种为主(占79.31%),耐药表型与耐药基因携带率呈正相关。Unlu等(2018)通过检测50株人源沙门氏菌分离株对青霉素、阿莫西林、哌拉西林、头孢他嗪、塞里阿松、甲氧氨苄嘧啶和左氧氟沙星的耐药性,以及耐药基因blaSHV-1、blaTEM-1、blaCTX-1、qnrA、qnrB、qnrS、sul1和sul2的携带情况,证实细菌耐药表型与其携带耐药基因呈密切正相关。本研究结果表明,采用设计的16对特异引物能从55株鸡源沙门氏菌广西分离株中检测出11种耐药基因,以blaTEM基因检出率最高(81.82%);其中,1株(占1.82%)携带7种耐药基因、6株(占10.91%)携带6种耐药基因、20株(占36.36%)携带5种耐药基因、12株(占21.82%)携带4种耐药基因、13株(占23.64%)携带3种耐药基因、3株(占5.45%)携带2种耐药基因;且通过拟合沙门氏菌分离株耐药表型与耐药基因携带率间的线性回归方程得知,耐药表型与耐药基因呈正相关,即沙门氏菌分离株携带耐药基因越多,其耐药性越严重。
细菌毒力受其耐药性及毒力基因携带情况的双重影响(Huehn et al.,2010;Dione et al.,2011)。Huehn等(2010)对77株人源和动物源沙门氏菌分离株进行毒力基因(avrA、ssaQ、mgtC、siiD、sopB、gipA、sodC1、sopE1、spvC和bcfC)携带情况及耐药性检测,结果发现细菌耐药性可增加其毒力,从而增强细菌适应环境的生存能力。Dione等(2011)通过检测185株人源和动物源沙门氏菌分离株的耐药性和毒力基因,发现沙门氏菌分离株对甲基氨苄嘧啶、阿莫西林、四环素、甲基氨苄嘧啶—磺胺甲恶唑、替卡西林、壮观霉素、链霉素、磺酰胺和呋喃妥因的耐药性与其毒力岛及质粒所携带的毒力基因(sopB、sitC、orfLC、pipD和pefA)存在显著正相关。此外,抗菌药物耐药基因与菌株毒力质粒密切相关,且具有多重耐药的沙门氏菌较未具有多重耐药的沙门氏菌毒力更强(Nayak et al.,2004;Ngoi and Thong,2013)。Nayak等(2004)研究表明,火鸡源沙门氏菌对红霉素、杆菌肽、新生霉素和利福平的多重耐药率高达100%,且这种多重耐药性是通过染色体变异及耐药基因转移而获得,同时能增强相应分离株的毒力。Ngoi等(2013)检测了111株沙门氏菌分离株(人源45株,动物源66株)的耐药性,发现62%人源菌株和23%动物源菌株具有多重耐药,处于高风险阶段的人源菌株(40%)是动物源菌株(18%)的2倍多。本研究随机选取10株鸡源沙门氏菌广西分离株,分析其耐药性与致病性的相关性,结果发现沙门氏菌分离株的耐药种类数量越多,其毒力越强。生产上长期使用抗菌药物导致细菌耐药性加重和毒力增强(Foley and Lynne,2008),是由于细菌毒力与耐药质粒共同进化,进而导致耐药性越多的细菌毒力越强,因此,生产上要加强临床用药管理,加大细菌耐药监测与防范。
4 结论
2015—2017年从广西发病鸡分离获得的致病性沙门氏菌以鼠伤寒沙门氏菌和鸡白痢沙门氏菌为主,普遍存在耐药性,且多重耐药现象严重。鸡源致病性沙门氏菌的耐药表型与其致病性间呈正相关,因此,生产上要加强临床用药管理,加大细菌耐药监测与防范。
参考文献:
董杰. 2015. 细菌获得性抗生素耐药基因研究进展[J]. 中国预防医学杂志,16(1):71-74. [Dong J. 2015. Research pro-gress on bacterial acquired antibiotics resistance gene[J]. Chinese Preventive Medicine,16(1):71-74.]
黄晓冬,蔡建秀,林海鸿. 2012. 天竺桂挥发油的毒理学研究[J]. 时珍国医国药,23(1):138-139. [Huang X D,Cai J X,Lin H H. 2012. Toxicology study of volatile oil of Tianzhugui[J]. Lishizhen Medicine and Materia Medica Research,23(1):138-139.]
黎宗強,施开创,李凤梅,王海清,张珍,尹彦文. 2016. 鸡源致病性沙门氏菌耐药表型与耐药基因、血清群的相关性研究[J]. 动物医学进展,37(3):25-32. [Li Z Q,Shi K C,Li F M,Wang H Q,Zhang Z,Yin Y W. 2016. Correlation analysis of antimicrobial resistance,resistance genes and serogroup of pathogenic Salmonella isolates from chickens[J]. Progress in Veterinary Medicine,37(3):25-32.]
李帆,罗行炜,刘建华,梁军,贺丹丹,潘玉善,苑丽,胡功政. 2018. 猪源沙门氏菌多药外排泵oqxAB和氟苯尼考耐药基因floR的检测分析[J]. 江西农业学报,30(11):82-85. [Li F,Luo X W,Liu J H,Liang J,He D D,Pan Y S,Yuan L,Hu G Z. 2018. Detection and analysis of multi-drug efflux pump oqxAB and florfenicol-tolerant gene floR in swine-derived Salmonella typhimurium[J]. Acta Agriculturae Jiangxi,30(11):82-85.]
廖成水,程相朝,张春杰,李银聚,吴庭才,李小康,王晓利,胡阿勇. 2011. 鸡源致病性沙门氏菌新近分离株的耐药性与耐药基因[J]. 中国兽医科学,41(7):751-755. [Liao C S,Cheng X C,Zhang C J,Li Y J,Wu T C,Li X K,Wang X L,Hu A Y. 2011. Antimicrobial resistance and resistance genes of pathogenic Salmonella recently isola-ted from chicken[J]. Chinese Veterinary Science,41(7):751-755.]
刘芳萍,赵玉林,李昌文,刘立新,李睿,罗鹏志,卢斯亮,张秀英. 2013. 鸡源性沙门氏菌耐药基因检测与耐药相关性分析[J]. 中国预防兽医学报,35(8):627-630. [Liu F P,Zhao Y L,Li C W,Liu L X,Li R,Luo P Z,Lu S L,Zhang X Y. 2013. Drug resistance gene detection and the resistance correlation analysis in Salmonella isolated from chickens[J]. Chinese Journal of Preventive Veterinary Medicine,35(8):627-630.]
沈學怀,张丹俊,潘孝成,赵瑞宏,戴银,胡晓苗. 2017. 安徽地区禽源沙门氏菌分离鉴定与耐药性研究[J]. 中国畜牧兽医,44(12):3663-3669. [Shen X H,Zhang D J,Pan X C,Zhao R H,Dai Y,Hu X M. 2017. Isolation,identification and drug resistance analysis of avian Salmonella in Anhui[J]. Chinese Animal Husbandry & Veterinary Medi-cine,44(12):3663-3669.]
施开创,李凤梅,邹联斌,许心婷,王海清,钟诚. 2015. 鸡源致病性沙门氏菌的分离鉴定及血清型和药物敏感性分析[J]. 中国畜牧兽医,42(8):2160-2168. [Shi K C,Li F M,Zou L B,Xu X T,Wang H Q,Zhong C. 2015. Isolation,identification and analysis of serotype and antibiotic susceptibility of pathogenic Salmonella from chickens[J]. Chinese Animal Husbandry & Veterinary Medicine,42(8):2160-2168.]
施开创,尹彦文,温丽霞,屈素洁,王海清,胡杰. 2018. 黏菌素耐药基因mcr-1 TaqMan-MGB荧光定量PCR检测方法的建立[J]. 南方农业学报,49(7):1447-1452. [Shi K C,Yin Y W,Wen L X,Qu S J,Wang H Q,Hu J. 2018. Establishment of TaqMan-MGB fluorescent quantitative PCR for detection of colistin resistance gene mcr-1[J]. Journal of Southern Agriculture,49(7):1447-1452.]
孙璐,王娟,黄秀梅,曲志娜,王君伟,杨瑞梅,郑增忍. 2017. 肉鸡屠宰生产链中的沙门氏菌耐药基因检测及耐药性相关性分析[J]. 中国动物检疫,34(1):35-39. [Sun L,Wang J,Huang X M,Qu Z N,Wang J W,Yang R M,Zheng Z R. 2017. Drug-resistant gene detection of Salmonella in broiler slaughtering production chain and correlation analysis on drug resistance[J]. China Animal Health Inspection,34(1):35-39.]
涂玉蓉,陈建红,任涛,张济培,司兴奎,牛森. 2011. 基于等位基因特异性PCR原理建立鸡白痢沙门氏菌PCR方法[J]. 中国畜牧兽医,38(5):93-96. [Tu Y R,Chen J H,Ren T,Zhang J P,Si X K,Niu S. 2011. Development PCR assay for detecting Salmonella pollorum based on allele-specific PCR[J]. Chinese Animal Husbandry & Veterinary Medicine,38(5):93-96.]
王嘉炜,肖英平,杨华,曹晨阳,杨保伟. 2017. 鸡肉源沙门氏菌血清型、药敏性及部分耐药基因研究[J]. 食品科学,38(15):140-146. [Wang J W,Xiao Y P,Yang H,Cao C Y,Yang B W. 2017. Serotyping,antibiotic susceptibility and some genes associated with quinolones and fluoroquinolines resistance of chicken-borne Salmonella[J]. Food Science,38(15):140-146.]
Ali J,Rafig Q A,Ratcliffe E. 2018. Antimicrobial resistance mechanisms and potential synthetic treatments[J]. Future Science,4(4):FSO290. doi:10.4155/fsoa-2017-0109.
Breui J,Brisabois A,Casin I,Armand-Lefèvre L,Frémy S,Collatz E. 2000. Antibiotic resistance in salmonellae isolated from humans and animals in France:Comparative data from 1994 and 1997[J]. Journal of Antimicrobial Chemotherapy,46(6):965-971.
Clinical and Laboratory Standards Institute(CLSI). 2014. Performance standards for antimicrobial susceptibility tes-ting;twenty-first informational supplement. CLSI Document M100-S24[S]. Clinical and Laboratory Standards Institute.
Dione M M,Ikumapayi U,Saha D,Mohammed N I,Adegbola R A,Geerts S,Ieven M,Antonio M. 2011. Antimicrobial resistance and virulence genes of non-typhoidal Salmonella isolates in the Gambia and Senegal[J]. Journal of Infection and Development Ctries,5(11):765-775.
Fardsanei F,Soltan Dallal M M,Douraghi M,Memariani H,Bakhshi B,Zahraei Salehi T,Nikkhahi F. 2018. Antimicrobial resistance, virulence genes and genetic relatedness of Salmonella enterica serotype enteritidis isolates recovered from human gastroenteritis in Tehran,Iran[J]. Journal of Global Antimicrobial Resistance,12:220-226.
Foley S L,Lynne A M. 2008. Food animal-associated Salmonella challenges:Pathogenicity and antimicrobial resistance[J]. Journal of Animal Science,86(14):E173-E187.
Huehn S,La Ragione R M,Anjum M,Anjum M,Saunders M,Woodward M J,Bunge C,Helmuth R,Hauser E,Guerra B,Beutlich J,Brisabois A,Peters T,Svensson L,Madajczak G,Litrup E,Imre A,Herrera-Leon S,Mevius D,Ne-well D G,Malorny B. 2010. Virulotyping and antimicrobial resistance typing of Salmonella enterica serovars re-levant to human health in Europe[J]. Foodborne Pathogens and Disease,7(5):523-535.
Hur J,Jawale C,Lee J H. 2012. Antimicrobial resistance of Salmonella isolated from food animals:A review[J]. Food Research International,45(2):819-830.
Lai J,Wu C,Wu C,Qi J,Wang Y,Wang H,Liu Y,Shen J. 2014. Serotype distribution and antibiotic resistance of Salmonella in food-producing animals in Shandong Pro-vince of China,2009 and 2012[J]. International Journal of Food Microbiology,180:30-38.
Lima T B,Pinto M F,Ribeiro S M,de Lima L A,Viana J C,Júnior N G,Cândido E S,Dias S C,Franco O L. 2013. Bacterial resistance mechanism:What proteomics can elucidate[J]. The FASEB Journal,27(4):1291-1303.
Lu Y,Wu C M,Wu G J,Zhao H Y,He T,Cao X Y,Dai L,Xia L N,Qin S S,Shen J Z. 2011. Prevalence of antimicrobial resistance among Salmonella isolates from chi-cken in China[J]. Foodborne Pathogens and Disease,8(1):45-53.
Michael G B,Schwarz S. 2016. Antimicrobial resistance in zoonotic nontyphoidal Salmonella:An alarming trend?[J]. Clinical Microbiology and Infection,22(12):968-974.
Nayak R,Stewart T,Wang R F,Lin J,Cerniglia C E,Kenney P B. 2004. Genetic diversity and virulence gene determinants of antibiotic-resistant Salmonella isolated from preharvest turkey production sources[J]. International Journal of Food Microbiology,91(1):51-62.
Nde C W,Logue C M. 2008. Characterization of antimicro-bial susceptibility and virulence genes of Salmonella serovars collected at a commercial turkey processing plant[J]. Journal of Applied Microbiology,104(1):215-223.
Ngoi S T,Thong K L. 2013. Molecular characterization showed limited genetic diversity among Salmonella ente-ritidis isolated from humans and animals in Malaysia[J]. Diagnostic Microbiology and Infectious Disease,77(4):304-311.
Ren X,Li M,Xu C,Cui K,Feng Z,Fu Y,Zhang J,Liao M. 2016. Prevalence and molecular characterization of Salmonella enterica isolates throughout an integrated broiler supply chain in China[J]. Epidemiology and Infection,144(14):2989-2999.
Thung T Y,Radu S,Mahyudin N A,Rukayadi Y,Zakaria Z,Mazlan N,Tan B H,Lee E,Yeoh S L,Chin Y Z,Tan C W,Kuan C H,Basri D F,Wan Mohamed Radzi C W J. 2018. Prevalence,virulence genes and antimicrobial resistance profiles of Salmonella serovars from retail beef in Selangor,Malaysia[J]. Frontiers in Microbiology,8:2697. doi:10.3389/fmicb.2017.02697.
Unlu O,Aktas Z,Tugrul H M. 2018. Analysis of virulence factors and antimicrobial resistance in Salmonella using molecular techniques and identification of clonal relationships among the strains[J]. Microbial Drug Resistance,24(10). doi: 10.1089/mdr.2018.0042.
Zishiri O T,Mkhize N,Mukaratiwa S. 2016. Prevalence of virulence and antimicrobial resistance genes in Salmonella spp. isolated from commercial chickens and human clinical isolates from South Africa and Brazil[J]. The Onderstepoort Journal of Veterinary Research,83(1):a1067. doi:10.4102/ojvr.v83i1.1067.
(責任编辑 兰宗宝)
