青藏高原矮火绒草内生细菌多样性及生物功能分析
2019-09-10程亮





摘要:【目的】探究矮火绒草(Leontopodium nanum)内生细菌的群落结构多样性及其生物学功能,为开发相应功能的生物菌剂提供參考,并为青藏高原生态农牧业生产提供有价值的内生细菌资源。【方法】采用组织分离法对矮火绒草植株内生细菌进行分离纯化,基于16S rDNA序列分析确定分离菌株的系统发育地位;通过平板对峙法检测分离菌株拮抗病原真菌活性;检测分离菌株的产吲哚乙酸(IAA)、溶磷和固氮能力;测定分离菌株除草活性、低温适生性及促种子萌发特性。【结果】从矮火绒草植株根、茎、叶和种子部位共分离获得52株内生细菌,基于16S rDNA序列分析发现52株菌株可归属于4门7纲10目14科18属。其中假单胞菌属细菌为根部优势属,约占根部细菌总数的52.17%;茎中以芽孢杆菌为优势属,约占茎部细菌总数的41.18%;各部位的内生细菌数量分布表现为根>茎>种子>叶。在52株内生细菌中,11株有拮抗病原真菌能力、9株具有产IAA能力、7株有溶磷活性、7株具有固氮活性、20株具有除草活性、13株具有耐低温能力和8株具有促生作用;从植株部位分布来看,7种类型的功能菌在根、茎和种子部位均有分布,拮抗菌和除草菌在根部所占的比例较高,溶磷菌株在各植株部位所占比例均较低;在叶中未分离到拮抗菌、产IAA菌、固氮菌和促生菌。各功能菌株分布在17个属,多样性较高,其中假单胞菌属和芽孢杆菌属中含有多种功能菌株,在植株4个部位所占比例也较高。【结论】矮火绒草植株不同部位内生细菌的数量分布具有差异性,但均可分离到不同类型的功能菌株,功能菌株涵盖17个属,其中以假单胞菌属和芽孢杆菌属居多。
关键词: 矮火绒草;内生细菌;多样性;生物学功能;青藏高原
中图分类号: S182;Q938 文献标志码: A 文章编号:2095-1191(2019)10-2222-12
Diversity and biological function of endophytic bacteria in Leontopodium nanum of Qinghai-Tibetan Plateau
CHENG Liang1,2
(1Institute of Plant Protection, Qinghai Academy of Agriculture and Forestry Science, Xining 810016, China;
2Key Laboratory of Agricultural Integrated Pest Management of Qinghai Province, Xining 810016, China)
Abstract:【Objective】The diversity and function of endophytic bacteria of Leontopodium nanum were explored to provide reference for developing biological bacterium agent with related functions and to provide valuable endophytic bacteria resources for ecological agriculture and animal husbandry production in Qinghai-Tibet Plateau. 【Method】The endophytic bacteria of L. nanum were isolated and purified by tissue isolation method. The phylogenetic status of the isolated strains was preliminarily determined based on 16S rDNA sequence analysis. The antagonistic activity of the strains against pathogenic fungi was detected by plate confrontation method. The indoleacetic acid(IAA) secretion, phosphate solubilization and nitrogen fixation abilities of the strains were tested. The herbicidal activity, low temperature suitability and seed germination characteristics were also determined. 【Result】Results showed that 52 endophytic bacteria that belonged to 28 genera, 14 families, 10 orders, 7 classes, 4 phyla were isolated from the root, stem leaf, and seed of L. nanum based on their 16S rDNA sequences. 52.17% isolates were identified as Pseudomonas, which was the most dominant genus in the roots of L. nanum. Bacillus was the most dominant genera in the stems of L. nanum, which accounted for 41.18% of the total. The quantitative distribution of endophytic bacteria in different parts of L. nanum was root>stem>seed>leaf. Furthermore, out of 52 isolates, 11 strains confirmed to have antifungal activity, 10 strains showed IAA-producing activity, 7 strains turned out to have phosphate-solubilizing activity,7 strains were proved to be azotobacter, 20 strains showed herbicidal activity, 13 strains showed low temperature tolerance and 8 strains exhibited growth-promoting effects. Seven types of functional endophytic bacteria were found in the root, stem, leaf and seed of L. nanum. Isolates with antagonistic and herbicidal activity had a relatively large proportion in the roots of L. nanum. The proportion of strains with phosphate-solubilizing activity in all plant parts was relatively small. Isolates with antagonistic, IAA-producing, nitrogen-fixing and growth-promoting activity were not discovered in the leaves of L. nanum. The functional endophytic bacteria were distribu-ted in 17 different genera and had high population diversity. The isolates from Pseudomonas and Bacillus were multi-functional strains with a high proportion in the four parts of seedlings. 【Conclusion】The number and distribution of endophytic bacteria in different parts of L. nanum plant are different, but can be isolated into different functional types. The functional strains consist of 17 genera, of which Pseudomonas and Bacillus are dominant genus.
Key words: Leontopodium nanum; endophytic bacteria; diversity; biological function; Qinghai-Tibetan Plateau
0 引言
【研究意义】自然界中几乎所有的植物都能与多种微生物形成互利共生或内寄生关系(Hardoim et al.,2015)。一直以来,植物—内生细菌共生体因其在生态环境中生长的优越性而备受关注(Vorholt,2012),在长期协同进化过程中内生细菌与宿主植物相互作用以维持互惠共生关系(White and Torres,2010)。宿主植物为内生细菌的生长繁殖提供营养物质和相对稳定的生存环境,而内生细菌通过调节和修饰宿主植物形态学、生理学及生物化学等特征,提高宿主植物在生物与非生物胁迫下的适应性,维持共生关系的稳定性(Chanway,1998)。因此,开展分离筛选植物内生细菌研究,可为今后开发功能抗病、除草、解磷、固氮及促生等多功能微生物菌剂提供菌种资源和筛选依据。【前人研究進展】近年来,有关植物内生细菌的研究主要集中在植物内生细菌基础生物学特性及其功能活性等方面。植物内生细菌的分布具有普遍性和多样性,在各种农作物及药用植物中均有存在,人们已从水稻、油菜、杜仲、黄芪和甘蔗等植物的苗期、成株期的根、茎和叶等部位分离到内生细菌(Sun et al.,2008;刘蓬蓬等,2018;王梅菊等,2018;陈小洁等,2019;刘鲁峰等,2019)。目前研究发现植物内生细菌的种类已超过129种,分属于54个属,主要集中在假单胞菌属(Pseudomonas)、肠杆菌属(Enterobacter)、芽孢杆菌属(Bacillus)、土壤杆菌属(Agrobacterium)、克雷伯氏菌属(Klebsiella)、泛菌属(Pantoea)和甲基杆菌属(Methylobacterium)等(Bulgarelli et al.,2013)。李晓璐等(2015)从水黄皮内生细菌中筛选出的蜡样芽孢杆菌对水稻害虫稻飞虱和稻纵卷叶螟有明显的毒杀作用,致死率在85%以上。陈超琼(2017)从西北荒漠地区采集的骆驼刺植物组织中分离获得的内生细菌LTYR-11Z不仅能促进小麦生长,还能提高小麦对干旱胁迫的抵抗能力。柳志强等(2017)从催吐萝芙木分离获得的内生枯草芽孢杆菌LYM3具有广谱抗菌性,其产生的抑菌活性产物主要为脂肽类物质。陆蓝翔等(2018)采用组织匀浆法从健康樟树组织中分离内生细菌,发现2株菌对扦插苗株高有较好的促生效果。赵玉华等(2018)从樟树周皮组织中分离获得的内生枯草芽孢杆菌EBS05对番茄植株具有明显的促生作用,对番茄抗番茄黄化曲叶病毒(TYLCV)具有诱导作用。Caulier等(2018)从马铃薯植株体内分离获得的Bacillus subtilis 30B-B6菌株对马铃薯晚疫病有很好的防治效果。【本研究切入点】矮火绒草(Leontopo-dium nanum)为菊科火绒草属多年生草本植物,是高寒草地牧区的优势牧草之一,是一种土壤趋于干旱出现的指示性物种,在我国主要集中在西北部及西南部地区,分布于高山或亚高山带,不仅抗逆性强、耐寒、喜湿,还能为家畜提供优质的营养物质,具有阻碍高寒生态群落旱生化和盐生化发展的作用(牟晓明等,2015)。目前报道的内生细菌主要来源于经济作物,对长期生活在高海拔、寒冷气候条件下不受人为活动干扰的植物内生细菌的研究相对较少,而针对矮火绒草内生细菌的研究尚无文献报道。【拟解决的关键问题】以矮火绒草的根、茎、叶和种子为试材,采用组织分离法分离其内生细菌,结合分子标记对分离的内生细菌进行鉴定并进行生物学功能测定,以期筛选出具有应用潜力的益生微生物,为开发相应功能的生物菌剂提供参考,并为青藏高原生态农牧业生产提供有价值的内生细菌资源。
1 材料与方法
1. 1 试验材料
1. 1. 1 植物材料 2016年6—9月从青海省祁连山东段的门源县珠固乡高寒草地采集矮火绒草的根、茎、叶和种子,混合均匀后装入无菌封口塑料袋,置于4 ℃冰箱中保存备用。
1. 1. 2 培养基 肉汁培养基(NA):牛肉膏3.00 g,蛋白胨5.00 g,NaCl 5.00 g,琼脂18.00 g,蒸馏水1000 mL,pH 6.8~7.0;马铃薯葡萄糖琼脂培养基(PDA):马铃薯200.00 g,葡萄糖20.00 g,琼脂18.00 g,蒸馏水1000 mL,自然pH;King氏液体培养基:蛋白胨20.00 g,K2HPO4 1.15 g,MgSO4·7H2O 1.50 g,丙三醇15 mL,L-色氨酸0.10 g(或不加色氨酸);Pikovaskaia培养基(PKO):葡萄糖10.00 g,磷酸钙5.00 g,(NH4)2SO4 0.50 g,NaCl 0.20 g,KCl 0.20 g,MgSO4 0.03 g,MnSO4 0.03 g,FeSO4·7H2O 0.03 g,蒸馏水1000 mL,pH 6.8~7.0;蒙金娜有机磷培养基:MnSO4·4H2O 0.03 g,FeSO4·7H2O 0.03 g,CaCO3 5.00 g,葡萄糖10.00 g,(NH4)2SO4 0.50 g,卵磷脂0.20 g,NaCl 0.30 g,KCl 0.30 g,酵母膏0.40 g,琼脂20.00 g,蒸馏水1000 mL,pH 7.0~7.5;改良阿氏无氮培养基(Ashby):葡萄糖10.00 g,K2HPO4 0.20 g,K2SO4 0.20 g,MgSO4·7H2O 0.20 g,NaCl 0.20 g,CaCO3 5.00 g,蒸馏水1000 mL,pH 7.0~7.2。低温筛选培养基:5×1C培养基(胰蛋白胨21.00 g、NaCl 15.00 g、大豆粉9.00 g、蒸馏水600 mL)200 mL,土壤提取液(土壤500.00 g、蒸馏水1000 mL,98 ℃煮45 min,滤纸滤出土壤液,过滤灭菌后保藏)100 mL,20%葡萄糖5 mL,加灭菌水至1000 mL。
1. 1. 3 指示菌 马铃薯晚疫病菌[Phytophthora infestans(Mont.)de Bary]和樱桃褐斑病菌(Mycosphaerella cerasella Aderh.)。
1. 2 试验方法
1. 2. 1 内生细菌分离纯化 采用梯度稀释法对内生细菌进行分离纯化。清水冲洗矮火绒草材料的根、茎、叶和种子,滤纸吸干表面水分;分别称取根、茎、叶和种子部位3~5 g,于超净工作台内用75%酒精(45 s)、3%次氯酸钠(3~5 min)依次对材料表面进行消毒,然后用无菌水洗涤3~5次,将样品在灭菌研钵中加适量无菌生理盐水研磨至匀浆状,取1.0 mL浸出液按10倍浓度梯度稀释后,吸取0.1 mL涂布于NA培养基上,最后一次洗涤水为空白对照。25 ℃恒温培养3~5 d,根据菌落形态、颜色、大小、边缘整齐度及表面形态等分类,纯化编号后4 ℃保存备用。
1. 2. 2 内生细菌属种分子鉴定 菌株基因组DNA提取按照试剂盒[生工生物工程(上海)股份有限公司]使用说明进行操作。以提取的内生细菌基因组DNA为模板,应用细菌16S rRNA序列通用引物27f(5'-AGAGTTTGATCCTGGCTCAG-3')和1492r(5'-GGTTACCTTGTTACGACTT-3')進行扩增。PCR反应体系25.0 µL:2×Taq PCR Master Mix 12.5 µL,DNA模板(50 ng/L)1.0 µL,上、下游引物各1.0 µL,双蒸水10.5 µL。扩增程序:95 ℃预变性5 min;95 ℃ 30 s,52 ℃ 30 s,72 ℃ 1.5 min,进行40个循环;72 ℃延伸10 min。PCR产物送至生工生物工程(上海)股份有限公司测序,测序结果用Chromas进行序列修正后,在NCBI数据库中进行BLAST检索,选取若干较高相似性的序列,用ClustalX 1.8进行多重序列比对,最后用MEGA 6.0的Neighbor-Joining构建系统发育进化树,各分支的置信度自举检测(Bootstrap)1000次。
1. 2. 3 内生细菌生物学功能测定 分泌吲哚乙酸(IAA)能力测定参考东秀珠和蔡妙英(2001)的方法,定性测定采用Salkowski比色法,定量测定采用纯3-IAA标准曲线计算内生细菌菌株的IAA分泌量。溶磷能力测定参考陆瑞霞等(2012)的方法,定性测定采用溶磷圈法,根据溶磷圈直径/菌落直径(D/d值)确定溶磷能力;采用钼锑抗比色法定量测定有效磷增量。固氮能力测定参考Piromyou等(2011)的方法,采用乙炔还原法测定固氮酶活性大小。抑菌能力测定参考崔月贞等(2016)的方法,采用平板对峙法测定抑菌效果,计算抑菌率。
除草活性测定参考王伟等(2019)采用培养皿分析法。供试杂草分别为野燕麦和野油菜种子。选择饱满完整的杂草种子,用10 g/L次氯酸钠溶液进行表面消毒,无菌水冲洗3次,在12孔板的孔上铺圆滤纸片,加入待测发酵滤液1.0 mL,每孔置10粒种子进行除草活性测定。每处理重复3次,另设清水作空白对照,28 ℃智能光照培养箱培养,处理3~5 d后测定胚芽(根)长,计算胚芽(根)抑制率。
低温适生特性检测参考谢永丽等(2014)的方法。将待测菌株接种到5×1C培养液中,过夜培养后取10.0 µL点到5×1C培养基上,置于0、4、10、14、18、30和45 ℃下,每天观察生长情况,7 d后记录生长结果。
促生特性测定采用玉米种子。将内生菌株接种到NA液体培养基中培养12 h,通过测定OD600及涂平板计数法测定菌体浓度,取107 CFU/mL菌悬液和0.9%灭菌生理盐水配制成混合液(1∶3)。植物种子表面消毒后用悬浮混合液浸种2 h后取出种子,将种子铺在有湿润滤纸的培养皿中,30 ℃暗培养,3 d后观察萌发种子数,7 d后测量种子根长、芽长和鲜重。每处理重复3次。以清水和0.9%灭菌生理盐水处理为对照。
2 结果与分析
2. 1 内生细菌在矮火绒草植株不同部位的种群分布
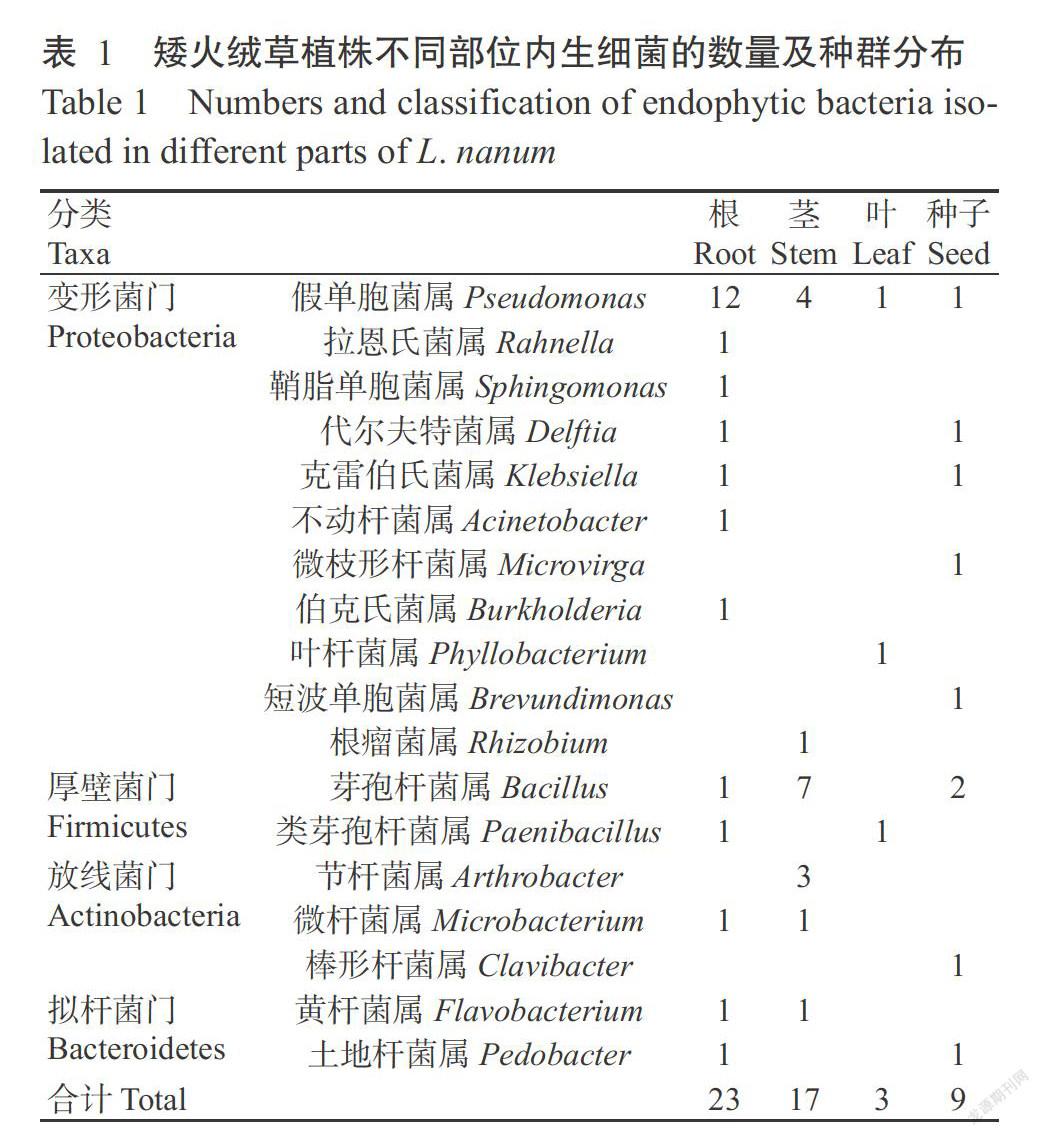
由表1可知,从矮火绒草植株的根、茎、叶和种子部位共分离到52株内生细菌,覆盖4个菌门,分别为变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinomycetes)和拟杆菌门(Bacteroides)。在门水平上,各植株部位中变形菌门和厚壁菌门细菌所占比例较高,分别为57.69%和23.08%,拟杆菌门最少,占7.69%。其中,在根部以变形菌门细菌所占比例最高,占根部细菌总数的78.26%;茎中以厚壁菌门细菌所占比例最高,占茎部细菌总数的41.18%;叶中所含4个菌门的比例均较低。
从属的水平上看,共分离出18个属的细菌,各植株部位细菌属的数量在3~12个。其中,根部最多,达12个属;种子次之,为8个属;叶中最少,仅有3个属。假单胞菌属(Pseudomonas)细菌在各植株部位所占比例均较高,是根部所占比例最高的属,为52.17%。茎中所占比例最高的为芽孢杆菌属(Bacillus)细菌,其次为假单胞菌属细菌,两属的细菌所占比例分别为41.18%和23.53%。各植株部位的共有属较少,仅假单胞菌属为各植株部位的共有属。总体上来看,矮火绒草植株的内生细菌数量分布表现为组织差异性,即根>茎>种子>叶。
2. 2 矮火绒草内生细菌的类群与系统发育分析结果
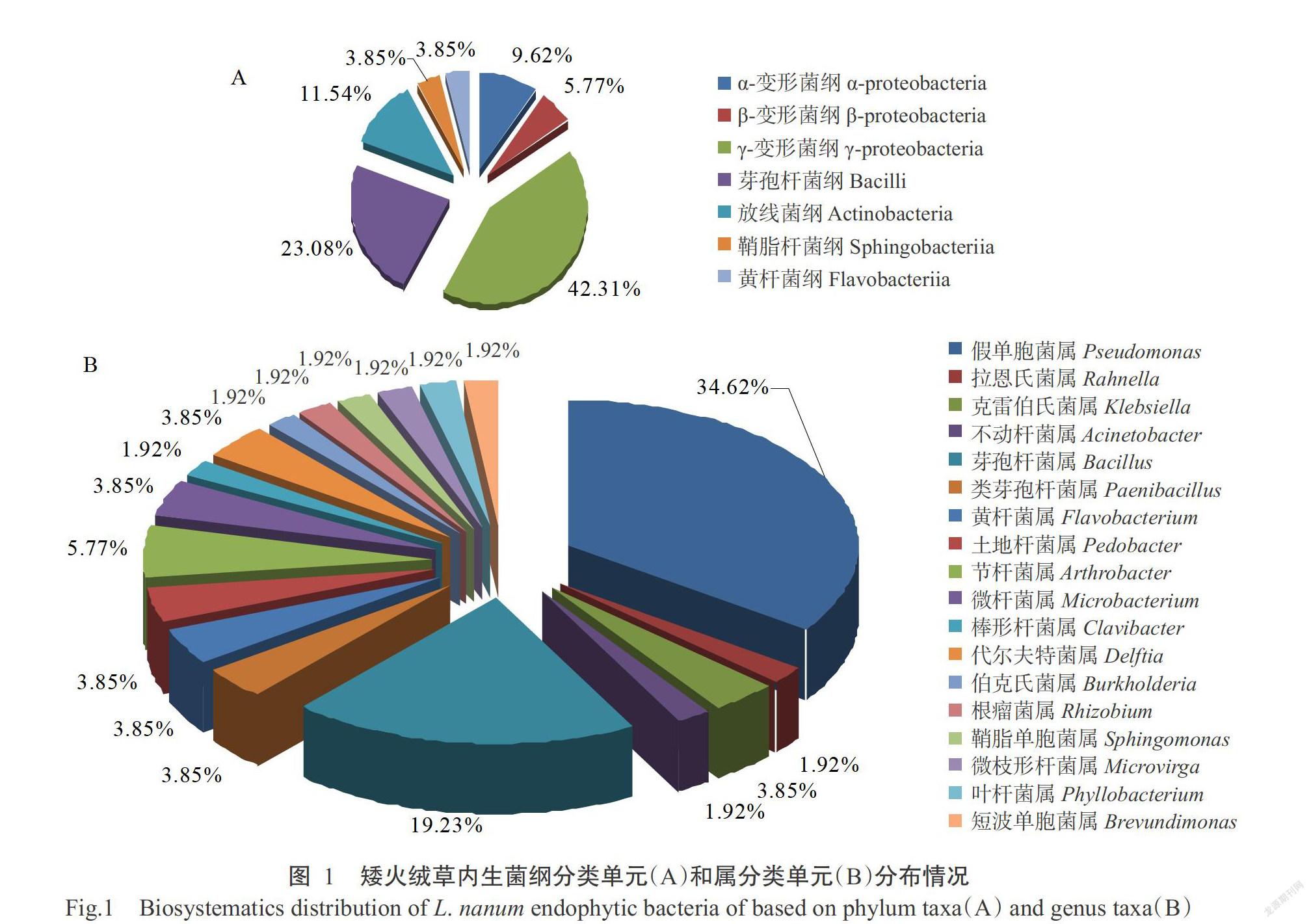
通过与NCBI数据库比对,分析52株内生细菌的16S rDNA序列同源性,结果(表2和图1-A)表明,矮火绒草植株中的内生细菌共覆盖7纲10目14科18属,其中22株细菌属于γ-变形菌纲(γ-proteobacteria),为第一优势类群细菌,占分离菌株的42.31%;12株属于芽孢杆菌纲(Bacilli),为第二优势类群细菌,占分离菌株的23.08%;此外,分离到6株放线菌纲(Actinobacteria)、5株α-变形菌纲(α-proteobacteria)、3株β-变形菌纲(β-proteobacteria)、2株鞘脂杆菌纲(Sphingobacteriia)和2株黄杆菌纲(Flavobacteriia)类群细菌,分别占分离菌株的11.54%、9.62%、5.77%、3.85%和3.85%。在目的水平上,假单胞菌目(Pseudomona-dales)为优势菌群,占总菌株数的36.54%,其次为芽孢杆菌目(Bacillales)和微球菌目(Micrococales),分别占总菌株数的23.08%和11.54%;在科的水平上,假单胞菌科(Pseudomonadaceae)为优势菌群,占总菌株数的34.62%,其次为芽孢杆菌科(Bacillaceae),占总菌株数的19.23%。
对γ-变形菌纲细菌进一步分析表明,该纲共分为4个属,分别是假单胞菌属、拉恩氏菌属(Rahnella)、克雷伯氏菌属(Klebsiella)和不动杆菌属(Acinetobacter),以假单胞菌属为主,约占分离菌株的34.62%,为优势种群,其余3个属的类群相对较少,合计占分离菌株的7.69%;芽孢杆菌纲细菌分为2个属,分别是芽孢杆菌属和类芽孢杆菌属(Paenibacillus),其中10株来自芽孢杆菌属,占分离菌株的19.23%;放线菌纲细菌分为3个属,分别为节杆菌属(Arthrobacter)、微杆菌属(Microbacteriaceae)和棒形杆菌属(Clavibacter);α-变形菌纲细菌分为5个属,分别为根瘤菌属(Rhizobium)、鞘脂单胞菌属(Sphingomonas)、微枝形杆菌属(Microvirga)、叶杆菌属(Phyllobacterium)和短波单胞菌属(Brevundimonas);β-变形菌纲细菌分为2个属,分别为代尔夫特菌属(Delftia)和伯克氏菌属(Burkholderia);鞘脂杆菌纲和黄杆菌纲细菌各有1个属,分别为土地杆菌属(Pedobacter)和黄杆菌属(Flavobacterium)(表2和图1-B)。
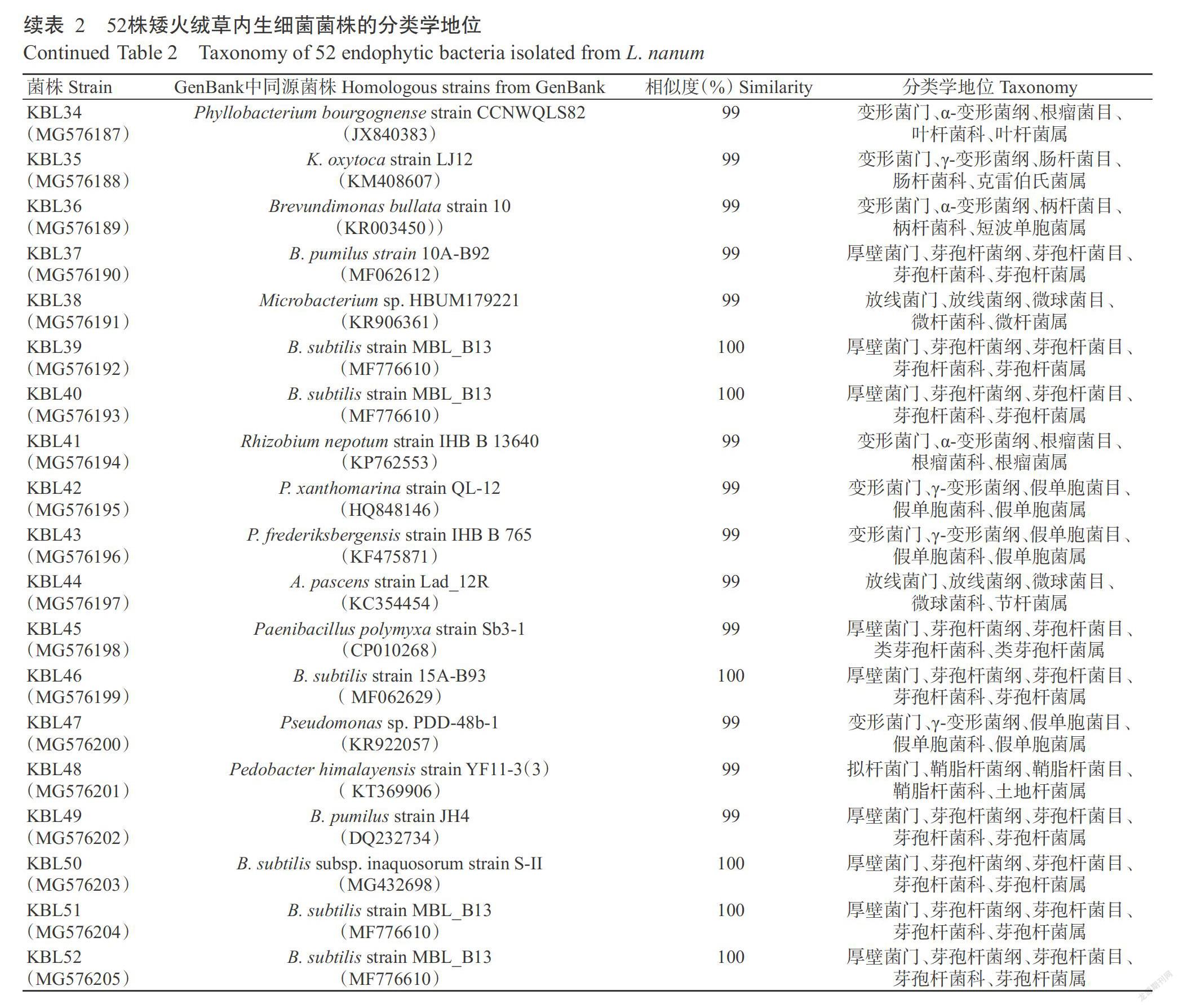
利用MEGA 6.0采用Neighbor-Joining法构建系统发育进化树,结果(图2)表明,矮火绒草内生细菌主要有4个进化分支,属于18个不同的属,其中假单胞菌属和芽孢杆菌属占分离菌株的53.85%。在γ-变形菌纲中,18株细菌(KBL1、KBL29、KBL5、KBL17、KBL15、KBL47、KBL2、KBL19、KBL43、KBL8、KBL22、KBL24、KBL25、KBL16、KBL28、KBL33、KBL30和KBL42)聚类于Pseudomonas属分支单元,属于同一属,但局部又分为7个种分类单元。其中菌株KBL1、KBL29和KBL5同源性较高,可能属于同一种。菌株KBL25、KBL16、KBL28和KBL33与Pseudomonas fluorescens相似性较高,均为99%,可能为同一种。菌株KBL23和KBL4分别归属于Acinetobacter和Rahnella;菌株KBL35和KBL18归属于Klebsiella。
分离得到的10株(KBL49、KBL37、KBL51、KBL52、KBL27、KBL3、KBL46、KBL40、KBL50和KBL39)芽孢杆菌纲聚类单元中,菌株KBL49和KBL37归属于Bacillus pumilus;菌株KBL51、KBL52、KBL3、KBL46、KBL40、KBL39、KBL50和KBL27与Bacillus subtilis的相似性为100%,归为同一种。菌株KBL10和KBL45与Paenibacillus prosopidis为同一属。
在放线菌纲中,菌株KBL12、KBL9和KBL44归属于Arthrobacter;菌株KBL11和KBL38归属于Microbacterium;菌株KBL31则聚类于Clavibacter。在β-变形菌纲中,菌株KBL32应为Burkholderia;菌株KBL7和KBL21归属于Delftia。在α-变形菌纲中,菌株KBL13、KBL36、KBL26、KBL34和KBL41分别归属于Sphingomonas、Brevundimonas、Microvirga、Phyllobacterium和Rhizobium。此外,在拟杆菌门中,菌株KBL6和KBL20归属于Flavobacterium;而KBL48和KBL14属于Pedobacter。
2. 3 矮火绒草植株内生细菌功能鉴定结果
分离获得的52株内生细菌中,共鉴定出除草活性菌株20株、分泌IAA的菌株9株、固氮菌7株、溶磷菌7株、耐低温菌13株、拮抗菌11株和促生菌8株。52株内生细菌中,除草活性菌株数量占总菌株数量的比例最高(38.46%),在各植株部位的功能菌中数量也最多。根中产拮抗和除草菌株数量较多,均占总分离菌株数的15.38%,其次是产IAA菌。在叶片中未分离到拮抗菌、产IAA菌、固氮菌和促生菌,仅分离到1株溶磷菌、1株除草活性菌和3株耐低温菌。根、茎和种子中均可分离到可培养的功能菌株(图3)。
2. 4 矮火绒草内生细菌中多功能菌属的多样性分析结果
由表4可知,内生细菌中的功能菌分布在17个不同的菌属,从本研究测定的7种功能属性菌的角度来看,20株除草菌株分别在11个菌属内有分布,13株耐低温菌分布在10个菌属内,11株拮抗菌分布在6个菌属内,8株促生菌分布在6个菌属内,7株溶磷菌分布在5个菌属内,9株产IAA菌分布在4个菌属内。假单胞菌属包括了除草活性菌、耐低温菌、拮抗菌、产IAA菌、促生菌、溶磷菌和固氮菌,是唯一覆盖各功能菌的菌属;其次为芽孢杆菌属,包括了除溶磷菌和促生菌之外的其他5种功能菌;节杆菌属包括了除拮抗菌和产IAA菌外的5种功能菌;克雷伯氏菌属包括了拮抗菌、产IAA菌、除草菌和耐低温菌;微杆菌属则包括溶磷菌、除草菌、拮抗菌和耐低温菌;黄杆菌属和类芽孢杆菌属均包括除草菌、耐低温菌和促生菌3种功能菌。
2. 5 矮火绒草内生细菌中有潜在应用价值的功能菌分析结果
对矮火绒草内生细菌的生物学功能测定结果显示,菌株拮抗能力的抑菌率为60.14%~95.47%,抑菌率最强的为菌株KBL17,分离自矮火绒草的根组织,属于假单胞菌属;菌株分泌IAA的能力为5.32~35.98 µg/mL,分泌IAA能力最强的为菌株KBL30,分离自矮火绒草的茎部组织,属于假单胞菌属;溶磷菌的溶磷能力为73.99~156.81 µg/mL,7株溶磷菌中有3株菌的溶磷能力大于100.00 µg/mL,其中溶磷能力最強的为菌株KBL12(节杆菌属),分离自根部组织,其次为菌株KBL19(假单胞菌属),也分离自根部组织;分离出的7株固氮菌中,固氮酶的活性介于98.57~369.29 nmol C2H4/(mL·h),菌株KBL16的固氮酶活性最大,分离自根部组织,属于假单胞菌属;来自种子组织的除草菌株数量相对较多,且有1株菌株(KBL3,芽孢杆菌属)对野燕麦和野油菜的除草活性大于>95.00%,有2株菌株(KBL15,假单胞菌属;KBL18,克雷伯氏菌属)的除草活性介于90.00%~95.00%;分离自叶部的菌株KBL10在4 ℃下培养12 h可显现出明显的菌苔,属于类芽孢杆菌属;在4个植株部位中只分离到8株促生菌,效果较好的为分离自种子组织的菌株KBL20(黄杆菌属)和KBL33(假单胞菌属)(表5)。在同时具备拮抗病原真菌和分泌IAA功能的菌株中,菌株KBL37的抑菌率达90.16%,分泌IAA的能力为27.98 µg/mL,该菌经16S rDNA序列比对,发现其与GenBank中1株具有抗真菌能力的菌株(芽孢杆菌属)相似性达99%。
3 讨论
3. 1 矮火绒草内生细菌的群落结构多样性
本研究分离到的52株内生细菌涵盖了4个菌门,分别为变形菌门、厚壁菌门、放线菌门和拟杆菌门,与Bulgarelli等(2013)、胥婷等(2015)报道的植物体内生细菌的种群结构一致。在分离得到的52株内生细菌中,变形菌门细菌占总分离菌株数的一半以上(57.69%)。有研究发现,水稻(Sun et al.,2008)、拟南芥(Bodenhausen et al.,2013)、互米花(李虎等,2014)、东南景天(邓平香等,2017)、巨菌草(林标声等,2018)等优势内生细菌门也均为变形菌门,说明变形菌门细菌广泛存在于植物体内。厚壁菌门细菌在促进植物生长发育、营养吸收、抗逆能力和生理生态过程等方面也扮演着重要角色(Vendan et al.,2010;Kumar et al.,2012)。本研究结果显示,矮火绒草植株内生细菌群体中也含有较丰富的厚壁菌门细菌,其中包括芽孢杆菌属和类芽孢杆菌属,可能与该属细菌内芽孢具有较强的抗逆能力有关,提示矮火绒草植株内生细菌中该属细菌值得进一步研究。
植物内生细菌具有丰富的多样性,并普遍存在于各种植物体内。其中,假单胞菌属、芽孢杆菌属、土地杆菌属和肠杆菌属为植物内生细菌的常见属和优势种群(Sturz et al.,2000)。本研究利用16S rDNA序列分析方法从矮火绒草根、茎、叶和种子4个不同组织共分离获得52株内生细菌,覆盖4门7纲10目14科18属,说明该植物内生细菌群体具有丰富的种群多样性和遗传多样性。其中假单胞菌属18株,占分离总菌株数的比例最高。此外,假单胞菌属内生细菌在植物根、茎、叶和种子中均有分布,且比例均很高,在根和茎中达50.00%以上。因此,假单胞菌是分布较广的植物内生细菌之一。与本研究结论相似,牧草(杨成德等,2016)、盐角草(赵帅等,2016)、线叶嵩草(魏立娟等,2018)和三叶鬼针草(胡泽瑞等,2019)等植物内生细菌群体优势细菌属也均为假单胞菌属,说明假单胞菌属细菌广泛存在于植物体内,可能与该属细菌多种功能活性有关。本研究仅利用16S rDNA序列分析对矮火绒草内生细菌进行分类,今后还需利用生理生化试验、(G+C)%及持家基因(gyrB)等进一步鉴定到种。
3. 2 矮火绒草内生细菌生物学功能多样性
近年来,随着微生物分离和鉴定技术的发展,被分离和鉴定出的植物功能内生细菌种类和数量逐年增加,发现假单胞菌属、芽孢杆菌属、肠杆菌属、固氮螺菌属、节杆菌属、沙雷氏菌属、克雷伯氏菌属、伯克霍尔德氏菌属和不动杆菌属等主要种属均具有不同的生物学功能。本研究对分离获得的52株内生细菌进行7项功能测定,结果表明,菌株分泌IAA的能力为5.32~35.98 µg/mL,其中产量最高的菌株KBL30(Pseudomonas sp. TMB3-1-1)与1株从土壤中分离的变形菌门、γ-变形菌纲、假单胞菌目、假单胞菌科的假单胞菌属细菌相似度达99%,其次为菌株KBL37,属于芽孢杆菌属。有研究证实,植物内生细菌如克雷伯氏菌属的某些细菌具有较强的IAA分泌能力,具有促进植物生长的能力(吕泽勋和宋未,1999;Ji et al.,2014),但本研究分离自矮火绒草种子的菌株KBL18(克雷伯氏菌属)的除草抑制率为94.78%,说明该属细菌也具有除草功能,为开发药肥兼用的微生物产品提供了菌株资源。此外,植物内生细菌如沙雷氏菌属、假单胞菌属和肠杆菌属等种属的某些细菌具有溶磷和促生能力(Hameeda et al.,2008)。陆瑞霞等(2012)从地八角根际分离具有溶磷能力的菌株,通过溶磷圈法筛选出7株溶磷能力较强的菌株。本研究在分离获得的52株内生细菌中有7株可在有(无)机磷选择性培养基上形成透明的溶磷圈,其中2株内生细菌(KBL12和KBL19)的溶磷活性最强,分别为156.81和135.87 µg/mL。
除了营养促生功能,植物内生细菌也是植物病害和杂草生物防治的资源菌来源,从植物体内分离筛选具有防病和除草作用的内生细菌将具有很好的应用前景。已有研究证明,内生细菌通过次生代谢产生一些抗真菌或除草物质来达到防治植物病害和杂草的目的(Ryan et al.,2008;陈世国和强胜,2015)。李明智等(2004)从反枝苋根际土壤中分离获得1株对反枝苋和荠菜等双子叶杂草具有较强除草活性的野油菜黄单胞菌反枝苋致病变种;李振东等(2011)从高山草甸紫花针茅中分离到2株对辣椒立枯丝核菌具有拮抗作用的内生细菌;柯杨等(2013)从冬凌草中分离筛选出对镰刀菌属及大茎点霉属病原真菌具有明显拮抗作用的内生细菌;魏立娟等(2018)从线叶嵩草植株中分离筛选出10株对马铃薯炭疽病有较强抗性的内生细菌。本研究从52株内生细菌中分离出11株同时对马铃薯晚疫病和樱桃褐斑病具有拮抗能力的菌株,20株对野燕麦和野油菜种子具有不同程度除草活性的菌株。
植物内生细菌因受植物保护而具有相对稳定的生态环境,在可持续农牧业生产和土壤修复方面是一类具有潜在应用价值且更直接、安全有效的微生物资源。本研究证实所分离得到的内生细菌的部分生物學功能,说明祁连高寒草甸矮火绒草能适应极端环境而生存下来是植物与内生细菌协调进化的结果,对于这部分功能菌株是否与宿主矮火绒草的抗逆生存相关还有待进一步验证。然而,传统的培养方法还不能完全揭示植物内生细菌的种类和分布情况,使得研究植物内生细菌的种群结构数量及多样性受到限制,因此,利用非培养的方法如高通量测序技术进一步探究矮火绒草植株内生细菌的群落结构、多样性及功能细菌预测具有必要性。
4 结论
从矮火绒草植株根、茎、叶和种子部位共分离纯化出52株内生细菌,归属于4门7纲10目14科18属,内生细菌数量分布表现为根>茎>种子>叶。其中,11株有拮抗病原真菌的能力、9株具有产IAA的能力、7株有溶磷活性、7株具有固氮活性、20株具有除草活性、13株具有耐低温能力和8株具有促生作用。各类型的功能菌在根、茎和种子部位均有分布,在叶中未分离到拮抗菌、产IAA菌、固氮菌和促生菌。各功能菌株分布在17个属,多样性较高,其中假单胞菌属和芽孢杆菌属具有多种功能菌株,是矮火绒草植株的重要内生细菌。
參考文献:
陈超琼. 2017. 骆驼刺内生细菌新种Pantoea alhagi LTYR-11Z的鉴定及其促作物抗旱机制初步研究[D]. 杨凌: 西北农林科技大学. [Chen C Q. 2017. The identification of a novel endophytic bacterium Pantoea alhagi LTYR-11Z from Alahagi sparsifolia Shap. and dissecting mechanism underlying enhanced drought resistance in crops[D]. Yangling: Northwest A & F University.]
陈世国,强胜. 2015. 生物除草剂研究与开发的现状及未来的发展趋势[J]. 中国生物防治学报,31(5):770-779. [Chen S G,Qiang S. 2015. The status and future directions of bioherbicide study and development[J]. Chinese Journal of Biological Control,31(5):770-779.]
陈小洁,王其,张欣悦,丁婷. 2019. 杜仲内生细菌拮抗小麦赤霉病菌研究[J]. 浙江农业学报,31(5):766-776. [Chen X J,Wang Q,Zhang X Y,Ding T. 2019. Study on endophytic bacteria isolated from Eucommia ulmoides with antimicrobial activity against Fusarium graminearum[J].Acta Agriculturae Zhejiangensis,31(5):766-776.]
崔月贞,杨小利,杨成德,薛莉,张俊莲,姚玉玲. 2016. 拮抗马铃薯晚疫病菌的高寒草地牧草内生细菌的鉴定及其生物学功能测定[J]. 植物保护学报,43(5):789-795. [Cui Y Z,Yang X L,Yang C D,Xue L,Zhang J L,Yao Y L. 2016. Identification and determination of biological functions of endophytic bacteria from alpine pasture against Phytophthora infestan[J]. Acta Phytophylacica Sinica,43(5):789-795.]
邓平香,郭荣荣,余光伟,种云霄,龙新宪. 2017. 超积累和非超积累生态型东南景天茎、叶内生细菌多样性分析[J].微生物学通报,44(3): 533-544. [Deng P X,Guo R R,Yu G W,Zhong Y X,Long X X. 2017. Characterization of endophytic bacterial communities from leaves and stems of two ecotype of Sedum alfredii by high-throughput sequencing[J]. Microbiology China,44(3):533-544.]
东秀珠,蔡妙英. 2001. 常见细菌系统鉴定手册[M]. 北京:中国科学出版社:364-398. [Dong X Z,Cai M Y. 2001. Manual for systematic identification of common bacteria[M]. Beijing: China Science Publishing House:364-398.]
胡泽瑞,刘媛,彭长连,李淑彬. 2019. 三叶鬼针草内生细菌群体多样性及重金属耐受和吲哚乙酸产生潜力[J]. 微生物学通报,46(1): 29-41. [Hu Z R,Liu Y,Peng C L,Li S B. 2019. Diversity,heavy-metal tolerance and indolea-cetic acid production of bacterial endophytes in Bidens pilosa[J]. Microbiology China,46(1): 29-41.]
柯杨,马瑜,沈莹华,李勃. 2013. 冬凌草内生细菌的分离鉴定及其对植物病害的生防作用[J]. 微生物学杂志,33(1):20-24. [Ke Y,Ma Y,Shen Y H,Li B. 2013. Isolation & identification of entophytic bacterial strain from Rabdosia rubescens & its biocontrol effects against plant pathogens[J]. Journal of Microbiology,33(1):20-24.]
李虎,廖丹,苏建强,黄福义,洪有为. 2014. 外来种互花米草根内细菌多样性及功能[J]. 应用与环境生物学报,20(5): 856-862. [Li H,Liao D,Su J Q,Huang F Y,Hong Y W. 2014. Diversity and function of endophytic bacteria in roots of exotic plant Spartina alterniflora[J]. Chinese Journal of Applied and Environmental Biology,20(5): 856-862.]
李明智,李永泉,徐凌,庄晓峰,孙自玲. 2004. 细菌除草剂黄单胞菌反枝苋致病菌的筛选[J]. 微生物学报,44(2):226-229. [Li M Z,Li Y Q,Xu L,Zhuang X F,Sun Z L. 2004. Screening of bacterial herbicide strain Xanthomo-nas campestris pv.etroflexus from Rhizosphere[J]. Acta Microbiologica Sinica,44(2):226-229.]
李晓璐,刘妍,淮亚红. 2015. 水黄皮内生菌的分离及其杀虫菌株的筛选[J]. 沈阳农业大学学报,46(5):608-612. [Li X L,Liu Y,Huai Y H. 2015. Isolation,identification and insecticidal activity of endophytes from Pongamia pinnata[J]. Journal of Shenyang Agricultural University,46(5):608-612.]
李振东,陈秀蓉,李鹏. 2011. 紫花针茅内生细菌的分离与鉴定[J]. 草原与草坪,31(1):8-12. [Li Z D,Chen X R,Li P. 2011. Screening and identification of endophytic bacteria from Stipa purpurea[J]. Grassland and Turf,31(1): 8-12.]
林标声,宋昭昭,张丽丽,范锦琳,林占熺. 2018. 巨菌草不同生长时期根、茎、叶内生细菌组成的多样性及差异[J]. 福建农林大学学报(自然科学版),47(3):352-360. [Lin B S,Song Z Z,Zhang L L,Fan J L,Lin Z X. 2018. Composition diversity and differences of endophytic bacteria in root,stem and leaf at different growth stages of Pennisetum sp.[J]. Journal of Fujian Agriculture and Forestry University(Natural Science Edition),47(3):352-360.]
刘蓬蓬,陈江宁,孟莉,贾天柱. 2018. 基于Illumina MiSeq高通量测序分析黄芪内生细菌多样性[J]. 中草药,49(11):2640-2645. [Liu P P,Chen J N,Meng L,Jia T Z. 2018. Diversity of endophytic bacteria in Astragali radix analyzed by Illumina MiSeq high-throughput sequencing technology[J]. Chinese Traditional and Herbal Drugs,49(11):2640-2645.]
刘鲁峰,寸海春,何鹏飞,狄义宁,吴毅歆,何丽莲,李富生,何月秋. 2019. 甘蔗内生菌分离鉴定及功能多样性研究[J].热带作物学报,40(6):1144-1152. [Liu L F,Cun H C,He P F,Di Y N,Wu Y X,He L L,Li F S,He Y Q. 2019. Isolation,identification and multiple function analyses of sugarcane endophytes[J]. Chinese Journal of Tropical Crops,40(6):1144-1152.]
柳志強,李乔曼,徐爽,吴曼莉,张楠,李晓宇. 2017. 催吐萝芙木内生菌Bacillus subtilis LYM3的抑菌活性产物[J]. 江苏农业学报,33(1):67-72. [Liu Z Q,Li Q M,Xu S,Wu M L,Zhang N,Li X Y. 2017. Antifungal activity pro-ducts of an endophyteBacillus subtilis LYM3 from Rauvolfia vomitoria Afzel[J]. Jiangsu Journal of Agricultural Sciences,33(1):67-72.]
陆蓝翔,江明明,王焱,张岳峰,张洪良,叶建仁. 2018. 两株樟树促生抗病内生细菌的分离、筛选及鉴定[J]. 南京林业大学学报(自然科学版),42(6):128-136. [Lu L X,Jiang M M,Wang Y,Zhang Y F,Zhang H L,Ye J R. 2018. Isolation,screening and identification of endophytic bacteria from Cinnamomum camphora that promote growth and antagonistic pathogen[J]. Journal of Nanjing Forestry University(Natural Sciences Edition),42(6):128-136.]
陆瑞霞,王小利,李显刚,姚拓,赵相勇. 2012. 地八角根际溶磷菌溶磷能力及菌株特性研究[J]. 中国草地学报,34(4): 101-108. [Lu R X,Wang X L,Li X G,Yao T,Zhao X Y. 2012. Capability of dissolving phosphate and chara-cteristics of phosphate-dissolving bacteria in rhizosphere of Astragalus bhotanensis in Guizhou[J]. Chinese Journal of Grassland,34(4): 101-108.]
吕泽勋,宋未. 1999. 产酸克雷伯氏菌SG-11生物合成吲哚-3-乙酸的检测[J]. 分析测试学报,18(5): 42-44. [Lü Z X,Song W. 1999. Determination of indole-3-acetic acid biosynthesized by Klebsiella Oxytoca SG-11[J]. Journal of Instrumental Analysis,18(5): 42-44.]
牟晓明,于应文,王先之,张红梅,徐长林,花立民. 2015. 青藏高原火绒草斑块群落空间格局分析[J]. 生态学报,35(16):5306-5315. [Mou X M,Yu Y W,Wang X Z,Zhang H M,Xu C L,Hua L M. 2015. Analysis of community spatial patterns of Leontopodium nanum patches in Qinghai-Tibetan Plateau[J]. Acta Ecologica Sinica,35(16):5306-5315.]
王梅菊,刘晨,吴明德,张静,杨龙,李国庆. 2018. 油菜内生细菌多样性分析及菌株CanL-30生防潜力评估[J]. 中国油料作物学报,40(2): 258-268. [Wang M J,Liu C,Wu M D,Zhang J,Yang L,Li G Q. 2018. Diversity of endophytic bacteria in Brassica napus and biocontrol potential of Bacillus subtilis CanL-30[J]. Chinese Journal of Oil Crop Sciences,40(2): 258-268.]
王偉,程亮,朱海霞,郭青云. 2019. 球孢白僵菌(Beauveria bassiana)NO6的分离、鉴定与除草活性[J]. 西北农业学报,28(2):297-304. [Wang W,Cheng L,Zhu H X,Guo Q Y. 2019. Isolation,identification,and herbicidal activity of Beauveria bassiana NO6[J]. Acta Agriculture Bo-reali-Occidentalis Sinica,28(2):297-304.]
魏立娟,王玉琴,杨成德,薛丽. 2018. 青海省海晏县线叶嵩草内生细菌的生物功能鉴定及测定[J]. 草地学报,26(3):764-769. [Wei L J,Wang Y Q,Yang C D,Xue L. 2018. Biological function identification and determination of endophytic bacteria in leaves of Kobresia capillifolia in Haiyan County,Qinghai Province[J]. Acta Agrestia Sinica,26(3):764-769.]
谢永丽,马莉贞,徐志伟,张英,李希来. 2014. 冻土荒漠区低温适生PGPR菌的分离鉴定及其抗菌促生特性[J]. 中国生物防治学报,30(1):96-100. [Xie Y L,Ma L Z,Xu Z W,Zhang Y,Li X L. 2014. Identification of low-temperature adapting PGPR strains isolated from frozen desert area and their antimicrobial and growth-promoting activity[J]. Chinese Journal of Biological Control,30(1):96-100.]
胥婷,杨丽强,宋宇,李新宇,张惠文. 2015. 不同草原类型针茅根部可培养内生细菌群落结构及其功能[J]. 生态学杂志,34(11):3101-3110. [Xu T,Yang L Q,Song Y,Li X Y,Zhang H W. 2015. Endophytic bacterial community structure and function of Stipa roots from different types of steppes in northern China[J]. Chinese Journal of Eco-logy,34(11):3101-3110.]
杨成德,王玉琴,陈秀蓉,张振粉,薛莉,王颖,姚玉玲. 2016. 2种嵩草属牧草休眠期内生细菌多样性研究[J]. 草业学报,25(8):136-144. [Yang C D,Wang Y Q,Chen X R,Zhang Z F,Xue L,Wang Y,Yao Y L. 2016. Diversity of endophytic bacteria isolated from Kobresia during winter dormancy[J]. Acta Prataculturae Sinica,25(8):136-144.]
赵帅,周娜,赵振勇,张科,田长彦. 2016. 基于高通量测序分析盐角草根部内生细菌多样性及动态规律[J]. 微生物学报,56(6): 1000-1008. [Zhao S,Zhou N,Zhao Z Y,Zhang K,Tian C Y. 2016. Endophytic bacterial diversity and dynamics in root of Salicornia europaea estimated via high throughput sequencingActa Microbiologica Sinica,56(6):1000-1008.]
赵玉华,李俊州,冯慧静,文才艺. 2018. 内生细菌EBS05对番茄植物的促生和诱导抗病性信号转导途径的研究[J]. 河南农业大学学报,52(1):59-65. [Zhao Y H,Li J Z,Feng H J,Wen C Y. 2018. Study on growth promotion and signaling pathway of induced systemic resistance elicitation mediated by endophytic bacteria strain EBS05 in tomato plant[J]. Journal of Henan Agricultural University,52(1):59-65.]
Bodenhausen N,Horton M W,Bergelson J. 2013. Bacterial communities associated with the leaves and the roots of Arabidopsis thaliana[J]. PLoS One,8(2): e56329.
Bulgarelli D,Schlaeppi K,Spaepen S,van Themaat E V L,Schulze-Lefert P. 2013. Structure and functions of the bacterial microbiota of plants[J]. Annual Review of Plant Biology,64(1): 807-838.
Caulier S,Gillis A,Colau G,Licciardi F,Liépin M,Desoignies N,Modrie P,Legrève A,Mahillon J,Bragard C. 2018. Versatile antagonistic activities of soil-borne Bacillus spp. and Pseudomonas spp. against Phytophthora infestans and other potato pathogens[J]. Frontiers in Microbiology,9:143.
Chanway C P. 1998. Bacterial endophytes:Ecological and practical implications[J]. Sydowia,50(2):149-170.
Hallmann J,Quadt A V,Mahaffee W F,Kloepper J W. 2011. Bacterial endophytes in agricultural crops[J]. Canadian Journal of Microbiology,43(10): 895-914.
Hameeda B,Harini G,Rupela O P,Wani S P,Reddy G. 2008. Growth promotion of maize by phosphate-solubilizing bacteria isolated from composts and macrofauna[J]. Microbiological Research,163(2):234-242.
Hardoim P R,van Overbeek L S,Berg G,Pirttilä A M,Compant S,Campisano A,Döring M,Sessitsch A. 2015. The hidden world within plants: Ecological and evolutionary considerations for defining functioning of microbial Endophytes[J]. Microbiology and Molecular Biology Reviews,79(3): 293-320.
Ji S H,Gururani M A,Chun S C. 2014. Isolation and characterization of plant growth promoting endophytic diazotrophic bacteria from Korean rice cultivars[J]. Microbiolo-gical Research,169(1): 83-98.
Kumar G,Kanaujia N,Bafana A. 2012. Functional and phylogenetic diversity of root-associated bacteria of Ajuga bracteosa in Kangra valley[J]. Microbiological Research,167(4):220-225.
Piromyou P,Buranabanyat B,Tantasawat P,Tittabutr P,Boonkerd N,Teaumroong N. 2011. Effect of plant growth promoting rhizobacteria(PGPR) inoculation on microbial community structure in rhizosphere of forage corn cultivated in Thailand[J]. European Journal of Soil Biology,47(1): 44-54.
Ryan R P,Germaine K,Franks A,Ryan D J,Dowling D N. 2008. Bacterial endophytes:Recent developments and applications[J]. FEMS Microbiology Letters,278(1): 1-9.
Sturz A V,Christie B R,Nowak J. 2000. Baterial endophytes:Potential role in developing sustainable systems of crop production[J]. Critical Reviews in Plant Sciences,19(1): 1-30.
Sun L,Qiu F B,Zhang X X,Dai X,Dong X Z,Song W. 2008. Endophytic bacterial diversity in rice(Oryza sativa L.) roots estimated by 16S rDNA sequence analysis[J]. Microbial Ecology,55(3): 415-424.
Vendan R T,Yu Y J,Lee S H,Rhee Y H. 2010. Diversity of endophytic bacteria in ginseng and their potential for plant growth promotion[J]. Journal of Microbiology,48(5):559-565.
Vorholt J A. 2012. Microbial life in the phyllosphere[J]. Nature Reviews Microbiology,10(12):828-840.
White J F Jr,Torres M S. 2010. Is plant endophyte-mediated defensive mutualism the result of oxidative stress protection?[J]. Physiologia Plantarum,138(4): 440-446.
(責任编辑 麻小燕)
