大花蕙兰‘红酒’× 莲瓣兰‘边草素花’杂交种组培快繁技术
2019-09-10刘洋王玉英李枝林李茹
刘洋 王玉英 李枝林 李茹
摘 要:该研究以大花蕙兰‘红酒’(Cymbidium hybridum ‘hongjiu’)×莲瓣兰‘边草素花’(C. tortisepalum ‘biancaosuhua’)F1代杂交种原球茎和根状茎为材料,比较了不同激素配比增殖分化、生根的培养基,建立了适用杂交兰组培快繁体系。结果表明:1/2MS+6-BA 1.0 mg·L-1+NAA 1.0 mg·L-1+AC 0.05%+香蕉80 g·L-1对原球茎增殖效果最佳,增殖率达到307%;1/2MS+6-BA 1.5 mg·L-1+NAA 1.0 mg·L-1 +AC 0.05%+香蕉80 g·L-1有利于原球茎分化,分化率为82%;1/2MS+TDZ 2.0 mg·L-1+NAA 0.1 mg·L-1+AC 0.05%+香蕉80 g·L-1对根状茎增殖分化效果最佳,增殖率为293%,分化率为79%;1/2MS+IBA 0.5 mg·L-1+NAA 0.3 mg·L-1+AC 0.05%+香蕉80 g·L-1为最佳生根培养基,生根率达到84.7%,且根粗苗壮,叶色浓绿。此体系为杂交兰种苗的规模化生产提供了技术支持。
关键词: 兰花杂交种, 根状茎, 原球茎, 增殖与分化
Tissue culture and rapid propagation techniques in Cymbidium hybridum ‘hongjiu’× C. tortisepalum ‘biancaosuhua’
LIU Yang, WANG Yuying, LI Zhilin*, Li Ru
( Institute of Landscape Plants, Yunnan Agricultural University, Kunming 650201, China )
Abstract:A rapid propagation technique system of hybrid orchid was established by comparing the effects of different hormone ratios on proliferation and rooting, with the protocorms and rhizomes of F1 hybrids of Cymbidium hybridum ‘hongjiu’ and C. tortisepalum‘biancaosuhua’ were used as materials. The results were as follows:1/2MS+6-BA 1.0 mg·L-1+NAA1.0 mg·L-1+AC 0.05%+banana 80 g·L-1 had the best conductive effects on proliferation of protocorm, and the proliferative rate reached to 307%;1/2MS+
6-BA 1.5 mg·L-1+NAA 1.0 mg·L-1+AC 0.05%+banana 80 g·L-1 medium was beneficial to differential protocorm culture, and the differential rate was 82%;1/2MS+TDZ 2.0 mg·L-1+NAA 0.1 mg·L-1+AC 0.05%+banana 80 g·L-1 medium was conductive to proliferation and differentiation of rhizome, and the proliferative rate reached 293%, the differential rate was 79%. Medium of 1/2MS+IBA 0.5 mg·L-1+NAA 0.3 mg·L-1+AC 0.05%+banana 80 g·L-1 was the best for rooting, the rooting rate was 84.7%, and the roots were healthy with strong seedlings, and the leaves were dark green. This system provides technical support for large-scale production of hybrid orchid seedlings.
Key words: Orchid hybrid, rhizome, protocorm, proliferation and differentiation
蘭花为中国传统名花,观赏价值极高。国兰(Chinese Cymbidium)是中国传统十大名花之一,通常是指兰科兰属(Cymbidium)植物中的部分地生兰,其花型较小,但气味芳香、叶态优美。大花蕙兰(Cymbidium hybridum)属兰科(Orchidaceae)兰属(Cymbidium)多年生草本植物,是兰属内一些附生兰杂交种的统称,其大部分品种叶片长且披散,花无香味(朱根发等,2004)。大花蕙兰‘红酒’为大花、早开花品种,常在圣诞节前后开花,可用于培育圣诞节开花的红花盆栽品种。莲瓣兰‘边草素花’是兰科兰属多年生草本植物,属地生兰,为细叶莲瓣兰类,叶槽较深,叶边金黄色,花为淡黄色全素,开花2~4朵,花幽香。
以‘红酒’ב边草素花’为亲本进行种间杂交,意在获得花期长、花朵较大、鲜艳美丽且有香味的兰花新品种。对大花蕙兰(Cymbidium hybridum)若采用传统的分株繁殖,则繁殖速度慢、周期长(卢思聪,1994),且大多是引进的国外优良品种,难以满足市场需求,因此需通过组织培养来快速繁殖大花蕙兰。国内外已开展了对兰花杂交种的研究,目前已有数千个品种,但对地生兰和附生兰杂交种的研究较少。近年来,国内的研究大多集中在杂交育种和胚培养方面(郑立明,2010;朱根发等,2005;丁长春和夏念和,2011;陈瑶瑶等,2009),杂交兰原球茎的增殖分化研究报道较多(宋莲等,2017;谢利等,2014),根状茎报道较少,但对大花蕙兰‘红酒’×莲瓣兰‘边草素花’F1代杂交种的快繁技术目前尚未见有研究报道。因此,本研究以大花蕙兰‘红酒’×莲瓣兰‘边草素花’F1代杂交种的根状茎和原球茎为材料,在不同的培养基上进行增殖分化、生根,以筛选出最适培养基,从而为杂交兰的工厂化生产和新品种选育奠定基础。
1 材料与方法
1.1 材料
大花蕙兰‘红酒’(♀)与莲瓣兰‘边草素花’()杂交种原球茎和根状茎材料,由云南农业大学花卉研究所自主培育。杂交种萌发后产生原球茎和根状茎。杂交兰产生的胚状体长条状称为根状茎,形成的胚状体圆球形称为原球茎,从中分别挑选出性状长势一致的原球茎和根状茎为试验材料。本试验在云南农业大学园林园艺学院花卉所组培实验室进行。
1.2方法
1.2.1 原球茎和根状茎的增殖分化 将原球茎大小为0.3 cm和根状茎约为1.5 cm,分别接种于1/2MS基本培养,添加不同浓度配比的NAA、TDZ和6-BA,附加香蕉80 g·L-1和活性炭0.5 g·L-1,暗培养45 d后再进行光照培养。培养条件为温度(23 ± 2) ℃,光照度1 800~2 500 lx。pH5.8,琼脂7 g·L-1和蔗糖30 g·L-1。每处理42个原球茎,根状茎处理30个,重复3次。对30 d后的增殖率和60 d后的出芽率进行数据分析。
1.2.2 生根培养 将苗高2~3 cm的无根苗接种于1/2MS基本培养添加如下植物激素浓度:6-BA 0.3 mg·L-1,NAA 0~2.0 mg·L-1和IBA 0~1.0 mg·L-1上进行光照培养,培养条件同上。培养60 d统计生根率、根长、根粗等情况。
1.3 数据统计分析
原球茎增殖分化阶段每瓶5个,每处理10瓶,重复3次;根状茎增殖分化阶段每瓶5个,每处理10瓶,重复3次;生根培养阶段每瓶5苗,每处理10瓶,重复3次。数据采用DPS9.50统计软件分析进行差异显著性分析。
2 结果与分析
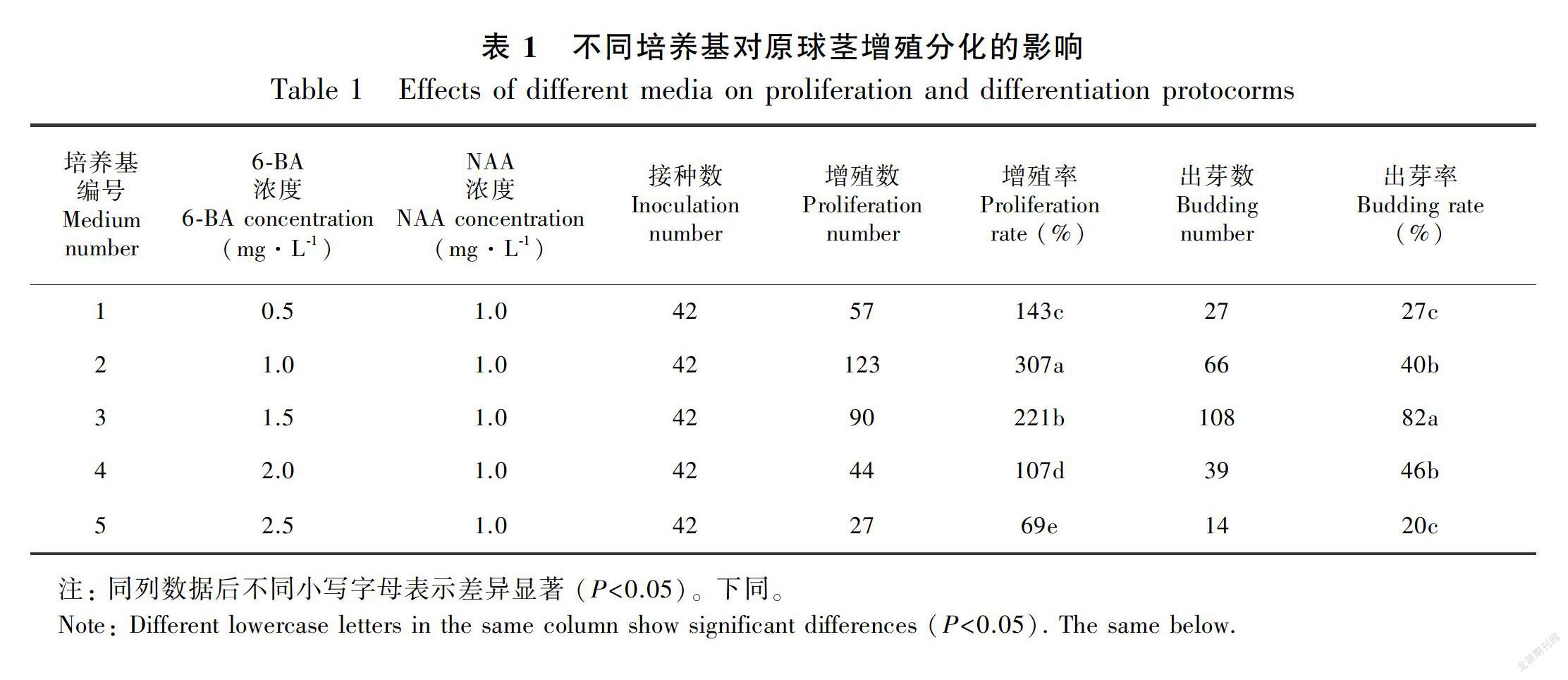
2.1 不同激素配比对原球茎增殖分化的影响
在原球茎增殖分化培养基中,培养10 d后,开始增殖、出芽分化,随着天数的增加,增殖率、出芽率增大,30 d后不同激素配比培养基增殖率、出芽率有所差异。由表1可知,随着6-BA浓度的增加,增殖率出现了先上升后下降的趋势,不同浓度6-BA对杂交兰原球茎增殖分化影响显著,2号培养基1/2MS+6-BA 1.0 mg·L-1+NAA 1.0 mg·L-1+AC 0.05%+香蕉80 g·L-1对原球茎增殖分化最好,增殖率为307%;比6-BA 2.0 mg·L-1、2.5 mg·L-1的培养基显著高186%、344%,数据表明6-BA浓度高于2.0 mg·L-1,原球莖增殖率明显下降,原球茎出芽率增殖不明显,5号培养基出现了部分褐化,由此可见激素浓度大于一定限度不利于原球茎增殖。3号培养基出芽率显著高于其他培养基,出芽率为82%,分别比添加NAA 1.0、2.0、2.5 mg·L-1培养基培养的出芽率显著高105%、78%、310%,芽体翠绿,无褐化情况,可见6-BA 1.5 mg·L-1最适于原球茎出芽增殖,太低或太高浓度的6-BA均不能启动芽分化,还会导致出芽黄化。
以上结果表明,6-BA 1.0 mg·L-1有利于原球茎增殖,6-BA 1.5 mg·L-1促进分化培养效果最佳,高浓度6-BA抑制了增殖分化效果。
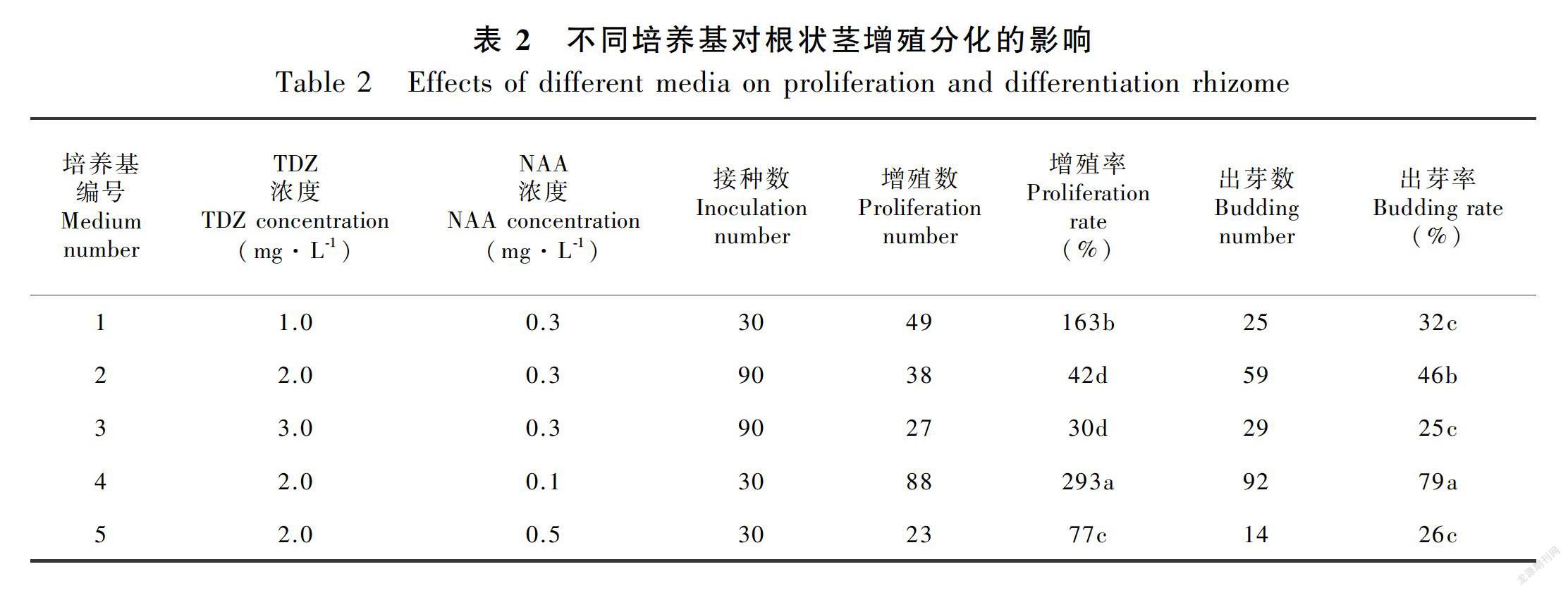
2.2 不同激素配比对杂交兰根状茎增殖分化的影响
将原球茎诱导出来的根状茎接种于不同浓度的培养基中进行培养,随时间延长增殖分化出根状茎、不定芽,结果如表2所示。不同浓度TDZ对根状茎增殖分化效果明显,NAA浓度为0.3 mg·L-1,处理1比含TDZ 2.0 mg·L-1、3.0 mg·L-1的培养基显著高288%、443%,随着TDZ浓度的增加,增殖率出现了明显下降的趋势,表明高浓度的TDZ不利于根状茎增殖,根状茎长度增长不明显,颜色较浅。TDZ浓度为2.0 mg·L-1时,NAA浓度为0.1 mg·L-1分化效果最佳,分别比添加NAA 0.3 mg·L-1、0.5 mg·L-1的培养基显著高216%、203%,且颜色呈绿色,根状茎长度明显增长,在原有的根状茎上增殖出长短不一的根状茎,茎周围新长出茂密的绒毛。随着NAA浓度增加分化率越低,抑制芽的分化,芽体颜色较浅,为淡绿色。所以综合考虑4号培养基1/2MS+TDZ 2.0 mg·L-1+NAA 0.1 mg·L-1+AC 0.05%+香蕉80 g·L-1对根状茎增殖分化效果最佳,增殖率为293%,出芽率为79%,出芽较多,芽体呈绿色。
以上结果表明, TDZ 2.0 mg·L-1和NAA 0.1 mg·L-1组合使用有利于根状茎的增殖分化,高浓度的TDZ、NAA抑制根状茎的增殖分化效果。
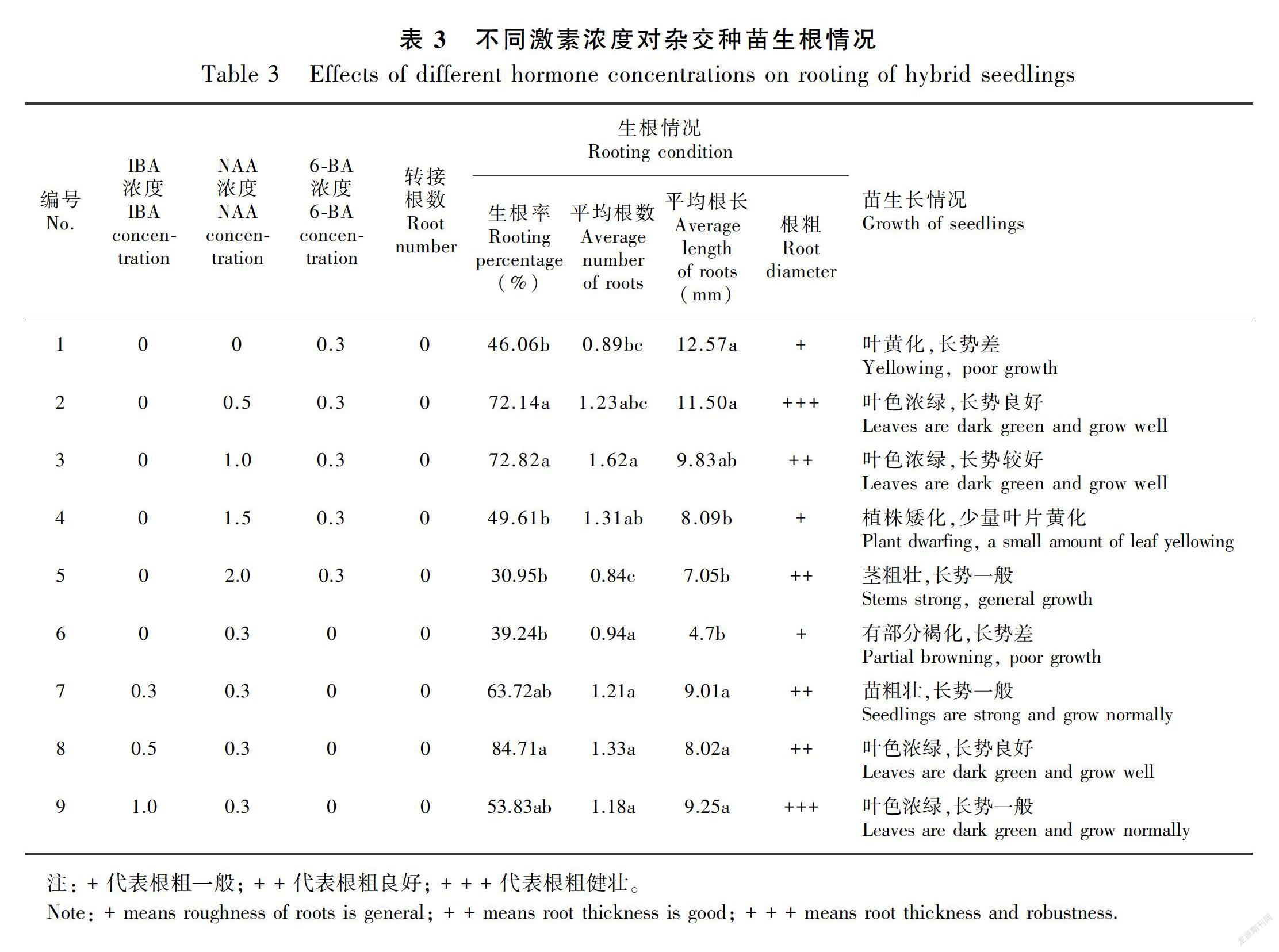
2.3 不同 NAA 、IBA浓度生根的影响
将原球茎和根状茎分化的无根小苗接种于不同培养基中培养,随着时间延长,苗体数量不断增加,60 d统计结果如表3可知,不同激素配比的培养基对植株生根有影响。2号培养基和3号培养基的生根率均较高,NAA浓度在0.5~1.0 mg·L-1为最佳浓度,生根率均达到72%,根系诱导较好,根粗而多,叶色浓绿,长势好;当NAA浓度大于1.0 mg·L-1时,苗的生根受到抑制,生根率出现了先上升后下降的趋势;受诱导形成的组培苗本身激素含量的影响,壮苗培养时低浓度的NAA可以更好地促进苗体生长,比添加NAA 1.5 mg·L-1、2.0 mg·L-1显著高46%、140%。但是,不添加NAA 植株则表现为矮化,叶片部分黄化。随着IBA浓度增大,生根率也明显提高,生根率出现了先上升后下降的趋势。在左利娟等(2015)的研究中IBA浓度对杂交兰根状茎有促进作用,本研究NAA 0.3 mg·L-1和IBA 0.5 mg·L-1组合使用为最佳浓度,生根率为84.7%,分别比添加IBA 0 mg·L-1、0.3 mg·L-1、1.0 mg·L-1的培养基显著高11%、32.9%、57.4%。综合考虑,1/2MS+IBA 0.5 mg·L-1+NAA 0.3 mg·L-1+AC 0.05%+香蕉80 g·L-1为最佳生根培养基。
以上结果表明,高浓度NAA抑制了生根效果,IBA 0.5 mg·L-1和NAA 0.3 mg·L-1组合使用促进植株生根,且叶色浓绿,根数较多而粗,苗长势良好。
3 讨论与结论
兰科植物大多是由原球茎分化成完整植株(Amaki & Haguchi, 1989),杂交兰诱导分化出原球茎进一步生长为根状茎(王国兴,1989),用于兰花组培的材料主要有茎尖、叶片、种子,目前大多采用种子萌发形成中间材料进行扩繁,本研究以杂交兰原球茎和根状茎为材料进行组培研究,以期实现杂交兰的规模化繁殖。
原球茎增殖分化选择培养基尤为重要,适宜浓度的激素配比对原球茎的增殖分化影响较大。吴彦秋等(2016)以杜鹃兰原球茎为材料,对比在1/2MS、MS、VW、KC培养基上的不同生长情况,1/2MS培养基的增殖率及长势显著高于其他处理。孙芳等(2012)和孙玉芬等(2014)研究也显示兰属植物组培以1/2MS效果较适宜。聂菁等(2016)以蝴蝶兰品种‘红太阳’无菌播种形成的原球茎为材料,6-BA 5.0 mg·L-1、NAA 0.7 mg·L-1为最佳的类原球茎诱导和增殖培养基浓度;本研究在激素和培养基选择具有相同性,以1/2MS培养基中添加6-BA 1.0 mg·L-1、NAA 1.0 mg·L-1增殖分化效果最佳,添加NAA、6-BA有利于原球茎分化,这与相关研究(宋莲等,2017;胡蕾和申婷,2017)一致, 说明不同品种的杂交兰对激素的敏感性有差异。杂交兰通过种子萌发获得原球茎,进一步分化出根状茎,根状茎增殖速度较慢,故提高根状茎的繁殖系数尤为关键。陈云喜等(2010)研究表明6-BA和NAA组合使用促进根状茎增殖分化,说明原球茎和根状茎增殖分化有其相似性。TDZ能刺激植株再生(Hutchinson & Saxena, 1996),但TDZ诱导芽变成完整植株存在问题,如生根困难、不利于芽的生长等(Huetteman & Preece, 1993)。在红花草莓组培诱导过程中TDZ的诱导效果优于6-BA,TDZ与NAA配合使用效果优于与IBA的组合(金美芳等,2017)。在蝴蝶兰的不定芽诱导中,单独添加TDZ或6-BA芽诱导率显著高于NAA与TDZ或6-BA的组合(程强强等,2011)。TDZ在杂交兰根状茎的增殖分化方面的研究尚未报道,因此本实验使用TDZ和NAA促进根状茎增殖,结果表明TDZ浓度2.0 mg·L-1和NAA0.1 mg·L-1组合使用时根状茎增殖的最佳效果,这与程强强等(2011)的研究有所差異,可能受植株本身激素的影响,在增殖培养中所需NAA浓度较低,激素浓度使用有所不同,使用新型激素TDZ和NAA组合促进根状茎增殖。组培苗长势决定了其后期扩繁和移栽的难易程度,许申平等(2018)以墨兰根状茎分化出苗,培养基MS+25 g·L-1糖+7.5 g·L-1琼脂+2 g·L-1活性炭,墨兰的生根效果最好,6-BA和NAA浓度增加幼苗生根率下降,本研究与之相较差异较大,这可能由杂交兰的特异性决定,不同杂交兰遗传特性的差异导致在生根阶段所需激素种类不一,同种激素不同浓度的生根情况有较大区别,激素选择上,IBA、NAA组合比6-BA、NAA组合生根率要好,生根培养基选择1/2MS,IBA 0.5 mg·L-1和NAA 0.3 mg·L-1组合可以促进植株生根,叶色浓绿,根数较多而粗,生根效果最佳,与左利娟等(2015)的研究一致。有研究表明活性炭促进增殖分化、苗体生根、防止褐化,王玉英等(2015)在辐射诱变的线艺兰快繁技术体系研究中加入了80 g·L-1香蕉泥;本研究在增殖分化、生根培养中均添加了香蕉泥和活性炭来促进苗体生长,减轻叶片褐化现象。
本研究结果表明,诱导筛选并建立了大花蕙兰‘红酒’×莲瓣兰‘边草素花’杂交兰的快繁技术体系,研究结果表明:最适宜原球茎增殖的培养基为1/2MS+6-BA 1.0 mg·L-1+NAA 1.0 mg·L-1+AC 0.05%+香蕉80 g·L-1;原球茎分化最佳培养基为1/2MS+6-BA 1.5 mg·L-1+NAA 1.0 mg·L-1 +AC 0.05%+香蕉80 g·L-1;1/2MS+TDZ 2.0 mg·L-1+NAA 0.1 mg·L-1+AC 0.05%+香蕉80 g·L-1对根状茎增殖分化效果最佳;1/2MS+IBA 0.5 mg·L-1+NAA 0.3 mg·L-1+AC 0.05%+香蕉80 g·L-1为最佳生根培养基,此体系的建立为种苗生产提供了技术支持。
参考文献:
AMAKI W, HAGUCHI H, 1989. Effects of dividing on the growth and organogenesis of protocorm-like bodies in Dortaenoosis [J]. Sci Hortic, 39(l): 63-68.
CHEN YY, ZHANG Y, ZHANG C, et al., 2009. A study on aseptic seed germination of interspecific hybrid between Cymbidium hybrida × C. sinense and C. faberi [J]. Acta Hortic Sin, 36(3): 441-446. [陈瑶瑶, 张燕, 张琛, 等, 2009. 杂交兰‘韩国桃花’×蕙兰种间杂交种子无菌萌发特征研究 [J]. 园艺学报, 36(3): 441-446.]
CHEN YX, HE DD, LIAO HR, et al., 2010.Factors influencing on shoot differentiation of rhizome of Cymbidium sinense × Cymbidium lancifolium [J]. Chin Agric Sci Bull, 26(9):65-69. [陈云喜, 何丹丹, 廖浩如, 等, 2010. 影响墨兰×兔耳兰根状茎芽分化的因素 [J]. 中国农学通报, 26(9):65-69.]
CHENG QQ, ZHUANG DH, XU DX, et al., 2011. The high-frequency induction of adventitious shoots and plant regene-ration from leaf explants of Phalaenopsis with added thidiazuron [J]. Sci Plant J, 29(4):524-530. [程强强, 庄东红, 许大熊, 等, 2011. TDZ高效诱导蝴蝶兰叶片不定芽及植株再生 [J]. 植物科学学报, 29(4):524-530.]
DING CC, XIA NH,2011. Embryo culture of interspecific hybrid between Cymbidium tortisepalum and C. skymint patty [J]. SW Chin J Agric Sci, 24(4):1609-1611. [丁长春, 夏念和, 2011. 莲瓣兰与大花蕙兰‘黄金薄荷’种间杂种胚培养研究 [J]. 西南农业学报, 24(4):1609-1611.]
HU L, SHEN T, 2017. Tissue culture and rapid propagation of hybrid orchid [J]. J Zhejiang Agric Sci, 58(2):259-260+264.[胡蕾, 申婷, 2017. 杂交兰的组织培养与快繁技术 [J]. 浙江农业科学, 58(2):259-260+264.]
HUTCHINSON MJ, SAXENA PK, 1996. Acetylasalicylic acid enchances and synchronizes TDZ-induced somatic embryogenesis in geranium (Pelargonium×horturum Bailey)tissue cultures [J]. Plant Cell Rep, 15:512-515.
HUETTEMAN CA, PREECE JE, 1993. TDZ: A potent cytokinin for woody plant tissue culture [J]. Plant Cell Tissue Organ Cult, 33:105-119.
JIN MF, CAO Z, CAI JJ, et al., 2017. Tissue culture and rapid propagation technique of red-flowered strawberry [J]. Guihaia, 37(11):1395-1405.[金美芳, 曹智, 蔡俊杰, 等, 2017. 红花草莓的组织培养与快繁技术研究 [J]. 广西植物, 37(11):1395-1405.]
LU SC,1994. Chinese Cymbidium and tactics of orchids [M]. Beijing: Golden Shield Press: 62-81. [卢思聪, 1994. 中国兰与洋兰 [M]. 北京:金盾出版社: 62-81.]
NIE Q, LIU LF, REN HH, et al., 2016. Preliminary study on multiplication and regeneration system of protocorm-like bodies in phalaenopsis [J]. Shanxi Univ (Nat Sci Ed ), 39(2):318-32.[聶菁, 刘丽凤, 任海虹, 等, 2016. 蝴蝶兰类原球茎诱导、增殖及植株再生条件初步研究[J]. 山西大学学报(自然科学版), 39(2):318-32.]
SONG L, WANG YY, ZHANG YH, et al., 2017. Polyploid induction in Cymbidium sinenthese ‘Lv mosu’× Cymbidium hybridum ‘Shijieheping’ rapid propagation techniques [J]. Jiangsu J Agric Sci, 45(24): 41-43. [宋莲, 王玉英, 张宇欢, 等, 2017. 墨兰绿墨素与大花蕙兰世界和平杂交种组培快繁技术 [J]. 江苏农业科学, 45(24):41-43.]
SUN F, LI CX, ZHANG L, et al., 2012. Study on rapid propagation and differentiation of filial generation of Cymbidium goeringii [J]. Chin Agric Sci Bull, 28(10):189-193. [孙芳, 李承秀, 张林, 等, 2012. 春兰名品杂交后代快繁与分化研究 [J]. 中国农学通报, 28(10):189-193.]
SUN XF, NING HJ, ZHANG SY, et al., 2006. Proliferation and differentiation of rhizomes from a filial generation of Cymbidium goeringii × Cymbidium hybridum [J]. J Zhejiang A & F Univ, 31(1):156-161. [孙玉芬, 宁惠娟, 张韶伊, 等, 2006. 春兰与大花蕙兰杂交后代根状茎增殖与分化条件 [J]. 浙江农林大学学报, 31(1):156-161.]
SONG L, WANG YY, ZHANG YH, et al., 2017. Polyploid induction in Cymbidium sinenthese ‘Lv mosu’× Cymbidium hybridum ‘Shijieheping’ rapid propagation techniques [J]. Jiangsu J Agric Sci, 45(24): 41-43. [宋莲, 王玉英, 张宇欢, 等, 2017. 墨兰绿墨素与大花蕙兰世界和平杂交种组培快繁技术 [J]. 江苏农业科学, 45(24):41-43.]
WANG GX, 1989. Preliminary study on stems of Cymbidium plants [J]. Acta Hortic Sin, (4):314-315. [王国兴, 1989. 兰属(Cymbidium)植物茎的初探 [J]. 园艺学报, (4):314-315.]
WU YQ, L X, LI XL, et al., 2016. Culture conditions of protocorms proliferation of Cremastra appendiculata [J]. N Hortic, (19):124-128.[吴彦秋, 吕享, 李小兰, 等, 2016. 杜鹃兰原球茎增殖培养条件 [J]. 北方园艺, (19):124-128.]
WANG YY, SU C, LI HY, et al., 2015. Study on rapid propagation technique of Cymbidium with verge line pattern leaves induced by irradiation [J]. N Hortic, 39(23):101-103. [王玉英, 苏畅, 李海燕, 等, 2015. 辐射诱变的线艺兰快繁技术体系研究 [J]. 北方园艺, 39(23):101-103.]
XIE L, MA XJ, GUO HR, et al., 2014. Control of bud diffe-rentiation of protocorm-like bodies during proliferation and micropropagation of hybrid Cymbidium [J]. Plant Physiol J, 50(2):209-213. [谢利, 马晓娟, 郭和蓉, 等, 2014. 杂交兰类原球茎增殖中芽分化的控制和快速繁殖 [J]. 植物生理学报, 50(2):209-213.]
XU SP, YUAN XY, WANG MF, et al., 2018. Micropropagation in vitro of Cymbidium sinensis [J]. Chin J Trop Crop, 39(5):926-930.[许申平, 袁秀云, 王默霏, 等, 2018. 墨兰(Cymbiduim sinense)組培快繁技术体系研究 [J]. 热带作物学报, 39(5):926-930.]
ZUO LJ, LI ZQ, ZHENG ZY, et al., 2015. Study of Cymbidium hybrid rhizome proliferation and differentiation [J]. Jiangsu J Agric Sci, 43(6):54-56. [左利娟, 李志强, 郑志勇, 等, 2015. 杂交兰根状茎的增殖与分化成苗技术 [J]. 江苏农业科学, 43(6):54-56.]
ZHENG LM, 2010. Crossbreeding experiments between Cymbidium goeringii and Cymbidium hybridium [J]. J Zhejiang Educ Inst, (3):61-65. [郑立明, 2010. 春兰与大花蕙兰种间杂交育种的试验 [J]. 浙江教育学院学报, (3):61-65.]
ZHU GF, WANG BQ, CHEN ML, et al., 2005. Study on hybridization among Cymbidium species and Cymbidium hybrid [J]. Chin Bull Bot, 22(4):445-448. [朱根发, 王碧青, 陈明莉, 等, 2005. 大花蕙兰与兰属植物种间杂交研究 [J]. 植物学通报, 22(4): 445-448.]
ZHU GF, CHEN ML, LUO ZW, et al., 2004. Induction and propagation of hybrid protocorm like-body of crosses between Cymbidium sinense and Cymbidium hybridium [J]. Acta Hortic Sin, 31(5): 688-690. [朱根发, 陈明莉, 罗智伟, 等, 2004. 墨兰与大花蕙兰种间杂种原球茎的诱导及增殖研究 [J]. 园艺学报, 31(5): 688-690.]
