巧解习题泛泛谈
2019-09-10刘琳
摘 要:化学学科知识点零散,学习方法多样化。基础薄弱,方法呆板,态度不积极,进取心不强的学生,学习效率低下,甚至越学思维越混乱,成绩每况愈下。为了改变这一现状,就得对症下药,从培养兴趣入手,从积累点滴方法开始。
关键词:守恒法;关系式法;圖像法
学生进入高中,学习内容增多,难度加大。学生不仅要及时适应新的学习环境,更重要的是从根本上转变义务教育阶段的学习方法。新版教材编排采用“螺旋式上升、层层递进”思路,让学生由简到难,循序渐进地去学习基础知识,慢慢提高能力。设想是好的,也已经践行多年了,但农村中下等学生适应起来却非常困难。因为课堂时间紧,没有课前预习和课后复习习惯,基础薄弱,理解能力差,单纯完成“必修”学习任务已经非常吃力。老师在高一阶段没法做到“适当延伸”以拓展学生知识面,也没有精力“开小灶”去开阔其视野。高二阶段,学习《化学反应原理》时基本不涉及元素周期律、元素化合物等知识板块,学习《有机化学基础》时必修2中所学的有机部分知识已经淡忘,老师串讲复习是有重点的、蜻蜓点水式的,学生如果不能及时查缺补漏,随着教学进度的延伸,学生学习化学越来越吃力,慢慢地就掉队了。
近年化学试题总体特点是:文字量大,信息量多,考点密集,得分率低。绝大多数学生在理综考试中总是把化学部分放在最后做答就能从根本上说明中学化学不好学,不易得分。针对时间少,内容多,考题难又想取得好成绩的现状,学习方法的总结,解题技巧的探索就显得特别必要。本文着重就解题技巧方面谈谈如何提高化学学习效率的问题。
一、应用“守恒法”解决问题
习题1:某200mL氯化镁和氯化铝混合液中c(Mg2+)为0.3mol/L,c(Cl-)为1.2mol/L。要使Mg2+全部转化为沉淀分离出来,至少需加4mol/LNaOH溶液的体积为mL学会审题,及时准确地捕捉到关键信息很重要。Mg2+全部转化为沉淀分离出来,此时Al3+已经完全转化为AlO2-。建立电荷守恒等式n(Cl-)=2n(Mg2+)+3n(Al3+),解得n(Al3+)=0.04mol,加NaOH溶液使Mg2+恰好沉淀并分离出来后,溶液中有n(Na+)=n(Cl-)+n(AlO2-),且n(AlO2-)=n(Al3+)=0.04mol,故n(NaOH)=n(Na+)=0.28mol,V(NaOH)=0.28mol÷4mol/L=70mL。
此题考点单一,有灵活性,旨在考查学生思维能力,既要熟悉“电荷守恒”,也要善于分析达到目的时溶液中溶质成分。
习题2:1.28g铜投入一定量的浓硝酸中,铜完全溶解,生成气体颜色越来越浅,共收集到VmL气体(标况),将盛有此气体的容器倒扣在水中,通入氧气恰好使气体完全消失,则需要标况下的氧气体积为mL
反应中铜将硝酸还原,氮元素化合价降低,但所收集氮的氧化物气体又被氧气在水溶液中完全氧化,氮元素化合价恢复至+5价。本题相当于用一定量的氧气将1.28g铜氧化至+2价,则利用铜和氧气之间反应用量确定需要标况下的V(O2)=224mL。
二、驾轻就熟用“关系式法”
习题3:①向29.6gFe2O3、FeO和Cu的混合物中,加入1mol·L-1硫酸溶液400mL时,固体恰好完全溶解,所得溶液中不含Fe3+。若用足量的CO在高温下还原相同质量的原混合物,得到的固体质量为g。②一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入350mL2mol·L-1的稀硝酸恰好使混合物完全溶解,放出2.24LNO(标况),往所得溶液中加入KSCN溶液,无红色出现。若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为mol.
①中固体恰好完全溶解,硫酸无剩余,原固体化合物中氧元素刚好与硫酸中氢元素结合为水,则n(O)=n(H2SO4)=0.4L×1mol·L-1=0.4mol。用足量的CO在高温下还原相同质量的原混合物,固体质量的减少部分即为氧元素的质量,还原后得到的固体质量为29.6g-0.4mol×16g·mol-1=23.2g。②中加入KSCN溶液无红色出现,故反应后溶液中的溶质只有Fe(NO3)2,则2n(Fe2+)=n(NO3-)=n(HNO3)-n(NO),解得n(Fe2+)=0.3mol。题目涉及物质种类多,反应复杂,学生审题感觉一头雾水!其实,面对这种问题别产生畏难情绪,深挖细研,寻找守恒关系,架设必要桥梁,从而删繁就简,化难为易了。
三、“图像法”解决问题一目了然
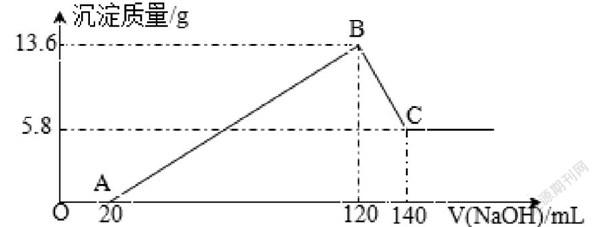
习题4:将一定质量的Mg-Al合金投入100mL一定物质的量浓度的某HCl溶液中,充分反应。向反应后的溶液中逐滴加入一定物质的量浓度的NaOH溶液,生成沉淀的质量与所加NaOH溶液的体积关系如下图。回答下列问题:
读图得知,向反应后溶液中滴加NaOH溶液,OA段用于中和过量盐酸,AB段沉淀Al3+和Mg2+,BC段溶解Al(OH)3。第120~140mLNaOH溶液溶解Al(OH)3沉淀,依据方程Al(OH)3+OH-=AlO2-+2H2O计算得出NaOH溶液的物质的量浓度是5mol/L,生成5.8gMg(OH)2沉淀消耗40mLNaOH溶液,生成7.8gAl(OH)3沉淀消耗40mLNaOH溶液,解得a值为20。B点时溶液中溶质为NaCl,守恒法解得原HCl溶液的物质的量浓度是6mol/L,原Mg-Al合金的质量是5.1克。
授人以鱼不如授人以渔。学生掌握的解题技巧反比于学习的“活化能”,自行解决问题便给他带来自信,自然而然产生兴趣。人的潜能是巨大的,只要学生有了信心,愿意投入精力,再有事半功倍的解题技巧,学习就不再是被逼的苦差事,而是一种乐趣,是实现报复、走向成功的桥梁。
作者简介:刘琳(1973年出生),女,甘肃庄浪人,现于甘肃省庄浪县第二中学任教,本科学历。中学高级教师。
