海带多糖抑制平滑肌细胞增殖及抗氧化活性研究
2019-09-10彭臻菲李泳宁魏碧娜林碧珠
彭臻菲 李泳宁 魏碧娜 林碧珠

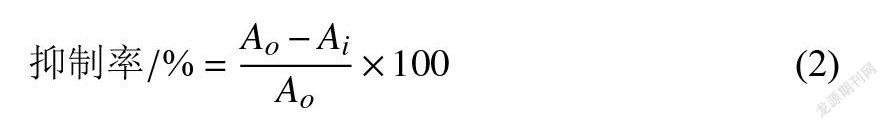




摘要:[目的]研究海带多糖对HO诱导血管平滑肌细胞(vascular smooth muscle cells,VSMC)增殖及胞内脂质过氧化物生成量的影响,为阐明海带多糖对VSMC的作用机制奠定基础。[方法]以HO为诱导剂建立体外VSMC增殖模型,通过四甲基偶氮唑盐法和细胞形态观察评价海带多糖对HO诱导VSMC生长和增殖的影响,同时以丙二醛为指标考察海带多糖对HO诱导VSMC胞内脂质过氧化物生成量的影响。[结果]以50umol·L-1HO为诱导剂建立VSMC体外增殖模型。四甲基偶氮唑盐法测定结果表明海带多糖对HO诱导VSMC增殖具有显著抑制活性,最大增殖抑制率达到73.56%。细胞形态学观察结果表明海带多糖作用下HO诱导的VSMC生长状态发生改变且细胞数量显著减少。丙二醛检测结果表明海带多糖作用下VSMC胞内脂质过氧化物量显著减少。[结论]海带多糖能够抑制HO诱导的VSMC增殖,且显著降低VSMC胞内脂质过氧化物生成量。
关键词:海带多糖;血管平滑肌细胞;HO诱导;细胞增殖;脂质过氧化物
中图分类号:P745文献标志码:A 文章编号:1008-0384(2019)12-1457-06
0 引言
[研究意义]近年来,随着社会经济发展与人们生活水平提升,心血管疾病发病率呈逐年上升趋势,已严重威胁人类健康。动脉粥样硬化是心血管系统疾病中最常见的疾病之一,也是心血管疾病共同的病理基础。积极预防和控制动脉粥样硬化是预防心血管疾病、降低疾病发病率的重要手段。(前人研究进展)病理学研究结果表明,VSMC增殖是早期动脉粥样硬化形成的始动环节之一,成为心血管疾病防治研究的重要靶细胞。同时,有研究发现,活性氧自由基(reactiveoxygenspecies,ROS)与VSMC增殖相关。血管紧张素Ⅱ、高糖等通过提高VSMC胞内ROS水平促进细胞增殖。抗氧化剂调控ROS介导信号通路抑制VSMC增殖。因此,以ROS清除剂筛选VSMC增殖抑制剂成为研究方向之一。[本研究切入点]海带是我国东南沿海常见的经济型养殖海藻,具有药食同源性,在我国多部古代医学典籍中均有记载其药学功效。多糖是海带主要的药效学活性成分,动物学试验研究结果表明,海带多糖可有效降低试验性大鼠血管脂质沉积,降低动脉粥样硬化风险。本课题组前期研究发现海带多糖具有清除超氧阴离子(O·)活性,且抑制碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)诱导VSMC增殖。已有研究发现HO通过调控O·导信号通路促进VSMC增殖。但是海带多糖对VSMC增殖抑制活性与其抗氧化活性相关性研究未见相关报道。[拟解决的关键问题]因此,本课题以氧化剂HO为诱导剂建立VSMC体外增殖模型,研究海带多糖对氧化剂诱导VSMC增殖及胞内过氧化物生成影响,为阐明海带多糖对VSMC的作用机制奠定基础。
1材料与方法
1.1 原料
海带多糖由本实验室制备,多糖含量为87.2%;DMEM培养基购自Gibco公司;胎牛血清(FBS)购自杭州四季青;丙二醛(MDA)检测试剂盒购自碧云天公司;二甲基亚砜(DMSO)、HO购自Sigma公司;动物细胞裂解液购自上海生工;MTT购自Biosharp公司;其他试剂均为国产分析纯。
1.2主要仪器设备
BCM-1000超净工作台,苏州净化设备有限公司;HERAcell 150i CO恒温培养箱,美国Thermo公司;TGL-16M冷冻离心机,湖南湘仪;P10-Y超纯水系统,科尔顿有限公司;M3酶标分析仪,美国MD公司;TS-100F倒置显微镜,日本尼康公司;UV-2600紫外-可见光分光光度计,日本岛津公司。
1.3试验方法
1.3.1细胞培养 VSMC由本实验室制备。细胞培养及传代:VSMC采用含10%FBS的DMEM培养液,于37℃、5%CO培养箱内静置培养。待细胞生长汇合后,吸弃培养瓶内培养液,PBS缓冲液清洗细胞瓶,加入适量0.25%胰酶,37℃放置3min,倒置顯微镜下观察,待细胞呈悬浮,即加入完全培养液终止酶解反应。吸管反复轻轻吹打培养液以分散细胞团,取0.5mL细胞悬液接种于新的培养瓶内,补加新鲜的完全培养液至3mL。置于37℃、5%CO培养箱静置培养。
1.3.2HO诱导VSMC增殖模型构建 取浓度为1×10个mL-1VSMC悬液接种96孔板,37℃、5%CO培养箱静置培养24h,待细胞完全贴壁后,用无血清的DMEM培养液37℃孵育8h。加入HO溶液于96孔板至终浓度为设定浓度,对照组用无血清DMEM代替HO。孵育至12h、24h、36h后加入MTT溶液(100ug·孔),孵育4h后,弃上清液,加入DMSO(200uL·孔)。振荡混匀,于578nm下检测吸光值。每个试验组设定6孔平行孔。细胞增殖率计算公式:
式中:A为HO模型组吸光值;Ao为对照组吸光值。
1.3.3MTT法测定VSMC增殖取对数生长期细胞悬液(1×10个·mL)接种于96孔培养板中,200uL孔,待细胞贴壁后更换无血清培养液,37℃、5%CO培养箱内静置过夜培养。吸弃培养液,向96孔板内分别加入0.1、0.5、1.o mg·mL海带多糖样品,每个浓度样品设置6个平行孔,HO模型组用DMEM代替多糖样品。培养至设定时间后,向各孔分别加入HO,继续孵育至设定时间,加入MTT溶液(100ug·孔),孵育4h后,弃上清液,加入DMSO(200uL·孔)。振荡混匀,于578nm下检测吸光值。细胞增殖抑制率计算公式:
式中:A为HO模型组的吸光值;A为海带多糖试验组吸光值。
1.3.4VSMC形态观察 取对数生长期细胞悬液(1×10cells·mL)接种于6孔培养板中,1mE·孔,待细胞贴壁后更换无血清培养液,37℃、5%CO培养箱内静置过夜培养。吸弃培养液,向6孔板内分别加入0.5、1.0mg·mL海带多糖样品,每个浓度样品设置3个平行孔,HO,模型组用DMEM代替多糖样品。培养至设定时间后,向各孔分别加入HO,继续孵育至设定时间后于倒置显微镜下观察细胞形态。
1.3.5MDA含量测定按1.3.4方法处理细胞,待细胞经无血清培养液过夜饥饿处理后吸弃培养液,向6孔板内分别加入0.1、0.5、1.0mg·mL海带多糖样品,每个浓度样品设置3个平行孔,HO模型组用DMEM代替多糖样品。培养至设定时间后,向各孔分别加入HO,继续孵育至设定时间后收集细胞,按碧云天MDA检测试剂盒说明操作,于532nm下测定吸光值,并计算MDA含量。
1.3.6数据分析 数据均采用SPSS 17.0软件进行统计学处理,均数±标准差表示,并对结果进行LSD-t检验。
2 结果与分析
2.1 HO诱导VSMC体外增殖模型的建立
本课题以HO为诱导剂建立VSMC体外增殖模型,结果如表1所示。在相同的HO浓度下,24h试验组VSMC增殖率均高于12h和48h试验组。而在HO相同作用时间下,VSMC增殖率均随着HO浓度的增加呈先上升而后下降的趋势。在HO浓度为10~100~rnol·L时,VSMC增殖率随着HO浓度增高而增大。当时间为24h,HO浓度为50gmol·L时,VSMC增殖率达到142.54%,再增加HO浓度至100umol·L,其VSMC增殖率略有增加,但与50umol·L试验组相比,差异并不显著。而当HO浓度增加至150umol·L,其VSMC增殖率则有所下降。可见当HO浓度增大至150lamol·L对VSMC具有细胞毒性,这与文献报道一致。因此,本课题选择HO诱导VSMC增殖处理浓度为50umol·L,作用时间为24h。
2.2 海带多糖对VSMC增殖作用的影响
采用MTT法测定海带多糖对VSMC增殖影响,结果见图1所示。从图1可以看出,海带多糖预处理时间相同时,随着海带多糖预处理质量浓度的增加VSMC增殖抑制率增大,呈量效相关性。在相同海带多糖预处理时间下,与海带多糖預处理质量浓度为0.1mg·mL-1试验组相比,海带多糖预处理质量浓度为0.5mg·mL和1.0mg·mL试验组VSMC增殖抑制率均显著增高(P<0.05)。当海带多糖预处理时间为12h时,质量浓度为1.0mg·mL海带多糖预处理试验组VSMC增殖抑制率为53.11%,是相同多糖预处理时间下0.1mg·mL海带多糖预处理试验组的5.72倍。由此可见,海带多糖可抑制氧化剂HO诱导VSMC增殖。
同时,由图l可以看出,当海带多糖预处理质量浓度高于0.5mg·mL时,与多糖预处理时间12h试验组相比,多糖预处理时间为24h和48h试验组VSMC增殖抑制率均显著增高(P<0.05),增殖抑制率均达到60%。其中,当海带多糖预处理质量浓度为1.0mg·mL时,多糖预处理时间为24h试验组VSMC增殖抑制率最大,达73.56%。因此,后续试验选择海带多糖预处理时间为24h。
2.3 海带多糖对VSMC形态影响
由图2可知,HO模型组细胞透光性强,细胞边缘模糊,细胞呈伸展的梭状,且细胞密度大。海带多糖预处理试验组VSMC形态则出现显著变化,0.5mg·mL海带多糖预处理试验组VSMC数目减少,且细胞胞质回缩,部分细胞呈圆形。1mg·mL海带多糖预处理试验组VSMC密度显著降低,细胞边缘清晰,细胞胞质回缩,镜下可见大部分细胞呈圆形。由此可见,海带多糖可引起VSMC生长形态改变,随着海带多糖预处理浓度的增高,VSMC数量显著减少,且呈圆形的VSMC数量增多,表明海带多糖预处理后VSMC形态发生显著变化,使其增殖速度减慢。
2.4 海带多糖对HO诱导VSMC胞内MDA生成的影响
研究发现,HO诱导VSMC胞内大量累积ROS可促进VSMC胞内一系列脂质过氧化产物的生成,进而诱导细胞释放生长因子促使VSMC增殖,因此脂质过氧化物是评估VSMC胞内ROS水平的重要参数。本课题以MDA表征胞内脂质过氧化物生成量,结果如表2所示。
从表2中可以看出,与对照组相比,HO模型组MDA含量显著提高,达到3.21umol·L,表明HO诱导VSMC胞内生成大量脂质过氧化物,ROS水平显著提高,这是其诱导VSMC增殖的重要因素。而采用不同质量浓度海带多糖进行预处理后,其VSMC胞内MDA生成量均有下降。當海带多糖质量浓度达到1.0mg·mL时,VSMC胞内MDA生成量最低,仅为1.27umol-L,与HO模型组相比下降了60.44%。由此可见,VSMC胞内脂质过氧化物生成量随着海带多糖预处理浓度的增加而降低,呈量效相关陸,表明海带多糖预处理后有效抑制VSMC胞内因HO诱导引起的ROS升高,提示海带多糖对HO诱导VSMC增殖的抑制机制与调控VSMC胞内ROS水平相关。因此,后续试验可进一步从分子水平探讨海带多糖对VSMC胞内ROS的调控机制,阐明海带多糖对HO诱导VSMC增殖抑制机制。
3讨论与结论
病理学研究发现,血管平滑肌细胞异常增殖是动脉粥样硬化形成的始动环节,也是动脉粥样硬化心血管疾病共同的病理基础。研究发现抗动脉粥样硬化活性物质西洛他唑通过阻断VSMC胞内ERK1/2信号通路,抑制VSMC增殖。Bin等对动脉粥样硬化形成分子机制研究发现,动脉粥样硬化重要诱因氧化低密度脂蛋白(ox-LDL)诱导VSMC胞内转录因子KLF5表达,进而上调胞内微小RNA-29a表达水平,最终促进VSMC增殖而形成动脉粥样硬化斑块。细胞学研究发现,ROS水平增高激活VSMC胞内MAPK信号通路并促进VSMC增殖。Yang等研究结果表明高糖处理引起细胞ROS水平增高是其诱导VSMC增殖的主要因素。因此,胞内ROS水平增高是VSMC增殖的促进因子。
天然产物活性研究结果表明,海藻多糖具有显著抗氧化活性,可有效降低胞内ROS水平。马军等研究发现海藻多糖具有自由基清除和抗脂质过氧化活性。杨运高等用大鼠红细胞免疫功能缺陷模型研究海藻多糖对红细胞免疫功能及自由基损伤的影响。试验结果显示,海藻多糖增强超氧化物歧化酶、谷胱甘肽等还原性物质活性,并降低MDA含量,表明海藻多糖可降低大鼠体内ROS水平,是抗氧化剂的重要备选资源。海带多糖是一种抗氧化活性显著的海藻多糖,其对DPPH、羟自由基、超氧阴离子等自由基的清除活性显著。张晴岚等研究发现海带多糖可改善大鼠血脂水平,提高一氧化氮浓度和一氧化氮合酶活性,抑制动脉粥样硬化斑块发生和发展。本课题以HO为诱导剂建立VSMC增殖模型,评估海带多糖作用下动脉粥样硬化始动因子VSMC生长与脂质过氧化水平的相关性。结果表明,海带多糖可抑制HO诱导VSMC增殖且呈量效相关性。而海带多糖浓度与VSMC胞内MDA含量呈负相关性,可见海带多糖缓解了VSMC胞内因HO诱导引起的ROS水平增高,表明海带多糖抑制VSMC增殖与其抗氧化活性相关。因此,后续研究需进一步从ROS调控细胞增殖的MAPK通路上进一步探讨海带多糖对VSMC增殖的抑制机制,为深度开发海带药用价值奠定基础。
