全身骨显像联合血清CA15-3、CEA、ALP对乳腺癌骨转移的诊断价值*
2019-09-09郑星宋丽萍
郑星, 宋丽萍
锦州医科大学附属第一医院核医学科(辽宁锦州 121001)
乳腺癌是威胁全球妇女健康最多见、发病率最高的恶性肿瘤之一,其在发展中国家发病率和病死率位于所有恶性肿瘤的首位[1]。而在乳腺癌晚期的患者中,发生骨转移者占总例数的60%以上[2]。乳腺癌患者骨转移的早发现、早诊断、早治疗对于辅助一线临床工作具有十分重要的作用。传统以肿瘤标志物或全身骨显像(WBS)的单项检测进行判断,因敏感度较低或特异度较低而影响对乳腺癌骨转移准确性的判断,通过WBS联合血清糖类抗原(CA15-3)、癌胚抗原(CEA)、碱性磷酸酶(ALP)水平检测的方法来提高准确度的研究鲜有报道,本研究通过WBS与以上3种肿瘤标志物联合检测的方法,评价其在乳腺癌骨转移诊断中的应用及临床价值。
1 资料与方法
1.1 一般资料 选取2016年1月至2018年1月期间收治经病理证实,行WBS的乳腺癌住院患者105例为研究对象,患者均为女性,年龄32~82岁,平均(58±9.3)岁。参照骨转移临床诊断标准,105例经病理证实为乳腺癌患者中,发生骨转移74例,未发生骨转移31例,骨转移发生率为70.48%(74/105)。
1.2 研究方法
1.2.1 CA15-3、CEA、ALP的检测 105例乳腺癌患者均于清晨空腹采静脉血3 mL待检,CEA、CA15-3通过采用电化学发光技术进行检测;ALP采用NPP底物-AMP缓冲液法检测,操作方法、步骤及检测结果严格按照试剂说明书进行。
1.2.2 显像操作 由经培训上岗的核医学科护士给患者静脉注射99mTc-MDP 740 MBq(20 mCi),2.5~3 h后排空小便做前后位及后前位全身显像,采用美国GE公司生产的SPECT/CT,采用低能高分辨率平行孔准直器进行采集,能峰140 keV,窗宽20%,矩阵128×128,床速15 cm/min。
1.2.3 骨显像诊断标准 2名中级职称以上的核医学医师采用双盲法进行图像分析,如有分歧则由另一位高年资医师最终判定。病变部位放射性核素分布不对称异常增高,结合临床情况和其他检查结果分析可除外如骨折、骨关节炎及骨代谢病等其他骨质病变。本研究根据病理活检、其他影像学检查结果及临床随访复查,作为确诊乳腺癌骨转移的诊断标准。按照soloway标准[3],将WBS结果分成4个等级:M0,未发生骨转移;M1发生骨转移,病灶数为1~2个;M2发生骨转移,病灶数为3~5个;M3发生骨转移,病灶数>5个。
1.2.4 联合诊断方法 采用WBS与血清CA15-3、CEA、ALP水平的并联检测的方式进行联合诊断。

2 结果
2.1 病理、WBS及随访结果 通过1年以上多次随访复查,有105例经病理证实为乳腺癌患者,其中发生骨转移74例,WBS阳性病例69例,敏感度为93.2%(69/74)。未发生骨转移31例,其中36例WBS为阴性,5例为WBS阳性,5例中4例为外伤所致,1例为骨关节炎。乳腺癌骨转移组患者胸骨、肩胛骨、多处肋骨、多处椎体骨、两侧髂骨、髋臼及右侧股骨近端均可见点团状异常显像剂摄取增高影。颅骨显像剂分布亦不均匀,见图1。未转移组WBS未见明显异常显像剂摄取增高及减低区,见图2。
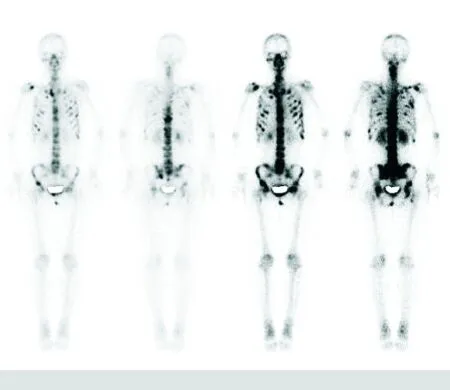
图1 全身广泛性骨转移瘤的乳腺癌患者的WBS结果
2.2 乳腺癌骨转移组与未转移组血清CA15-3、CEA、ALP水平 血清CA15-3、CEA、ALP水平比较,骨转移组较未转移组血清指标明显升高,差异有统计学意义(t=6.798、5.041、6.146,P<0.05)。见表1。
2.3 血清CA15-3、CEA、ALP水平与全身骨转移分级(骨转移病灶数)的相关性 74例乳腺癌骨转移患者中,按照soloway标准,M1发生骨转移率为22.97%(17/74);M2发生骨转移率为33.78%(25/74),

图2 未发生骨转移的乳腺癌患者的WBS结果
表1 乳腺癌骨转移组与未转移组血清CA15-3、CEA、ALP水平比较

表1 乳腺癌骨转移组与未转移组血清CA15-3、CEA、ALP水平比较
血清指标骨转移组(n=74)未转移组(n=31)CA15-3(U/mL)61.88±62.5011.02±9.92CEA(ng/mL)15.85±16.163.91±8.01ALP(IU/L)97.29±40.8957.71±24.18
M3发生骨转移率为43.24%(32/74)。M1、M2和M3各组CA15-3、CEA、ALP水平的差异均有统计学意义(P<0.05),随骨转移分级升高,血清学表现呈显著上升趋势。Pearson相关分析结果显示,全身骨转移分级与CA15-3、CEA、ALP水平存在相关性(r=0.685、0.618、0.625,P<0.05)。见表2。
表2 骨转移不同分级的患者CA15-3、CEA、ALP水平的比较
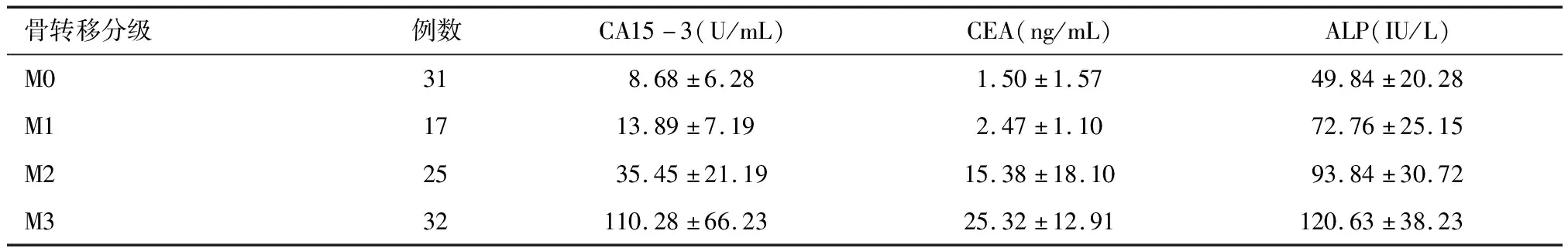
表2 骨转移不同分级的患者CA15-3、CEA、ALP水平的比较
骨转移分级例数CA15-3(U/mL)CEA(ng/mL)ALP(IU/L)M0318.68±6.281.50±1.5749.84±20.28M11713.89±7.192.47±1.1072.76±25.15M22535.45±21.1915.38±18.1093.84±30.72M332110.28±66.2325.32±12.91120.63±38.23
2.4 WBS联合血清CA15-3、CEA、ALP对乳腺癌骨转移的评价 CA15-3诊断乳腺癌骨转移的敏感度、特异度及准确度分别为68.9%(51/74)、77.4%(24/31)及71.4%(75/105);CEA诊断乳腺癌骨转移的敏感度、特异度及准确度分别为54.1%(40/74)、87.1%(27/31)及63.8%(67/105);ALP诊断乳腺癌骨转移的敏感度、特异度及准确度分别为58.1%(43/74)、80.6%(25/31)及64.8%(68/105);WBS诊断乳腺癌骨转移的敏感度、特异度及准确度分别为93.2%(69/74)、83.9%(26/31)及90.47%(95/105);通过二联及三联的方法进行判定,对乳腺癌骨转移诊断的准确度均有所提高,而WBS联合血清CA15-3、CEA、ALP诊断乳腺癌骨转移的敏感度、特异度及准确度分别为达到了98.6%(73/74)、87.1%(27/31)及95.2%(100/105),见表3。经ROC曲线分析,联合检测区曲线下面积(AUC)为0.932,高于其他单独、二联及三联检测(P<0.05)。见图3。
3 讨论
GLOBOCAN 2012统计数据显示乳腺癌是中国女性最常见的癌症,而全球每年将近有170万女性被诊断为乳腺癌,其中有522 000例乳腺癌相关的死亡。自2008年以来乳腺癌的发病率及其病死率增加了将近18%。2013年,美国女性侵袭性乳腺癌新发病例数约232 340余例,死亡病例数39 620余例[4]。我国女性乳腺癌的发病率和病死率虽然低于世界其他国家的平均水平,但近几年的发病率明显提高[5]。1988—2007年这不到20年的时间里,我国女性罹患乳腺恶性肿物的粗发病率增长了1.2~2.8倍[6]。
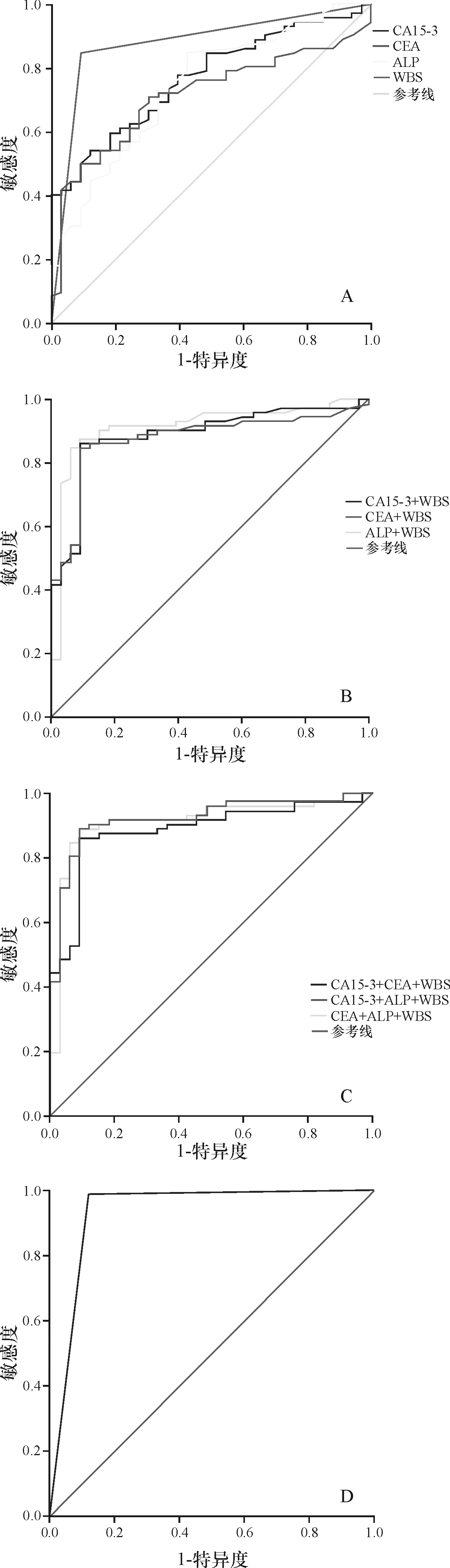
A:单一指标检测诊断乳腺癌骨转移的ROC曲线;B:二联检测诊断乳腺癌骨转移的ROC曲线;C:三联检测诊断乳腺癌骨转移的ROC曲线;D:四联检测诊断乳腺癌骨转移的ROC曲线

表3 血清CA15-3、CEA、ALP诊断乳腺癌骨转移的ROC曲线分析
肿瘤标志物是在癌细胞生长过程中,由癌细胞本身或机体对癌细胞产生应答而产生的,可以反映癌细胞存在和生长的一类生物分子,它对肿瘤的诊断、筛查以及预后监测等方面有十分重要的价值[7-8]。然而目前发现的肿瘤标志物虽然多达数十种,但是单一的肿瘤标志物诊断恶性肿瘤的敏感度及特异度较低。国内外多采用多种肿瘤标志物联合检测进行综合评价,来诊断乳腺癌及判断转移、复发和疗效评价[9]。目前临床上采用的诊断乳腺癌的肿瘤标志物有CEA;糖蛋白抗原(CA),主要为CA125、CA15-3及CA199。CA15-3、CEA与乳腺癌的发生、发展有一定的相关性,对乳腺癌骨转移有一定的预测价值[10]。CEA是一种具有人类胚胎抗原决定簇的酸性球蛋白,通常存在于3~6个月的正常胎儿消化道内皮细胞,正常人体内含量甚少,而患癌后重新出现,是预示和监测肿瘤复发和转移的灵敏、可靠的指标。有文献指出,CEA与CA15-3联合检测可提高诊断符合率[11]。CA15-3来源于乳汁脂肪酸以及乳腺细胞癌细胞,是一种乳腺细胞表面糖蛋白变异体,与乳腺癌、肺癌及胰腺癌等恶性肿瘤相关。CA15-3是目前国内外公认对乳腺癌诊断最佳肿瘤标志物,可用于乳腺癌疗效评价及复发、转移检测[12]。本研究CA15-3诊断乳腺癌骨转移的敏感度和特异度分别为68.9%和77.4%,CEA的敏感度和特异度分别为54.1%和87.1%,发生骨转移患者血清CA15-3和CEA水平明显高于未发生骨转移组,且随着全身骨转移分级的升高,骨转移病灶数目的增多,CA15-3和CEA水平亦有明显升高,说明CA15-3、CEA与全身骨扫描均具有不同程度诊断乳腺癌骨转移的临床价值。
血清ALP是一种能够将对应底物去磷酸化的酶,它广泛分布于骨骼(成骨细胞)和肝脏等组织当中。ALP主要由成骨细胞分泌,当骨折、骨关节炎、骨代谢病及恶性肿瘤骨转移等疾病造成骨骼损伤时,成骨细胞会增加ALP的分泌以促进磷酸盐沉积,进而加快骨骼修复的速度,在此过程中血清ALP一直处于较高的水平。本研究发现,乳腺癌骨转移患者血清ALP水平高于未发生骨转移组,且骨转移分级与ALP水平成正比,因此ALP水平可作为诊断乳腺癌患者是否发生骨转移及判断疗效及预后的指标。
骨是晚期乳腺癌最常见的转移部位,全身骨扫描在癌症患者的治疗过程中应用最为频繁[13]。全身骨扫描作为核医学科应用最多、最广泛的检查项目[14],因其拥有敏感度高的特点,可以早期探查到骨转移灶,是诊断患者骨转移的首选影像检查方法。但是骨扫描也存在特异度低的特点,几乎所有的骨骼疾病都会在扫描图像上出现异常的显像剂摄取增高影。WBS对骨转移只能起到粗筛的作用[15]。严清波等[16]对250例可疑转移性骨病变和不明原因骨痛的患者行全身骨扫描后回顾性分析,发现全身骨扫描的假阳性率可达18.4%。故在临床日常诊治过程中,往往需要结合其他检查方式来确定骨转移的发生。而随着计算机诊断方式、方法的不断进步,乳腺癌骨转移检出的敏感度及准确度有所提升。最近有日本学者通过WBS的平面成像(PI)联合计算机辅助诊断系统(CAD)获得的图像(VSBONE)对乳腺癌骨转移进行诊断,使得骨转移诊断的准确度有所提高,但仍需对CAD系统进行改进,以减少假阴性[17]。研究通过联合检测的方法,提高了对乳腺癌骨转移的敏感度及准确度。本研究显示单纯检测血清CA15-3、CEA、ALP的敏感度为68.9%、54.1%及58.1%,通过WBS与以上肿瘤标志物二联及三联的方法进行判定,对乳腺癌骨转移诊断的准确度均有所提高,而WBS联合血清ALP、CA15-3、CEA检测的敏感度可达到98.6%,准确度达到95.2%,均明显高于单独、二联及三联检测血清学结果。
综上所述,WBS联合血清CA15-3、CEA、ALP检测,可以提高乳腺癌骨转移的检出率,为一线临床科室早期诊断乳腺癌骨转移提供辅助依据,综合分析后以便制定更加合理的治疗方案,提高疗效。
