我院近六年348例医疗器械不良事件报告分析
2019-09-09赵亚丽殷志红刘小华韩凯谭梦轩
赵亚丽,殷志红,刘小华,韩凯,谭梦轩
长沙市第四医院 a. 设备科;b. 人事科,湖南 长沙 410006
引言
如何有效控制医疗风险,保证公众医疗安全,一直都是国内外医疗器械研发、生产、监管和使用部门的首要工作[1-2]。早在20 世纪80 年代美国、欧盟、日本等发达国家便陆续开始重视此项工作,并建立报告和监管制度[3]。相比而言,我国是在2000 年左右逐步形成全国统一的组织监管体系,并强化对医疗器械的执法职能[4]。我国药品不良反应监测中心自2002 年到2016 年共计收到167.53 万份可疑医疗器械不良事件报告[5]。大量翔实的数据和分析,从侧面也反映了近些年我国在医疗器械不良事件报告现状监测工作正在逐步改善和提升。我院是市属公立三级医院,2012 年5 月正式成立医疗器械不良事件领导小组。2012 年至2017 年共计收到348 例医疗器械不良事件,有必要对近几年的数据进行统计分析,并对医疗器械不良事件的风险监管进行思考[6-8]。
1. 我院医疗器械不良事件报告情况
1.1 近六年报告数趋势
本文主要利用Excel 软件进行汇总统计,按年份逐张录入每例报告所属医疗器械分类名称、事件表现、信息未填项等,并采用Origin 软件绘图。图1 中曲线图为2012 年至2017年我院医疗器械不良事件报告数的趋势图。近六年我院共有效上报348 例不良事件。2012 年上报例数为18 例,2017 年上报例数为91 例。从2014 年开始每年报告数均在60 例以上。
1.2 报告人员岗位分布
图1 中饼状图体现了上报人员岗位分布情况。根据报告人员岗位进行统计,护士报告的数量是303 例,占总报告数87.07%;医生报告的数量是36 份,占总报告数10.34%;技师报告的数量是9 例,占总报告数2.59%。
1.3 涉及器械分类数量及构成比
根据国家食品药品监督总局2017 年第104 号发布的修订版《医疗器械分类目录》进行归类[9],我院近六年医疗器械不良事件报告共涉及15 类产品。表1 具体统计了每例报告的医疗器械分类名称、事件表现及事件数等。其中,报告数量位列前五位的依次是注输、护理和防护器械(包含注射器、输液器具及管路、引流容器、医护用品等);医用诊察和监护器械(包含病人监护设备、遥测和中央监护设备、心电电极片等);呼吸、麻醉和急救器械(包含呼吸机、呼吸管路、通气用气管插管等);临床检验器械(包含动静脉采血容器、血球分析仪等);物理治疗器械(包含磁疗机、低温治疗仪等)。相应事件数及构成比为分别为200例(57.47%)、50 例(14.37%)、22 例(6.32%)、18 例(5.17%)和13 例(3.74%),共303 例,占总报告数的87.07%。
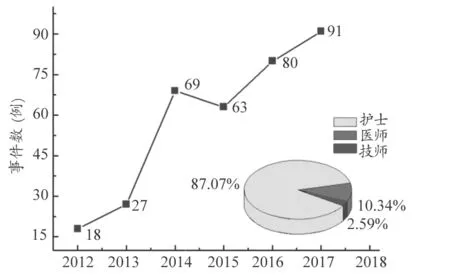
图1 2012~2017年我院医疗器械不良事件报告情况
1.4 按报告表中填写项缺失统计情况
报告表中填写项信息准确度和完整度直接影响着医疗器械不良事件的客观分析、后期追踪以及报告表的质量评估[10]。结合国家药品不良反应监测中心于2016 年6 月6 日颁发的《医疗器械不良事件报告表质量评估规定(试行)》(监测与评价械〔2016〕25 号),图2 对近六年报告表中13 项所占报告数量较高的必填项和非必填项缺失情况做了详细统计。其中必填项中缺失项按报告数量由高到低依次为注册证号(8分)、初步处理(2 分)、产品批号或编号(4 分)、事件表现(10 分)和事件陈述(22 分);非必填项缺失项按数量由高到低依次是患者电话(0 分)、预期作用(4 分)、原因分析(4分)、生产日期(1 分)、企业电话(0 分)、型号规格(4 分)、有效日期(2 分)、生产企业(4 分)。总体来看,患者电话、预期作用、注册证号、原因分析和生产日期缺失的报告数量排在前五位,分别为116、112、87、82 和78 例。
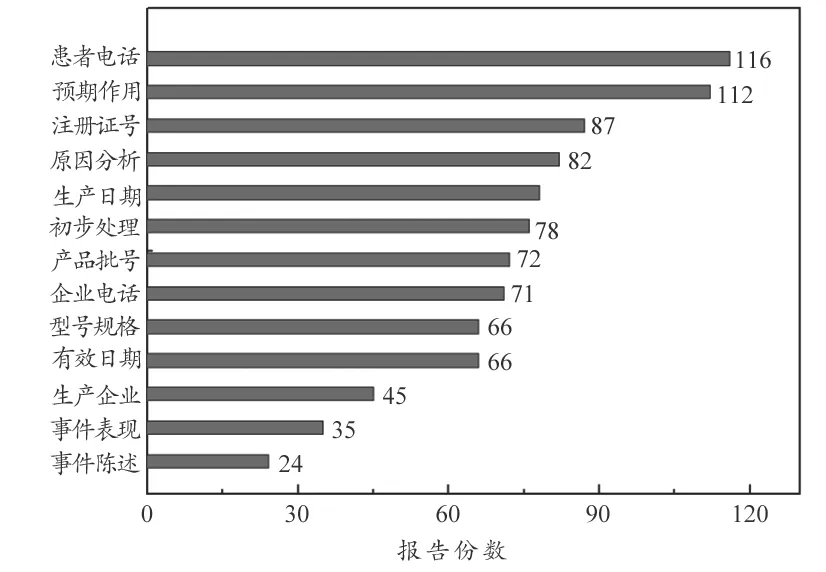
图2 报告表内容填写缺失项统计图
2 讨论
2.1 结果分析
从2012 年到2017 年我院医疗器械不良事件报告例数基本保持上升趋势。尤其从2014 年开始上升比例最明显,2014 年比2013 年增加155.56%,2017 年共上报91 例,比2016 年增长了13.75%。
护士、医师、技师均参与不良事件报告中,但护士报告的数量占大多数,医师和技师的报告数占总报告数仅12.93%。由护士报告的不良事件数每年均占主导地位,这也与护士是医疗器械日常监管和使用的主体有关。
报告中医疗器械类别涵盖广泛,共有15 类。整体排名及种类与2016 国家药品不良反应监测年度报告中基本保持一致[5]。发生不良事件的概率较高的大都属于使用量大或使用频率高的医疗器械。涉及的主要表现包含输液器的针头缺失、连接不紧,注射器内有异物、针头变形,过敏致局部反应,器械使用中故障、破损等。
本文结合《报告表质量评估规定》及缺失较多的填写项一共统计了13 处项目缺失情况,其中包含注册证号、初步处理、产品批号或编号、事件表现和事件陈述五处必填项。从2012 年到2017 年,每年报告中五处必填项填写完整率依 次 为16.67%、40.74%、50.72%、58%、55%、49.45%。从数据分析可以看出报告质量仍存在波动。2012 年到2015年呈稳定增长趋势;然而由于2016 年和2017 年报告的基数较大,出现了小幅度下降趋势。

表1 不良事件涉及器械分类、事件表现、事件数及构成比
不良事件报告数的逐年升高,器械种类涉及面多,以及表中必填项内容完整率提升等现象,与近几年院内不良事件上报流程转变和宣传培训增多等改善工作密不可分。具体表现如下:
(1)上报方式和审批流程转变。从2016 年8 月起由原先打印纸质报告表手工填写转变为院内办公系统在线直报,并直接层层发送至各领导审批,大大提高上报效率(从原先最快3 天可缩短至0.5 天),并避免手写字迹潦草和不清晰引起网报错误。
(2)宣传力度和培训方式增加。建立临床科室设备专干微信群,不定期宣传相关知识;并将医疗器械不良事件上报作为近两年设备专干年度会议的重点之一,着重传达上报范围、流程及规范、当年上报情况等,确保报告内容的准确性、完整性和时效性。
2.2 存在的问题
整体来看,目前我院医疗器械不良事件上报和监管工作处在萌芽期,仍存在许多问题需要改善。
(1)医师和技师报告份数占少数。每年的上报人员大部分由护士上报,医师和技师的上报意识和参与感有待加强。
(2)严重事件报告为零。近六年348 份医疗器械不良事件报告均属一般性的事件报告,没有出现危及生命、导致机体功能和结构永久性伤害或损伤以及必须采取医疗措施才能避免伤害或损伤的严重事件报告。
(3)报告大部分集中在某几类器械种类,报告质量有待提高。如注输、护理和防护器械类报告有200 份,占总报告数的57.47%。常用且使用量大的医用耗材报告率高于医用电子设备。存在报告内容重复、漏报,填报项错误、缺失、不规范等现象。对于注册证号、产品批号或编号、事件陈述等填写项信息缺失较多,影响上报以及后期问题事件追溯。
3 建议
医疗机构始终是医疗器械使用的主体,其在不良事件监测管理工作中占据重要地位[11-12]。为防止相关伤害事件重复发生和蔓延,保障临床工作安全有效运转,建议从以下方面进行改进:
(1)健全医疗器械不良事件监管体系,逐步引入信息化管理。一个健全的管理体系对医疗器械不良事件监管工作至关重要[13-14]。建议医院监管部门之间应定期面对面沟通,就严重或涉及范围广的医疗器械不良事件及时制定解决方案,深化制度的执行。同时应与省市和国家上级管理部门加强交流,做好有效连接,建立便捷完整的反馈体系。为提高监管工作效率,需逐步引入信息化管理并加快机制建设,通过信息化技术建立有效的医疗器械市场监管信息网络,实现信息资源共享。尽量避免报告与监管工作常流于形式。
(2)加强医务人员参与感,保证报告的质量。利用网络群、办公系统、面对面交流等方式让医务人员明确医疗器械不良事件的基本概念、报告范围、填写规范、应急处理等认识,改善报告的质量,避免有价值的报告流失。对于频繁发生或特别严重的医疗器械不良事件,应将此类经验教训作为典型教材,在全院引起重视。
(3)根据发生的不良事件从源头上解决问题。建议生产企业在产品的设计、生产及出厂前严格按照相关国家标准和行业标准,保证生产质量,降低产品的不合格率。同时要完善产品(尤其是进口产品)的说明书,关注产品上市后安全信息,提高产品临床使用的安全性和有效性。医院采购部门可根据发生过不良事件的医疗器械,建议企业的不良记录,减少或者避免同类的医疗器械不良事件的发生,避免不合格产品对医院经济成本的损失。
(4)使用科室和管理部门加强抽查和巡检工作。预防和避免使用过程中器械故障对患者造成二次伤害,例如对于过敏体质患者使用的心电电极片,应增加更换和护理的频率。设备管理部门应积极配合使用科室加强医疗器械的日常检查和维护保养,保证运行环境要求,增加对易老化、易损耗部件状态的监测,发现磨损老化等情况,立即停止使用并更换。加强和完善医务人员的管理和培训,规范各项操作规程和使用注意事项,正确熟练地使用医疗器械,减少因操作不当引起的不良事件。
4 总结
使用群体对医疗器械不良事件的认知界定和上报意识的加强,报告质量的提升,以及监管体系和制度的合理化和完善化,目前都是我院需努力的方向。当前我国医疗器械不良事件监测管理体系,与欧美等发达国家相比,仍存在一定差距,需进一步努力和完善[15-16]。在制度建设的不断深化和改革中,不但要注重专业人员的培训和管理,多与相关部门交流学习,借鉴国内外优秀的管理案例,还需要医疗机构、生产厂商及监管部门等共同参与到监管活动中,形成统一战线,保障公众用械安全[17]。
