新一代抗癫痫药对新生大鼠脑发育的影响
2019-09-07徐晓科蔡方成
徐晓科,蔡方成
(1.西安市儿童医院神经内科,陕西 西安 710002;2.重庆医科大学附属儿童医院神经内科,重庆 400014)
研究显示,常用的治疗新生儿惊厥药物如苯巴比妥、地西泮、苯妥英无论单药还是联合用药对健康新生大鼠脑发育均有不同程度的影响,尤其联合用药可导致持久难以恢复的脑损伤[1]。与传统药物相比,新一代抗癫痫药(antiepileptic drugs,AEDs)如奥卡西平(oxcarbazepine,OXC)、左乙拉西坦(levetiracetam,LEV)、托吡酯(topiramate,TPM)等具有毒副作用低、耐受性好、疗效与传统药物相当等优势。为此,专家们呼吁应积极探索新一代AEDs治疗新生儿惊厥的疗效和安全性[2]。动物实验已证实,治疗剂量的LEV和TPM不存在致新生大鼠脑组织损伤的危险性[3-4]。近年来,越来越多的临床医生将新一代AEDs用于新生儿惊厥的抢救,且取得了一定疗效[5]。BLUME等[6]对美国31家儿童医院的调查发现,6 099例新生儿惊厥患儿中有28例应用OXC,28例应用TPM,22例应用LEV进行治疗。目前,尚未见到关于OXC对未成熟脑发育影响的实验研究报道,更缺少有关苯巴比妥(phenobarbitone,PB)等传统一线AEDs治疗无效基础上加用新一代AEDs对脑损伤影响的观察。因此,本研究选用以OXC、TPM、LEV为代表的新一代AEDs,按照新生儿惊厥急救时的临床用药剂量换算大鼠剂量,观测单药或联合用药对新生大鼠脑发育的影响。
1 材料与方法
1.1 实验动物及分组健康清洁级7日龄Wistar大鼠270只(由第三军医大学附属大坪医院实验动物中心提供),雌雄各半。将大鼠随机分为对照组、OXC30组、OXC60组、TPM组、LEV组、PB组、PB+OXC30组、PB+TPM组和PB+LEV组,每组30只。
1.2 药物、试剂与仪器TPM片(西安杨森制药有限公司,国药准字 H20020555),OXC口服混悬液(瑞士Novartis公司,国药准字 H20080626),LEV片(比利时UCB公司,国药准字 H20091018);伊红、苏木精(美国Sigma公司),碳酸锂(重庆东方试剂厂),硫瑾(国药集团化学试剂有限公司);A-120-Csi电子天平(西班牙COBOS公司),TDx荧光偏振免疫测定仪(美国Abbott公司),COVER-015光学显微镜(日本Olympus公司),石蜡切片机、Leica照相系统(德国Lica公司),Image-Pro Plus图像处理分析软件(美国Media Cybernetics公司)。
1.3 各组大鼠干预措施新生儿惊厥临床抢救中OXC、TPM、LEV的负荷剂量分别为60、10、60 mg·kg-1。各组大鼠给药剂量依据人与大鼠间药物剂量体表面积换算公式[7]及相关文献[3-4]进行确定。OXC30组、OXC60组、TPM组、LEV组及PB组大鼠分别灌胃给予OXC 187.5 mg·kg-1(相当于临床剂量30 mg·kg-1)、OXC 375.0 mg·kg-1(相当于临床抢救剂量60 mg·kg-1)、TPM 62.5 mg·kg-1(相当于临床抢救剂量 10 mg·kg-1)、LEV 375.0 mg·kg-1(相当于临床抢救剂量60 mg·kg-1)、PB 62.5 mg·kg-1(相当于临床抢救剂量10 mg·kg-1);PB+OXC30组、PB+TPM组、PB+LEV组大鼠腹腔注射PB 62.5 mg·kg-1,4 h后,再分别灌胃OXC 187.5 mg·kg-1、TPM 62.5 mg·kg-1、LEV 375.0 mg·kg-1;对照组大鼠腹腔注射生理盐水0.1 mL。新生儿惊厥实际临床治疗中均应用负荷剂量PB,若无效则采取负荷剂量OXC,预实验过程中发现PB联合较大剂量OXC(60 mg·kg-1)时新生大鼠死亡率过高,故本实验中PB联合用药采用较低剂量OXC(187.5 mg·kg-1)。
1.4 各组新生大鼠体质量和脑质量测定给药前各组取10只新生大鼠,准确称体质量,精确至0.01 g。给药后24 h给予100 g·L-1水合氯醛(3 mL·kg-1)麻醉新生大鼠,再次称体质量。心脏取血200~300 μL,断头取脑(取自额极向后约3~5 mm,位于视交叉和乳头体间含海马的脑组织),纱布沾净表面血渍,电子天平称脑质量,精确至0.001 g。
1.5 各组新生大鼠脑组织病理组织学观察给药后24 h,各组取10只大鼠给予100 g·L-1水合氯醛(3 mL·kg-1) 进行麻醉,心脏取血 200~300 μL(备用),继之以生理盐水和40 g·L-1多聚甲醛先后进行组织灌流固定。断头取脑,40 g·L-1多聚甲醛固定24 h脱水,石蜡包埋,选择5 μm厚度冠状面连续切片,分别行苏木精-伊红(hematoxylin-eosin,HE)染色、尼氏染色,光镜下观察脑组织颞叶皮层及海马神经元尼氏体病变情况。
1.6 各组大鼠学习记忆能力测试各组大鼠给药后,分配母鼠喂养,每只母鼠喂养7只,直至出生第21天断奶并饲养于标准饲养笼内,出生第23天起接受Morris水迷宫空间记忆能力的训练。采用定位航行试验检测大鼠的学习记忆能力。出生第23天让大鼠自由游泳2 min,为水迷宫测试做准备。从第2天起、即出生第24天,每日上午8点开始训练,共训练4次,每次从不同点入水,记录大鼠寻找并爬上平台所需时间 (即寻台潜伏期),连续5 d。如果大鼠在60 s内未找到平台,潜伏期记为60 s。空间探索试验测量大鼠的空间位置记忆能力,于定位航行实验结束后次日上午(出生第29天)撤除平台,统一选择第3象限池壁中点作为入水点,将大鼠面向池壁放入水中,记录在60 s内跨过该象限平台相应位置的次数。
1.7 各组成年大鼠脑组织病理学观察Morris水迷宫测试完成后次日(出生第30天)按照1.4方法取大鼠脑组织。分别行HE、尼氏染色。尼氏染色的切片在400倍光镜下摄像,进行颞叶皮层及海马下托复合体神经细胞计数。
2 结果
2.1 各组新生大鼠体质量及脑质量比较结果见表1。给药前各组大鼠体质量比较差异无统计学意义(P>0.05);给药后24 h,OXC60组、PB+OXC30组、PB+TPM组、PB+LEV组和PB组大鼠体质量均低于对照组,差异有统计学意义(P<0.05);OXC30组、TPM组、LEV组与对照组大鼠体质量比较差异无统计学意义(P>0.05)。PB+OXC30组、PB+TPM组、PB+LEV组与PB组大鼠体质量比较差异均无统计学意义(P>0.05)。
OXC60组、PB+OXC30组大鼠脑质量显著低于对照组,差异有统计学意义(P<0.05);其余各给药组与对照组大鼠脑质量比较差异均无统计学意义(P>0.05)。PB+OXC30组、PB+TPM组、PB+LEV组与PB组大鼠脑质量比较差异均无统计学意义(P>0.05)。
表1 9组新生大鼠脑质量及体质量比较
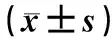
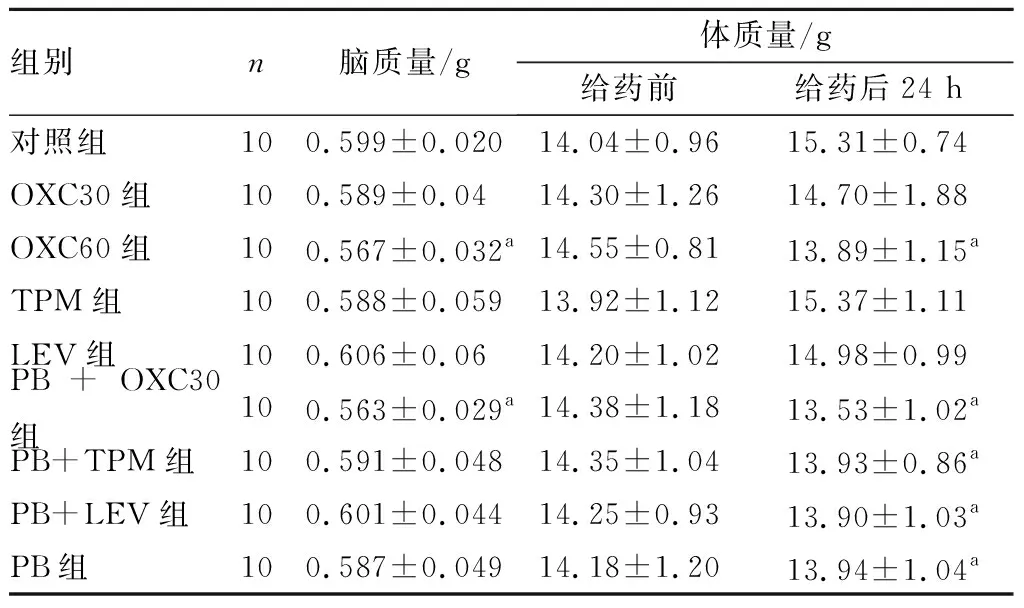
组别n脑质量/g体质量/g给药前给药后24 h对照组100.599±0.02014.04±0.9615.31±0.74OXC30组100.589±0.0414.30±1.2614.70±1.88OXC60组100.567±0.032a14.55±0.8113.89±1.15aTPM组100.588±0.05913.92±1.1215.37±1.11LEV组100.606±0.0614.20±1.0214.98±0.99PB+OXC30组100.563±0.029a14.38±1.1813.53±1.02aPB+TPM组100.591±0.04814.35±1.0413.93±0.86aPB+LEV组100.601±0.04414.25±0.9313.90±1.03aPB组100.587±0.04914.18±1.2013.94±1.04a
注:与对照组比较aP<0.05。
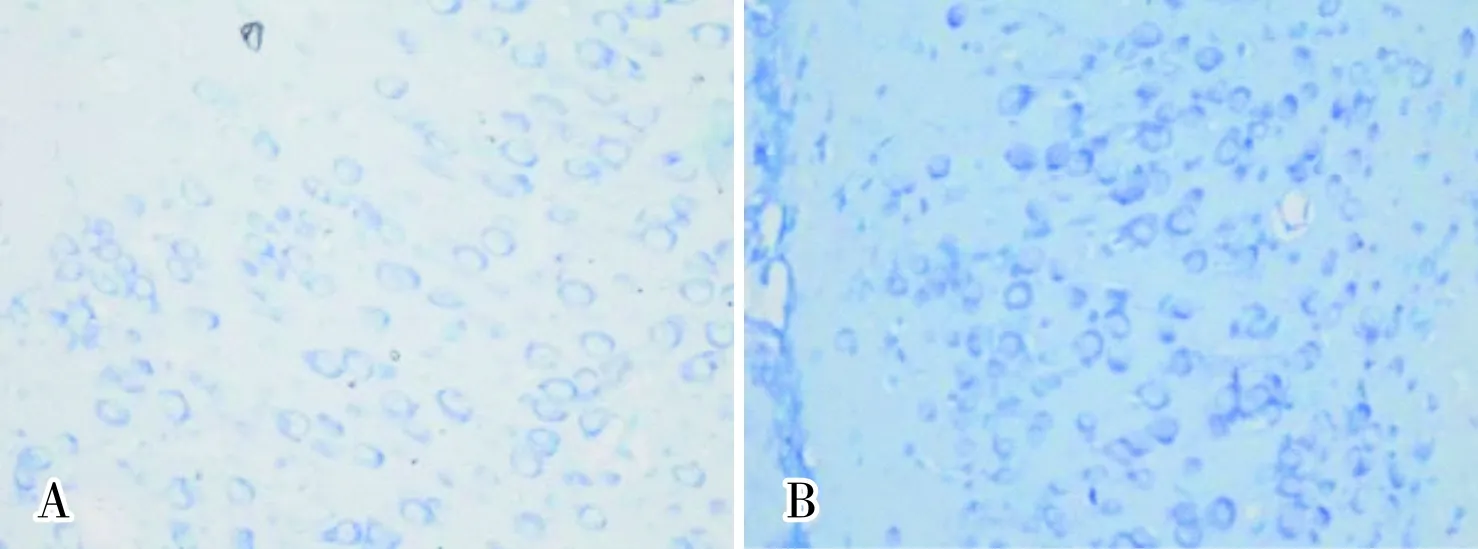
2.2 给药后24 h各组大鼠脑组织病理学改变HE染色结果显示,对照组大鼠脑组织颞叶皮层及海马各区均未见明显结构性异常,神经细胞分布均匀,边界清晰,胞质嗜酸性,着色均匀,胞核大、规则、圆形或椭圆形,染色深蓝,呈嗜碱性,染色质分布均匀,核仁明显(图1A);各给药组大鼠脑组织颞叶皮层结构未见明显异常。OXC60组、PB组、PB+OXC30组、PB+TPM组及PB+LEV组大鼠脑组织海马下托复合体出现部分细胞核固缩、深染,核周空泡,细胞皱缩等病理改变(图1B)。PB+OXC30组大鼠脑组织海马下托大部分神经细胞胞质浓缩变暗,体积缩小,胞膜皱缩,呈三角形或不规则形态(图1C),且其病变严重程度明显大于PB组;PB+TPM、PB+LEV组与PB组大鼠脑组织病理学变化基本一致;OXC30、TPM、LEV组大鼠脑组织海马下托均未见明显病理学改变(图1D)。
尼氏染色结果显示,对照组大鼠脑组织颞叶皮层及海马各区结构完整,神经细胞层次清晰,胞质内尼氏小体着色均匀,呈蓝紫色小颗粒状(图2A)。OXC30组、TPM组和LEV组大鼠脑组织颞叶皮层、海马各区未见明显异常,尼氏小体分布、着色基本均匀(图2B)。OXC60组与PB+OXC30组、PB+TPM组及PB+LEV组大鼠脑组织颞叶皮层可见少数神经细胞尼氏小体减少,部分溶解消失(图2C)。OXC60组大鼠海马下托可见部分神经细胞胞体及轴丘内尼氏体减少、移位,甚至溶解、消失,表现为细小颗粒状淡蓝染物质,甚至无小颗粒蓝染物质(图2D);PB组大鼠海马下托可见尼氏小体减少,部分溶解(图2E),PB+OXC30组(图2F)大鼠脑组织病理学改变明显重于PB组;PB+TPM、PB+LEV组大鼠脑组织病理学改变与PB组基本一致。
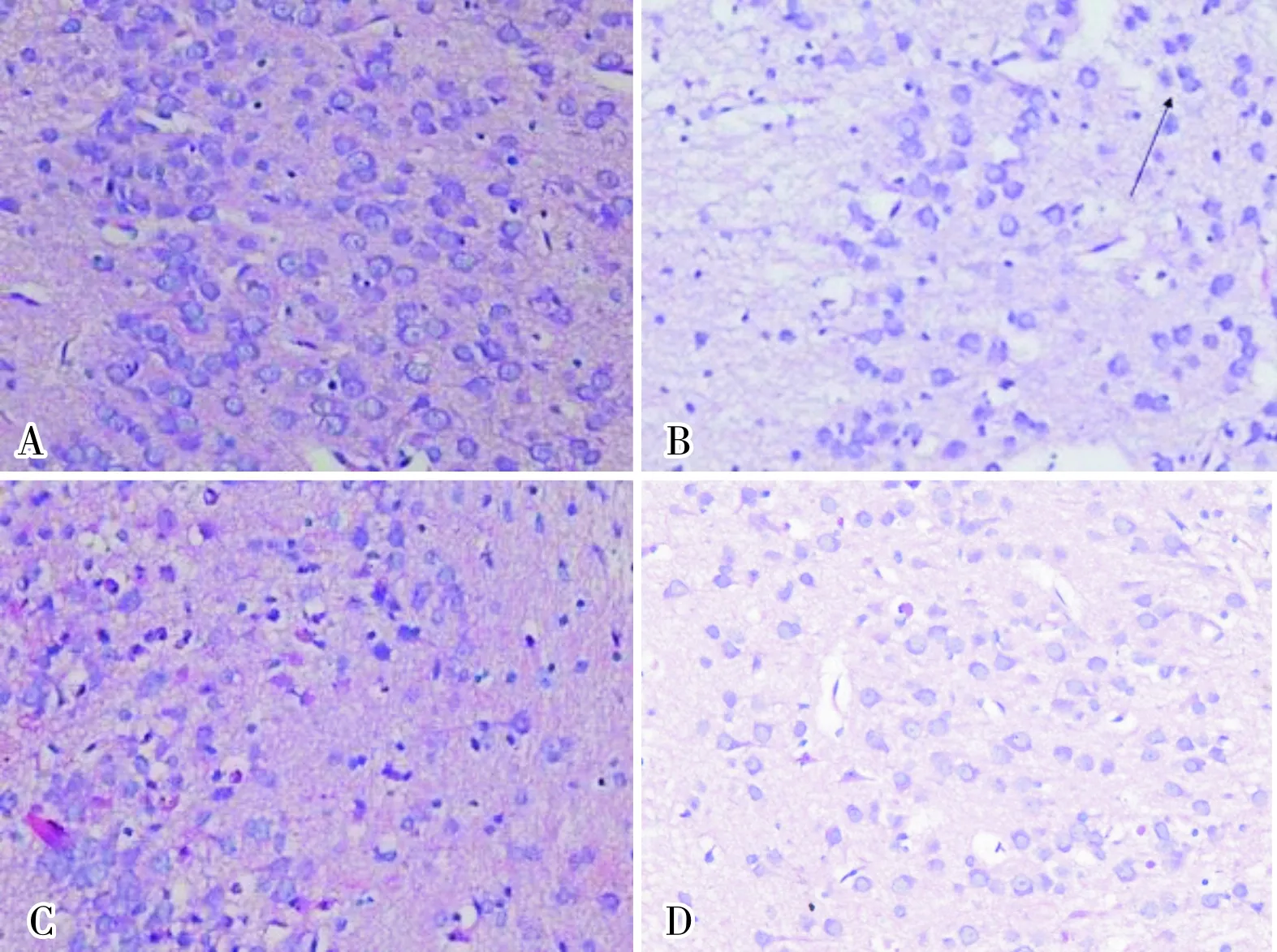
A:对照组;B:PB组;C:PB+OXC30组;D:OXC30组。
图1 各组大鼠给药后24 h脑组织海马下托病理学改变(HE染色,×400)
Fig.1 Brain histopathological changes of rats in each group at 24 hours after administration(HE staining,×400)
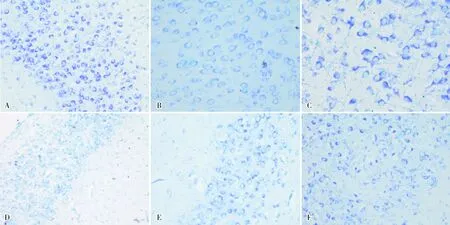
A:对照组大鼠海马下托;B:LEV组大鼠海马下托;C:OXC60组大鼠颞叶皮层;D:OXC60组大鼠海马下托;E:PB组大鼠海马下托;F:PB+OXC30组大鼠海马下托。
图2 各组大鼠给药后24 h脑组织病理学改变(尼氏染色,×400)
Fig.2 Brain histopathological changes of rats in each group at 24 hours after administration(Nissl′s staining,×400)
2.3 各组大鼠空间学习记忆能力比较结果见表2。OXC60组和PB+OXC30组大鼠穿越平台次数少于对照组,差异有统计学意义(P<0.05)。OXC30组、TPM组、LEV组、PB组、PB+TPM组和PB+LEV组与对照组大鼠穿越平台次数比较差异无统计学意义(P>0.05);PB+OXC30组、PB+TPM组和PB+LEV组与PB组大鼠穿越平台次数比较差异无统计学意义(P>0.05)。
各组大鼠寻台潜伏期随训练时间延长而呈下降趋势,第1、2、3、4天,各给药组大鼠寻台潜伏期与对照组比较差异均无统计学意义(P>0.05)。PB+OXC30组大鼠第5天寻台潜伏期长于对照组,差异有统计学意义(P<0.05),其余各给药组大鼠第5天寻台潜伏期与对照组比较差异均无统计学意义(P>0.05)。第1、2、3、4、5天,PB+OXC30组、PB+TPM组、PB+LEV组与PB组大鼠寻台潜伏期比较差异无统计学意义(P>0.05)。
表2 9组大鼠穿越平台次数及寻台潜伏期比较
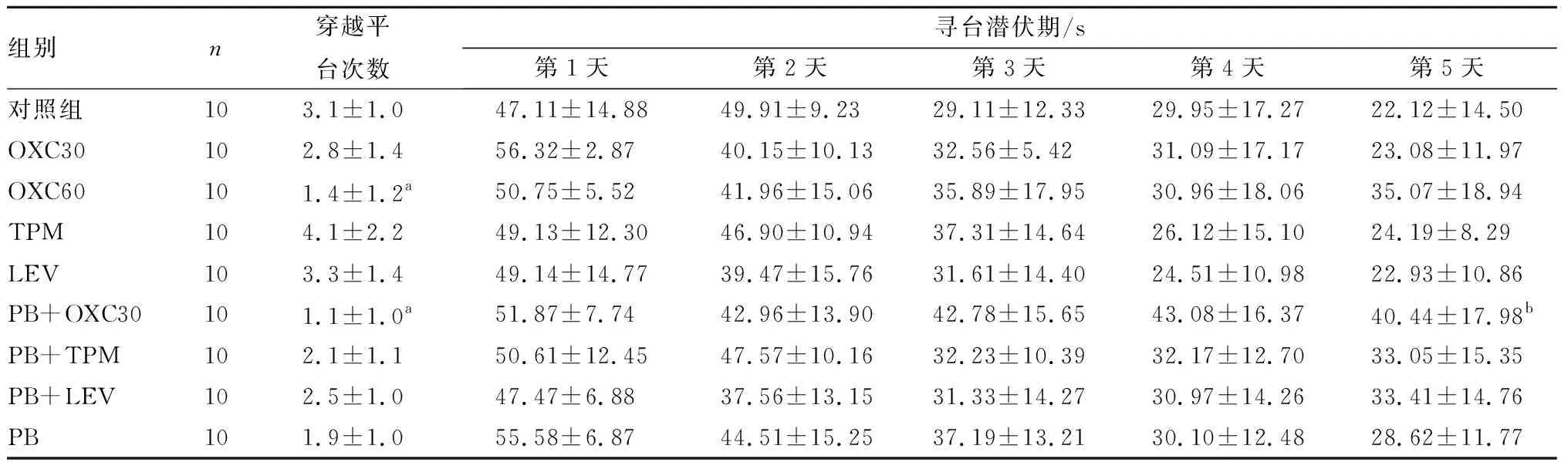
组别n穿越平台次数寻台潜伏期/s第1天第2天第3天第4天第5天对照组103.1±1.047.11±14.8849.91±9.2329.11±12.3329.95±17.2722.12±14.50OXC30102.8±1.456.32±2.8740.15±10.1332.56±5.4231.09±17.1723.08±11.97OXC60101.4±1.2a50.75±5.5241.96±15.0635.89±17.9530.96±18.0635.07±18.94TPM104.1±2.249.13±12.3046.90±10.9437.31±14.6426.12±15.1024.19±8.29LEV103.3±1.449.14±14.7739.47±15.7631.61±14.4024.51±10.9822.93±10.86PB+OXC30101.1±1.0a51.87±7.7442.96±13.9042.78±15.6543.08±16.3740.44±17.98bPB+TPM102.1±1.150.61±12.4547.57±10.1632.23±10.3932.17±12.7033.05±15.35PB+LEV102.5±1.047.47±6.8837.56±13.1531.33±14.2730.97±14.2633.41±14.76PB101.9±1.055.58±6.8744.51±15.2537.19±13.2130.10±12.4828.62±11.77
注:与对照组比较aP<0.01,bP<0.05。
2.4 给药后23 d各组大鼠脑组织病理学改变结果见图3、图4和表3。HE染色结果显示,对照组大鼠脑组织颞叶皮层及海马各区神经细胞分布均匀;神经细胞胞膜清晰,细胞质弱嗜酸性呈淡红色,多有突起;细胞核大而规则、呈圆形或椭圆形、位于细胞中央,弱嗜碱性呈淡蓝色,染色质分布均匀,核仁清晰可见(图3A)。OXC30组、TPM组、LEV组、PB+TPM、PB+LEV组均未见明显异常。PB+OXC30组大鼠颞叶皮层可见多数退行性变的红色神经细胞:其胞体异常增大,细胞质丰富,呈强嗜酸性深染,细胞核小且不规则,轮廓模糊,被细胞质所覆盖(图3B);海马下托神经元减少,胶质细胞相对增多(图3C)。OXC60组大鼠仅见海马下托细胞排列稍稀疏(图3D)。
尼氏染色结果显示,PB+OXC30组大鼠可见海马下托复合体细胞排列稍稀疏,胶质细胞相对增多(图4B);其余各给药组大鼠颞叶皮层结构尚完整,层次清晰,神经细胞胞质内有均匀的蓝染尼氏小体颗粒,未见明显的尼氏小体溶解现象,与对照组大鼠脑组织(图4A)比较无明显差异。
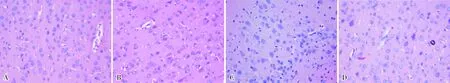
A:对照组;B:PB+OXC30组颞叶皮层;C:PB+OXC30组海马下托;D:OXC60组海马下托。
图3 给药后23 d大鼠脑组织病理学改变(HE染色,×400)
Fig.3 Brain histopathological changes of rats at 23 days after administration(HE staining,×400)
A:对照组海马下托;B:PB+OXC30组海马下托。
图4 给药后23 d大鼠脑组织病理学改变(尼氏染色,×400)
Fig.4 Brain histopathological changes of rats at 23 days after administration(Nissl′s staining,×400)
2.5 各组大鼠脑组织神经细胞计数比较结果见表3。各给药组与对照组大鼠颞叶皮层神经细胞计数比较差异均无统计学意义(P>0.05)。PB+OXC30组大鼠海马下托区神经细胞计数少于对照组,差异有统计学意义(P<0.05);其余各给药组与对照组大鼠海马下托区神经细胞计数比均差异无统计学意义(P>0.05)。PB+OXC30组、PB+TPM组、PB+LEV组与PB组大鼠海马下托区神经细胞计数比较差异无统计学意义(P>0.05)。
表3 9组大鼠脑组织神经细胞计数比较
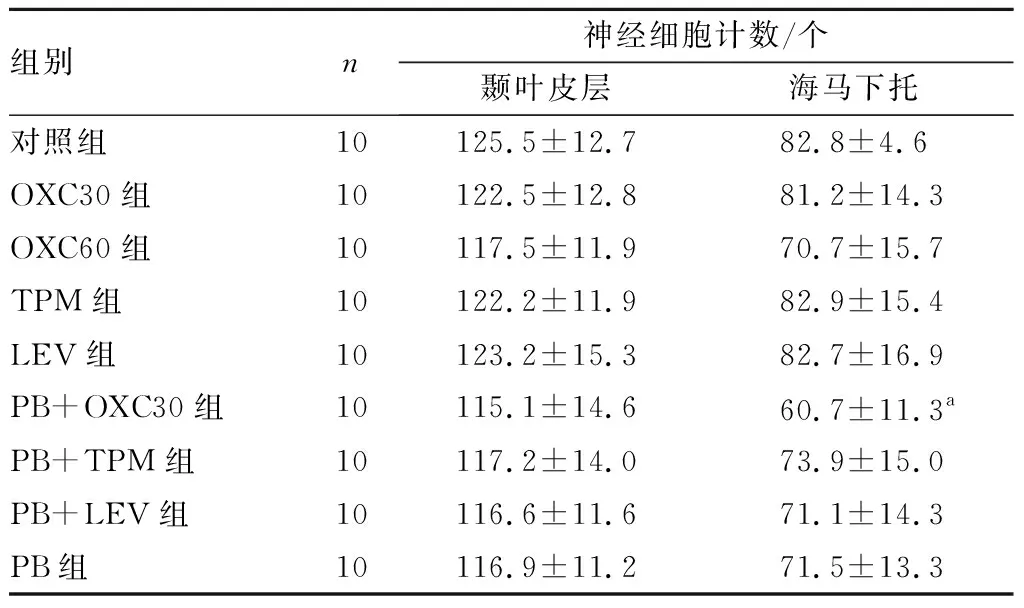
组别n神经细胞计数/个颞叶皮层海马下托对照组10125.5±12.782.8±4.6OXC30组10122.5±12.881.2±14.3OXC60组10117.5±11.970.7±15.7TPM组10122.2±11.982.9±15.4LEV组10123.2±15.382.7±16.9PB+OXC30组10115.1±14.660.7±11.3aPB+TPM组10117.2±14.073.9±15.0PB+LEV组10116.6±11.671.1±14.3PB组10116.9±11.271.5±13.3
注:与对照组比较aP<0.01。
3 讨论
为探索新一代抗癫痫药在新生儿惊厥急性期抢救中对脑发育的影响,本研究采用7日龄健康大鼠进行实验,以排除各种病理因素本身对药物性脑损伤结果的干扰。因OXC在大鼠体内的代谢与人类不同,大鼠体内存在高浓度的OXC原化合物,仅少数转化为10,11-二氢-10-羟基卡马西平(10,11-dihydro-10-hydroxycarbazepine,MHD),而OXC进入人体后立即转化为活性代谢产物MHD,因此,大鼠血清MHD浓度相对较低[9]。因为PB联合375.0 mg·kg-1剂量的OXC时,新生大鼠死亡率非常高,模型无法建立,所以本研究改为联合 187.5 mg·kg-1剂量的OXC。很遗憾未进一步追究其死亡原因及统计死亡率,为本研究的不足。
新生儿期是惊厥发生的高风险时期,美国新生儿惊厥发生率为1.8‰~3.5‰,早产儿则更高[10]。严重或反复的惊厥发作会导致惊厥性脑损伤,多数专家主张对新生儿惊厥应积极给予药物治疗[2]。目前,各国用于治疗新生儿惊厥的一线药物仍是PB、地西泮和苯妥英等传统AEDs,其中PB被列为首选用药[2,6,10]。本课题组前期研究显示,治疗剂量的PB、地西泮和苯妥英等药物均易导致新生大鼠脑损伤,且联合用药对长期学习记忆能力的影响更大[1]。近年来,广大学者呼吁积极开展新一代AEDs抢救新生儿惊厥。动物实验结果显示,无论长期或急救性用药,治疗剂量TPM不仅不会导致新生儿大鼠脑损伤或远期认知功能障碍,还对缺氧缺血的神经有保护作用[3,11-13]。本研究发现,TPM组大鼠体质量无明显下降,甚至还有些偏高,这与药物作用于人类截然相反,可能在大鼠体内存在与人类不同的其他的作用机制。LEV在任何剂量下都不会引起未成熟脑损伤[4,14]。尽管临床工作中已有医师将OXC用于难治性新生儿惊厥的抢救[6],但仍缺乏关于OXC对未成熟脑发育是否有损伤的实验研究。有研究经胃管给予成年大鼠 100 mg·kg-1OXC后引起海马区细胞丢失[15]和视网膜神经节细胞毒性损伤[16]。本研究结果表明,OXC对新生大鼠确实存在近、远期脑组织病理学和认知功能损伤的危险性,但187.5 mg·kg-1剂量的OXC并未引起新生大鼠明显脑损伤;当给予375.0 mg·kg-1剂量的OXC 24 h后,大鼠脑质量显著减轻并伴有明显脑内神经细胞减少,还导致大鼠远期(用药后23 d)大脑皮层神经细胞计数持续低下和视觉空间记忆功能减退,大鼠水迷宫寻台潜伏期显著延长,穿越平台次数明显减少,提示OXC脑损伤存在剂量依赖关系。AYALA-GUERRERO等[15]研究发现,应用 100 mg·kg-1剂量OXC即可导致成年大鼠脑损伤,与本研究结果不一致,具体原因尚不清楚。但AYALA-GUERRERO等[15]的研究中,曾反复腹腔注射戊巴比妥麻醉大鼠以完成脑电图、眼动图、肌电图检测及动物的处死,因此不能排除该麻醉剂本身或麻醉剂联合OXC导致脑损伤的可能性。
本课题组前期研究已证实,即使一次性使用治疗剂量的PB、DZP或PHT等传统AEDs,依然会导致健康新生大鼠脑损伤,PB+DZP或PB+PHT可明显加重此种损伤。同时,停药3周后海马神经细胞计数和Morris水迷宫学习记忆测试显示,PB+DZP或PB+PHT联合用药可导致大鼠持续性神经细胞显著减少和远期学习记忆功能低下,而单药使用时并未见此种远期伤害[1]。由于临床抢救中约50%新生儿惊厥可能面临2种以上AEDs联合治疗,且国内外绝大多数以PB为首选[2,6,10]。因此,在新一代AEDs被正式批准用于新生儿惊厥抢救的前后相当长时间里,将面临新一代AEDs与PB等传统AEDs联合用药问题。为此,本研究分别以OXC30、TPM和LEV单药为对照,重点观察PB联合抢救剂量的TPM、LEV和较低剂量OXC对新生大鼠脑发育的影响。HE与尼氏染色结果一致表明,小剂量(187.5 mg·kg-1)OXC、抢救剂量的TPM (162.5 mg·kg-1)和LEV (375.0 mg·kg-1),均未造成明显的脑组织病理损害,亦未造成远期的不良影响。而抢救剂量OXC、PB联合小剂量OXC均能引起海马下托复合体明显的组织病理学损伤,且以PB+OXC30组更为严重。抢救剂量的TPM、LEV则未加重PB所引起病理学损伤。经过连续3周的生长发育,PB+TPM组、PB+LEV组及OXC60组大鼠的大脑功能得到了一定的恢复。但PB+OXC30组大鼠脑损伤却难以恢复,虽未见明显的病理性损伤改变,但其颞叶皮层出现异常增多的红色神经细胞,且海马下托部的神经细胞数目显著减少,可能是学习记忆能力持续低下的原因。PB+TPM及PB+LEV联合用药,既未加重PB单药对新生大鼠脑损伤严重程度,也未出现LEV或TPM在其他实验中发现的脑保护作用。虽然单独使用低剂量OXC未见明显脑损伤,但与PB联合用药后存在明显的近远期损害;WANG等[17]研究显示,酶诱导剂抗癫痫药物(PB、卡马西平、苯妥英)和一些新一代AEDs(TPM、拉莫三嗪)能轻度升高OXC有效代谢产物MHD;TARTARA 等[18]报道OXC的新陈代谢中约30%是由PB诱导的。停药3周后(出生第30天)再测试,PB+OXC30联合用药组大鼠的颞叶皮层与海马神经细胞计数,以及水迷宫视觉空间记忆功能均明显低于PB和OXC30单药组。充分表明,即使较小剂量的OXC与PB一次性联用,也会明显加重PB单药引起的未成熟脑损伤,并可能对脑发育过程带来持久不良影响。
本研究揭示了新一代AEDs OXC存在剂量依赖性地致未成熟脑损伤可能性。OXC因其良好的临床疗效曾被美国神经学会和抗癫痫学会(2005年)列为儿童难治性部分性癫痫的推荐用药[19],因OXC存在对未成熟脑造成近期及远期损害的可能性,应谨慎用于新生儿和婴儿的临床治疗中,避免对发育脑造成药物性损害。考虑到未成熟神经细胞γ-氨基丁酸受体的反常性兴奋反应特征,在新生儿和婴儿抢救中,更要回避与PB或DZP等激活γ-氨基丁酸受体药物联合使用。LEV和TPM是当前最适合被推荐为用于新生儿惊厥抢救的新一代AEDs。在正式被认可前尚需要更多的临床与实验研究来验证其疗效及安全性。
