UGT1A1基因与伊立替康致结肠癌患者腹泻及中性粒细胞减少的关系分析
2019-09-07陈霁晖黄晓会李莉霞卜书红
陈 伦,陈霁晖,张 青,黄晓会,李莉霞,卜书红
0 引言
结肠癌是常见的消化道恶性肿瘤,好发于乙状结肠和直肠交界处,有较高的发病率和病死率。研究认为,肿瘤发生为多基因的病理反应[1]。近年来,随着分子遗传学、基因组学的快速发展,相关研究发现,肿瘤细胞基因型不仅参与肿瘤分化、增殖及预后,还与癌细胞对化疗药物的敏感性相关,基因预测化疗药物毒副反应备受临床关注[2]。伊立替康为中晚期结直肠癌的常用化疗药物,在肝脏内可快速水解为活性产物7-乙基-10-羟基喜树碱(SN-38),抑制DNA单链断裂后修复,影响DNA复制及转录,引起肿瘤细胞凋亡,从而起到治疗作用[3]。但SN-38主要通过尿苷二磷酸葡糖醛酸转移酶家族(UGTs)在肝脏中代谢,UGT1A1基因变异可降低UGT1A1表达,减少SN-38转化,增加伊立替康所致的不良反应[4-5]。既往研究报道,UGT1A1基因多态性和伊立替康所致的腹泻、中性粒细胞减少有一定关系[6],但此结论尚存争议。本研究旨在探讨UGT1A1基因与伊立替康致结肠癌患者腹泻及中性粒细胞减少的关系,从而指导临床个体化用药。
1 资料与方法
1.1 一般资料 收集我院2017年5月至2018年4月入院治疗的60例结肠癌患者,入选标准[7]:均经病理组织活检确诊为结肠癌;心肝肾等功能无明显异常;预计生存时间超过3个月;距离最近1次化疗或者手术时间超过4周;有可测量病灶。排除标准:接受放疗;其他恶性肿瘤病史;严重多器官功能障碍;消化道及黄疸梗阻;造血功能不全;妊娠或者哺乳阶段;既往接受过伊立替康治疗;本研究药物过敏禁忌证。男36例,女24例;年龄36~74岁,平均(60.35±9.38)岁;低分化腺癌23例,中、高分化腺癌37例。
1.2 治疗方法 患者入院后均采用伊立替康联合氟尿嘧啶治疗,静脉滴注125~180 mg/m2伊立替康,第1天;静脉滴注400 mg/m2氟尿嘧啶和亚叶酸钙200 mg/m2,第1~2天,1 600 mg/m2静脉泵注维持46 h,3周为1个周期,均治疗2~4个周期,患者出现严重不良反应时,暂停给药并给予对症治疗,待恢复至≤1级后再继续治疗,并将伊立替康剂量下调1个单位25 mg/m2。
1.3UGT1A1基因分型 收集患者治疗结束时外周静脉血3 ml,放置在抗凝管中,保存在-20 ℃低温冰箱中待检。取400 μl全血在2 ml离心管中,加入10 μl蛋白酶K、90 μl 10%异丙醇、410 μl STE溶液,摇晃2 min,放置在65 ℃水浴锅中消化过夜。在充分消化血样中加入300 μl饱和氯化钠溶液,混匀后加入400 μl氯仿,混合均匀后在20 ℃环境中,在12 000 r/min离心机下离心20 min。将上清液转移至1.5 ml离心管中,键入等体积的-20 ℃预冷异丙醇,混合均匀后,在4 ℃环境下离心15 min,除去上清液。在离心管中加入-20 ℃预冷75%乙醇溶液,按照以上离心条件离心15 min,去除上清液。并重复1次以上操作,室温条件下晾干沉淀,加入100 μl Mili-Q水解液进行沉淀。取1 μl DNA样本,取1%琼脂糖凝胶电泳检测样本质量,采用分光光度计测定样本浓度及纯度。取Mili-Q水稀释样本至10 ng/μl备用。参照Genbank的UGT1A1基因序列及配套软件设计UGT1A1基因药物遗传多态性位点特异性引物(UGT1A1*28:rs8175347,UGT1A1*6:rs4148323)。全部引物均由配套试剂盒提供,引物母液浓度为100 μmol/L,稀释所有引物为1~10 μmol/L备用。取人外周血DNA为模板进行PCR扩增反应,采用1.5%琼脂糖凝胶电泳测定PCR产物。用人外周血DNA为模板进行touch down PCR扩增,采用HRM方法进行测定,用Bipedit软件进行序列比对,并分析基因类型。
第1步不提取DNA,第2步不进行扩增。取患者外周血2 ml,EDTA抗凝处理;采用北京华夏时代基因发展科技有限公司提供的测序反应通用试剂盒,并严格按照说明书操作。提取白细胞后,采用荧光检测仪对UGT1A1*28(rs8175347)和UGT1A1*6(rs4148343)位点进行检测。
1.4 药物毒性评价标准 患者入院后均查阅病历,记录性别、年龄、ECOG评分、转移器官数目等资料。每个化疗周期后,均查阅患者血液学检查、病史等。采用美国国家研究所不良反应分度标准4.0[8]评估患者化疗后腹泻、中性粒细胞减少情况,包含0~4级。①腹泻。0级:无,1级:大便次数每天增加2~3次,2级:大便次数每天增加4~6次或者中度腹痛、夜间大便,3级:大便每天增加7~9次或者严重腹痛或者大便失禁,4级:大便每天增加10次或者需肠外支持治疗或者明显血性腹泻。②中性粒细胞减少。0级:中性粒细胞≥2.0×109/L;1级:中性粒细胞1.5×109/L~1.9×109/L;2级:中性粒细1.0×109/L~1.4×109/L;3级:中性粒细胞0.5×109/L~0.9×109/L;4级:中性粒细胞<0.5×109/L。其中3、4级为严重不良反应。
1.5 统计学分析 数据处理采用SPSS 18.0软件包,计数资料用率(%)表示,数据比较采用χ2检验,单因素分析有意义的因素用Logistic回归方程进行多因素分析,P<0.05为差异有统计学意义。
2 结果
2.1UGT1A1不同基因型和伊立替康致腹泻及中性粒细胞减少的关系UGT1A1*28、UGT1A1*6突变基因型患者腹泻、中性粒细胞减少发生率均分别高于野生型患者,差异有统计学意义(P<0.05),见表1。
2.2 结肠癌患者伊立替康致腹泻、中性粒细胞减少的单因素分析 单因素分析显示,结肠癌患者伊立替康致腹泻、中性粒细胞减少0~4级患者在不同性别、年龄、转移器官数目、UGT1A1*28基因型、UGT1A1*6基因型、伊立替康剂量中比较差异有统计学意义(P<0.05);在不同ECOG评分比较差异无统计学意义(P>0.05),见表2、表3。
2.3 结肠癌患者伊立替康致腹泻、中性粒细胞减少的Logistic回归分析 将可能导致严重腹泻、中性粒细胞减少的性别、年龄、转移器官数目、UGT1A1*28基因型、UGT1A1*6基因型、伊立替康剂量等因素纳入Logistic回归方程进行分析,结果显示,UGT1A1*28基因型、UGT1A1*6基因型、伊立替康剂量是结肠癌患者伊立替康致腹泻、中性粒细胞减少的独立危险因素,见表4、表5。
3 讨论
结肠癌是严重危及患者生命安全的恶性肿瘤,近年来,随着人们生活环境、饮食习惯的改变,其发生率呈上升趋势。结肠癌的早期症状隐匿,缺乏特异性临床表现,多数患者纠正时已为中晚期,化疗是此类患者的重要治疗手段。
伊立替康为半合成的可溶性喜树碱衍生物,主要作用于细胞周期S期,通过抑制拓扑异构酶Ⅰ,代谢为SN-38,影响DNA复制及细胞分裂,导致肿瘤细胞死亡[9-10]。尽管伊立替康在结肠癌治疗中的效果已得到研究证实[11-12],但随着其在临床的广泛应用,其所致的腹泻及中性粒细胞减少等不良反应较为突出,限制其使用。机体肝细胞内SN-38在UGT1A1作用下转化为SN-38G,通过胆汁排泄至肠道后,在β-葡萄糖醛酸酶作用下转化为SN-38,血液及肠道中高浓度的SN-38又增加血液学毒性风险,增加肠壁炎症细胞渗透性,促进水及电解质的分泌,导致内环境改变,肠道内菌群失调,从而引起腹泻[13-14]。UGT1A1又可促进SN-38转化为SN-38G,从而减轻其不良反应。侯慧轩等[15]研究发现,中国患者出现伊立替康致严重不良反应的发生率较欧美国家低,此差异一方面可能和国内化疗剂量有关,另一方面,有研究报道,UGT1A1基因多态性分布有明显的种族差异,可能导致伊立替康在不同个体中的毒性反应存在差异[16]。因此,分析UGT1A1基因多态性和伊立替康不良反应间的关系有重要价值。
UGT1A1基因位点有多种突变,其中UGT1A1基因第28位点的启动子区TATA盒中的TA数目重复叠加差异可影响此基因多态性,TA插入延长或者减少缩短均可减少UGT1A1基因合成,影响酶功能[17]。TA6/TA6是UGT1A1*28基因最常见的野生基因型,启动子区其次重复的主要为TA6/TA7杂合突变型。UGT1A1*6基因是由UGT1A1第一外显子211位点出现单核苷酸替换所致,主要为野生型及杂合突变型,作用上和UGT1A1*28基因相似,能够调控UGT1A1基因活性,此基因突变能够降低患者对SN-38的代谢能力[18]。
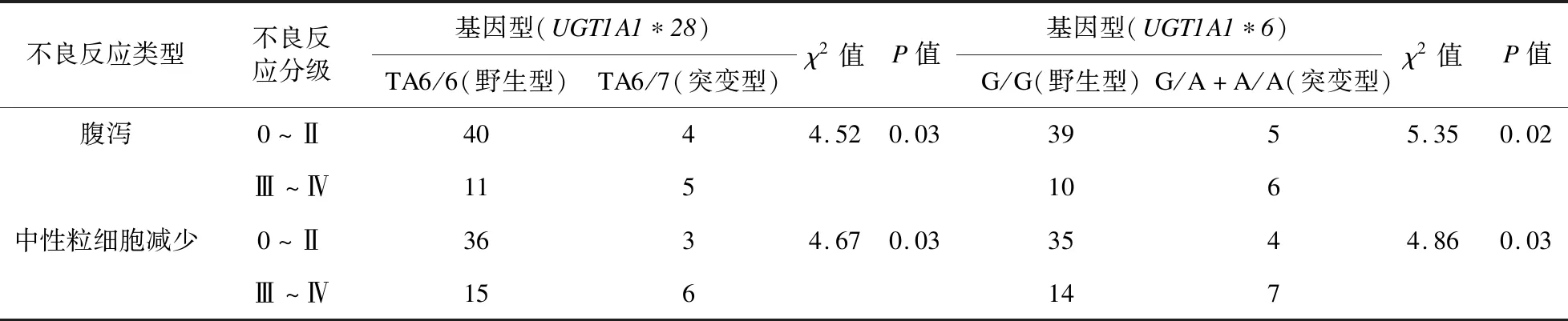
表1 UGT1A1不同基因型和伊立替康致腹泻及中性粒细胞减少的关系(例,%)
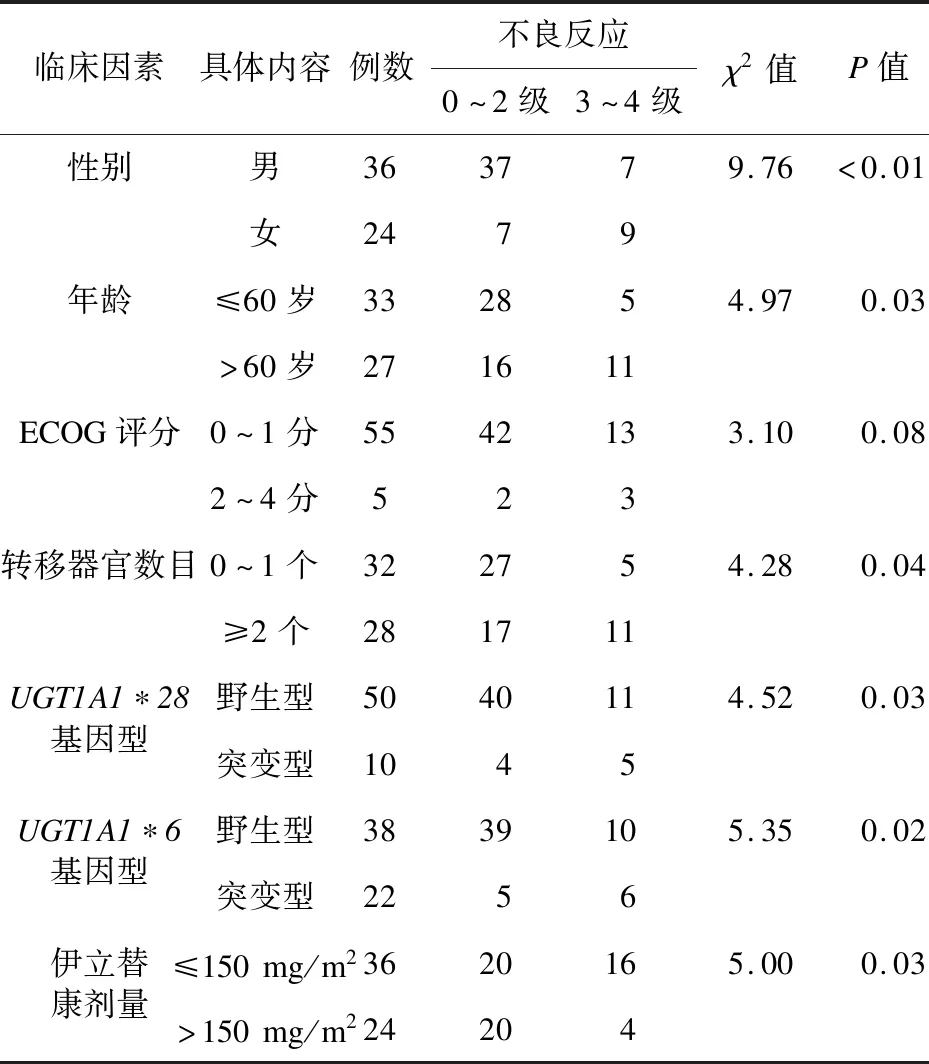
表2 结肠癌患者伊立替康致腹泻的单因素分析(例,%)
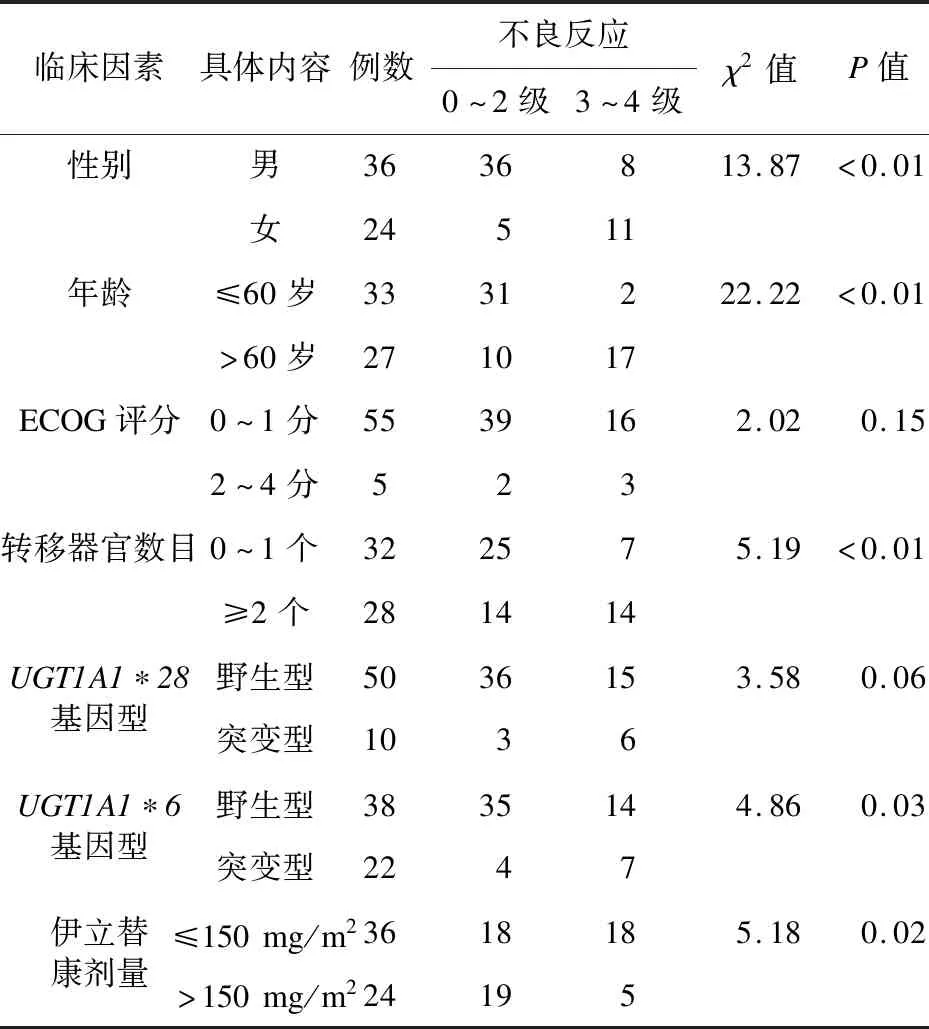
表3 结肠癌患者伊立替康致中性粒细胞减少的单因素分析(例,%)

表4 结肠癌患者伊立替康致腹泻的Logistic回归分析

表5 结肠癌患者伊立替康致中性粒细胞减少的Logistic回归分析
陈茹等[19]研究报道,UGT1A1基因多态性可增加伊立替康治疗结肠癌患者腹泻、中性粒细胞减少的危险性。本研究结果显示,UGT1A1*28基因、UGT1A1*6基因型和严重腹泻、中性粒细胞减少患者有良好相关性,以上基因突变型患者腹泻的发生率明显高于野生型,同时Logistic回归分析发现,性别、年龄、转移器官数目和严重腹泻、中性粒细胞减少的发生无关,排除了其对伊立替康所致毒性反应的影响,进一步说明UGT1A1基因多态性和腹泻的关系。临床治疗实践中,不可避免地根据患者自身经济、个人体质等调整伊立替康剂量,可能影响伊立替康所致不良反应,既往已有研究报道,伊立替康不良反应受化疗剂量的影响[20],本研究也支持此结论,因此,临床应综合考虑UGT1A1*28、UGT1A1*6的影响。但本研究未进一步分析伊立替康剂量和UGT1A1的关系,加上样本量缺乏代表性,因此UGT1A1基因型和伊立替康剂量的关系认识尚需大样本研究证实,加上性别、年龄、转移器官数目等因素可能存在一定的交互影响,进一步分析各个因素之间的相关性,得出的结果可能更加可靠。
综上所述,UGT1A1基因与伊立替康所致结肠癌患者腹泻及中性粒细胞减少有关,可为临床伊立替康不良反应的干预及用药选择提供理论依据。
