伊立替康诱导结肠癌细胞凋亡的分子机制
2018-12-13高文彪
黄 河 魏 童 高文彪
(新疆医科大学第五附属医院胃肠外科,新疆 乌鲁木齐 830011)
伊立替康是喜树碱衍生物,在机体内可以转变为具有药理活性的代谢产物。伊立替康和其代谢产物广泛分布在肝脏和肠道〔1〕,其活性代谢产物与DNA拓扑异构酶Ⅰ相互作用,通过阻断酶与DNA结合影响DNA 复制,形成无法逆转的DNA双链断裂,导致细胞周期阻滞和细胞死亡〔2〕。此外,对于多重耐药的癌细胞系也有部分活性〔3〕。然而,恶性结肠癌细胞仍有可能通过DNA损伤引起基因突变,或通过激活其他保护机制例如细胞自噬,对伊立替康耐药〔4〕。
肿瘤发生发展的作用机制并不十分清楚,p38与细胞类型、癌症分期、活化程度有关〔5〕。有研究提出,p38通过诱导细胞存活信号防止过早凋亡,并对损伤的DNA进行修复,扮演着保护细胞的重要角色〔6〕。激活的p38可以引起炎性细胞因子和酶的表达,促进血管生成与肿瘤转移。在结肠癌组织中,p38α是细胞增殖和生存所必需的,抑制p38α将导致细胞周期阻滞,细胞凋亡或自噬性细胞死亡〔7,8〕。
本研究考察了不同浓度的伊立替康对结肠癌细胞SW620凋亡的影响,探讨p38在伊立替康诱导结肠癌凋亡过程中的作用。
1 材料和方法
1.1实验材料 人类结肠癌细胞株SW620购自ATCC公司;伊立替康购自pfizer公司;MTT、二甲基亚砜(DMSO)、DAPI、碘化丙啶(PI)、p38特异性抑制剂SB 203580购自Sigma-Aldrich公司。酶联免疫吸附试验(ELISA)试剂盒、SignalSilence®p38 MAPK siRNA试剂盒购自CST公司。胎牛血清、DMEM培养基购自Thermo Fisher 公司,其他试剂均购自上海碧云天生物技术有限公司。
1.2实验方法
1.2.1细胞培养 用含10%胎牛血清(FBS)、100 U/ml青霉素、100 μg/ml链霉素的DMEM培养基培养人类结肠癌细胞株SW620。在温度为37℃、CO2体积分数为5%的饱和湿度孵育箱中培养。每周2次传代2次,待细胞密度超过90%后使用0.05%胰蛋白酶消化,操作过程确保无菌。使用DMSO作为稀释剂配制SB 203580原液。SB 203580(10 μmol/L)溶液在伊立替康前20 min加入细胞培养液。
1.2.2MTT法检测伊立替康对SW620细胞的毒性作用 将结肠癌细胞SW620接种于96孔板中,用不同浓度的伊立替康处理,在显微镜下观察细胞的存活情况。用磷酸盐缓冲液(PBS)小心冲洗2~3遍,然后加入10 μl 5 mg/ml MTT溶液,置于培养箱中继续培养4 h。每孔加入150 μl DMSO,在摇床上低速振荡15 min,使结晶物能够充分溶解。在酶标仪490 nm处测定各孔的吸光度值。
1.2.3ELISA测定p38 活性 伊立替康处理后的结肠癌细胞通过离心收集上清,所有细胞分组的预处理和p38活性测定按照ELISA试剂盒说明书操作。对不同样品进行测定,根据数据绘制p38和磷酸化p38的标准曲线。以磷酸化p38与同一样品中的总p38的比值作为p38活性指标。
1.2.4流式细胞术检测细胞凋亡 使用碘化丙啶染色对不同浓度伊立替康处理的结肠癌细胞的凋亡进行定量。细胞用胰蛋白酶消化后,收集细胞,用 PBS洗涤,离心去PBS,用预冷的70%乙醇在4℃固定2 h。冲洗后细胞重悬于含0.1% Triton X-100、50 μg/ml RNaseA和0.5 μg/ml碘化丙啶的溶液中,避光孵育30 min。通过流式细胞仪测定细胞样本中的凋亡比率。
1.2.5siRNA实验 使用SignalSilence®p38 MAPK siRNA试剂盒(Cell Signaling Technology公司),根据说明书步骤操作,特异性沉默p38 MAPK的表达。细胞稳定转染siRNA 48 h后,加入伊立替康作用并观察细胞的增殖和凋亡情况。
1.3统计学分析 采用SPSS17.0统计软件进行单因素方差分析,LSD-t检验进行组间均数的比较。
2 结 果
2.1不同浓度伊立替康对结肠癌细胞SW620生长的抑制作用 伊立替康抑制细胞生长和增殖,与其浓度和时间有关,呈剂量依赖性和时间依赖性(P<0.05)。见表1,图1,图2。
2.2伊立替康诱导SW620细胞凋亡 10、20 μmol/L伊立替康并不能显著引起结肠癌细胞凋亡〔细胞凋亡率为(5.47±1.23)%,(9.23±1.57)%〕,直到浓度增加至40、80 μmol/L,导致细胞显著凋亡增加〔细胞凋亡率分别为(20.83±2.51)%,(41.25±2.49)%〕,100 μmol/L伊立替康作用于SW620细胞后凋亡率升至(49.37±2.35)%与空白对照组(0%)相比差异有统计学意义(P<0.05)。
2.3p38 在伊立替康诱导SW620细胞凋亡过程中的活性变化 40 μmol/L伊立替康处理 SW620细胞,p38的激活相对较为缓慢;伊立替康作用24 h后,p38活性明显增加并且不断提高直至实验结束(48 h)。然而,100 μmol/L伊立替康处理SW620细胞过程中,p38活性在约 12 h内急剧升高,达到峰值,接着慢慢地减弱直到试验结束。值得注意的是,在作用48 h后,p38 活性几乎达到基底水平。见表2。

表1 不同浓度伊立替康处理SW620 细胞不同时间后存活细胞比例
相同时间,不同浓度组间比较:1)P<0.05
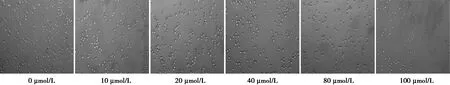
图1 不同浓度伊立替康作用于SW620 细胞24 h后的电子显微照片(×10 000)

图2 0 μmol/L和40 μmol/L伊立替康分别作用于SW620细胞0、24、48、72 h的电子显微照片(×10 000)

时间(h)40 μmol/L100 μmol/L0100.00100.002104.13±6.86104.02±6.744105.94±7.65109.92±7.768106.67±7.68117.68±8.1912108.56±7.69137.87±14.232)16115.78±7.931)132.67±13.562)24121.46±9.371)128.35±10.892)36126.83±9.761)118.76±8.8648133.75±13.891)110.23±7.84
与0、2、4、8、12 h比较:1)P<0.05;与0、2、4、8、36、48 h比较:2)P<0.05
2.4p38 MAPK通路在伊立替康诱导SW620细胞凋亡中的作用 使用化学抑制剂 SB203580及siRNA干扰技术特异性抑制p38的表达,然后给予伊立替康处理细胞,结果表明两者均能使p38 MAPK信号通路的活性显著降低。两种方法联用会导致p38几乎完全失活。见表3。
当p38 MAPK的活性被抑制时,用40 μmol/L伊立替康处理结肠癌细胞,发现SW620细胞凋亡明显增加,并且在48 h后达到峰值。此外,40 μmol/L伊立替康作用24 h后,与对照组比较,存活细胞百分比显著降低。100 μmol/L伊立替康处理组则表现出相反的效应,在整个实验期间,p38活性被抑制后,加入伊立替康作用不同时间,SW620细胞凋亡减少,同时存活细胞百分比明显增加,特别是在24 h和48 h之间的时间段。见表4、表5。

表3 加入抑制剂SB203580 或转染p38 siRNA后p38的活性变化
与伊立替康组比较:1)P<0.05

表4 p38活性被抑制后,40 μmol/L伊立替康处理SW620细胞不同时间,细胞的凋亡、存活比例
与同组其他时间点比较:1)P<0.05;下表同

表5 p38活性被抑制后,100 μmol/L伊立替康处理SW620细胞不同时间,细胞的凋亡、存活比例
3 讨 论
有研究报道伊立替康及其他抑制细胞生长的药物在多种恶性肿瘤细胞中会激活 p38 MAPK〔9,10〕。 p38信号似乎与抗凋亡蛋白Bcl-2和Bcl-xL有关,随着DNA损伤,抗凋亡蛋白Bcl-2和Bcl-xL的表达增加〔11〕。另一方面,p38 还可能通过直接激活 p53〔12〕或通过控制转录〔13〕来调节细胞增殖和凋亡。因此,在细胞生长抑制剂治疗恶性肿瘤的过程中,p38对细胞存活和凋亡有至关重要的调控作用。本研究发现,伊立替康激活相关信号诱导细胞凋亡,且具有剂量依赖性。此外,在伊立替康治疗结肠癌的体外模型中验证了p38 MAPK信号通路的潜在作用。本实验数据表明,伊立替康抑制细胞的生长和增殖,呈剂量和时间依赖性,且浓度在 40 μmol/L出现明显的细胞毒性,进一步的实验显示较低浓度伊立替康作用12 h,p38活性继续稳步增加,同时发生有限的细胞凋亡。当p38的活性被抑制后,给予伊立替康作用12 h,细胞凋亡明显增加,直至实验结束(48 h)。在此浓度下,p38的活性和细胞凋亡之间有直接的因果关系。此外,p38 MAPK信号通路被抑制的细胞组,细胞存活率也相应降低。有研究提出在癌细胞中p38信号代表了早期应激反应,使细胞有时间来评估损伤程度,进行修复〔14〕。在结肠癌细胞中p38具有潜在控制自噬的保护性作用〔15〕。以热休克蛋白(Hsp)27表达增加为例可以推断,随着p38活性缓慢而持续地增强,激活了特定的自我保护机制,一定程度上抑制了细胞凋亡的关键信号〔16〕。另一方面,随着高剂量伊立替康治疗导致p38活性快速增加,存活信号可能切换为细胞凋亡信号,进而导致细胞死亡。当给予抑制剂SB203580 或siRNA沉默p38的表达时,细胞凋亡明显减少,同时细胞存活率也相应提高。p38可能通过诱导凋亡前体蛋白的表达,如死亡受体、Fas及其配体FasL及Bax、Bcl-2家族的Bim或Noxa〔17,18〕,促进细胞凋亡。已知p38关联多种凋亡途径的表达或活性,如c-FLIP,Bcl-2,ERKs和Akt信号转导通路〔19,20〕。p38也有可能通过促进线粒体凋亡信号活性导致细胞凋亡〔21〕。所以,关于p38 MAPK在伊立替康治疗结肠癌过程中扮演的角色仍需进一步研究。总之,伊立替康处理SW620 结肠癌细胞过程中激活p38通路,呈剂量依赖性。低剂量伊立替康诱导p38 活性缓慢增长,从而激活生存机制,如Hsp27表达抑制细胞凋亡。相反,较高剂量伊立替康可导致 p38 活性迅速增加,诱导细胞凋亡。
