高活力木聚糖酶菌株的筛选、酶学性质及酶解应用*
2019-09-05何敏超闫志英张金峰刘云云陈小燕许敬亮
何敏超,闫志英,张金峰,刘云云,陈小燕,许敬亮†
(1.中国科学院广州能源研究所,中国科学院可再生能源重点实验室,广东省新能源和可再生能源研究开发与应用重点实验,广州 510640;2.中国科学院成都生物研究所,中国科学院环境与应用微生物重点实验室,环境微生物四川省重点实验室,成都610041;3.淮阴工学院,江苏省生物质转化与过程集成工程实验室,江苏 淮安,223003)
0 引 言
木聚糖酶在食品、制浆造纸、饲料、生物能源等领域中具有广阔的应用前景。在食品行业中,木聚糖酶可有效改善面团的持水性和稳定性,延长食品货架寿命[1];在制浆造纸领域,可提高纸浆白度并降低化学漂白剂的用量[2];在饲料行业,可降低水溶性木聚糖导致的食糜黏性增高,破碎植物细胞壁,释放营养物质;在生物能源领域中,木聚糖酶可以增大木糖的得率,增加总还原糖的量[3]。木聚糖酶通过改善纤维素酶的酶解率而降低纤维素酶的应用成本[4]。木聚糖酶通过降解木聚糖及木寡糖来降低此二者对于纤维素酶酶解的空间位阻作用[5-6]。因此,通过木聚糖酶的应用可以促进木质纤维素乙醇以及高附加值化学品生物精炼的发展。
木聚糖酶的研究侧重于产木聚糖酶菌株的筛选及选育[7]、基因工程菌的构建[8]、培养条件的优化等方面[9]。木聚糖酶酶解预处理后木质纤维素的研究报道相对较少。预处理后液体中常含乙酸、阿魏酸、糠醛、5-羟甲基糠醛和香草醛。酵母利用酶解后的可发酵糖产生乙醇。已有研究报道表明,这些水解产物和发酵产物可能会对纤维素酶的酶解起到抑制作用[10]。然而,仅有极少数的研究报道了水解产物对木聚糖酶酶解的影响作用[11]。黑曲霉是木聚糖酶和纤维素酶重要的生产菌,尚未见水解产物对黑曲霉木聚糖酶酶活影响的研究报道。
本研究对实验室筛选出的产木聚糖酶野生菌株进行分子鉴定及固态发酵单因素优化,并对该木聚糖酶的酶学性质进行初步研究,以期为今后该菌株大规模酶解预处理后农业废弃物原料提供前期的实验基础。
1 实验部分
1.1 材料、试剂及仪器
土壤样品采自广西壮族自治区河池市环江县木论自然保护区。
木聚糖(含量≥90%)购自Sigma公司;D-木糖(含量≥99%)购自上海源聚生物有限公司;3,5-二硝基水杨酸(含量≥98%)购自上海国药集团化学试剂公司。其他试剂均为市售分析纯。
LRH-250生化培养箱(上海一恒科技有限公司);HCQ-X 30℃恒温震荡器(上海一恒科技有限公司);JG16-WS台式高速离心机(湖南湘仪实验室仪器开发有限公司);BIOTECK-EON酶标仪(基因有限公司);HH-S8数显恒温水浴锅(江苏金怡仪器科技有限公司)。
1.2 培养基
斜面培养基。土豆200 g/L,葡萄糖20 g/L,琼脂20 g/L。土豆去皮,切成片,称取200 g并加水1 000 mL,煮沸30 min,8层纱布过滤,取滤液并补足1 000 mL,然后加入琼脂和葡萄糖,熔化、分装并灭菌。
初筛培养基。木聚糖10.0 g/L,KNO31.0 g/L,MgSO40.5 g/L,NaCl 0.5 g/L,K2HPO40.5 g/L,琼脂20 g/L,pH 6.0。
复筛培养基。玉米芯3.0 g/L,(NH4)2SO42.0 g/L,KH2PO42.0 g/L,CaCl20.3 g/L,MgSO40.3 g/L,FeSO4·7H2O 5 mg/L,CoCl220 mg/L,MnSO41.6 mg/L,ZnSO41.4 mg/L,pH 5.6。
固态发酵培养基。玉米芯与麸皮3.6 g,固液比1∶2.5,液体为pH 5.6的Mandels营养液[12]。Mandels营养液为不加玉米芯的复筛培养基。
1.3 筛选方法
1.3.1 平板初筛
将1.0 g土样加入装有50 mL无菌生理盐水的150 mL摇瓶中,摇床震荡60 min。取1 mL摇匀的液体加入15 × 150试管中,注入9 mL无菌生理盐水,摇匀后梯度稀释至10-6。分别吸取10-3、10-4、10-5、10-6四个稀释度的菌悬液0.25 mL涂布于初筛培养基上,30℃倒置培养,48~96 h观察水解圈大小,选择水解圈与菌落圈直径比值较大的菌落进行纯化及后续研究。
1.3.2 摇瓶复筛
将初筛得到的菌株接入种子培养液中,150 r/min、30℃培养72 h后以2.5% 接种量接种至复筛培养液中,于相同条件下摇瓶培养4 d、5 d、6 d,吸取1 mL发酵液稀释到适当倍数测定木聚糖酶活力。
1.4 分子生物学鉴定方法
采用改良十六烷基三甲基溴化铵(cetyl trimethyl ammonium bromide, CTAB)法提取菌株总脱氧核糖核酸(deoxyribonucleic acid, DNA),选择扩增真菌内转录间隔区(Internal Transcribed Spacer,ITS)序列的通用引物ITS1:5’-TCC GTA GGT GAA CCT GCG CG-3’和ITS4:5’-TCC TCC GCT TAT TGA TAT GC-3’对曲霉SM751总DNA进行序列的扩增。聚合酶链式反应(polymerase chain reaction,PCR)扩增条件为:95℃预变性3 min;94℃变性1 min,52℃退火50 s,72℃延伸50 s,35个循环;72℃延伸10 min。PCR扩增产物采用DNA凝胶回收试剂盒进行割胶回收,并测序。将该序列与美国国家生物技术信息中心(National Center for Biotechnology Information, NCBI)数据库中的已知序列进行局部序列排比检索(basic local alignment search tool, BLAST)比较分析,获得相关种属的18S核糖体DNA(ribosome deoxyribonucleic acid, rDNA)序列,构建系统发育树。
1.5 单因素优化方法
在初始固态发酵培养基(玉米芯与麸皮总质量为3.6 g、固液比为1∶2.5、液体为pH 5.6的Mandels营养液)的基础上,考察不同玉米芯与麸皮比例(9∶1、7∶1、5∶1、3∶1、1∶1、1∶3、1∶5、1∶7、1∶9、全玉米芯、全麸皮)对Aspergillus nigerSM751产木聚糖酶酶活的影响。考察不同氮源(硝酸铵、酵母粉、尿素、磷酸氢二铵、碳酸铵、硫酸铵、氯化铵和蛋白胨)对产木聚糖酶的影响。考察不同初始pH值(3.5、4.0、4.5、5.0、5.5、6.0和6.5)对产木聚糖酶的影响。考察不同料水比(1∶1.5、1∶2.5和1∶3.5)对产木聚糖酶的影响。考察不同接种量(2.5%、5.0%、7.5%和10.0%)对产酶的影响。
1.6 木聚糖酶酶活测定方法
于15 mL的具塞刻度试管中加入1 mL的1%木聚糖溶液(0.2 M,pH 4.8的醋酸缓冲液配置)、0.5 mL醋酸缓冲液和0.1 mL适当稀释酶液于50℃条件静止反应30 min后加入2 mL的3,5-二硝基水杨酸溶液摇匀煮沸10 min,定容到15 mL于540 nm下测定吸光度值。空白中的酶液用灭活的酶液代替[13]。酶活力单位定义:在上述测定条件下,每1 mL粗酶液1 min水解产生1 µmol底物所需的酶量为一个酶活单位(international unit, IU)。
2 结果与讨论
2.1 产木聚糖酶微生物的筛选与鉴定
在以木聚糖为唯一碳源的筛选培养基上,经观察水解圈(22 mm)与菌落圈(18 mm)比值的初筛和液体发酵复筛,从广西壮族自治区环江县木论自然保护区土样中分离到一株木聚糖酶活性较高的菌株(1001.33 IU/mL),将其编号为SM751。根据ITS序列的变化进行菌株SM751的种属鉴定。菌株SM751的ITS序列被扩增和测序,并保存于NCBI基因库(登记号为KJ194466)。利用BLAST方法对该序列进行比对,并使用MEGA 6.0软件构建系统发育树。在图1系统发育树上,该菌株与Aspergillusniger表现出98%的相似性。该菌株保藏于中国微生物菌种保藏管理委员会普通微生物中心(China General Microbiological Culture Collection Center,CGMCC),其编号为CGMCC No.8670。

图1 菌株Aspergillus niger SM751系统发育树Fig.1 The phylogenetic tree of ITS rRNA sequences of Aspergillus niger SM751
2.2 玉米芯与麸皮不同比例对产酶的影响
玉米芯与麸皮是重要的农业副产品和农业废弃物。在图2中,以玉米芯为碳源时,木聚糖酶酶活为1 172.82 IU/g。以麸皮为碳源时,木聚糖酶酶活为7 367.83 IU/g,是玉米芯为碳源时酶活的6.28倍。随着玉米芯比例的下降(9∶1、7∶1、5∶1、3∶1、1∶1),木聚糖酶酶活呈上升趋势(2 077.16 IU/g、2 688.10 IU/g、3 201.28 IU/g、3 531.18 IU/g、7 331.17 IU/g)。1∶1时的木聚糖酶酶活是其他比例酶活的两倍到三倍。随着麸皮比例的上升(1∶1、1∶3、1∶5、1∶7、1∶9),木聚糖酶酶活分别为7 331.17 IU/g、 8 125.38 IU/g、7 551.11 IU/g、7 868.79 IU/g和7 050.14 IU/g。这表明Aspergillus nigerSM751吸收和利用玉米芯和麸皮混合物的机制比较复杂,且优先利用麸皮作为碳源[14]。在玉米芯与麸皮比例为1∶3时,其木聚糖酶酶活力为8 125.38 IU/g,远高于其他混合比例的木聚糖酶酶活,因此选择玉米芯与麸皮比例为1∶3作为后续发酵碳源。
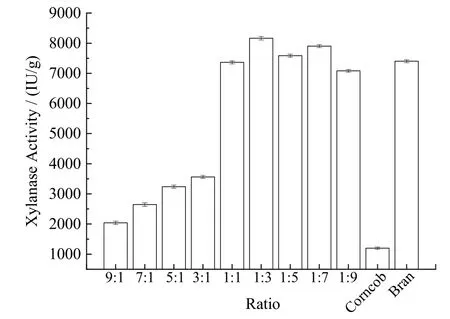
图2 玉米芯与麸皮不同比例对菌株产酶的影响Fig.2 Effect of ratio between corncob and wheat bran on the xylanase activity of strain SM751
2.3 氮源对菌株产酶的影响
分别用1.4 g的硝酸铵、酵母粉、尿素、磷酸氢二铵、碳酸铵、硫酸铵、氯化铵和蛋白胨代替2.0 g的硫酸铵。在图3中,以尿素作为氮源,其木聚糖酶酶活力最高(8 113.16 IU/g)。酵母粉木聚糖酶酶活力最低(5 962.69 IU/g)。因此,选择尿素为最佳氮源。

图3 不同氮源对菌株SM751产酶的影响Fig.3 Effect of various nitrogen sources on the xylanase activity of strain SM751
2.4 初始pH对菌株产酶的影响
初始pH能够影响微生物的生理和最终的木聚糖酶酶活。在图4中,96 h、120 h和144 h的木聚糖酶酶活分别是8 772.97 IU/g、8 601.91 IU/g和6 720.40 IU/g,相应的最佳初始pH值是3.5、3.5和5.0。最佳的初始pH值随着时间的变化而变化。在96 h、120 h和144 h,木聚糖酶酶活最低的初始pH都是4.5。这可能是由于初始pH 4.5相较于其他初始pH不适合于Aspergillus nigerSM751发酵产酶。在120 h,pH 6.0的木聚糖酶酶活仅次于pH 3.5的酶活,这说明菌株Aspergillus niger在偏酸性条件下也可以较好地产酶。选择pH 3.5作为最佳的初始pH。

图4 不同初始pH对菌株SM751产酶的影响Fig.4 Effect of various initial pH on the xylanase activity of strain SM751
2.5 不同接种量对菌株产酶的影响
在发酵工艺中,接种量是一个重要的影响因素。图5中,96 h、120 h 和144 h最高的木聚糖酶酶活分别是8 504.16 IU/g、9 567.18 IU/g和7 123.46 IU/g,其相应的最佳接种量分别是10%、10%和 7.5%。在96 h和120 h,2.5%接种量的木聚糖酶酶活高于5.0%和7.5%接种量的酶活。总体而言,随着时间的延长,相同接种量的木聚糖酶酶活呈下降趋势。在接种量为10%时,120 h的木聚糖酶酶活大于144 h的木聚糖酶酶活。这说明,较大的接种量不仅能促进木聚糖酶的酶活,而且能够缩短发酵时间。选择10%作为最佳的接种量。

图5 不同接种量对菌株SM751产酶的影响Fig.5 Effect of inoculum on the xylanase activity of strain SM751
2.6 不同料水比对菌株产酶的影响
在固态发酵过程中,料水比是一个关键的影响参数。图6显示,96 h、120 h 和144 h的最大木聚糖酶酶活分别是9 090.66 IU/g、8 663.00 IU/g和8 235.35 IU/g,相应的料水比是1∶3.5。在相同的发酵时间下,木聚糖酶酶活随着料水比的增大而增大,并且料水比在1∶2.5、1∶3.5的条件下,木聚糖酶酶活是料水比1∶1.5的2倍。这说明利用Aspergillus nigerSM751固态发酵时,水分对于产酶有极大的影响作用。总体而言,随着时间的延长,木聚糖酶的酶活呈下降趋势。选择料水比1∶3.5作为最佳的料水比。
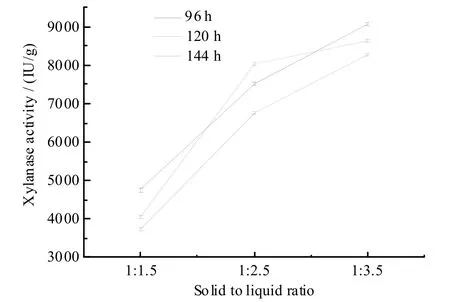
图6 不同料水比对菌株SM751产酶的影响Fig.6 Effect of various ratio between solid and liquid on the xylanase activity of strain SM751
在玉米芯与麸皮比例为1∶3,1.4 g尿素为氮源,初始pH值为3.5,料水比为1∶3.5,接种量为10.0 %的条件下进行固态发酵,120 h后木聚糖酶酶活力为10 446.92 IU/g。
2.7 木聚糖酶的酶学特性
最适pH和最适温度是重要的酶学特性,决定了酶的应用条件。在50℃条件下,于pH值为3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5条件下分别测定木聚糖酶酶活力。以最大的酶活为100%,其他pH条件下酶活与最大酶活的百分数为Y轴,做酶活残留率曲线。在图7中,该木聚糖酶有两个最佳pH范围,一个为3.0~4.5,另一个为5.0~6.0。在pH范围为3.0~4.5,酶活残留率为95%~97%。这个范围内较高的酶活残留率有助于预处理后木质纤维素中木聚糖的酶解[15]。在pH范围为5.0~6.0内,酶活残留率高达98%~100%。这表明该酶在酸性和偏酸性条件下具有良好的酶解潜力。

图7 不同pH对菌株SM751木聚糖酶酶活的影响Fig.7 Effect of pH on the xylanase activity of strain SM751
在最适pH 5.0下,分别于37℃、45℃、50℃、55℃、60℃、65℃条件下测定木聚糖酶酶活。以最高酶活力为100%计算各温度下的相对酶活力,结果见图8。由图可知,最适温度为45℃,50℃时酶活残留率为97%。可见,45~50℃适合木质素酶解产木聚糖。当温度高于50℃,木聚糖酶的酶活残留率急剧下降。相较于最佳温度,55℃和60℃的酶活残留率分别为42.78%和3.87%。

图8 不同温度对菌株SM751木聚糖酶酶活的影响Fig.8 Effect of temperature on the xylanase activity of strain SM751
2.8 木聚糖酶对抑制物的耐受性能
木质纤维素经过酸处理、碱处理或者高温液态水处理后,会产生一些有毒害作用的抑制物[10,16]。这些有毒的抑制物包括呋喃类化合物(糠醛、5-羟甲基糠醛)、乙酸、酚类化合物(香草醛、阿魏酸)。在酿酒酵母发酵酶解的葡萄糖会产生乙醇。因此,有必要对上述化合物影响木聚糖酶活性进行研究。
在图9中,中浓度和高浓度的糠醛可以激活木聚糖酶,其激活率分别可达7.63%和15.88%;而低浓度的糠醛微弱地抑制木聚糖酶,其抑制率为0.82%。中浓度和低浓度的5-羟甲基糠醛抑制木聚糖酶,其抑制率分别为7.01%和27.83%;而高浓度的5-羟甲基糠醛显著激活木聚糖酶,其激活率可达18.35%。考虑到糠醛可以与3,5-二硝基水杨酸反应,因此设置了相应的对照以消除这种反应的影响[17]。此外,也有类似的研究表明,糠醛及5-羟甲基糠醛可以激活木聚糖酶的酶活[18]。Aspergillus nigerSM751所产的木聚糖酶对于糠醛和5-羟甲基糠醛具有良好的耐受性能。乙酸在低浓度、中浓度和高浓度对木聚糖酶具有轻微的激活作用,其激活率分别为0.2%、0.21%和3.92%。
酚类化合物(香草醛、阿魏酸)随着浓度的变化,对于木聚糖酶酶活的影响也不同[11,19]。香草醛在低浓度时,其对木聚糖酶的抑制率为4.54%,而在中浓度和高浓度时,其对木聚糖酶的激活率分别是1.65%和7.84%。阿魏酸在低浓度时对于木聚糖酶没有影响,而在中浓度和高浓度时,其对木聚糖酶的激活率分别为3.09%和5.16%。LI等[20]的研究结果则表明香草醛和阿魏酸抑制木聚糖酶的酶活。然而,另有研究结果显示,阿魏酸可以激活木聚糖酶酶活[21]。

图9 不同抑制物对菌株SM751木聚糖酶酶活的影响Fig.9 Effect of inhibitory compound on the xylanase activity of strain SM751
乙醇在中浓度时对木聚糖酶酶活没有影响,然而在低浓度和高浓度下可以轻微地激活木聚糖酶酶活,其激活率分别为1.44%和3.92%。VAN DYK等[22]的研究结果显示乙醇抑制木聚糖酶的酶活。
利用Aspergillus nigerSM751所产的木聚糖酶酶解高温液态水预处理之后的甘蔗渣。高温液态水的预处理条件为:料水比1∶20、180℃和4 Mpa下处理20 min。预处理之后,在50℃、150 r/min和pH 4.0下添加500 IU/g的木聚糖酶酶解24 h,木糖得率为75.63%。
3 结 论
研究了新筛选菌株Aspergillus nigerSM751固态发酵产木聚糖酶的潜力。该菌株能够产生高水平的木聚糖酶,并且所产的粗酶具有良好的pH稳定性。木聚糖酶酶活最高可达10 446.92 IU/g。此外,该酶对糠醛、5-羟甲基糠醛、香草醛、阿魏酸和乙醇具有优良的耐受性。23.0 g/L的糠醛和25.7 g/L的5-羟甲基糠醛对木聚糖酶的激活率分别达15.9%和18.4%。该酶的最适温度、最适pH和对抑制物的优良耐受性使得该酶在酶解预处理后木质纤维素方面具有良好的应用潜力。
