心脏运动康复对慢性心衰患者外周淋巴细胞MMP及JAK/STAT3通路的影响
2019-09-05郝广华
魏 波,郝广华
(1西安医学院附属汉江医院心血管内科,汉中 723003;2西安交通大学第二附属医院心血管内科;*通讯作者,E-mail:guanghua-h@163.com)
慢性心力衰竭(chronic heart failure,CHF)是心脏疾病的主要终点事件,也是导致心血管疾病死亡率居高不下的重要原因。尽管目前慢性心力衰竭的病理机制研究及药物治疗已经取得了相当瞩目的成就,但慢性心衰的5年死亡率仍居高不下,波动于40%-50%[1];现有研究表明,运动康复治疗能通过调节血管-紧张素系统激活、线粒体损伤、减轻心室重构等途径提高慢性心衰患者的运动耐力,对改善长期预后具有重要意义[2]。
众所周知,线粒体损伤是心衰发生发展的重要病理机制,但其具体机制仍未完全阐明。MMP的减低和消散能较早地反映线粒体的损伤情况,因此常被作为线粒体损伤的重要检测指标。Song等[3]发现,慢性心力衰竭患者外周淋巴细胞线粒体MMP明显降低,与ROS的水平变化和心功能分级具有明显相关性;另有研究表明[4],白介素激活的Janus激酶(Janus kinases, JAK)/信号转录及转导激活因子3(signal transduction and activator of transcription 3, STAT3)JAK/STAT3信号通路可能通过调控心室重构、心肌细胞肥大、心肌炎症损伤及肾素-血管紧张素系统等各个环节参与慢性心力衰竭发病[5]。JAK/STAT3信号通路激活能够减轻病理应激所致线粒体氧化应激损伤,减少MMP消散,具有维持线粒体功能及稳定性的作用[6]。因此,外周血淋巴细胞中MMP、JAK及STAT3信号分子的表达变化及相互作用可能在一定程度上反映心衰的病程进展。因此,我们对运动康复治疗前后患者外周淋巴细胞MMP、JAK及STAT3分子表达进行检测,其结论将为寻找新的慢性心力衰竭诊断及预后指标,评估运动康复疗效提供实验依据。
1 资料与方法
1.1 研究对象
选取2018-01~2018-06在本院门诊就诊的慢性心衰患者80例,所有患者均符合2012年欧洲心脏病学会心力衰竭诊断和治疗指南。纳入标准:进一步确定存在典型的心衰症状和体征,近1个月内无心衰急性发作及入院治疗史。排除标准:排除严重主动脉瓣狭窄、致命性心律失常、Ⅱ型以上房室传导阻滞,梗阻性心肌病、瓣膜病、缩窄性心包炎、肺栓塞、急性心肌梗死、活动性感染、急性心力衰竭、恶性肿瘤、自身免疫性疾病、严重的肝脏、肾脏、血液疾病、慢性阻塞性肺病等急慢性疾病。
研究对象心衰分级参照纽约心功能(New York Heart Association, NYHA)分级标准,心功能Ⅱ级56例、Ⅲ级24例。其中心衰组40例,男性28例,女性12例,平均年龄(62.3±7.4)岁;运动组共40例,男性26例,女性14例,平均年龄(61.8±8.3)岁;同时期,健康体检者40例,男性22例,女性18例,平均年龄(60.3±9.3)岁;运动组和心衰组的年龄、性别、NYHA心功能分级、吸烟史、相关病史等(高尿酸、高血脂、糖尿病、肥胖)差异均无统计学意义(均P>0.05),并且均接受常规药物抗心衰治疗。运动组在给予药物治疗的同时进行心脏康复运动治疗。
患者通过代谢当量决定运动强度,起初进行床上活动,后进行床旁活动(如步行、踏步等)、爬楼梯、弹力带等运动;医务人员根据患者身体状况选择运动方式并逐渐增加运动量。运动康复治疗整个过程,尽力保证治疗的安全性及连续性(参照《慢性稳定性心力衰竭运动康复中国专家共识》)。治疗6个月后,对各组患者进行6MWT及心脏彩超,并检测MMP、JAK、STAT3、BNP等指标;本研究已获得医院伦理委员会的同意批准。
1.2 标本采集及检测
1.2.1 血清BNP测定 收集所有研究对象外周抗凝血,从肘中静脉取血5 ml。静置2 h后2 000 r/min离心20 min分离出血清,并冻存在-70 ℃冰箱,随后用电化学发光免疫分析法检测BNP水平(罗氏,德国)。
1.2.2 分离制备淋巴细胞并检测MMP 取2 ml静脉血加入EDTA抗凝。用等量的PBS液(2 ml)稀释,混匀。吸取淋巴细胞分离液2 ml加入离心管中,再将稀释抗凝血液小心沿管壁加至分离液上,应注意保持两者界面清晰。常温下离心20 min(2 000 r/min)。用毛细吸管轻轻吸出乳白色的淋巴细胞,加入另一支已含有2-5 ml Hank’s液的离心管中,混匀后离心10 min(1 500 r/min)。
1.2.3 分离纯化线粒体及MMP测定 用冰浴预冷的PBS轻轻重悬细胞沉淀,取少量细胞用于计数,剩余细胞600g,4 ℃离心5 min沉淀细胞。加入1-2.5 ml线粒体分离试剂或临用前添加了苯甲基磺酰氟(PMSF)的线粒体分离试剂至(2 000-5 000)万细胞中,轻轻悬浮细胞,冰浴放置10-15 min。匀浆10-30下左右把细胞匀浆在600g,4 ℃离心10 min后,小心把上清转移到另一离心管中,接着在11 000g,4 ℃离心10 min,小心去除上清。沉淀即为分离得到的细胞线粒体;采用荧光JC-1荧光探针法试剂盒(GENMED公司,上海),96孔板加入10 μl纯化的线粒体样品,室温下孵育10 min,样本检测前置于冰槽里,荧光酶标仪以激发波长490 nm,散发波长590 nm进行测量。
1.2.4 real-time PCR检测JAK、STAT3的mRNA表达 前述方法提取外周血单个核细胞RNA,反转录为cDNA,检测JAK、STAT3基因表达。引物序列见表1。反应体系:5×PrimeScript Buffer 2 μl,Prime-Script RT Enzyme Mix 0.5 μl,Oligo dT Prime(50 μmol/L) 0.5 μl,Random 6(50 μmol/L)0.5 μl,然后加入Total RNA后,加入RNase Free H2O至10 μl。将反应管放入梯度PCR仪中,设置反转录条件:37 ℃ 15 min,85 ℃ 5 s,完成反转录反应。采用2-ΔΔCt法并应用IQ5软件进行结果分析。
表1 JAK、STAT3与管家基因GAPDH的引物
Table 1 Primer sequences of JAK,STAT3 and GAPDH
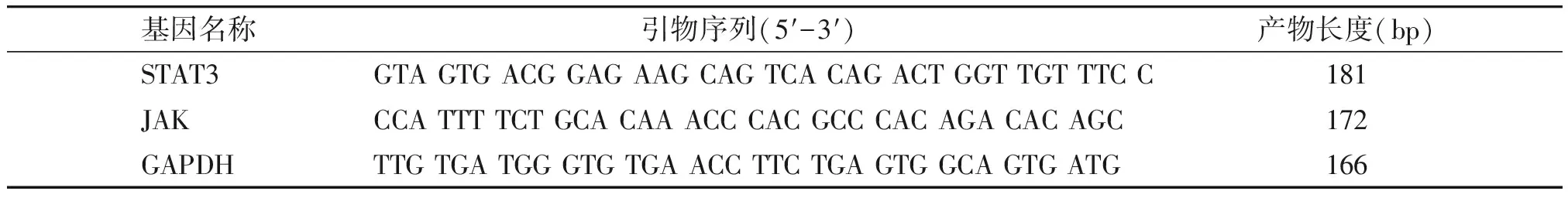
基因名称引物序列(5′-3′) 产物长度(bp)STAT3GTA GTG ACG GAG AAG CAG TCA CAG ACT GGT TGT TTC C181JAKCCA TTT TCT GCA CAA ACC CAC GCC CAC AGA CAC AGC172GAPDHTTG TGA TGG GTG TGA ACC TTC TGA GTG GCA GTG ATG166
1.3 心脏结构与功能监测
采用GE-VIVO9型心脏超声检测仪及沃克6MWT分析监测系统对患者心脏结构、左室射血分数(left ventricular ejection fraction, LVEF)、左室舒张末内径(left ventricular end diastolic diameter, LVEDD)、左室收缩末内径(left ventricular end-systolic diameter, LVESD)及6MWT进行检测,检测过程中严密监测患者生命体征、症状,保证整个过程安全有效。
1.4 统计学分析
2 结果
2.1 运动组及心衰组一般资料比较
两组年龄、性别、吸烟史、高血压史、糖尿病史、高脂血症、超重、心功能之间比较差异无统计学意义(均为P>0.05,见表2)。
2.2 运动组及心衰组心脏彩超及6MWT结果比较
心衰组药物治疗后LVEF和6MWT较治疗前增加,差异具有统计学意义(P<0.05);而LVEDD和LVESD治疗前后无明显差异(P>0.05)。运动组6MWT、LVEF较治疗前显著增加,而LVEDD、LVESD均较治疗前减低,差异具有统计学意义(P<0.05);运动组6MWT、LVEF较心衰组增加,差异具有统计学意义(P<0.05),而LVEDD和LVESD较心衰组显著降低(分别为P<0.05,P<0.01),差异具有统计学意义(见表3)。
表2 运动组和心衰组基线临床资料比较
Table 2 Comparison of baseline between rehabilitation group and CHF group

指标运动组(n=40)心衰组(n=40)χ2/tP年龄(岁)61.8±8.362.3±7.41.4920.391男性(例)26280.4350.534吸烟史(例)22180.4630.476高尿酸(例)26230.0630.068糖尿病(例)12150.4010.503高脂血症(例)18231.0680.187超重(例)20220.5640.602心功能分级(例) Ⅰ级 0 0 Ⅱ级30260.8210.376 Ⅲ级10140.160.967 Ⅳ级 0 0

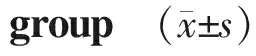
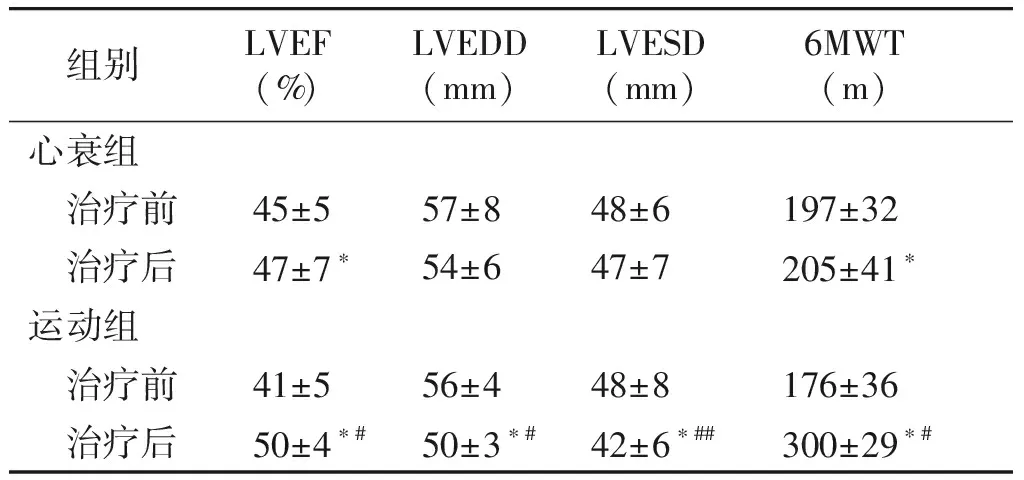
组别LVEF (%) LVEDD (mm) LVESD (mm) 6MWT (m) 心衰组 治疗前45±557±848±6197±32 治疗后47±7∗54±647±7205±41∗运动组 治疗前41±556±448±8176±36 治疗后50±4∗#50±3∗#42±6∗##300±29∗#
LVEF:左室射血分数;LVEDD:左室舒张末内径;LVESD:左室收缩末内径;与治疗前比较,*P<0.05,**P<0.01;治疗后与心衰组比较,#P<0.05,##P<0.01
2.3 各组患者外周血BNP水平比较
治疗前三组患者外周血清BNP结果提示心衰组及运动组均较对照组显著升高,差异具有统计学意义(分别为P<0.05与P<0.01);运动治疗后,心衰组和运动组BNP水平较运动前明显降低,差异具有统计学意义(均P<0.05);运动治疗后运动组与心衰组比较BNP降低幅度较心衰组更显著,差异具有统计学意义(P<0.05,见图1)。

与对照组比较,*P<0.05,**P<0.01;组内与治疗前比较,#P<0.05,##P<0.01;与治疗组比较,&P<0.05图1 各组治疗前后血清BNP水平比较Figure 1 The serum levels of BNP in three groups before and after treatment
2.4 外周血淋巴细胞MMP荧光强度比较
治疗前,心衰组及运动组荧光强度均较对照组显著降低,差异具有统计学意义(分别为P<0.01与P<0.05);治疗后,心衰组较治疗前比较MMP无明显差异(P>0.05),运动组较治疗前明显增加,差异具有统计学意义(P<0.05);治疗后,运动组MMP较心衰组明显升高,差异具有统计学意义(P<0.05,见图2)。

与对照组比较,*P<0.05,**P<0.01;组内与治疗前比较,#P<0.05,##P<0.01;运动组与治疗组比较,&P<0.05图2 各组治疗前后外周血淋巴细胞MMP比较Figure 2 MMP in peripheral lymphocyte in three groups before and after treatment
2.5 淋巴细胞中JAK/STAT3mRNA水平比较
治疗前,心衰组JAK和STAT3 mRNA水平较对照组明显降低,差异具有统计学意义(分别为P<0.01与P<0.05),运动组JAK和STAT3的mRNA水平较对照组显著降低,差异具有统计学意义(分别为P<0.05与P<0.01);心衰组和运动组两组治疗前后JAK、STAT3的mRNA表达水平比较,差异无统计学意义(P>0.05)。治疗后,运动组JAK和STAT3的mRNA表达水平较心衰组明显增加,差异具有统计学意义(P<0.05,见图3)。
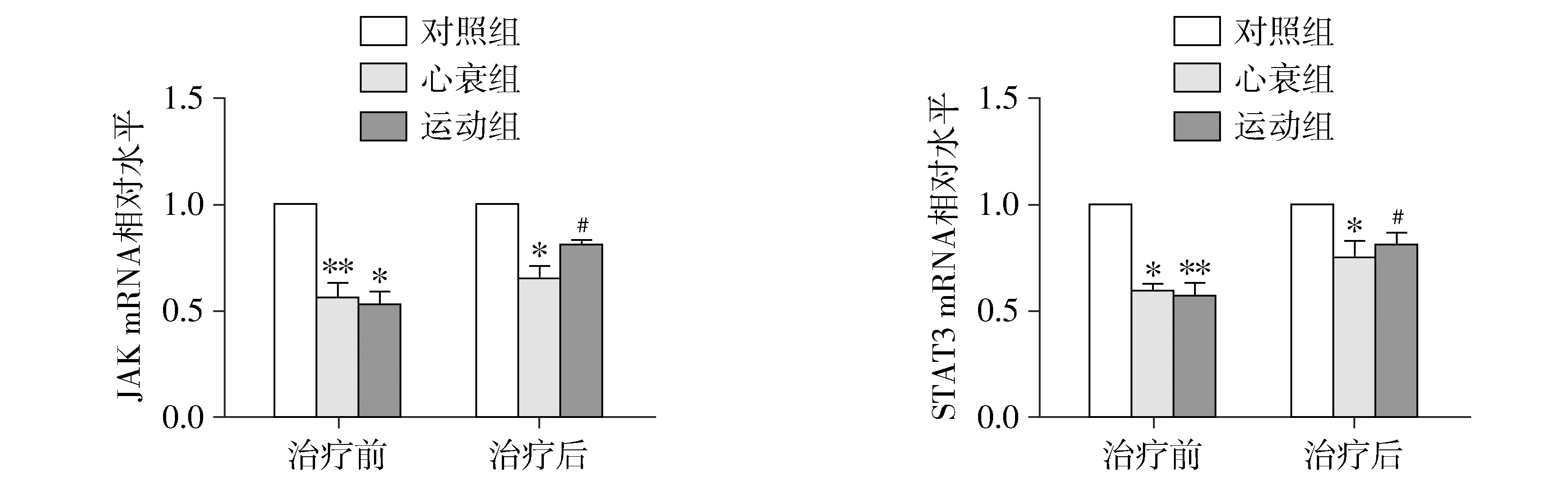
与对照组比较,*P<0.05,**P<0.01;与心衰组比较,#P<0.05,##P<0.01图3 各组治疗前后外周血淋巴细胞JAK、STAT3 mRNA水平比较Figure 3 Relative expression of JAK and STAT3 mRNA in three groups before and after treatment
3 讨论
心脏运动康复是以适量低强度有氧运动为核心的康复疗法,广泛适用于临床症状相对较稳定、无明确运动禁忌证的患者。近年来多项研究表明,运动康复治疗可提高心衰患者的心功能和运动耐力,改善生活质量及远期预后[7]。然而,在我国甚至世界范围内运动康复治疗的开展及相关研究仍处于起步阶段[8]。慢性心力衰竭病理生理机制复杂,免疫系统在慢性心衰的发病中发挥重要作用[9]。外周血淋巴细胞的功能及病理生理变化与心力衰竭时心肌细胞功能障碍存在一定的相关性[6]。因此,外周淋巴细胞中相关分子的检测,有望成为心衰疗效判断及预后的血液检测指标的“观察窗口”。
线粒体不但为心肌舒缩活动提供主要能量,而且是使心肌细胞具备正常活性的重要物质保障[10];线粒体损伤参与并促进了心力衰竭的发病及进展[11]。研究表明,线粒体通透性转换孔存在于线粒体的内膜和外膜中间,其在正常生理情况下处于关闭的状态,是维持MMP及线粒体正常功能的先决条件,对调控线粒体代谢底物的摄取及ATP合成、电子传递链活性、线粒体生物发生、线粒体动力学等线粒体功能具有重要的作用[12]。在细胞受到氧化应激刺激以后,线粒体产生的大量ROS,ROS过量积累会诱发线粒体通透性转换孔的开放,可引起线粒体极化、MMP下降,诱导细胞凋亡及能量代谢异常。因此,MMP的下降被认为是线粒体功能损伤的重要标志。而心肌细胞线粒体损伤造成氧化应激活性产物的堆积,可进一步抑制JAK/STAT3信号通路的激活[13]。
JAK/STAT3信号通路激活对心肌缺血再灌注损伤、心力衰竭的心功能具有重要保护作用[14]。心肌细胞中的IL-6、IL-11、白血病抑制因子、睫状节神经细胞营养因子等通过配体与细胞膜受体的结合后形成同型或异源二聚体,随后与糖蛋白130(gp130)将细胞信号传递至STAT3。研究表明,JAK/STAT3信号通路激活可减少MMP消散,是瘦素对缺血再灌注心肌损伤及海马神经元损伤发挥保护作用的重要机制[15,16],可减轻缺血再灌心肌线粒体损伤,减少缺血坏死面积,改善心脏功能[5]。另有研究表明,抑制线粒体JAK/STAT3的磷酸化活性,使STAT3对心肌线粒体的保护作用减弱,其下游分子MnSOD表达的降低,诱导心肌及其线粒体损伤,参与扩张型心肌病的发病[17]。尽管部分研究证明,心脏功能损伤与MMP的消散及JAK/STAT3信号通路抑制有关。同时,也有少量研究发现,JAK/STAT3信号通路的激活,促进了心衰的炎症状态的驱动和维持[18]。研究结论的不一致可能与病情严重程度及病程的不同阶段有关。
慢性心力衰竭新体液机制的改变可能对淋巴细胞的生理状态和活力产生影响。心衰患者外周淋巴细胞MMP、ROS的水平监测[19],对心衰严重程度及再住院率有一定的预测价值。而有研究发现,JAK/STAT3通路不但可通过上调锰型超氧化物歧化酶(MnSOD)基因表达而发挥对线粒体的间接保护作用,而且还可通过调节线粒体电子传递链活性[20]和抑制线粒体膜通透性转换孔的开放[21]而发挥对线粒体的直接保护作用。与其结论一致,本研究对慢性心力衰竭患者的外周淋巴细胞中线粒体损伤相关分子进行检测,发现MMP的降低、JAK/STAT3表达水平降低与心脏功能损伤一致;另外,运动康复治疗在一定程度能增加MMP,促进JAK/STAT3表达,改善心脏结构功能及远期预后,提高心衰患者的运动耐力。因此,外周血淋巴细胞中线粒体MMP及JAK/STAT3分子表达可能成为潜在的血清标志分子和潜在慢性心力衰竭新的治疗靶标;并且运动康复治疗可能通过减轻线粒体功能损伤改善慢性心衰疾病进展及远期预后。
本研究是对心衰患者外周淋巴细胞线粒体功能及相关分子表达的初步探索,其局限性在于仅检测了外周血淋巴细胞线粒体损伤及相关分子变化,尚未对不同病程、病情不同严重程度的MMP及JAK/STAT3及相关信号通路的其他分子进行动态检测。同时,线粒体损伤与JAK/STAT3信号通路之间的具体相互作用机制尚待进一步的深入研究。
