广西红壤区林木根际溶磷菌的筛选与鉴定
2019-09-05邓小军李海星李武应王会利宋贤冲覃祚玉
邓小军,颜 权,李海星,韩 华,李武应,唐 健,王会利,宋贤冲,覃祚玉
(1.广西壮族自治区林业科学研究院 a.国家林业局中南速生材繁育实验室;b.广西优良用材林资源培育重点实验室,广西 南宁 530003;2.广西派阳山国有林场,广西 宁明 532500;3.天峨县林朵林场,广西 天峨 547300)
土壤是森林生态系统的重要组成部分,也是林业健康发展的物质基础,是满足社会对林产品需求和实现林业可持续发展的重要保障。磷元素是植物所必需的第二大元素,然而世界大部分土壤处于缺磷状态[1],施入土壤的大量磷素容易与阳离子结合形成无法被植物利用的难溶磷酸盐,南方森林土壤95%的磷都是无法被植物直接吸收的难溶态磷,磷素缺乏是影响林木生长的重要因子之一[2]。近年来,随着南方尤其是南亚热带速生丰产林的快速发展,南方森林为国家提供了大量的木材需求。同时南方速生丰产林大部分为人工纯林,生物多样性简单,生态系统薄弱,林地产出多,大量不合理的化学肥料施用造成生态环境质量下降,水土污染和地力衰退等问题日益严重[3]。
林木根际是森林土壤生态系统的重要组成部分,是土壤-林木-微生物三者互相联系互相影响的地方。众多研究[4-6]表明,土壤微生物参与森林生态系统的氮、磷、钾等物质和能量循环,施加土壤有益菌是有效增加植物产量、平衡土壤生态提高土壤质量的途径之一。Sperber等[7]发现,大部分的溶磷微生物均出现在植物根际土壤中。溶磷微生物不仅能提高土壤磷素的有效性,满足植物根系对磷素的需求[8-9],还能分泌一些植物生长激素,促进植物的生长提高植物的抗逆能力。同时根际环境也能提供溶磷微生物生长繁殖的一些营养物质,它们具有相互促进的作用。目前,关于溶磷菌微生物肥料的研究主要在农业领域[4,10-11],戴沈艳等[10]从红壤水稻土分离获得一株对磷酸钙非常好效果的菌株,其溶磷量达到159.1 mg·L-1,而关于林木溶磷菌株的研究还不多[12-15]。因此,本研究从广西不同红壤区林木根际土壤筛选了溶磷微生物,进行了摇瓶发酵和传代培养试验,确定其溶磷能力,并进行了种属鉴定,为下一步研制林木菌肥菌剂提供菌种基础材料,同时为南方尤其是南亚热带人工林的减肥增效及可持续经营提供数据和参考。
1 材料与方法
1.1 培养基
PKO(Pikovskaya's Medium)培养基:葡萄糖 ,10 g;Ca3(PO4)2,3 g; (NH4)2SO4,0.5 g; NaCl,0.1 g;MgSO4·7H2O ,0.1 g;KCl,0.2 g; MnSO4,0.004 g;FeSO4·7H2O,0.002 g; 酵母膏,0.6 g;水,1 000 mL;pH值7.2。
LB培养基配方见文献[13]。
1.2 土壤样品
从广西红壤区梧州、田林、宁明、天峨、贺州、南宁、玉林等地林木优势木根际土壤采取0~20 cm深度的林木根际土壤样品,每份0.5 kg,装入没有拆封过的薄膜封口袋中,贴上标签并注明采集地点、日期,封口。置于冰袋中带回实验室置于4 ℃保存,进行溶磷菌株分离。
1.3 林木根际溶磷菌分离纯化
将不同地区的林木根际土壤称取样品5 g,置于装有45 mL 0.85%生理盐水的150 mL无菌锥形瓶中,振荡混匀制成悬浮液。用移液枪从中吸取1 mL悬浮液注入盛有9 mL 0.85%无菌生理盐水的试管中,振荡混匀,再从此试管中吸取1 mL,注入另一盛有9 mL 0.85%无菌NaCl溶液的试管中,以此类推,制成土壤含量依次为10-3、10-4、10-5g·mL-1的3种梯度的悬浮液。用移液枪吸取50 μL土壤悬浮液涂布PKO平板,每个梯度重复4次,并作好记录标记。恒温28℃,培养3 ~5 d,以透明圈直径(D)和菌落直径(d)比值(即HE值)的大小对该菌株溶磷能力进行初筛,将HE值高的菌株分别接种到LB培养基上进行纯化,在PKO培养基上连续传代3次后都能正常生长则确定为有效溶磷菌株,然后保存到LB斜面培养基上,置于4 ℃的冰箱保存。
1.4 各溶磷菌株的溶磷能力的测定及复筛
准备250 mL锥形瓶,装入100 mL PKO培养基,灭菌冷却,用移液枪吸取1 mL待测菌株菌液(108cfu·mL-1)接种至锥形瓶中。每个菌株设置5个重复,对照处理加1 mL无菌水代替菌液。将上述锥形瓶置于28 ℃、160 r·min-1摇床培养3 d。将发酵液置离心机以10 000 r·min-1转速离心10 min,取5 mL上清液,用钼锑钪比色法[16]在波长700 nm下测定有效磷含量。
1.5 林木根际溶磷菌菌落形态观察
以平板划线法分离纯化得到溶无机磷菌株,置于28 ℃培养36 ~48 h。观察记录各菌株菌落的大小、颜色、形态、光泽度等。
1.6 16 S rDNA测序和构建系统发育树
1.6.1 细菌总 DNA 的提取
细菌总DNA提取方法见文献[17]略有改动,具体步骤如下:
1) 取培养24 h的摇床液体NA菌株发酵液,在5 000 r·min-1转速下离心10 min,获取目标菌体富集物。
2) 取30 mg菌体加入1 mL菌体裂解液悬浮沉淀,加质量浓度50 mg·mL-1的溶菌酶5 μL,震荡混匀,置于37 ℃保温20 min。
3) 加蛋白酶K(20 mg·mL-1)20 μL,摇晃均匀,保持65 ℃ 1 h。
4) 用等体积的酚∶氯仿∶异戊醇(25∶24∶1)混合液抽提,在12 000 r·min-1转速下离心10 min,吸取上清液置于另一离心管,重复抽提一次。
5) 用等体积的氯仿∶异戊醇(24∶1)抽提一次,12 000 r·min-1转速下离心10 min,取上清于另一离心管。
6) 加0.1 V醋酸纳溶液(pH值 5.2)和2 V无水乙醇,混匀,-20 ℃沉淀2 h。
7) 4 ℃下12 000 r·min-1转速下离心10 min,收集底部沉淀,然后用70% 乙醇洗涤沉淀,干燥后溶解于适量的TE中,-20 ℃保存备用。
1.6.2 PCR产物扩增与纯化
以提取的细菌DNA为PCR模板,用16S rDNA 的通用引物(正向引物 16Sf,5′-AGAGTTTGATCCTGGCTCAG-3′;反向引物16Sr,3′-ACGGCTACCTTGTTACGACT-5′)对 目标细菌基因组DNA进行扩增。
PCR 反应体系:10×Ex Taq Buffer 2 μL、2.5 mmol dNTP Mix 1.6 μL、Template 0.5 μL、5 U Ex Taq酶0.2 μL、10 μmol 引物各0.8 μL、模板DNA 1 μL、ddH2O 补足20 μL。
PCR 反应条件:先在95 ℃变性5 min;然后以95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1.5 min,一共24 次循环;72 ℃延伸10 min。获得PCR 产物送上海美吉生物技术有限公司纯化测序。
1.6.3 系统发育树的构建
将测序获得的菌株16SrDNA序列申请提交到Genbank数据库,并在 NCBI上BLAST比对,选取一些有代表性的菌株16S rDNA序列,然后用 Bioedit的 Multiple Sequence Alignment进行同源性分析,最后采用MEGA 4.1构建该菌株的系统发育树(Bootstrap=1000)。
1.6.4 数据处理与分析
所获得的数据用Excel (Version 2007,Microsoft Inc.)软件处理,以±SD表示。用SPSS(Version 18.0,SPSS Inc.)进行数据统计分析,采用Tukey’s HSD检验对数据进行单因素方差(One-way ANOVA)分析。
2 结果与分析
2.1 林木根际溶磷菌初筛
采用PKO培养基筛选广西不同地区林木根际解无机磷菌株,共获得有效菌株42株。获得HE值大于1.2的溶无机磷菌株6株(表1)。

表1 6株初筛溶磷菌的HE值†Table 1 The HE values of six promising phosphatesolubilizing strains
初筛结果见表1。根据透明圈法初步判断菌株溶磷效果,HE值大于1.2的溶无机磷菌株有6株,即L202、L205、L301、L302、L401、L503。溶磷能力最强的菌株(D/d≥2.5)为L205,与其他菌株差异显著。其余5个溶磷菌株D/d值范围介于1.27~1.88之间。菌株在PKO培养基上呈现的HE值大小与菌株代谢产物酶或者酸的种类及释放的快慢等相关。有学者[18]研究发现,从土壤中筛选获得具有明显溶磷圈的溶磷菌经过纯化传代培养后又失去了溶磷能力。Kucey等[19]研究发现溶磷菌在转移传代过程中50%的菌株溶磷能力减弱甚至消失了。所以透明圈法只能作为溶磷菌的初步筛选指标,所获得的菌株需要进一步进行复筛来确定其溶磷效果。
2.2 林木根际溶磷菌菌株溶磷量测定及复筛结果
通过锥形瓶液体摇瓶发酵测定了其中6株HE值大于1.2菌株的溶磷量,结果见表2。发现6株菌株均具有较好的溶磷能力,各菌株发酵液溶磷量存在差异,6株菌株的有效磷增量在78.38 ~203.04 mg·L-1之间,其中,L205溶磷量最高,达到了203.04 mg·L-1;其次是L503和L301,分别是175.55 mg·L-1和162.28 mg·L-1。L205、L503、L301菌株溶磷效果差异不显著。菌株L401溶磷量最少,仅为78.38 mg·L-1,与其他菌株差异显著,而不加菌株的CK检测出有效磷含量为5.02 mg·L-1,与其他处理差异显著。

表2 6 株菌株摇瓶发酵溶磷能力Table 2 Six strain fermentation phosphate solubility
2.3 不同菌株发酵液中pH值的变化
有研究表明,溶磷微生物在培养期间发酵液的酸碱度会呈降低趋势,发酵液中有效磷的增量同发酵液的pH值相关,这与本次研究结论一致[20-21]。不同溶磷菌株发酵液pH值的变化见表3,结果表明,不同溶磷菌株随着培养时间的增加,pH值逐渐降低,其中溶磷量最多的菌株L205发酵3 d后的pH值最低,为3.13,与L302菌株处于同一水平,与其他处理差异显著。这是由于溶磷微生物会分泌一些酸性物质从而发酵液的pH值下降,但是其pH值下降程度与其溶磷量没有显著的数量关系,这说明溶磷菌除了分泌酸性物质还可能存在其他溶磷机制[4,22]。
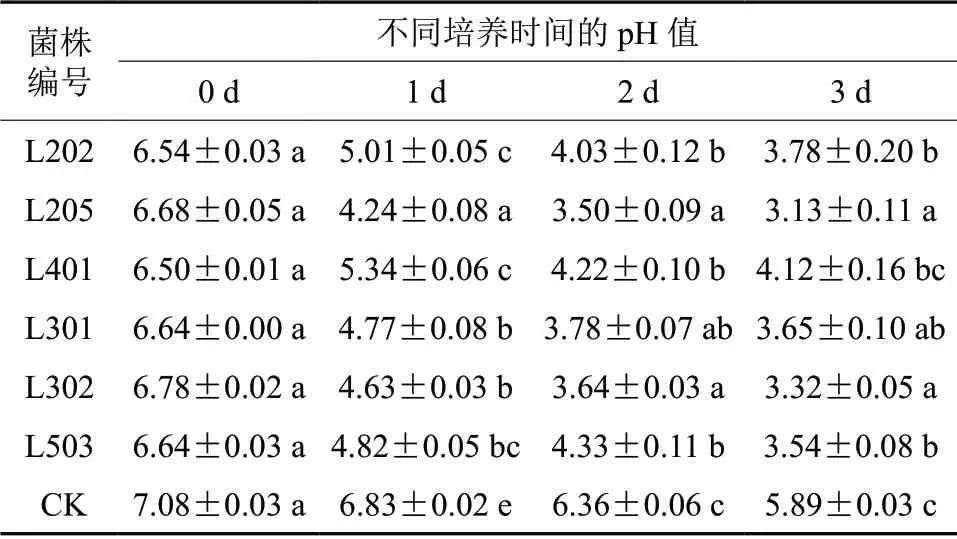
表3 不同溶磷菌株发酵液pH值的变化Table 3 Variation of pH in the different culture medium
2.4 林木根际溶磷菌菌落特性观察
把筛选得到的高效溶磷菌培养36 h后观察其生长情况:细菌L205菌落不透明,表面粗糙,边缘不整齐,生长速度中等;真菌L301菌落呈灰白色圆形,较大,边缘整齐,孢子呈青色。 L205和L301均在72 h后就可以观察到明显的溶磷圈。

图1 L205、L301菌落形态Fig.1 Colony morphology of strain L205 and L301
2.5 高效溶磷菌株L205系统进化树构建与分析
菌株L205的16S rDNA的PCR扩增产物长约1 398 bp,经测序得到基因序列并提交进入美国GenBank,其登录号为MH670897。 将高效溶磷细菌L205的16 S rDNA与GenBank数据库中的序列进行Blast比对,选取同源性最高的序列,运用Clustal软件进行多重序列的同源性分析,并利用MEGA4.0进行系统发育树的构建(图2)。由系统发育树可知,测序鉴定结果为:L205为巨大芽孢杆菌Bacillus megaterium,置信度为88%。
3 结论与讨论
森林土壤枯枝落叶等凋落物多,有机物丰富,土壤微生物相对于耕地土壤更为丰富。有研究发现细菌是旱地土壤溶磷微生物中数量所占比例最大的一类[23]。目前文献上报道的溶磷菌菌属主要有芽孢杆菌Bacillus、沙门氏菌Salmonella、假单胞杆菌Pseudomonas、产碱菌Alcaligenes等,其中巨大芽孢杆菌Bacillus megaterium是在农业耕地上发现最早、溶磷效果最好、应用面积最为广泛的菌株[12]。

图2 基于16S rDNA序列分析L205的系统发育树图谱Fig.2 Neighbour-joining trees of L205 based on 16S rDNA sequences
不同地区土壤环境气候特征不同,不同植物其根际环境情况也有所差异,有研究[24]表明特殊的土壤环境会导致非土著微生物定殖能力差、菌种淘汰率高等弊端,故农用微生物肥料在南方林业生产中应用效果不理想情况突出。广西土壤主要为红壤,红壤也是我国南方典型的土壤类型。目前关于我国南方红壤地区林木根际溶磷菌的报道并不多。由于其特殊的成土过程,土壤中氧化铁、氧化铝和粘粒较高,有效磷缺乏,制约着该地区林木蓄积量的提高。相关研究[5]也表明广西林地土壤“富氮、缺磷、中等钾”。本研究从广西不同红壤区林木根际土壤筛选得到多株有效溶磷菌株,它们溶解无机磷的有效磷增量在78.38~203.04 mg·L-1之间,其中从林木根际土壤筛选得到的菌株L205溶磷量最高,达203.04 mg·L-1。通过16 S rDNA与GenBank中的序列进行Blast比对,鉴定得出细菌L205为巨大芽孢杆菌,具有一定的应用潜力。下一步可以研究该菌株的溶磷机制、林木根际定殖效果和促生长效应,为基于该菌株的红壤区林木菌肥菌剂研发提供基础数据。
