Hep G2肝癌细胞外泌体对人树突状细胞成熟与功能的影响
2019-09-04林世杰张丽峰
林世杰,周 虎,张丽峰,冷 静
(1.广西国际壮医医院,广西 南宁 530201;2.广西医科大学,广西 南宁 530021;3.广西中医药大学,广西 南宁 530200)
恶性肿瘤是严重危害人类健康的疾病之一,同时也是全球第二大死亡原因。其中,肝细胞癌(Hepatocellular carcinoma,HCC)是肝脏最常见的原发性肿瘤,它是导致癌症相关性死亡的第二大病因,也是全球第16大常见死因[1-2]。我国是肝细胞癌(下简称“肝癌”)的高发国家,肝癌是我国发病率第5位、死亡率第3位的恶性肿瘤[3-4],目前肝癌的主要治疗方法是手术切除,但由于多数患者被确诊时已处于中晚期,所以肝癌患者的生存率普遍不高[5],免疫治疗是肝癌治疗的热门研究领域,近年来取得了一定的进展[6]。
外泌体(Exosomes)是一种由不同细胞分泌的囊泡小体,直径一般为30~100 nm[7],其含有大量与其来源及功能相关的蛋白质、RNA等成分[8]。肿瘤细胞分泌的外泌体含有亲代肿瘤细胞物质,并通过将其内容物转运至受体细胞,从而影响细胞内信号通路,在肿瘤发展中发挥重要作用[9]。
树突状细胞(Dendritic cells,DC)在启动先天和适应性免疫反应中发挥重要作用。众所周知,经肿瘤诱导的DC是一把双刃剑,一方面,不成熟的DC捕获抗原并逐渐成熟,然后迁移到淋巴结激活T细胞,刺激宿主抗肿瘤免疫反应[10];另一方面,肿瘤微环境中的特异性信号可能会抑制DC成熟,导致形成具有免疫抑制或免疫耐受的DC[11-12]。肿瘤来源外泌体(Tumor-derived exosomes,TEXs)在肿瘤免疫逃逸中有着重要作用,其自身携带的生物学信号可作用于肿瘤微环境、远处组织及细胞,诱导免疫细胞功能紊乱[13]。研究表明TEXs可诱导DC免疫耐受或成熟障碍及活化特异性T细胞的功能缺陷[14-18]。基于上述研究,本课题组拟探索肝癌外泌体是否也可诱导DC的成熟障碍和功能减退。
1 实验材料
1.1 细胞系 人肝癌细胞系HepG2由广西医科大学组织与胚胎学教研室提供,无癌活性的永生化肝细胞MIHA购自上海素尔生物科技有限公司,细胞用含有10%FBS(Gibco)的 RPMI-1640(Gibco)培养于37 ℃、5%CO2的培养箱中;树突状细胞取自健康人外周血单个核细胞,培养于含10%FBSRPMI-1640培养基,于培养基中加入浓度为20 ng/ml的粒细胞-巨噬细胞集落刺激因子(Granulocyte-macrophage colony stimulating factor,GM-CSF)、10 ng/ml的白介素4(Interleukin-4,IL-4)、105U/ml的 β 干扰素(Interferon-β,IFN-β)。
1.2 主要试剂 无外泌体FBS、ExoQuick-TC外泌体提取试剂盒购自美国SBI公司;BCA蛋白浓度测定试剂盒、SDS-PAGE快速凝胶配制试剂盒购自碧云天公司;抗体Anti-CD63、Anti-Alix购自美国Santa cruz公司;抗体 FITC anti-Human CD83、FITC anti-Human CD80、APCanti-Human CD86、APCanti-HLA DR、Human Trustain FCX购自美国Biolegend公司;Human CD14 Positive selection kit、Ficoll淋巴细胞分离液购自美国Stemcell公司;Human IL-12 p70 ELISA Kit购自中国欣博盛公司;CCK-8试剂盒购自中国碧云天公司。
2 方法
2.1 外泌体的提取 收集含10%无外泌体FBS的HepG2细胞培养上清液,加入15 ml离心管中,300×g离心5 min去除细胞碎片,收集上清液于另一离心管,使用0.22μm无菌滤头过滤上清液并收集进新管,于4℃10 000×g离心30 min。将收集的上清液加入10 kb超滤管中,水平离心机上3 000×g离心15 min,收集过滤后的上清液,加入提取试剂,将混合液放于4℃冰箱过夜,次日将混合液置于离心机上,1 500×g、4℃离心30 min,弃去上清液,用PBS缓冲液重悬沉淀,BCA蛋白浓度测定后将样本置于-80℃冰箱保存。通过透射电镜观察外泌体形态,用PBS稀释外泌体样本,于铜网上滴加10μl样本,室温放置1~2 min,滤纸吸去多余液体。向铜网上滴加30μl 2%磷钨酸,室温负染1~2 min,并用滤纸吸干多余的负染液。室温下用PBS冲洗网格3遍,白炽灯下晾干后电镜下观察。
2.2 Nano FCM检测外泌体粒径分布及颗粒浓度 Nano FCM是类似于流式细胞仪工作原理的微小颗粒分析仪器,检测范围在20~200 nm之间。本研究使用Nano FCM仪器检测ExoQuick-TC试剂盒法提取的HepG2细胞外泌体,步骤如下:样本获得的外泌体样本用200μl PBS重悬后,取10μl用PBS稀释500倍,先用单纯PBS上样,检测溶液粒径值,作为外泌体上机检测背景值,将稀释好的外泌体样本上机,检测其粒径分布及颗粒浓度。
2.3 Western Blot检测外泌体及细胞的标记蛋白 提取细胞总蛋白,方法为:用预冷的PBS清洗细胞3次,在细胞中加入200μl RIPA蛋白裂解液(含2μl PMSF),冰上裂解10 min,12 000×g、4 ℃离心15 min,收集上清液,BCA法测定样本蛋白浓度后待用。取50 ml外泌体样本,加入50μl RIPA蛋白裂解液。取20μg蛋白样本加入上样缓冲液中,于99℃金属浴中煮10 min,经SDS-PAGE分离电泳,半干转PVDF膜,5%脱脂牛奶封闭后,分别加入一抗(按1∶1 000稀释):Anti-CD63、Anti-Alix、Cytochrome C,4 ℃孵育过夜。按1∶2 500稀释二抗,室温孵育2 h,显影收集数据。
2.4 DC的诱导 取健康志愿者的外周血10 ml经过Ficoll密度离心后分离出人外周血单个核细胞(peripheral blood mononuclear cell,PBMCs),经磁珠分离后获得CD14+细胞。将分离的细胞培养于含10%FBS的RPMI-1640培养基中,调整细胞浓度为5×105个/ml,接种于 48 孔板,500 μl/孔;于培养基中加入 GM-CSF 20 ng/ml、IL-4 10 ng/ml、IFN-β 105U/ml,培养箱中培养24 h。向不成熟的DC中加入50μg/ml、100μg/ml、200μg/ml的 HepG2外泌体,同时加入10 ng/ml的脂多糖(Lipopolysaccharide,LPS)刺激 DC成熟,培养72 h后收获DC待检,将上清液冻存于-80℃。
2.5 DC表面分子染色及流式细胞仪检测 将DC收集于1.5 ml EP管中,使用1 ml 0.1%FBSRPMI-1640清洗1次,用200μl完全培养基重悬细胞。各管平分为2组,并从各管中分别取出10μl细胞悬液放于1个新管中作为不染色的空白对照,各管加入3.5μl FC封闭抗体,冰上孵育15 min。分2组加入荧光标记抗体,冰上孵育 30 min:① anti-CD83 FITC、anti-CD86 APC;② anti-CD80 FITC、anti-HLA DR APC。各管加入1 ml 1%FBSRPMI-1640洗细胞1次,离心弃上清液后加入500μl 4%多聚甲醛固定细胞,流式上机检测。
2.6 ELISA检测DC培养上清液中IL-12的水平 从-80℃冰箱中取出DC培养上清液,解冻。按照Human IL-12 p70 ELISA试剂盒说明书进行实验。
2.7 CCK-8检测DC刺激同种异体淋巴细胞增殖的能力 提取与DC来源不同的健康个体的PBMCs,用2%FBSRPMI-1640重悬后接种于细胞培养皿,置于细胞培养箱中培养2 h,取未贴壁的细胞即为淋巴细胞。完全培养基重悬细胞后加入96孔板,每孔100μl,2×105个/孔;取已刺激成熟的DC加入96孔板,每孔100 μl,2×104个/孔;即 DC∶淋巴细胞=1∶10;培养72 h后,各孔加入20μl CCK-8溶液,放置于培养箱3~4 h后,酶标仪检测A450OD值。按公式计算:刺激指数(Stimulating Indext,SI)=(实验组OD值-未刺激组OD值)/未刺激组OD值。SI值越大则DC刺激异体T细胞增殖的能力越强。
2.8 统计学分析 数据用SPSS 21.0和GraphPad Prism 7.0进行数据处理和作图,统计分析。实验数据以均数±标准差(x±s)表示,多组实验组间计量数据采用单因素方差分析;两组数据之间的差异比较用t检验,P<0.05认为差异有显著性意义。
3 结 果
3.1 HepG2细胞来源外泌体电镜鉴定 见图1。
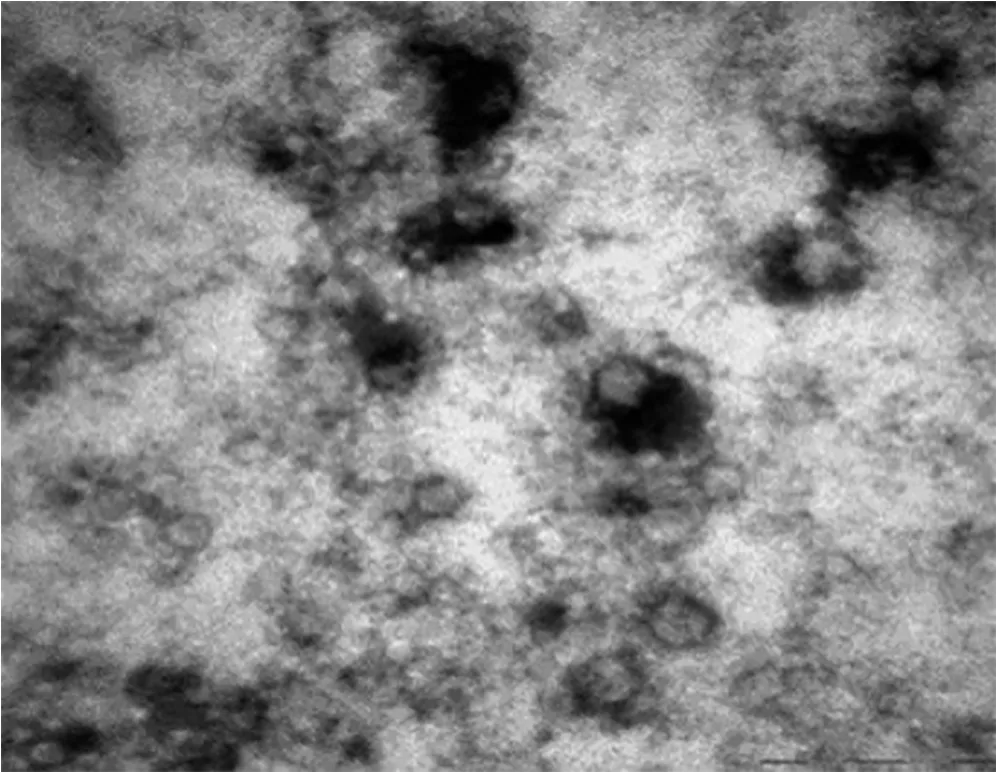
图1 外泌体的电镜观察图
如图1所示,在透射电镜下观察,本研究所提取的外泌体大小在30~100 nm以内,其呈现出外泌体独特的杯状形态,有着双膜结构,可根据其形态特征证明其为外泌体[19]。
3.2 外泌体粒径分布及浓度 采用Nano FCM仪器检测ExoQuick-TC试剂盒法提取的HepG2细胞外泌体样本,显示其平均粒径为75.81±26.47 nm(图2),浓度为 4.98×1010个/ml(10 ml培养上清液所得外泌体用200μl PBS稀释)。同时,提取MIHA细胞外泌体,Nano FCM检测显示其粒径分布在50~150 nm之间,平均粒径74.91±25.38 nm(图3)。
3.3 Western Blot检测外泌体特征性蛋白的表达 见图4、图5。
图4、图5显示,HepG2和MIHA细胞及其来源的细胞外泌体表达CD63与Alix,并且外泌体中无细胞色素C(Cytochrome C),表明了本研究所提取的外泌体并无细胞碎片的污染[20],可为后续的实验排除了细胞裂解物的干扰。
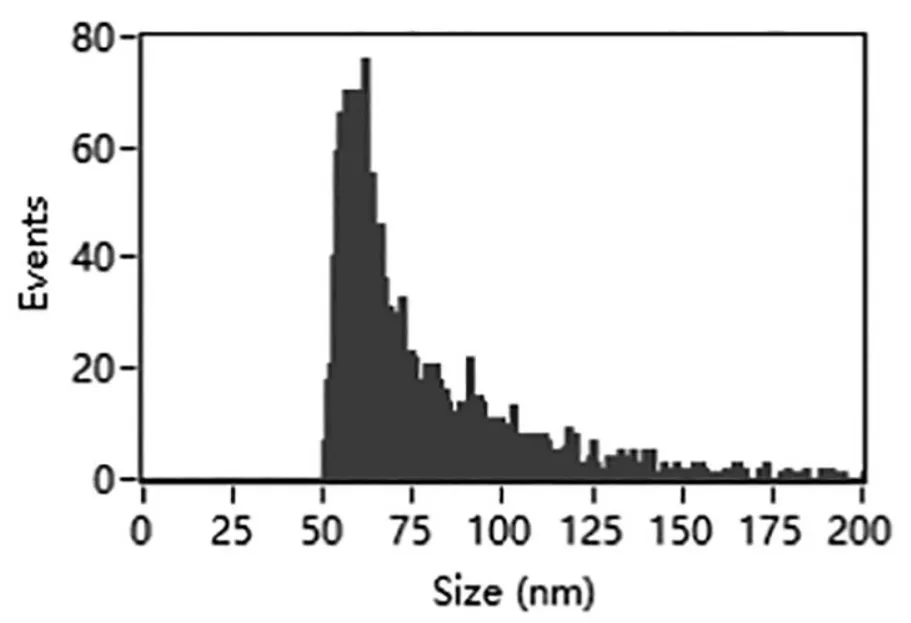
图2 HepG2外泌体的Nano FCM检测结果
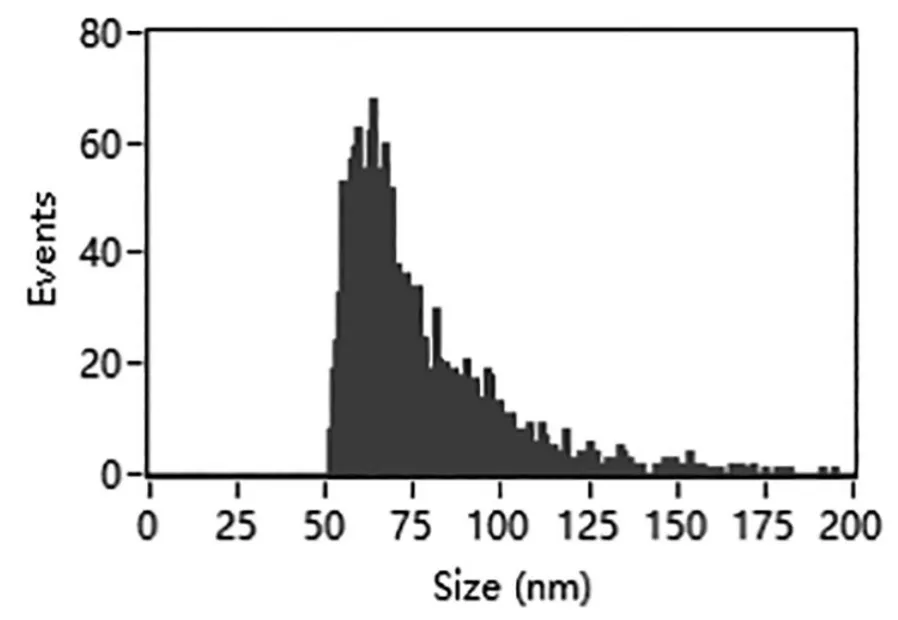
图3 MIHA外泌体的Nano FCM检测结果
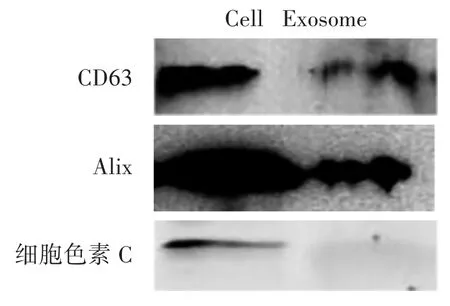
图4 HepG2细胞及外泌体相关蛋白表达
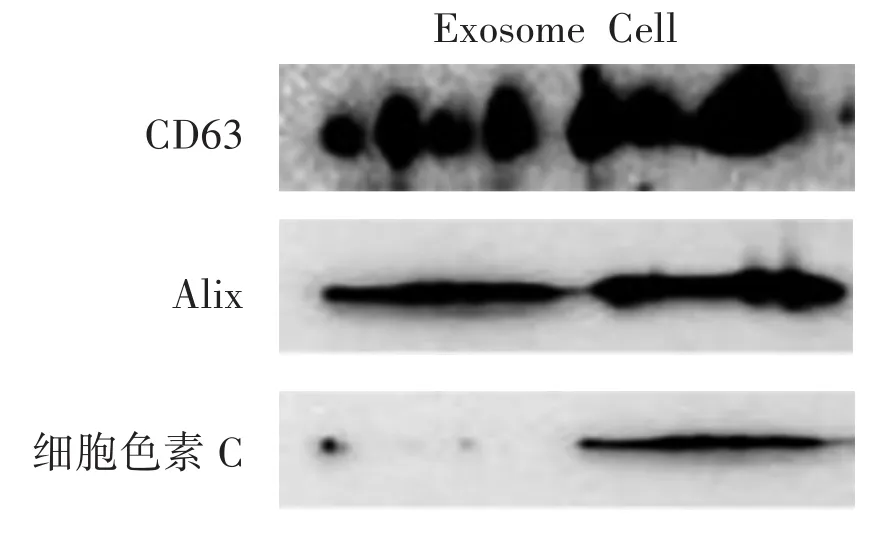
图5 MIHA细胞及外泌体相关蛋白表达
3.4 HepG2细胞来源外泌体对DC成熟的影响 流式检测DC各表面分子表达结果见图5。流式检测发现,与仅加入LPS的对照组相比,HepG2外泌体刺激的DC表达CD80和CD83的细胞比例明显下降,差异有显著性意义(P<0.01),并呈一定的浓度依赖性,即外泌体含量越高阳性率越低;MIHA-EXO组较单独LPS组无明显差异,结果见表1。而HepG2外泌体刺激的DC表达CD86、HLA-DR的比例与LPS对照组比较无明显差异,阳性率均在95%以上(图5)。
表1 HepG2细胞来源外泌体对DC中CD80、CD83表达的影响 (±s)
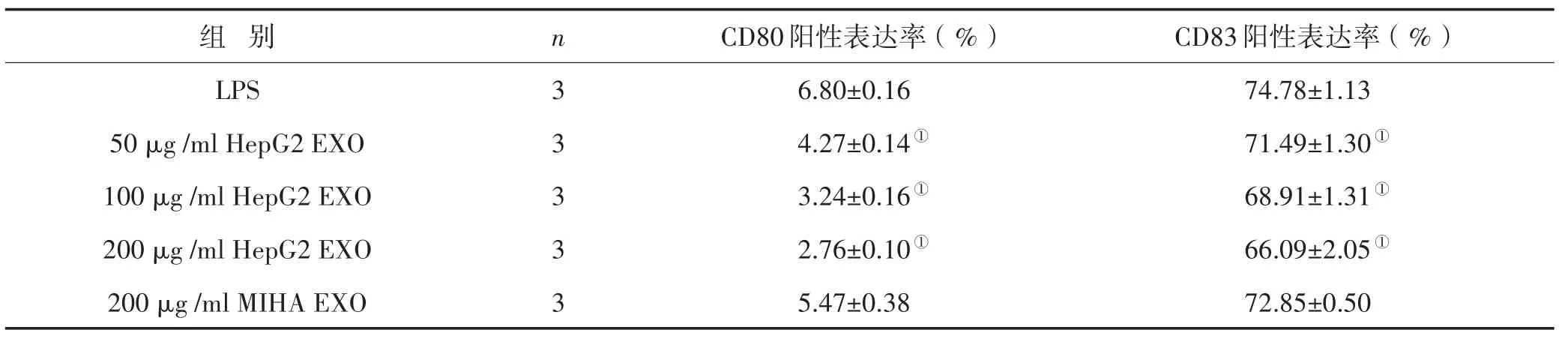
表1 HepG2细胞来源外泌体对DC中CD80、CD83表达的影响 (±s)
注:与LPS组比较,①P<0.01
组 别LPS 50μg/ml HepG2 EXO 100μg/ml HepG2 EXO 200μg/ml HepG2 EXO 200μg/ml MIHA EXO n 3 3 3 3 3 CD80阳性表达率(%)6.80±0.16 4.27±0.14①3.24±0.16①2.76±0.10①5.47±0.38 CD83阳性表达率(%)74.78±1.13 71.49±1.30①68.91±1.31①66.09±2.05①72.85±0.50
3.5 HepG2外泌体对DC分泌IL-12的影响 见表2。结果显示,与LPS对照组相比,浓度为200μg/ml的HepG2 EXO干预组DC培养上清液中IL-12的量明显减少,差异具有统计学意义(P<0.05),50 μg/ml、100 μg/ml HepG2 EXO干预组则无明显差异(P>0.05),提示肝癌细胞外泌体浓度较高时对DC分泌IL-12有抑制作用。200μg/ml的MIHA EXO组较单独LPS组无显著差异(P>0.05)。
3.6 HepG2外泌体对DC刺激淋巴细胞增殖效应的影响 见表3。
结果表明,与LPS对照组比较,200μg/ml HepG2 EXO对DC刺激淋巴细胞增殖效应的刺激指数明显降低(P<0.05),而50μg/ml、100μg/ml HepG2 EXO干预后差异不明显(P>0.05),这说明较高浓度的肝癌细胞外泌体可以抑制DC刺激异体T细胞增殖的能力。200μg/ml MIHA EXO组较单独LPS组无显著差异(P>0.05)。
4 讨论
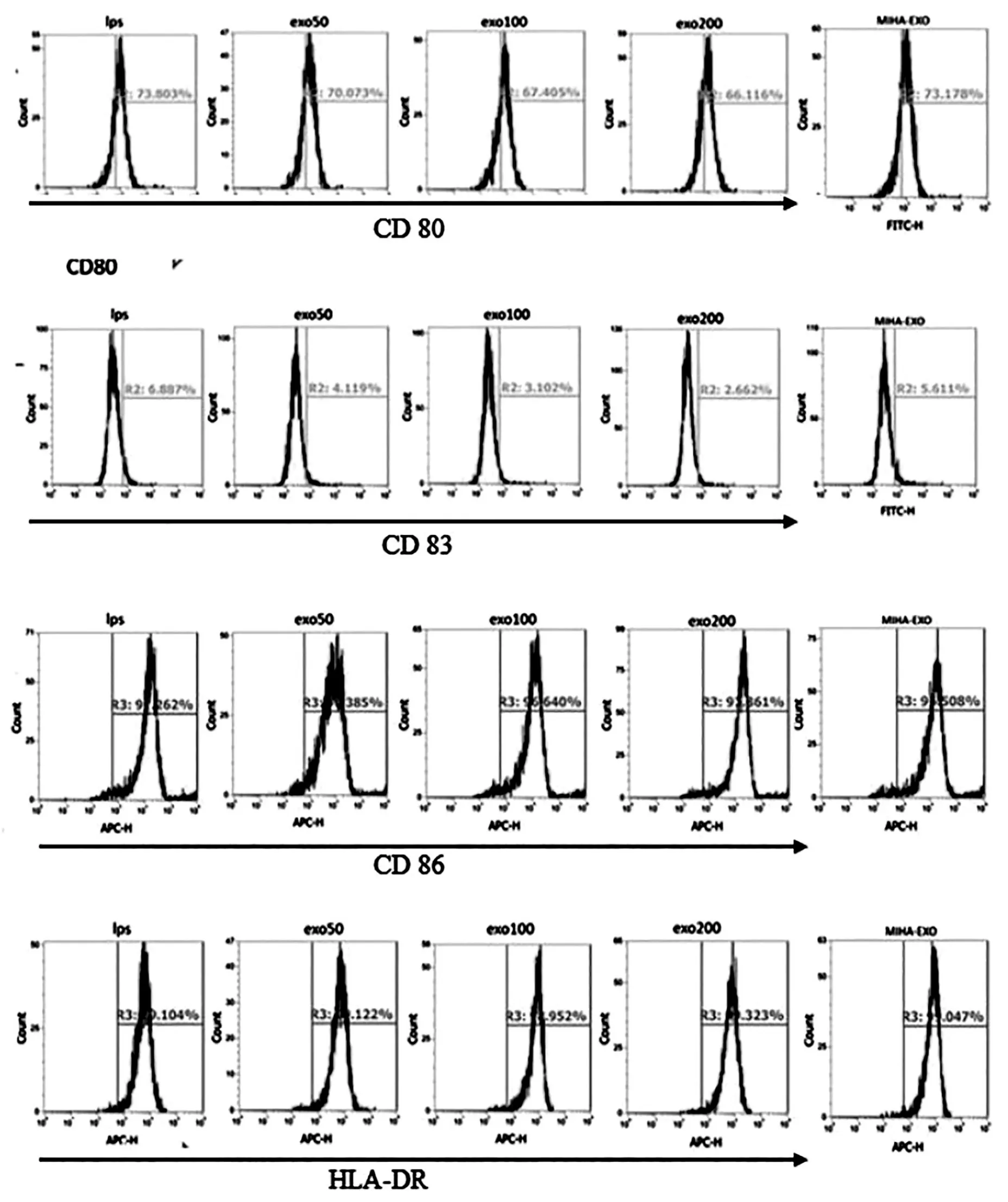
图5 流式检测DC表面分子表达结果
表2 ELISA检测DC培养上清液中细胞因子IL-12的浓度 (±s)
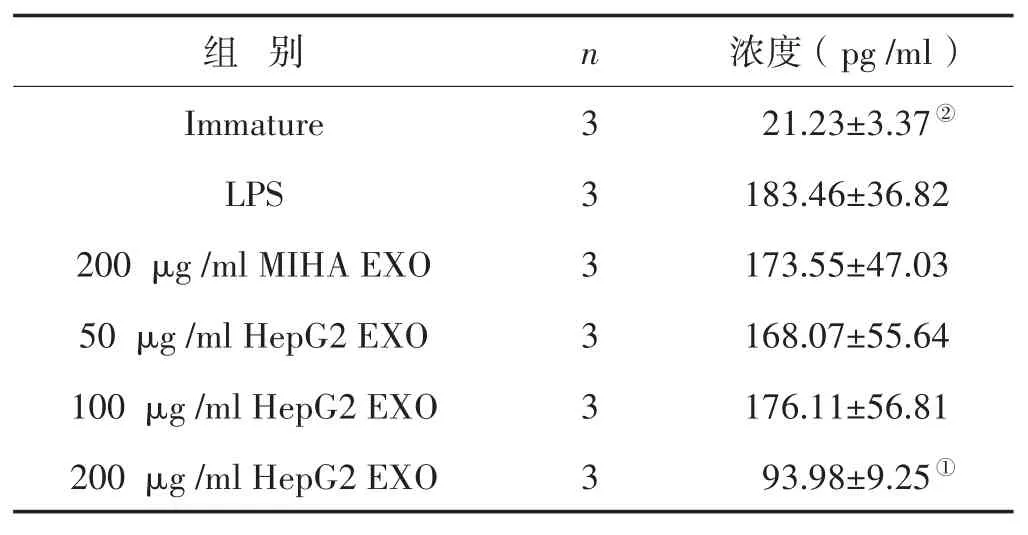
表2 ELISA检测DC培养上清液中细胞因子IL-12的浓度 (±s)
注:与LPS组比较,①P<0.05,②P<0.01
组 别Immature LPS 200μg/ml MIHA EXO 50μg/ml HepG2 EXO 100μg/ml HepG2 EXO 200μg/ml HepG2 EXO n 3 3 3 3 3 3浓度(pg/ml)21.23±3.37②183.46±36.82 173.55±47.03 168.07±55.64 176.11±56.81 93.98±9.25①
表3 HepG2外泌体对DC刺激淋巴细胞增殖效应的刺激指数 (±s)
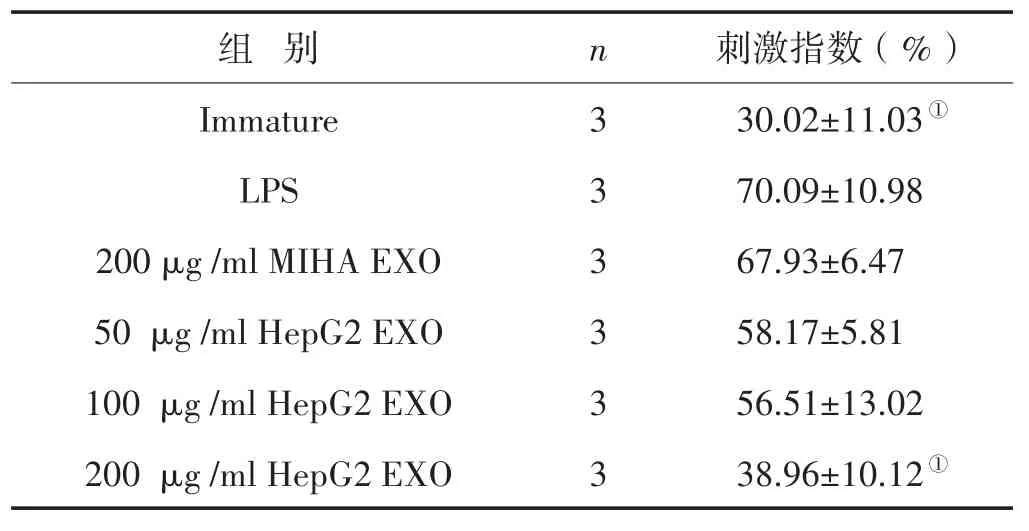
表3 HepG2外泌体对DC刺激淋巴细胞增殖效应的刺激指数 (±s)
注:与LPS组比较,①P<0.05
组 别Immature LPS 200μg/ml MIHA EXO 50μg/ml HepG2 EXO 100μg/ml HepG2 EXO 200μg/ml HepG2 EXO n 3 3 3 3 3 3刺激指数(%)30.02±11.03①70.09±10.98 67.93±6.47 58.17±5.81 56.51±13.02 38.96±10.12①
DC是人体内最重要的抗原提呈细胞,对天然免疫与特异性免疫有着重要的连接作用,DC可以活化初始T淋巴细胞,在人体抗肿瘤特异性免疫应答的启动中发挥着重要作用[21]。不成熟的DC通过表达模式识别受体,可识别并摄取外源性抗原,还有很强的抗原加工能力,但是由于其低表达MHCⅡ类分子、黏附分子以及CD80、CD83、CD86等共刺激分子,所以不成熟的DC激活免疫应答的能力较弱[22-23]。当不成熟的DC接触到LPS等炎性刺激剂后可以逐渐发育成熟。成熟的DC识别、摄取和加工抗原的能力减弱,但是高表达MHCⅡ类分子、黏附分子和共刺激分子,因此能有效地提呈抗原、诱导T细胞活化,启动特异性免疫应答。在肿瘤微环境中DC常常是不成熟的,因此无法诱导有效的特异性抗肿瘤免疫应答,原因主要有两个方面:一方面是因为肿瘤细胞存在抗原的缺失和抗原调变,使不成熟DC难以识别和摄取肿瘤抗原;另一方面,肿瘤微环境中的特异性抑制信号可以抑制DC的成熟,并且使得其变成具有免疫抑制作用的DC。TEXs作为肿瘤细胞物质运输与信息传递的载体,在肿瘤免疫抑制中发挥重要作用,其不仅能促进局部肿瘤微环境的形成,还因其具有脂质双层膜的结构,可以稳定地远距离运输,作用于全身,这一功能与肿瘤的转移密切相关。研究表明多种恶性肿瘤的TEXs可以诱导DC的成熟抑制、免疫耐受、抗原提呈功能下降或丧失等[17,24-25],但是肝癌来源的 TEXs对 DC 功能抑制的研究还较少。本研究发现,肝癌细胞HepG2来源的外泌体对DC表面CD80、CD83的表达有一定抑制作用。CD80是DC提供T细胞活化“第二信号”的重要分子,如果缺乏CD80等共刺激分子提供的“第二信号”,则接受了“第一信号”的T细胞不但不能被激活产生特异性免疫应答,反而会发生失能[26-27]。CD83是DC的成熟标记之一,肿瘤组织中的树突状细胞CD83分子表达量的高低是评判肿瘤预后的指标之一,CD83表达越低则预后越差[28-29]。本研究发现肝癌外泌体降低了DC这两种分子的表达,提示肝癌细胞通过外泌体途径诱导全身性的免疫抑制是一种促进肿瘤发展与转移的可能机制。IL-12又称细胞毒性淋巴细胞成熟因子(cytotoxic lymphoctyto maturation factor,CLMF)或自然杀伤细胞刺激因子(natural killer cell stimulation factor,NKSF),其是在 Th1 细胞分化和Th1型细胞因子介导的抗肿瘤免疫和抗炎症免疫中发挥作用的最重要细胞因子,主要由活化的巨噬细胞、DC和中性粒细胞产生,可通过促进IFN-γ的产生诱导CD4+Th0细胞向Th1细胞分化,在Th1反应中处于不可或缺的地位[30-32]。IL-12作为一种细胞因子和免疫调节因子有直接抗肿瘤作用,在原发性、继发性肿瘤的抗肿瘤免疫反应中均发挥重要作用[33-34],我们发现,肝癌外泌体有较强的抑制DC分泌IL-12的免疫抑制效应,说明肝癌外泌体可以导致DC的抗肿瘤免疫功能降低。在混合淋巴细胞反应中,我们利用CCK-8试剂检测各孔淋巴细胞的相对增殖数量,CCK-8试剂中含有WST-8,在电子载体PMS的作用下可以与细胞中线粒体内的某些脱氢酶发生反应,生成甲瓒产物(Formazan dye),该物质具有高度水溶性,呈橙黄色。当活细胞数量越多时,甲瓒的生成也越多,颜色就越深,根据这一特性可以用酶标仪测量450 nm处的吸光度来判断各孔中活细胞相对数量,并且CCK-8试剂对细胞毒性也非常小,一般不会对细胞生长状态造成影响[35]。混合淋巴细胞反应可以直接反映DC诱导同种异体T淋巴细胞增殖的能力,成熟的DC诱导异体T淋巴细胞增殖的能力较强,本研究观察到较低剂量(50μg/ml、100μg/ml)的肝癌细胞外泌体没有明显影响DC刺激异体T淋巴细胞的能力,而高剂量(200μg/ml)肝癌细胞外泌体可以使DC刺激指数降低,进一步验证了肝癌细胞外泌体对DC的免疫功能抑制。
综上,肝癌细胞外泌体对DC表面成熟相关分子表达、介导抗肿瘤免疫的细胞因子IL-12的分泌、刺激同种异体T淋巴细胞增殖的能力均有一定的抑制作用,这为我们理解肝癌的免疫逃逸及发展、转移提供了思路,同时也为肝癌的免疫治疗,特别是DC相关的免疫治疗提供了理论基础。
