2株海鞘共附生真菌的次生代谢产物研究
2019-09-03乔玉宝樊成奇唐莹莹田晓清
乔玉宝,樊成奇,唐莹莹,田晓清
(1.中国水产科学研究院东海水产研究所,上海 200090;2.上海海洋大学,上海 201306;3.农业部远洋与极地渔业创新重点实验室,上海 200090;4.农业部东海渔业资源开发利用重点实验室,上海 200090)
海洋环境一般具有高盐和寡营养等特点,一些局部海区还具有高压、低温和低光照等特征,这些特殊性导致生活在其中的很多生物尤其是微生物在长期的适应性进化过程中可能会产生一些有别于陆地生物的防御体系,从而使得它们成为抗肿瘤、抗菌、抗病毒和抗心血管疾病等药物先导化合物的重要来源[1]。在新结构海洋天然产物中,海洋真菌和放线菌来源分别占8.5%和3.5%,脊索动物海鞘的次级代谢产物也占到4.7%,它们都是结构新颖的海洋天然产物重要来源[2]。
我国海鞘资源丰富,已记录的中国沿海海鞘分布在渤海5种、黄海21种、东海24种、南海53种,种类合计有 70余种,其中许多属种如Hartmeyeria等为我国所特有[3-4]。目前国内海鞘的次级代谢产物研究与国际先进水平还存在一定差距,主要集中在瘤海鞘属柄海鞘(Styela clava)[5]和短腹海鞘属星座美洲海鞘(Aplidium constellatum)[6]。中国学者对海鞘共附生微生物的次级代谢产物研究也还处于起步阶段,早期文献报道了香豆素类新结构化合物来源于海鞘的青霉菌[7];2017年,裴召苓等[8]从中国黄海的威海海域柄海鞘来源放线菌Streptomyces coelicoflavus(HQA809)中分离鉴定了2个吡喃酮类化合物,从菊海鞘(Botryllus schlosseri)来源的Nocardiopsis dassonvillei(HQA404)中分离鉴定了1个吩嗪类化合物和1个苯酚类化合物,其中吩嗪类化合物对鳗弧菌(Vibrio anguillarum)和副溶血弧菌(V.parahaemolyticus)的MIC值分别为50 μM和25μM,显示出很好的活性。本课题组前期也进行了不同海鞘化学成分的研究[9-11]以及中国各海区的海鞘共附生微生物资源的持续收集和活性次级代谢产物的基础研究[12]。在此基础上,本文研究了分离自瘤海鞘属皱瘤海鞘(S.plicata)和冠瘤海鞘(S.canopus)样品的共附生真菌Purpureocillium sp.FBZ-1和Penicillium sp.BNG-1的次级代谢产物,以期为今后海鞘共附生微生物代谢产物的相关研究提供参考资料。
1 材料与方法
1.1 材料与试剂
生物材料:新鲜海鞘于2015年3月23、24日分别采自广西北海南汅(冠瘤海鞘)和防城港白龙码头(皱瘤海鞘),海水冲洗后立即封装于无菌管内,冷藏保存运输至实验室,海鞘品种由东海水产研究所樊成奇研究员鉴定。
微生物鉴定材料:真菌DNA小剂量快速提取试剂盒(上海生工生物公司);18S引物(上海美吉生物公司);PCR扩增体系(康为世纪)。
色谱填料和试剂:HP-20大孔吸附树脂(Mitsubishi Chemical,Japan);凝胶 Sephadex LH-20(Pharmacia Biotech,Sweden);凝胶 Sephadex G-25(Pharmacia Biotech,Sweden);预制 GF254 TLC硅胶板(青岛海洋化学公司);液相用乙腈、甲醇(色谱级,Tedia,USA);其余溶剂均为分析纯(AR,上海国药集团)。
分离培养基:孟加拉红固体培养基(葡萄糖10.0 g,蛋白胨 5.0 g,磷酸二氢钾 1.0 g,硫酸镁0.5 g,琼脂20.0 g,1/3000孟加拉红溶液100 mL,陈海水 1 000 mL)[13];PDA固体培养基(马铃薯200.0 g,葡萄糖10.0 g,琼脂18.0 g,陈海水1 000 mL);YPD固体培养基(酵母膏10.0 g,蛋白胨 20.0 g,葡萄糖20.0 g,琼脂18.0 g,陈海水1 000 mL)。用于分离菌株时每种培养基添加氯霉素和萘啶酮酸各 30 U·mL-1,pH 6.0~6.5[14]。
发酵培养基:YPD液体培养基。
1.2 仪器
超净工作台:北京东联哈尔仪器有限公司DL-CJ-INDII型;高压灭菌器:上海申安医疗器械厂LDZX-75KBS型;大型恒温培养箱:Shanghai Chemstar Instruments Co.,Ltd ATB-032型;电热恒温鼓风干燥箱:上海一恒科技有限公司DHG-9123A型;微生物恒温培养箱:上海一恒科技有限公司DHP 9162A型;高速微量离心机:上海生工生物有限公司HICO 21型;PCR仪:杭州朗基科学仪器有限公司AG-22331型;凝胶成像系统:上海天能科技有限公司GIS-1600型;超声仪:上海汉克科学仪器有限公司SK250LH型;旋转蒸发仪:上海亚荣生化仪器厂RE-2000;显微镜:上海光学仪器一厂XSP-44X.9型;半制备 HPLC系统:Shimadazu LC-20AT pump,SIL-20A auto sampler,SPD-M20A PDA detector以及 YMC-Pack ODS-AQ column(250×10 mm,S-5μm,12 nm,常用进样量 100μL,流速 2.5 mL·min-1);UV:Shimadzu SPD-M20A PDA detector; ESI-MS:Finnigan LCQ DECA instrument;NMR:Bruker AM-400 spectrometer(TMS内标);LC-MS:Agilent 1290 HPLC-6224 TOF MS;波谱学技术1H-NMR(400 MHz)、13C-NMR(126 MHz)等。
1.3 共附生微生物的分离和培养
1.3.1 菌株的分离纯化
将冠瘤海鞘和皱瘤海鞘样品在超净工作台内剪碎,分别称取1 g左右海鞘样品加入到装有10 mL无菌水的50 mL无菌管中,震荡混匀后静置于4℃冰箱过夜。将样品悬液进行1×10-1、1×10-2、1×10-3的梯度稀释,每个梯度分别取100μL涂布于孟加拉红、PDA和YPD固体培养基上,由于菌种的适宜生长环境是27℃左右,故将培养皿放于27℃培养箱中倒置培养[15]。培养约1~2周后长出菌落,根据颜色、形态等特征挑取差异较大的菌落,接种至相应新鲜培养基上继续分离培养。最终得到的菌株保存于相应的斜面培养基上,置于4℃冰箱保种。
1.3.2 菌落形态观察
由于课题研究真菌的次级代谢产物,根据菌株形态挑选出疑似真菌纯化菌株接种在YPD平板培养基,27℃下倒置培养7~10 d,观察并记录菌落大小、颜色、质地、有无分泌物等特征[16]。载玻片上滴一滴清水,刮取少量菌丝体和孢子在清水中分散均匀,盖上盖玻片,在光学显微镜下观察菌丝形态、直径等特性和孢子的颜色、外形并记录[17]。
1.3.3 菌株18S rDNA-ITS序列分析
将真菌发酵液减压抽滤得菌丝体。取适量菌体,加入液氮充分研磨至粉末状[18]。使用真菌DNA小剂量快速提取试剂盒提取真菌基因组DNA,并于 -20℃保存备用。采用 18S-EF3:TCCTCTAAATGACCRAGTTTG和 18S-EF4:GGAAGGGRTGTATTTATTAG,扩增真菌 18S rDNA-ITS序列。
PCR扩增体系为50μL∶2×Taq PCR Master Mix 25μL,引物各2μL,模板 DNA 5μL,重蒸水16μL。扩增程序:94℃预变性5 min,94℃变性30 s,56℃退火30 s,72℃延伸1 min,共35个循环,最后72℃延伸10 min[19]。取5μL PCR扩增产物经质量分数为1%的琼脂糖凝胶,100 V电泳30 min,检测 DNA大小,然后用凝胶成像分析系统拍照。提取的DNA-20℃保存之后送上海美吉生物医药科技有限公司测序。所测结果在NCBI网站比对,种属归类。
1.4 FBZ-1菌株代谢产物分离纯化
1.4.1 FBZ-1菌株发酵
配制两瓶300 mL YPD液体培养基,置于500 mL三角瓶中,121℃高温灭菌30 min,再接入经过活化培养的FBZ-1菌株,20℃、160 r·min-1进行摇床发酵培养,5 d后得到种子发酵液。将种子液按一定比例接种于含有0.75 L YPD液体培养基的2 L三角瓶中,在20°C、160 r·min-1分两批进行摇床发酵培养,每批发酵培养一周,共得到约20 L发酵液。
1.4.2 FBZ-1化合物的提取分离
菌株FBZ-1的20 L发酵液经抽滤分为胞外滤液和菌体两部分。因菌体和发酵液极性不一样,故菌体用甲醇和丙酮超声提取,发酵液用乙酸乙酯萃取。菌体置于-80℃冰箱中冷冻,然后取出自然解冻破壁,依次加入2 L的丙酮和甲醇(MeOH)超声破碎,分别提取2次,提取液减压低温浓缩除去有机溶剂。将胞内水溶液上Middle Chromatogram Isolated gel(MCI gel),用水洗脱 4个柱体积1 200 mL,再用 MeOH/H2O(10∶90)洗脱900 mL,洗脱液舍弃;继续依次用MeOH/H2O(40∶60→60∶40→80∶20→100∶0)梯度洗脱,每梯度洗脱液用量均为1 200 mL。胞外滤液用旋转蒸发仪浓缩至1 L,用乙酸乙酯按照1∶1萃取4次,将上层的乙酸乙酯相浓缩后,用40%MeOH超声震荡溶解后过MCIgel,也依次用MeOH/H2O(40∶60→60∶40→80∶20→100∶0)对 MCIgel中的浓缩液进行梯度洗脱,每梯度洗脱液用量均为2 500 mL。将胞外、胞内同梯度的洗脱液分别合并,浓缩蒸干,得到 40%Me(3.54 g)、60%Me(1.63 g)、80%Me(0.35 g)和100%Me(1.70 g)4个部位。
最主要的40%Me部分用水溶解后过MCI gel,依次用 MeOH/H2O(10∶90→20∶80→35∶65→50∶50→100∶0)进行梯度洗脱,每个梯度洗脱 1 L浓缩蒸干得到40%MeI(2.36 g)、40%MeⅡ(3.82 g)、40%MeⅢ(2.70 g)和 40%MeⅣ(1.81 g)。
40%MeI部分过正相硅胶柱,依次用CHCl3/MeOH/H2O(6∶1∶0.1→5∶1∶0.1→4∶1∶0.1→3∶1∶0.1)进行梯度洗脱,每个梯度洗脱1 L得到40%MeIa和40%MeIb,其中40%MeIa经 HPLC反复进样制备,分离得到化合物1(4 mg,17.83 min)。流动相为乙腈-水(均含0.1%三氟乙酸):0 min,15%乙腈;7 min 30 s,20%乙腈;8 min,30%乙腈;14 min 30 s,40%乙腈;14 min 42 s,70%乙腈;18 min 30 s,70%乙腈;19 min,15%乙腈。40%MeIb部分经检测后不做处理。
40%MeⅡ部分用反相RP-18柱色谱,依次用CH3CN/H2O(15∶85→25∶75→60∶40→80∶20→100∶0)进行梯度洗脱,每个梯度洗脱1L,将洗脱液浓缩蒸干得到40%MeⅡa和40%MeⅡb两个部分。其中40%MeⅡa部分经HPLC反复进样制备得到40%MeⅡa1、40%MeⅡa2和其余部分,40%MeⅡa1部分过正相硅胶柱,依次用CHCl3/MeOH(20∶1→16∶1→12∶1)进行梯度洗脱,每个梯度洗脱 500 mL,得到化合物 2(4 mg);40%MeⅡa2部分经Sephadex LH-20凝胶柱层析分离,用70%乙醇洗脱300 mL得到化合物3(6 mg)和化合物 4(5 mg)。
40%MeⅢ部分经Sephadex LH-20凝胶柱层析分离,70%无水乙醇洗脱,得到40%MeⅢa、40%MeⅢb、40%MeⅢc 3个部分,其中 40%MeⅢb部分经HPLC反复进样制备,得到化合物5(12 mg,14.42 min)、化合物 6(12 mg,14.42 min)、化合物 7(3 mg,16.05min)和化合物 8(2 mg,19.26 min)。液相流动相为乙腈-水(均含0.1%三氟乙酸):0 min,15%乙腈;2 min,20%乙腈;14 min,25%乙腈;21 min,45%乙腈;21 min 30 s,70%乙腈;24 min 30 s,70%乙腈;25 min,15%乙腈。40%MeⅢc部分经HPLC反复进样制备,浓缩得到化合物9(5 mg,26.42 min)。流动相为乙腈-水(均含0.1%三氟乙酸):0 min,15%乙腈;2 min,20%乙腈;14 min,25%乙腈;24 min,45%乙腈;24 min 30 s,70%乙腈;26 min 30 s,70%乙腈;27 min,15%乙腈。
60%Me部分经薄层层析和HPLC-TOF MS分析未发现有价值的成分,故不做处理。
80%Me经 MeOH溶解后用粗硅胶(200~300目)拌样上硅胶柱,依次用 CHCl3/MeOH(40∶1→30∶1→20∶1)进行梯度洗脱,每个梯度洗脱500 mL,得化合物 10(37 mg)。
1.5 BNG-1菌株代谢产物分离纯化
1.5.1 BNG-1菌株发酵
配制300 mL YPD液体培养基,置于500 mL三角瓶中,高温灭菌(121℃,30 min),再接入经过活化培养的BNG-1菌株,进行发酵培养。选取发酵培养的条件为20℃、160 r·min-1,5 d后得到种子发酵液。将种子液按一定比例接种于含有约0.75 L YPD液体培养基的2 L三角瓶中,在20℃、160 r·min-1条件下进行摇床发酵培养,每批发酵24瓶培养一周,两批共得到36 L发酵液。第3批和第4批采用无菌的20 L发酵罐培养,在20℃、100 r·min-1条件下培养两周,又得到40 L发酵液。
1.5.2 BNG-1化合物的提取分离
菌株BNG-1的76 L发酵液经抽滤分为胞外滤液和菌体两部分,菌体放在自封袋做好标记置于-80℃冰箱中冷冻待用。胞外滤液用旋转蒸发仪浓缩至5 L左右,由于浸膏较多,采用萃取将化学极性部位分段后再采用柱色谱层析进行分离纯化。用乙酸乙酯按1∶1萃取后分成水相和乙酸乙酯相,其中乙酸乙酯相用水(含20%的MeOH)溶解后用石油醚按1∶1萃取4次,下层水相另作处理。将萃取后的石油醚相浓缩蒸干,用石油醚、水以及甲醇等溶剂均难溶,用丙酮溶解后分层,取上清液粗硅胶拌样过正相硅胶柱,依次用 CHCl3/MeOH/H2O(5∶1∶0.1→4∶1∶0.1→3∶1∶0.1→2∶1∶0.1)进行梯度洗脱,每个梯度洗脱500 mL,分成4个部分,分别为 PEI、PEⅡ、PEⅢ和 PEⅣ。其中 PEI过正相硅胶柱,依次用CHCl3/MeOH(10∶1→8∶1→6∶1→5∶1)进行梯度洗脱,每个梯度洗脱 300 mL,得到 PEIa、PEIb、PEIc 3个部分。PEIa部分过凝胶柱,用乙醇等梯度洗脱,得到PEIa1、PEIa2和PEIa3 3个部分。其中PEIa1经HPLC反复进样制备得到化合物11(76 mg,16.96 min)和化合物 12(15 mg,26.62 min)。进样量 60μL,流动相为乙腈-水(均含0.1%三氟乙酸):0 min,25%乙腈;2 min,25%乙腈;14 min,35%乙腈;25 min,60%乙腈;25 min 30 s,70%乙腈;28 min 30 s,70%乙腈;29 min,25%乙腈。PEIb部分通过正相硅胶柱,依次用CHCl3/MeOH(10∶1→8∶1→6∶1→5∶1)进行梯度洗脱,每个梯度洗脱300 mL,得化合物13(278 mg)。PEIc部分用氯仿溶解后经正相硅胶柱,依次用 CHCl3/MeOH(10∶1→8∶1→6∶1→5∶1)进行梯度洗脱,每个梯度洗脱300 mL,分别得化合物14(15 mg)和化合物15(10 mg)。
菌体置于-80℃冰箱中冷冻,然后取出自然解冻破壁,依次加入2 L的丙酮和甲醇(MeOH)超声破碎30min,分别提取3次,提取液减压浓缩得到总浸膏。将浸膏用水/石油醚按1∶1萃取4次,将萃取后的水相与之前胞外的水相合并,减压浓缩除去残余的石油醚,过大孔吸附树脂柱,用水洗脱3个柱体积,再用 MeOH/H2O(10∶90)洗脱6 L,洗脱液舍弃。继续依次用MeOH/H2O(30∶70→60∶40→85∶15→100∶0)梯度洗脱,每个梯度用量分别为6 L,浓缩得到30%Me(53.86 g)、60%Me(48.74 g)和 85%Me(17.88 g)3个部分。
30%Me过反相RP-18柱,先用10%MeOH洗脱900 mL除杂,再依次用20%MeOH、30%MeOH和50%MeOH洗脱,每个梯度洗脱900 mL,减压浓缩得到 30%MeI(8.28 g)、30%MeⅡ(5.55 g)和 30%MeⅢ(4.69 g)。30%MeI部分用水溶解后过 G-25凝胶柱,用蒸馏水洗脱经HPLC分析检测后合并浓缩得到30%MeIa和30%MeIb两个部分。30%MeIa部分用H2O溶解后经HPLC反复进样制备,依次得到化合物16(3 mg,7.98 min)、化合物 17(20 mg,18.37 min)、化合物18(8 mg,22.09 min)和几个不纯的化合物Ia1、Ia2和Ia3。进样量40μL,流动相为乙腈-水(均含0.1%三氟乙酸):0 min,17%乙腈;2 min,17%乙腈;21 min,32%乙腈;22 min,70%乙腈;24 min 30 s,70%乙腈;25 min,17%乙腈。Ia2部分过凝胶柱得化合物19(20 mg)。30%MeIb也经HPLC反复进样制备,得到化合物化合物20(13 mg,12.43 min)、21(2 mg,14.90 min)和 1个混合物Ib1。进样量30μL,流动相为乙腈-水(均含 0.1%三氟乙酸):0 min,15%乙腈;2 min,15%乙腈;17 min,25%乙腈;18 min,70%乙腈;20.5 min,70%乙腈;21 min,15%乙腈。Ib1过正相硅胶柱,依次用 CHCl3/MeOH(6∶1→5∶1→4∶1)进行梯度洗脱,每个梯度洗脱300 mL得到化合物22(10 mg)。
60%Me(48.74 g)部分上正相硅胶柱,依次用 CHCl3/MeOH(16∶1→12∶1→10∶1→8∶1)进行梯度洗脱,每个梯度洗脱1.5 L,得到60%MeI、60%MeⅡ和60%MeⅢ3部分。其中60%MeI经凝胶柱分离得到MeIa、MeIb、MeIc和MeId 4个部分。其中MeIa部分经HPLC反复进样制备,得化合物 23(5 mg)、化合物 24(35 mg)。进样量 40 μL,流动相为乙腈-水(均含0.1%三氟乙酸):0 min,15%乙腈;2 min,15%乙腈;26 min,40%乙腈;27 min,80%乙腈;29 min 30 s,80%乙腈;30 min,15%乙腈。
85%Me部分用粗硅胶拌样上柱,依次用CHCl3/MeOH(20∶1→16∶1→12∶1→10∶1)进行梯度洗脱,每个梯度洗脱1 L得到9个部分,其中85%MeⅢ部分过凝胶柱,得到Ⅲa、Ⅲb、Ⅲc和Ⅲd。Ⅲd经过正相硅胶柱,依次用 CHCl3/MeOH(20∶1→16∶1→12∶1)进行梯度洗脱,每个梯度洗脱300 mL得到Ⅲd1,Ⅲd1经凝胶柱分离纯化,依次得化合物25(3 mg)、化合物 26(45 mg)。85%MeⅦ部分过正相硅胶柱,依次用 CHCl3/MeOH(20∶1→16∶1→12∶1→10∶1)进行梯度洗脱,每个梯度洗脱500 mL,得到Ⅶa、Ⅶb和Ⅶc。Ⅶa部分过凝胶柱得到Ⅶa1、Ⅶa2和Ⅶa3。Ⅶa3部分经HPLC反复进样制备,得到化合物27(15 mg,7.59 min)和化合物 28(8 mg,9.25 min)。进样量 50 μL,流动相为乙腈-水(均含0.1%三氟乙酸):0 min,40%乙腈;2 min,40%乙腈;3 min,50%乙腈;15 min,60%乙腈;15 min 30 s,40%乙腈。
2 结果与分析
2.1 菌种鉴定
2.1.1 显微镜菌丝形态观察
参照文献[20]中的方法将1.3.2中菌株形态观察结果记录如下(放大40倍观察),镜检结果显示菌株 FBZ-1(图1-a)、BNG-1(图1-b)符合真菌的形态特征。

表1 菌株FBZ-1、BNG-1菌丝体特征[20]Tab.1 M ycelium characters of strains FBZ-1 and BNG-1
2.1.2 测序结果
从这2株海鞘中也分离鉴定了其他共附生微生物,由于课题原因未做测序鉴定。菌株FBZ-1和BNG-1送样均测序拼接成功。将上海美吉生物医药科技有限公司所测结果在NCBI网站比对,种属归类如表2。
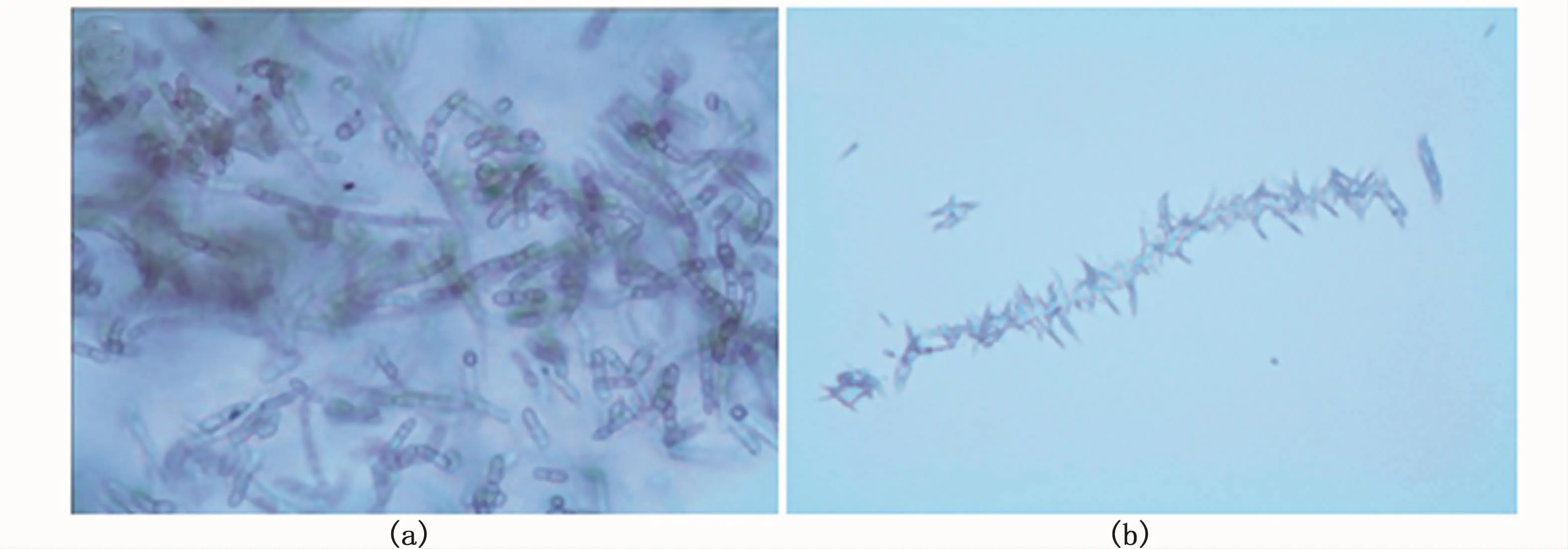
图1 菌株 FBZ-1(a)、BNG-1(b)的显微镜照片Fig.1 M icrophotographs of strains FBZ-1(a)and BNG-1(b)colony
从比对结果可以得出,FBZ-1属于淡紫拟青霉属,BNG-1属于青霉属。
2.2 真菌FBZ-1、BNG-1化合物的结构鉴定
从防城港白龙皱瘤海鞘共附生的淡紫拟青霉FBZ-1和北海南汅的冠瘤海鞘共附生的青霉BNG-1这2株真菌发酵液中,主要采用萃取和柱层析技术(MCI柱层析、正反相硅胶柱层析、凝胶柱层析及半制备高效液相色谱等)进行次级代谢产物的分离纯化,并运用波谱学技术(HPLC TOFMS、1H-NMR、13C-NMR等)和物理化学方法,鉴定了其中28个成分的化学结构。
化合物1:绿色固体。正离子模式的ESI-MS数据:m/z243.0879[M+H]+,265.069 8[M+Na]+,推断化合物 1对应分子式为C12H10N4O2。1H-NMR(CD3OD,400 MHz)数据如下:δH2.52(s,3H),2.54(s,3H),7.73(s,1H),7.93(s,1H)。13C-NMR(126 MHz,Pyr)δ 161.30,151.15,146.96,144.03,142.33,139.09,138.27,130.16,128.97(CH),126.43(CH),19.71(CH3),19.18(CH3)。数据与文献[21]报道一致,因此化合物1鉴定为已知生物碱类化合物lumichrome。
化合物2:荧光黄色无定型粉末。1H-NMR(CD3OD,400 MHz)数据如下:δH0.95(t,J=14.8 Hz,3H),1.02(d,J=6.8 Hz,3H),1.43(d,J=6.8 Hz,3H),1.50(m,1H),1.96(m,1H),2.52(m,1H),3.89(m,1H),4.02(m,1H)。数据与文献[22]报道一致,因此化合物2鉴定为已知化合物环(异亮氨酸-丙氨酸)。
化合物3:白色固体。正离子模式的ESI-MS数据:m/z 217.0966[M+H]+,433.186 4[2M+H]+,推断化合物 3对应分子式为C12H12N2O2。1H-NMR(CD3OD,400 MHz)数据如下:δH3.07(m,1H),3.43(m,1H),3.97(m,1H),4.42(s,1H),4.61(s,1H),7.04(m,1H),7.13(m,1H),7.32(m,1H),7.48(m,1H)。数据与文献[23]报道一致,因此化合物3鉴定为已知生物碱类 1,2,3,4-四氢-β-咔啉-3-羧酸。
化合物4:黄色固体。1H-NMR(CD3OD,400MHz)数据如下:δH7.47(m,1H),7.79(m,2H),8.45(m,2H),8.68(d,J=12.0 Hz,1H),9.12(s,1H)。数据与文献[24]报道一致,因此化合物4鉴定为已知生物碱类化合物β-咔啉。

表2 18S rDNA序列与NCBI中已知序列的比对结果Tab.2 18S rDNA sequences com pared w ith known sequences in NCBI
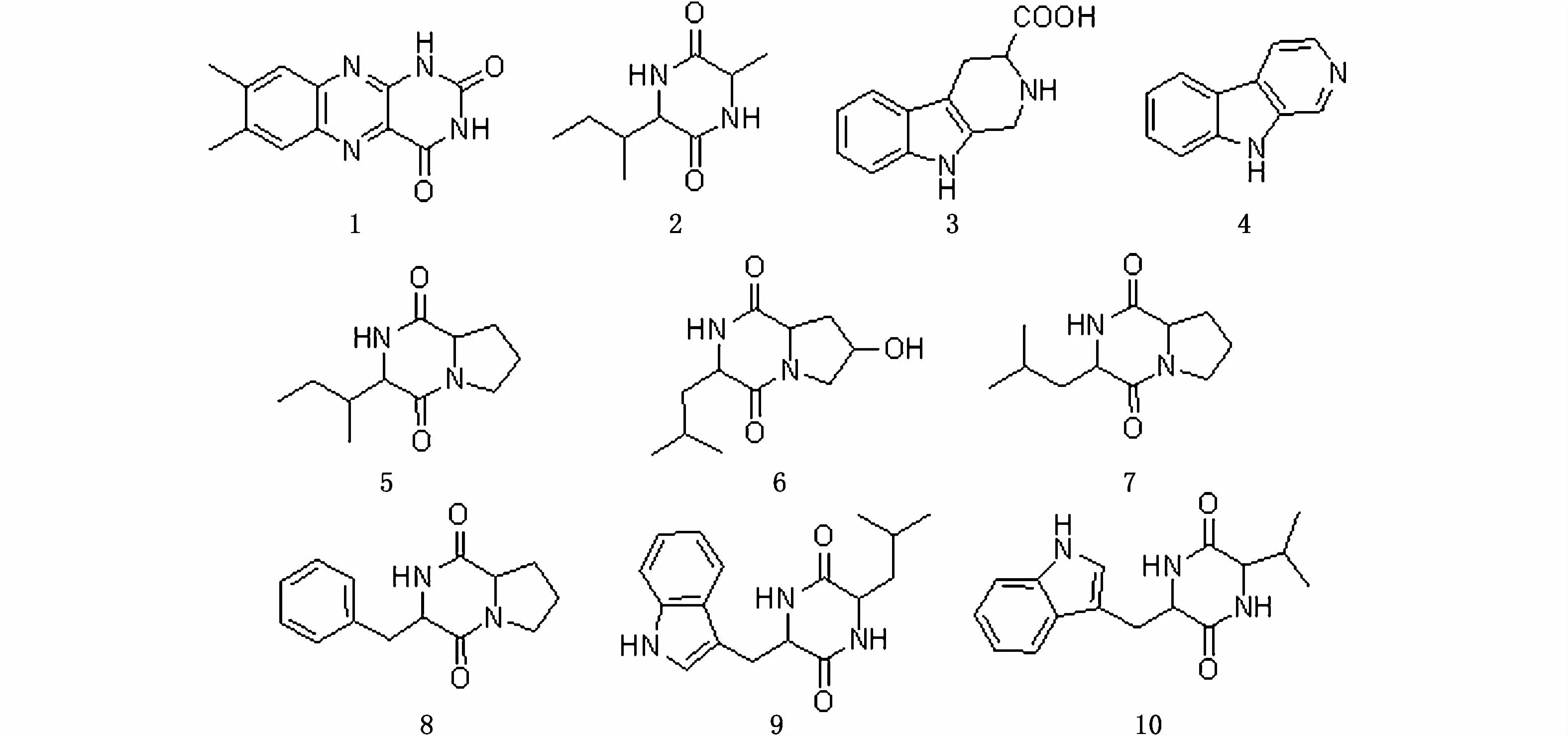
图2 菌株FBZ-1中化合物1~10的结构Fig.2 Structures of com pounds 1~10 from FBZ-1
化合物5:黄色固体。准分子离子峰为m/z 211.143 8 [M+H]+,推 断 分 子 式 为C11H18N2O2。1H-NMR(CD3OD,400 MHz)数据如下:δH0.93(t,J=6.7 Hz,3H),1.08(d,J=4.0 Hz,3H),1.34(m,1H),1.59(m,1H),1.79(m,1H),1.95(m,4H),2.18(m,1H),3.52(m,2H),3.87(d,J=3.2 Hz,1H),4.22(m,1H)。数据与文献[24]报道一致,因此化合物5鉴定为已知化合物环(异亮氨酸-脯氨酸)。
化合物6:黄色固体。正离子模式的ESI-MS数据:m/z227.138 4[M+H]+,249.120 4[M+Na]+,453.270 0[2M+H]+,475.252 0[2M+Na]+,推断化合物 6对应分子式为C11H18N2O3。1H-NMR(CD3OD,400 MHz)数据如下:δH0.98(d,J=4.0 Hz,3H),1.01(d,J=4.4 Hz,3H),1.46(m,1H),1.69(m,1H),2.04(m,3H),2.35(m,1H),3.57(m,2H),4.09(s,1H),4.28(t,J=10.8 Hz,1H)。数据与文献[24]报道一致,因此化合物6鉴定为已知化合物环(亮氨酸-羟基脯氨酸)。
化合物7:无色无定型粉末。正离子模式的ESI-MS数据:m/z 211.144 0[M+H]+,233.125 5[M+Na]+,推断化合物7对应分子式为 C11H18N2O2。1H-NMR(CD3OD,400 MHz)数据如下:δH0.97(m,6H),1.54(m,1H),1.93(m,3H),2.02(m,2H),2.31(m,1H),3.52(m,2H),4.15(m,1H),4.27(m,1H)。数据与文献[24]报道一致,因此化合物7鉴定为已知化合物环(亮氨酸-脯氨酸)。
化合物8:浅黄色无定型粉末。正离子模式的ESI-MS数据:m/z 245.128 3[M+H]+,推断化合物8对应分子式为 C14H16N2O2。1H-NMR(CD3OD,400 MHz)数据如下:δH1.24(m,1H),1.82(m,2H),2.10(m,1H),3.18(m,2H),3.39(m,1H),3.56(dd,J=18.8,8.0 Hz,1H),4.09(dd,J=11.2,2.8 Hz,1H),4.46(s,1H),7.27(m,5H)。数据与文献[24]报道一致,因此化合物8鉴定为已知化合物环(苯丙氨酸-脯氨酸)。
化合物9:淡黄色无定型粉末。正离子模式的 ESI-MS数据:m/z 300.169 9[M+H]+,推断化合物 9对应分子式为 C17H21N3O2。1H-NMR(CD3OD,400 MHz)数据如下:δH0.44(d,J=6.8 Hz,3H),0.57(d,J=6.4 Hz,3H),0.96(m,2H),1.06(m,1H),3.08(m,1H),3.45(m,1H),3.55(m,1H),4.24(m,1H),6.96(m,1H),7.06(m,2H),7.30(m,1H),7.58(m,1H)。数据与文献[25]报道一致,因此化合物9鉴定为已知化合物环(色氨酸-亮氨酸)。
化合物 10:黄褐色无定型粉末。1H-NMR(CDCl3,400 MHz)数据如下:δH0.77(d,J=6.4 Hz,3H),0.82(t,J=6.4 Hz,3H),1.26(m,2H),1.50(m,1H),3.26(m,1H),3.44(m,1H),3.86(m,1H),4.33(s,1H),6.33(s,1H),7.13(m,1H),7.21(m,1H),7.36(m,1H),7.62(m,1H)。数据与文献[26]报道一致,因此化合物10鉴定为已知化合物环(色氨酸-缬氨酸)。
化合物11:白色油状。正离子模式的ESIMS数据:m/z 164.110 4[M+H]+,推断化合物11对应分子式为 C10H13NO。1H-NMR(CD3OD,400 MHz)数据如下:δH1.89(s,1H),2.76(t,J=14.8 Hz,1H),3.37(t,J=14.8 Hz,1H),7.22(m,2H)。数据与文献[27]报道一致,因此化合物11鉴定为已知芳香胺类化合物N-乙酰苯乙胺。
化合物12:黄色固体。1H-NMR(CD3OD,400 MHz)数据如下:δH1.76(t,J=12.8 Hz,2H),2.61(t,J=15.2 Hz,2H),2.90(t,J=15.2 Hz,2H),3.55(t,J=12.8 Hz,2H),4.13(t,J=12.8 Hz,2H),7.22(m,5H)。13C-NMR(126MHz,MeOD)δ172.75,139.96,127.59(CH×2),127.43(CH×2),125.37(CH),60.57(CH2),57.38(CH2),35.03(CH2),30.75(CH2),30.08(CH2)。数据与文献[28]报道一致,因此化合物12鉴定为芳香胺类化合物N-(4-羟基)丁酰苯乙胺。
化合物13:黄褐色油状。正离子模式的ESIMS数据:m/z 105.071 4[M+H]+,122.096 9[M+NH4]+,推断化合物 13对应分子式为C8H11N。1H-NMR(CDCl3,400 MHz)数据如下:δH2.80(t,J=16.0 Hz,2H),3.10(t,J=15.6 Hz,1H),7.40(m,5H)。数据与文献[29]报道一致,因此化合物13鉴定为已知芳香胺类化合物苯乙胺。

图3 菌株BNG-1中化合物11~28的结构Fig.3 Structures of compounds 11~28 from BNG-1
化合物14:浅黄色结晶。1H-NMR(CD3OD,400 MHz)数据如下:δH2.66(t,J=15.2 Hz,2H),3.03(t,J=14.8 Hz,2H),7.03(m,3H),7.31(d,J=8.4 Hz,1H),7.52(d,J=8.0 Hz,1H)。数据与文献[30]报道一致,因此化合物14鉴定为已知芳香胺类化合物色胺,即吲哚乙胺。
化合物 15:黄色固体。1H-NMR(CDCL3,400 MHz)数据如下:δH2.78(t,J=15.2 Hz,2H),3.12(t,J=14.8 Hz,2H),3.48(s,3H),7.04(s,1H),7.13(t,J=14.4 Hz,1H),7.20(t,J=14.4 Hz,1H),7.36(d,J=8.0 Hz,1H),7.61(d,J=8.0 Hz,1H)。数据与文献[31]报道一致,因此化合物15鉴定为已知芳香胺类化合物N-甲基色胺。
化合物 16:淡黄色无定型粉末。1H-NMR(CD3OD,400 MHz)数据如下:δH0.96(m,3H),2.47(m,1H),2.94(m,1H),3.21(dd,J=17.6,10.0 Hz,1H),4.01(s,1H),4.36(s,1H),6.94(s,1H),7.29(m,5H),8.72(s,1H)。数据与文献[32]报道一致,因此化合物16鉴定为已知化合物环(苯丙氨酸-5-甲基-3,4-脱氢脯氨酸)。
化合物 17:褐色无定型粉末。1H-NMR(CD3OD,400 MHz)数据如下:δH1.73(d,J=6.5 Hz,3H),3.21(m,1H),3.44(m,1H),4.54(m,1H),7.05(m,1H),7.14(m,1H),7.33(m,1H),7.48(m,1H)。13C-NMR(126MHz,MeOD)δ169.45,136.02,128.67,124.82,121.19(CH),118.22(CH),116.70(CH),109.90(CH),103.16,50.96(CH),21.02(CH2),16.11(CH3)。数据与文献[33]报道一致,因此化合物17鉴定为已知生物碱类化合物 3,4-二氢-3-甲基-β-咔啉-1-酮。
化合物18:浅褐色固体。正离子模式的ESIMS数据:m/z206.0772[M+H]+,推断化合物18对应分子式为C11H11NO3。1H-NMR(CD3OD,400 MHz)数据如下:1H-NMR(CD3OD,400 MHz)数据如下:δH3.06(m,1H),3.24(m,1H),4.40(m,1H),7.09(t,J=14.0 Hz,1H),7.18(t,J=14.0 Hz,1H),7.23(s,1H),7.42(d,J=8.0 Hz,1H),7.68(d,J=7.2 Hz,1H)。数据与文献[34]报道一致,因此化合物18鉴定为已知生物碱类化合物2-羟基-3-吲哚丙酸。
化合物 19:黄褐色无定型粉末。1H-NMR(C5D5N,400 MHz)数据如下:δH2.86(m,2H),3.12(m,2H),7.15(d,J=7.8 Hz,1H),7.31(d,J=7.8 Hz,1H)。数据与文献[35]报道一致,因此化合物19鉴定为已知化合物对羟基苯乙胺。
化合物20:白色无定型粉末。正离子模式的ESI-MS数据:m/z[M+H]+,推断化合物 20对应分子式为 C16H16N4O2。1H-NMR(CD3OD,400 MHz)数据如下:δH0.79(m,1H),2.01(m,1H),3.20(m,1H),3.51(m,1H),4.07(m,1H),4.33(m,1H),7.06(t,J=14.8 Hz,1H),7.06(m,2H),7.43(m,1H),7.66(d,J=8.0 Hz,1H)。数据与文献[35]报道一致,因此化合物20鉴定为已知化合物环(色氨酸-天冬酰胺)。
化合物21:无色固体。1H-NMR(CD3OD,400 MHz)数据如下:δH3.25(m,1H),3.55(m,1H),4.14(s,1H),7.09(t,J=14.8 Hz,1H),7.18(t,J=15.2 Hz,1H),7.23(s,1H),7.42(d,J=8.0 Hz,1H),7.68(d,J=7.6 Hz,1H)。数据与文献[36]报道一致,因此化合物21鉴定为已知化合物色氨酸。
化合物22:黄色固体。1H-NMR(CDCl3,400 MHz)数据如下:δH0.98(m,12H),1.2-1.4(m,16H),1.70(m,2H),4.25(m,4H),7.63(m,2H),7.73(m,2H)。数据与文献[37]报道一致,因此化合物22鉴定为已知化合物邻苯二甲酸异辛酯。
化合物23:白色结晶。1H-NMR(CD3OD,400 MHz)数据如下:δH0.92(d,J=6.5 Hz,3H),1.08(d,J=6.5 Hz,3H),1.96(m,3H),2.31(m,1H),2.47(m,1H),3.52(m,2H),4.03(s,1H),4.20(t,J=14.0 Hz,1H)。数据与文献[24]报道一致,因此化合物23鉴定为已知化合物环(缬氨酸-脯氨酸)。
化合物 24:白色无定型粉末。1H-NMR(CD3OD,400 MHz)数据如下:δH0.94(m,6H),1.43(d,J=6.4 Hz,3H),1.60-1.85(m,3H),3.90(m,1H),4.02(m,1H)。数据与文献[38]报道一致,因此化合物24鉴定为已知化合物环(亮氨酸-丙氨酸)。
化合物 25:浅黄色固体。1H-NMR(CDCl3,400 MHz)数据如下:δH6.21(d,J=2.0 Hz,1H),6.34(d,J=2.0 Hz,1H),6.84(d,J=8.8 Hz,2H),7.36(d,J=6.8 Hz,2H),8.06(s,1H)。13C-NMR (126 MHz,MeOD)δ181.13,164.86,162.73,158.60,157.69,153.66(CH),130.25(CH×2),123.62,122.18,115.13(CH×2),105.15,98.99(CH),93.65(CH)。数据与文献[39]报道一致,因此化合物25鉴定为异黄酮类化合物5,7,4-三羟基异黄酮。
化合物 26:墨绿色无定型粉末。1H-NMR(C5D5N,400 MHz)数据如下:δH2.23(s,3H),2.30(s,3H),3.60(s,6H),7.87(s,1H),8.04(s,1H)。13C-NMR (126MHz,Pyr) δ 162.10,151.84,147.73,144.87,143.09,139.86,139.15,131.05,129.74(CH),127.19(CH),49.69(CH3×2),20.44(CH3),19.86(CH3)。数据与文献[40]报道一致,因此化合物26鉴定为已知化合物 2,4-N,N-dimethyllumichrome。
化合物27:白色固体。1H-NMR(CD3OD,400 MHz)数据如下:δH6.83(m,4H),6.93(dd,J=11.2,6.4 Hz,1H),7.01(dd,J=8.0,2.0 Hz,1H),7.35(dd,J=12.0,8.8 Hz,1H),8.05(dd,J=12.0,8.8 Hz,1H),8.11(s,1H)。数据与文献[41]报道一致,因此化合物27鉴定为异黄酮类化合物5,7,3,4-三羟基异黄酮。
化合物28:无色固体。正离子模式的ESIMS数据:m/z 255.0652[M+H]+,推断化合物28对应分子式为 C15H10O4。1H-NMR(CD3OD,400 MHz)数据如下:δH6.83(d,J=8.4 Hz,3H),6.93(dd,J=11.2,6.4 Hz,1H),7.35(dd,J=14.0,8.8 Hz,2H),8.05(dd,J=14.0,8.8 Hz,1H),8.11(s,1H)。数据与文献[42]报道一致,因此化合物28鉴定为异黄酮类化合物7,4-二羟基异黄酮。
3 讨论与展望
通过对FBZ-1、BNG-1两株真菌的次级代谢产物多样性研究,发现其次代产物种类少且结构单一,主要是芳香胺、生物碱和二酮哌嗪,可能与实验采用的浸提、发酵的方案有关,具体原因有待后期进一步验证。皱瘤海鞘化学成分研究开始较早且比较系统,1989年就报道了在该海鞘中首次发现的西松烷型二萜类成分 styelolide[43]。从中分离得到的化合物类型包括核苷[35]、甾醇、萜类、神经酰胺[44-46]以及肽类成分 plicatamide[47-48]和 tunichrome sp-1[49];而从其共附生真菌菌株FBZ-1中分离鉴定的次级代谢产物以环二肽类居多。冠瘤海鞘化学成分研究目前较少,分离到的主要有混合甾醇、酰胺和酯类物质[50-52];从其共附生真菌菌株BNG-1中分离到的化合物有辛酯和酰胺类,样品虽不是采自同一批次同一地点,但通过对比发现共附生微生物与其宿主代谢产物的化合物类型存在相似性。另外,从菌株BNG-1中还分离到一种人体必需的色氨酸(不能自身合成,只能靠从外界摄取而来)。目前该氨基酸在医药和食品行业用途广泛,既可以稳定抑郁症患者情绪,还可用作食品添加剂或防腐剂使用[53-54]。化合物16为对羟基苯乙胺,通常作为兴奋剂使用,还可以用来缓解偏头痛以及诊断嗜铬细胞瘤,其盐酸盐是制备降血脂药苯扎贝特的中间体(intermediate of bezafibrate)[35,55]。化合物22可能为溶剂引入的增塑剂成分,化合物25、27和28可能为实验引入的YPD培养基成分,具体原因有待进一步验证。
研究表明环二肽类物质具有广泛的生物活性如抑菌、抗肿瘤、抗心脑血管疾病等方面的重要生理活性和应用价值[56-57]。何培青等[58]从北极海洋细菌Pseudoalteromonas sp.2018中分离鉴定的环(脯氨酸-酪氨酸)和环(脯氨酸-亮氨酸)对辣椒疫霉(Phytophthora capsici)等多种农作物病原真菌具有抑制作用,且最小抑制浓度为125~500μg·mL-1。从菌株FBZ-1中分离出7种环二肽类物质,包括环(脯氨酸-亮氨酸),而淡紫拟青霉(Purpureocillium sp.)对多种植物病原线虫都具有生物防治作用[59-60],几种环二肽共同作用可能会增强菌株对病原真菌的抑制活性,这可能是该菌株防治农作物病害的主要机理。
由于本研究未产生结构新颖的新化合物,可能是由于本实验只使用了YPD一种发酵培养基且培养条件简单的缘故。具体原因有待进一步研究验证。周雅琳等[61]曾采用仿生培养和高盐胁迫两种不同的发酵条件诱导珊瑚共附生真菌产生新的氯代产物,研究表明微生物次级代谢能力是可以通过多种途径加以调节的,例如环境胁迫等。在实验室培养的条件下,调控特殊结构与功能的次代产物的基因可能不能表达,而只有在特殊环境中才能应激产生,从而导致代谢通路可能关闭[62]。因此,仿生培养和高盐胁迫将是一个有效的诱导途径,使微生物体内“沉默的基因”表达出来,从而获得良好活性的化学产物。
后期将进一步优化真菌的发酵条件,尝试使用不同的海洋培养基,扩大发酵规模并富集微量成分,以期获得较为复杂或构型特殊的未知化合物。同时尽量模拟海洋生物原来的生活环境,让共附生微生物在寡营养低盐的仿生培养基中培养,使用低温低光照的培养条件,从而有更多的机会利用氯来合成结构新颖、生理活性好的新次级代谢产物。
课题组前期研究发现东海主要水产养殖区海鞘优势种皱瘤海鞘资源单位产量大于200 g·m-2,分布遍及闽北罗源湾至东海最南端的南澳岛北部水域,局部的资源单位产量甚至可以达到湿重10 kg·m-2以上,资源较为丰富;同时研究还发现其化学成分结构类型多变,具有抗肿瘤、抗乙肝病毒等显著生物活性,提示这些物种具有潜在的重要药用价值[5]。因此,充分利用这些海鞘类污损生物的资源,深入探究其生物活性成分并规模化开发具有药用价值的海洋新药具有重要的意义。
