达氏鲟dmc1基因的克隆及在精子生成中的表达分析
2019-09-03李创举杨俊琳危起伟
向 浩,叶 欢,李创举,杨俊琳,3,厉 萍,杜 浩,危起伟
(1.华中农业大学水产学院,湖北武汉 430070;2.中国水产科学研究院长江水产研究所,农业部淡水生物多样性保护重点实验室,湖北武汉 430223;3.中国科学院水生生物研究所,湖北武汉 430072)
Dmc1最早发现于酵母中,是大肠杆菌(Escherichia coli)RecA 蛋 白 的 同 源 蛋 白[1]。RecA蛋白的另一个同源蛋白Rad51除了在减数分裂中起重要作用外,还参与有丝分裂重组DNA的修复。Dmc1蛋白和Rad51蛋白共同定位于减数分裂前期Ⅰ的偶线期,为同源染色体配对和交叉重组所必需[2]。1996年发现Dmc1蛋白是哺乳动物细胞减数分裂特异的重组蛋白,仅在哺乳动物处于减数分裂过程的生殖细胞中表达。人的Dmc1蛋白与酵母的Dmc1蛋白的同源性为54%,存在大肠杆菌RecA蛋白家族中保守的第二结构域部分,包括两个ATP结合位点和两个DNA结合区[3],表明Dmc1蛋白在进化过程中是高度保守的,同时也反映了Dmc1蛋白结构上的稳定性对生物体功能的重要性。
减数分裂中,染色体的正常分离依赖于合线期同源染色体精确配对形成的二价体,而同源重组和联会复合体是影响同源染色体配对的主要因素[4-5]。在酵母菌 (Saccharomyces cerevisiae)中,一些减数分裂必需或特异基因如dmc1、rad51和hop1已被克隆[6-8]。研究发现,酵母dmc1基因的突变和敲除都会使减数分裂停滞在偶线期,导致同源染色体联会失败,减数分裂细胞内积聚大量的双链断裂(DSB)重组中间体[9],表明dmc1在减数分裂的同源染色体配对和交叉重组中起着重要的作用[10]。近年来,不同倍性鲫鲤(Carassius auratus×Cyprinus carpio)[11]、日本鳗鲡 (Anguilla japonica)[12]、 蝾 螈 (Cynops orientalis)[13]、牦牛(Bos grunniens)和犏牛(Bos grunniens × Bos taurus)[14]、小 鼠 (Mus musculus)[3,6]、人(Homo sapiens)[3,6,15]等物种中克隆得到 dmc1的同源基因,而有关达氏鲟(Acipenser dabryanus)dmc1基因的研究尚未见报道。小鼠dmc1基因在减数分裂Ⅰ细线期到偶线期中特异表达,为同源染色体联会配对所必需。若dmc1突变或者被敲除,会导致减数分裂停滞在偶线期,不会出现同源染色体联会或在少数非同源染色体之间出现联会异常[16];另外,犏牛睾丸组织dmc1基因低水平表达所表现出的减数分裂障碍与小鼠dmc1基因突变和敲除的表型一致,表明睾丸组织dmc1基因的低表达可能与犏牛的雄性不育有一定的关系,进一步说明dmc1在哺乳动物细胞减数分裂的同源重组过程中起着重要的作用[14]。蝾螈dmc1基因在前细线期高水平表达,并一直持续到精子生成阶段[13]。日本鳗鲡中发现dmc1基因仅在减数分裂Ⅰ的早期表达[12],并一直持续到粗线期,但其表达量逐渐减少。在不同倍性鲫鲤中,dmc1基因也只在其早期卵巢或者精巢中特异表达[11],显示dmc1基因在减数分裂过程中的功能保守性。
鲟鱼类是现存最早的脊椎动物之一,已生存超过2亿年,具有重要的进化地位。达氏鲟隶属鲟形目(Acipenseriformes),鲟科(Acipenseridae),鲟属,又名沙腊子、长江鲟,纯淡水定居性鱼类,是长江珍稀濒危鱼类,为国家一级保护动物,对其开展种质资源保护研究具有重要意义。目前有关达氏鲟的研究主要集中在生物形态学[17-18]、种群生态学[19-20]、遗传学及物种鉴定方面[21]。达氏鲟生殖发育相关分子研究进行了dead end[22]、vasa[23]基因的表达特征和功能分析。本研究利用PCR技术克隆得到达氏鲟dmc1基因的编码区序列,利用生物信息学方法分析达氏鲟dmc1基因编码区特征和系统进化关系;并采用RT-PCR分析达氏鲟dmc1基因在其不同组织和不同发育时期精巢的表达特征,以期获得达氏鲟减数分裂特异标记基因,为达氏鲟初级和次级精母细胞的鉴定提供参考。
1 材料与方法
1.1 实验用鱼及样品
实验用鱼为全人工繁殖1~3龄的子二代达氏鲟,来自中国水产科学研究院长江水产研究所荆州太湖试验场。分别取试验鱼心、肝、脾、肾、鳃、肠、垂体、下丘脑、精巢和卵巢等组织,在液氮中速冻后,置于-80℃冰箱保存备用。对于不同发育时期的精巢组织,取一部分用Bouin’s试液固定12~16 h后,置于70%乙醇中4℃保存。
1.2 达氏鲟精巢不同发育时期组织学染色
不同发育时期的达氏鲟精巢组织在Bouin’s试液中固定后经酒精脱水、二甲苯透明,石蜡包埋切片,切片的厚度为4μm;用苏木精-伊红染色法染色(Carazzi苏木精、0.2%伊红水溶液),中性树胶封片。正置荧光显微镜(DM5000B,Leica)观察并拍照。
1.3 RNA提取及cDNA的制备
使用 RNeasy Plus Mini Kit(Qiagen,Cat No.74134)试剂盒提取各种组织的总RNA,RNA浓度和纯度用核酸测定仪(Nanodrop 2000)测定,并用DNaseⅠ(TaKaRa)消化处理总RNA以消除基因组DNA的残留,最后1.5%琼脂糖凝胶电泳检测其完整性。采用 PrimeScript®RT reagent Kit With gDNA Eraser(TaKaRa,Cat No.RR047A)试剂盒合成cDNA第一链,操作按照说明书进行。合成的cDNA于-20℃保存备用,用于后续编码区序列克隆和荧光定量PCR分析。
1.4 达氏鲟dmc1基因编码区序列的获得
根据达氏鲟性腺转录组数据库序列设计上、下游引物Dmc1-Fw和Dmc1-Rv(表1),以上述反转录获取的精巢cDNA为模板,扩增出dmc1基因的编码区序列。PCR扩增体系为25μL:上游引物0.5μL,下游引物0.5μL,模板cDNA 1μL,10×PCR Buffer:2.5μL,MgCl2:2.0μL,dNTP:0.5 μL,Taq酶:0.5μL,ddH2O:18.0μL。扩增条件为:94℃变性4 min;94℃ 30 s,54℃ 30 s,72℃1 min 30 s,38 cycles;72℃延伸 10 min。PCR反应产物用1.5%琼脂糖凝胶电泳鉴定并回收纯化目的片段,然后克隆到pMD19-T载体上,16℃连接过夜。连接产物转化 Trans5α大肠杆菌(Escherichia coli),经 Ampicillin抗性筛选,挑取阳性菌落,扩大培养后进行菌液PCR鉴定,并由上海生工生物工程股份有限公司进行测序。
1.5 Dm c1序列分析及系统进化树构建
将测序所得核苷酸序列在NCBI中BLAST进行同源性比对,使用ORF Finder确定开放阅读框,并推导其相应的氨基酸序列;利用TMHMMServer 2.0对蛋白的跨膜区域进行预测;使用 Signal P 4.1 Server预测信号肽;ExPASy ProtParam对所推测的蛋白质基本物理化学参数进行分析;采用CLUSTAL X软件对核苷酸和氨基酸序列进行同源性的比对分析;利用MEGA 7.0软件中Neighbor-joining方法进行系统进化分析,并进行1 000次自展检验(Bootstrap)评估进化树分支可信度。
1.6 达氏鲟dmc1基因的组织表达特征分析
为分析dmc1基因在2龄达氏鲟雌、雄个体不同组织的表达特征,以各种组织cDNA为模板,用dmc1基因特异引物Dmc1-F1和Dmc1-R1(表1)进行RT-PCR检测,以β-actin为内参。反应体系:1μL cDNA为模板,上游、下游引物各0.5 μL,10×PCR Buffer:2.5μL,MgCl2:2.0μL,dNTP:0.5μL,Taq酶:0.5μL,ddH2O:18μL。扩增条件为:94℃预变性4 min;94℃ 变性30 s,54℃ 复性30 s,72℃延伸20 s,反应进行35个循环,最后72℃延伸10 min。扩增产物使用1.5%的琼脂糖凝胶电泳检测。
1.7 达氏鲟dmc1基因在不同发育时期精巢的表达分析
为验证设计的定量PCR引物Ad Dmc1-qRT-F和Ad Dmc1-qRT-R(表1)的可行性,以达氏鲟精巢cDNA为模板,用ddH2O做连续10倍梯度稀释,5个浓度梯度,从1到1∶1×104,每个梯度设置3个重复,进行荧光定量PCR来建立标准曲线。20μL荧光定量PCR体系:模板1μL,荧光定量PCR上、下游引物各0.4μL,2×PowerUpTMSYBR®Green Master Mix 10μL,ddH2O 8.5μL。PCR反应程序:95℃预变性2 min;95℃变性15 s,57℃退火 15 s,72℃延伸 15 s,读板温度 77℃,读板时间5 s;40次循环,做熔解曲线分析温度为60~95℃。根据荧光值的变化规律,系统将自动生成标准曲线和熔解曲线。
以上述逆转录获得的达氏鲟不同发育时期的精巢cDNA为模板,采用qRT-PCR技术分析dmc1基因在不同发育时期精巢的表达情况。20 μL PCR反应体系为:2×PowerUpTMSYBR®Green Master Mix 10μL,上、下游引物各0.4μL,ddH2O 8.5μL。PCR反应程序同制作标准曲线进行的荧光定量PCR反应程序。每个样品设置3个平行,以达氏鲟β-actin为内参,用灭菌双蒸水代替模板作为阴性对照。应用2-ΔΔCT法确定dmc1基因mRNA表达量,利用SPSS 22.0统计软件进行数据分析,当P<0.05时认为差异显著,P<0.01时认为差异极显著。
2 结果与分析
2.1 dmc1基因编码区序列特征分析
获得达氏鲟Dmc1开放阅读框(open reading frame,ORF)为 1 029 bp,编码 342个氨基酸。ExPASy ProtParam分析达氏鲟Dmc1前体蛋白的理化性质,推测达氏鲟 Dmc1的分子式为C2964H4901N1029O1223S255,总共包括10 372个原子,其蛋白质分子量(protein molecular weight,Mr)为82.696 kDa,理论等电点(isoelectric point,pI)为5.04;该蛋白由22种氨基酸组成,其不稳定指数(instability index)为 46.85,属于不稳定蛋白;亲水性平均指数为0.829,属于疏水性蛋白。
利用SignalP 4.1 Server在线分析,结果显示该预测蛋白不存在信号肽序列,也未发现跨膜区,表明其不是分泌性蛋白、跨膜蛋白。结构域分析结果显示:达氏鲟Dmc1蛋白与其它物种一样都含有大肠杆菌RecA蛋白家族保守的第二结构域(63-342)、Rad51_DMC1_radA,B(103-337)结构域和 recomb_DMC1(26-340)结构域。同时在这些保守区域内还含有两个嘌呤核苷酸的结合位点(motifs A和B)和两个DNA结合区(L1和 L2)(图1)。

表1 PCR相关引物序列Tab.1 Primers used for PCR

图1 达氏鲟Dm c1氨基酸序列的预测及与其他物种Dm c1氨基酸序列的比较Fig.1 Predicted Dm c1 am ino acid sequence of Acipenser dabryanus and alignment w ith other species
2.2 达氏鲟dmc1基因同源性分析
利用CLUSTAL X分析达氏鲟Dmc1和已经报道的其他物种Dmc1的氨基酸序列同源性。多重比对达氏鲟、日本鳗鲡、尼罗罗非鱼、斑马鱼、鲫鲤、青鱂、蝾螈、爪蟾、小鼠和人的Dmc1氨基酸序列(表2),发现在这些物种中,Dmc1氨基酸序列具有较高的同源性,其中任意两者的同源一致性都在85%以上,并且都含有两个可以结合核酸motif(GEFRTGKT和 LLIID),这表明 Dmc1蛋白在进化过程中可能比较保守。系统进化分析显示(图2),Ad Dmc1属于RecA家族Dmc1蛋白分支,且属于四足动物类分支,与硬骨鱼类分支分开。
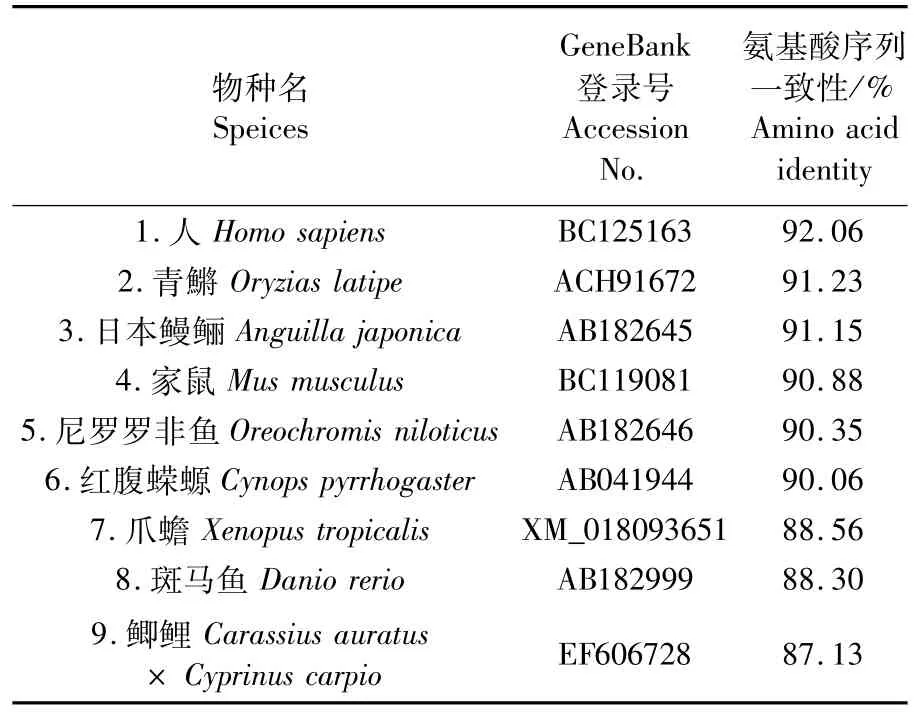
表2 达氏鲟Dm c1氨基酸序列和其他物种的相似性比较Tab.2 Percentage identities in am ino acid sequence of Ad Dm c1 w ith other species

图2 Dm c1氨基酸序列系统发育树(达氏鲟Dm c1加粗显示)Fig.2 Phylogenetic relationship of fish Dm c1 proteins(bold font shows Acipenser dabryanus Dm c1)
2.3 达氏鲟dmc1基因在不同组织中的表达特征
采用RT-PCR方法分析dmc1基因在达氏鲟雌、雄个体9种组织中的表达特征。如图3所示,在达氏鲟雌雄个体9种组织中,dmc1基因仅在精巢和卵巢中表达;而在心、肝、脾、肾、鳃、肠、垂体和下丘脑中未发现dmc1的表达,表明dmc1基因为达氏鲟性腺特异表达。
2.4 达氏鲟dmc1基因real-time PCR标准曲线的建立
将达氏鲟精巢cDNA模板按10倍倍比稀释5个浓度梯度,对dmc1基因进行real-time PCR扩增,得到标准曲线、熔解曲线(图4)并进行分析。可知标准曲线中的拷贝数与CT值两者基本呈线性反比关系,基因片段回归方程为:Y=-3.176X+34.531,标准曲线相关系数R2=0.996,表明线性关系良好,扩增效率为106.486%,熔解曲线显示单一的峰,无非特异性峰,扩增产物单一,无非特异性扩增及引物二聚体形成。符合实验的要求,可用于后续目的基因片段的定量分析。
2.5 达氏鲟不同发育时期精巢中dmc1基因m RNA的表达水平
根据HE染色结果可将达氏鲟精巢发育分为6个时期:0、Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ期。0期精巢中,未形成精小囊,可见少量原始生殖细胞(图5-a);Ⅰ期精巢中,精原细胞增殖,可见大量A型精原细胞(图5-b);Ⅱ期精巢中出现B型精原细胞,但主要还是以A型精原细胞为主(图5-c);Ⅲ期精巢中,以初级精母细胞为主,存在着少量次级精母细胞(图5-d);Ⅳ期精巢中,有大量初级精母细胞、次级精母细胞、精子细胞,还有少量的精子(图5-e);Ⅴ期精巢中,主要是精子(图5-f)。
Real-time PCR结果(图6)显示,在0期和 I期的精巢中,dmc1基因没有表达,Ⅱ期精巢中其有微弱表达;在Ⅲ期和Ⅳ期中其表达量急剧增加,并在Ⅳ期达到最高水平;Ⅴ期精巢中其表达量显著性降低(P<0.05)。

图3 达氏鲟dmc1基因的组织表达特性Fig.3 Tissue-specfic expression of Addmc1

图4 dmc1基因扩增动力学曲线与熔解曲线Fig.4 Am p lification dynam ics curve and m elting curve of dm c1

图5 达氏鲟精巢不同发育时期形态结构Fig.5 M orphological structure of testis of Acipenser dabryanus at different development stages
3 讨论
本研究成功克隆了达氏鲟dmc1基因的编码区序列,获得开放阅读框(ORF)为1 029bp,编码342个氨基酸。与其他鱼类Dmc1氨基酸序列进行同源性比较,发现达氏鲟Dmc1与青鱂同源性最高,为91.23%,同时与人类、小鼠也具有较高的相似性,分别为92.06%和90.88%。蛋白预测分析表明,达氏鲟Dmc1与其他物种一样都含有大肠杆菌RecA蛋白家族保守的第二结构域、recomb_DMC1结构域和Rad51_DMC1_radA,B结构域,并且在这些保守区域内还含有两个嘌呤核苷酸的结合位点(motifs A和 B)[9]和两个 DNA结合区(L1、L2),其中motif A(GEFRTGKT)是ATP/GTP结合位点,这个motif广泛存在于Dmc1及同源蛋白、DNA重组与修复蛋白RecA和Rad51中[15]。根据Dmc1的多重序列比对和系统进化分析发现,Ad Dmc1属于RecA家族Dmc1蛋白分支,且属于四足动物类分支,与硬骨鱼类分支分开,初步认为本研究克隆得到的序列是达氏鲟dmc1基因。
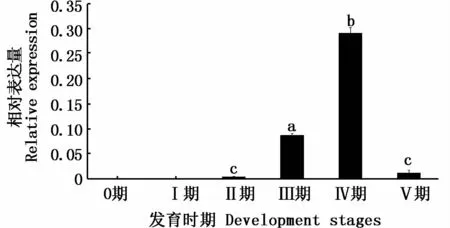
图6 达氏鲟精巢不同发育时期dmc1基因mRNA的相对表达水平Fig.6 Relativem RNA level of dmc1 gene of testis in Acipenser dabryanus at different development stages
对多种鱼类研究发现,dmc1基因在不同组织的表达特征较为保守,即仅在性腺中特异表达。在红鲫、鲤、四倍体鲫鲤及三倍湘云鲫中[11],dmc1基因只在其早期卵巢或者精巢中特异表达。在第四代雌核发育二倍体鲫鲤中(G4)[24]中,同样发现dmc1基因只在G4性腺中表达。本研究通过RTPCR分析发现,达氏鲟dmc1基因也只在性腺中特异表达,说明其可能只在性腺中发挥作用。
在达氏鲟不同发育时期精巢的研究结果表明,dmc1基因在0~Ⅰ期精巢中不表达;在Ⅱ、Ⅲ、Ⅳ期精巢中其表达量逐渐升高,并在Ⅳ期精巢中达到最高;在Ⅴ期精巢中,其表达量显著性下降(P<0.05)。结合HE染色结果发现,0期精巢中未形成精小囊,可见少量原始生殖细胞;Ⅰ期精巢中精原细胞增殖,可见大量A型精原细胞;Ⅱ期精巢中出现B型精原细胞,但主要还是以A型精原细胞为主;Ⅲ期精巢中,以初级精母细胞为主,存在着少量次级精母细胞;Ⅳ期精巢中,有大量初级精母细胞、次级精母细胞、精子细胞,还有少量的精子;Ⅴ期精巢中,主要是精子,初步推断dmc1基因主要在精母细胞中表达。这与dmc1基因在小鼠中的表达特征类似,小鼠dmc1基因仅在减数分裂I细线期到偶线期的精母细胞中特异表达[9]。然而,在蝾螈的研究中,发现dmc1基因在减数分裂I细线期开始显著表达,且一直持续至精子生成阶段,即dmc1基因不仅在精母细胞中表达,而且在精子细胞中也表达[13],这表明dmc1基因可能在单倍体细胞(如精子细胞)中发挥一定的作用,并非仅调控减数分裂过程中染色体的联会和重组。日本鳗鲡中,dmc1基因只在减数分裂Ⅰ的早期表达[12],并持续到粗线期,但其表达量逐渐降低。综上所述,虽然dmc1基因在表达时期存在种间特异性,但其主要在减数分裂过程中起作用。
精子发生是一个复杂的细胞增殖及分化的过程,其中减数分裂又是最为关键的步骤。在此过程中,一些基因的存在与否、表达水平对形成具有活性的成熟精子有着至关重要的作用[25]。研究表明,dmc1基因在犏牛睾丸组织中低水平表达所表现出的减数分裂障碍与小鼠dmc1基因突变、敲除的表型一致,表明dmc1基因的低水平表达与犏牛的雄性不育有一定关系[14],这可能对治疗雄性不育提供新思路。在酵母中,dmc1基因的突变导致减数分裂中的DSBs修复大幅减少,出现联会紊乱。而在人和小鼠的雄性个体中,dmc1基因的突变使联会紊乱,造成精子生成障碍。与哺乳动物不同,青鱂缺失dmc1基因仍会产生少量畸形精子,暗示青鱂中存在 DSBs修复的补偿途径[26]。dmc1基因作为减数分裂过程中的特异表达基因,能标记生殖细胞进行减数分裂的开始,有助于阐述一些物种从有丝分裂到减数分裂的形态转变机制[13]。经过十多年的发展,鱼类生殖细胞移植技术已成功应用到多种鱼类,在种质资源保存、增殖放流和物种恢复方面具有重大的应用潜力。近年来有关达氏鲟精原细胞移植的研究已经取得阶段性成果,但高效的移植依赖于精原干细胞的体外增殖培养。前期已开展了达氏鲟精原细胞培养方面的工作,但对培养的达氏鲟精原干细胞鉴定还有所欠缺。目前,已鉴定的达氏鲟生殖细胞标记基因有dnd和vasa,但是它们除了在精原细胞表达外,在精母细胞中也有表达。因此,有必要鉴定在特异类型生殖细胞表达的基因。本研究中dmc1基因在精子生成中所表现出的结果,推断其可能为减数分裂标记基因,将为后续体外培养精原干细胞的鉴定奠定基础。
