河川沙塘鳢GHR和IGF-2基因克隆及m RNA的时序表达
2019-09-03朱文旭张宏叶张红燕尹绍武陈树桥周国勤
朱文旭,张宏叶,王 涛,王 丹,张红燕,尹绍武,陈树桥,周国勤
(1.南京师范大学生命科学学院,江苏省生物多样性与生物技术重点实验室,南京 210023;2.南京市水产科学研究所,南京 210036)
鱼类既是自然界重要的生物资源,也是人类主要食物蛋白来源之一。鱼类的生长是一个相当复杂而又系统的过程,受到多种激素的调节,其中生长激素和类胰岛素生长因子轴(GHR/IGF轴)作为控制机体生长、发育、代谢的重要组件发挥着不可替代的作用。GHR/IGF轴由生长激素(GH)、生长激素结合蛋白(GHBP)、生长激素受体(GHR)、胰岛素样生长因子(IGF)、胰岛素样生长因子受体(IGFR)以及胰岛素样生长因子结合蛋白(IGFBP)等基因组成[1]。
GH是一种由脑垂体释放的激素,能够促进鱼体生长,参与多种合成与代谢过程,其在组织和细胞水平上发挥作用的前提是与靶细胞膜上的GHR结合以介导下游的一系列反应。组织中GHR数量的多少、功能的正常与否将直接影响到GH在组织中效应的发挥[2]。LEE等[3]首次在金鱼(Carassius auratus)中克隆出硬骨鱼类的GHR基因,迄今为止已有数十种鱼类的 GHR cDNA序列被克隆,包括大菱鲆(Scophthalmus maximus)[4]、虹鳟(Oncorhynchusmykiss)[5]、尼罗罗非鱼(Oreochromis niloticus)[6]等。这些序列与哺乳动物的GHR序列具有一定的相似性,说明GHR基因的信号转导机制具有一定的保守性。VINCENT等[7]对 GHR基因的结构分析表明,GHR两个保守的BOX盒序列中任何一个氨基酸突变都会导致GH的效应丧失,表明它们在GHR介导的GH生理信号的过程中发挥了重要作用。ZHONG等[8]在鲫(Carassius auratus)的研究中表明,禁食处理后,三倍体鲫GHR/IGF轴基因表达量仍显著高于二倍体鲫,表明三倍体中GH/IGF轴基因的表达升高在三倍体鱼生长速度快中起关键作用。
胰岛素样生长因子(insulin-like growth factors,IGFs)是生长激素(growth hormone,GH)发挥作用的介质[9],主要在肝中合成,具有促进有丝分裂、诱导细胞分化、调节生长等作用[10]。IGF家族包括 IGF配体、IGF受体(insulin-like growth factor receptor,IGFR)和6种 IGF结合蛋白(insulin-like growth factor binding protein,IGFBPs)[11]。1978年 RINDERKNECHT等[12]首次在人类血液中分离出IGF-2,此后,IGF-2基因相继在哺乳类、鸟类、两栖类等动物中被克隆。在 鱼 类 中 已 在 虹 鳟[13-14]、大 麻 哈 鱼(Oncorhynchus keta)、银大麻哈鱼(O.kisutch)、斑马鱼(Brachydanio rerio)等[12]中克隆得到 IGF-2的cDNA序列。其转录产物在不同鱼中的存在形式也不一致。有研究显示,从罗非鱼及马苏大麻哈鱼(Oncorhynchusmasou)分别检测到3种IGF-2转录产物和1种主要的IGF-2转录产物[15-16],对这些不同转录产物的结构分析表明,它们很可能是由于不同的剪接方式以及具有多个多聚腺苷酸位点引起的。此外,CHEN等[17]通过对尼罗罗非鱼注射IGF-2,结果发现其体质量增加了72%,说明IGF-2能够促进其生长。
动物的生长轴基因是调节出生后生长的主要内分泌轴线,其表达存在雌雄二态性,这可能是导致动物生长和形态变化雌雄二态性的主要原因。河川沙塘鳢(Odontobutis potamophila)属鲈形目(Perciformes),沙塘鳢科(Odontobutidae),沙塘鳢属,在生长上表现出显著的性别二态性,雄性河川沙塘鳢比同期雌性生长速度快30%以上。目前,关于河川沙塘鳢生长调控分子的研究非常有限,这在很大程度上阻碍了河川沙塘鳢的产业化发展。本研究首次克隆得到河川沙塘鳢GHR/IGF轴基因GHR和IGF-2的全长,采用qRT-PCR技术对其组织分布及胚胎发育不同阶段的表达进行了分析,并研究了河川沙塘鳢在不同生长发育阶段和不同组织雌、雄鱼的生长差异及GHR、IGF-2基因表达差异,旨在从分子水平探讨河川沙塘鳢生长相关基因对其生长发育及雌雄生长差异的调控机理,为该鱼的高效养殖积累基础资料。
1 材料与方法
1.1 实验材料
实验用鱼河川沙塘鳢取自江苏省南京市水产科学研究所周岗基地,为同一繁殖批次。于玻璃循环缸中暂养7 d,确定健康无病后开始实验。采用镜检观察的方法确定胚胎发育时期并采集8个发育阶段(受精卵期、桑椹胚期、原肠胚期、神经胚期、体节期、口裂期、出膜后1 d、3 d)。另取1龄河川沙塘鳢[体质量(30.0±1.5)g]的9个组织(脑、肝、鳃、肌肉、肾、性腺、脾、心、肠)的材料用于组织表达的研究。雌、雄鱼基因表达差异研究则同一繁育批次成鱼分别取90、150、210、270、330 d雌、雄河川沙塘鳢,雌、雄鱼每时间段各随机取3尾个体的肝、肌肉、脑组织分装于1.5 mL离心管中(RNase-free)。所取的全部材料速冻于液氮10 min后于-80℃冰箱保存备用。
1.2 总RNA的提取及cDNA合成
将-80℃冻存的组织取出,用高纯总RNA快速抽提试剂盒(离心柱型)(Bioteke,Beijing,China)根据说明书提取河川沙塘鳢组织总RNA,用RNA浓度测定仪测定每个样品的RNA浓度及纯度,用1%琼脂糖凝胶电泳检测其完整性。以总RNA为模板,根据反转录试剂盒HiScriptTM1st Strand cDNA Synthesis Kit(Vazyme,Shanghai,China)的说明进行反转录,获得cDNA第一条链。
1.3 河川沙塘鳢GHR和IGF-2基因全长的克隆
从河川沙塘鳢转录组测序的cDNA文库分别筛选得到654、1 950 bp的IGF-2和GHR基因的cDNA中间 EST序列,5′RACE System for Rapid Amplification of cDNA Ends Version 2.0试剂盒获得基因的 5′端序列。采用 Clontech公司的SMARTerTMRACE cDNA Amplification Kit试剂盒获得目的基因的3′端序列。本实验克隆基因所需引物见表1。
1.4 GHR和IGF-2基因的生物信息学分析
使用DNAman软件分析基因的生物信息。核苷酸和氨基酸序列的同源性使用BLAST程序(http://blast.ncbi.nlm.nih.gov/Blast.cgi)进行检索。采用蛋白质分析专家系统(expert protein analysis system,ExPASy)(http://www.expasy.org/)确定其开放阅读框进而预测氨基酸序列,理论分子量(MW)和等电点(pI)用pI/MW在线工具(http://www.expasy.org/tools/pi_tool.html)进行预测。使用在线软件 SMART(http://smart.embl-heidelberg.de/)对预测到的氨基酸序列进行结构和功能的分析,SignalP 3.0(http://genome.cbs.dtu.dk/services/SignalP)进行信号肽的预测,使用在线软件ClustalW2(http://www.ebi.ac.uk/Tools/msa/clustalo/)进行多序列比对。用MEGA 5.0软件(http://www.megasoftware.net/),重复1000次构建 N-J系统发育树[18]。
1.5 河川沙塘鳢GHR和IGF-2基因的表达分析
根据已获得的GHR、IGF-2基因cDNA全长序列分别设计特异性引物,按照qRT-PCR试剂盒SYBR Green Master kit(Roche, Basel,Switzerland)说明书以β-actin作为内参基因分析GHR、IGF-2基因的mRNA表达。反应体系为20 uL,Faststart Universal SYBR GreenMaster 10μL,正反向引物各3μL,cDNA模板4μL。反应程序为95℃ 10 min;95℃ 10 s,55℃ 30 s,40个循环,4℃保存。其中,每条引物配置成浓度为2μmol·L-1的 工 作 液,cDNA 模 板 浓 度 为5 ng·L-1。

表1 克隆GHR和IGF2基因及实时荧光定量PCR所用引物Tab.1 Primers used for charactering IGF-2 and GHR gene of Odontobutis potamophila
1.6 数据分析
实验结果数据采用2-ΔΔCt法来计算目的基因的相对表达量,应用SPSS 19软件对实验数据进行统计分析、差异显著性检验分析。用t检验计算P值,当P<0.05时为差异显著,P<0.01为差异极显著。数值均采用平均值±标准差(Means±SD)表示。使用Origin 8.6软件绘制柱状图。
2 结果与分析
2.1 GHR和IGF-2基因的序列分析
利用RACE技术克隆得到河川沙塘鳢GHR基因的cDNA全长序列为2 719 bp(GenBank登录号:MG820031)(图1),包括编码609个氨基酸的开放阅读框1 830 bp、251 bp的5′UTR区和638 bp的3′UTR区,其中3′UTR区域具有28 bp的PolyA尾巴,表明获得的该cDNA全长序列3′末端序列具有完整性。ExPASy软件预测的氨基酸分子量为98 589.94,理论等电点为4.8,GHR多肽序列包含一个21个氨基酸的信号肽、227个氨基酸的胞外结构域、22个氨基酸的单个跨膜结构域和339个氨基酸的胞内结构域,在胞外结构中包含有保守的半胱氨酸残基和FGDFSmotif,胞内有两个保守的box(图1-A)。
IGF-2基因的cDNA全长序列为1 586 bp(GenBank登录号:MG820032)(图 2),包括 642 bp的开放阅读框、48 bp的5′UTR区和896 bp的3′UTR区,其中3′UTR区域具有16 bp的 PolyA尾巴,表明获得的该cDNA全长序列3′末端序列也具有完整性。共编码213个氨基酸,ExPASy软件预测的氨基酸分子量为24 448.46,理论等电点为10.0。IGF-2编码区经SignalP软件分析发现,其包含一个52个氨基酸的信号肽及A、B、C、D和E 5个保守的结构域,且6个半胱氨酸残基参与形成3对二硫键(图1-B)。
2.2 GHR和IGF-2基因的进化树及氨基酸同源性分析
采用MEGA 5.0以N-J法构建基于GHR和IGF-2氨基酸序列的分子系统进化树(图2)。进化树聚类结果显示,所有鱼类聚为一支,两栖类(及鸡)和哺乳类动物聚类为另外的分支,而河川沙塘鳢IGF-2、GHR基因与其亲缘关系较近的大黄 鱼 (Larimichthys crocea)、大 弹 涂 鱼(Bolephthalmus pectinirostris)等鱼类聚为一支,这与传统的分类系统是一致的(图2)。同源性序列分析表明河川沙塘鳢GHR基因与大弹涂鱼、石斑鱼(Epinephelus coioides)、半滑舌鳎(Cynoglossus semilaevis)、大黄鱼的同源性为68.95%~80.79%(图 3)。IGF-2基因与大黄鱼、尖吻鲈(Lates niloticus)、鳜 (Siniperca chualsi)、卵 形 鲳 鲹(Trachinotus ovatus)的同源性较高,为86.98%~88.84%(图4)。
2.3 河川沙塘鳢GHR和IGF-2基因的表达特征分析
利用qRT-PCR的方法分析了河川沙塘鳢GHR、IGF-2基因在9种组织表达情况,由图5可知,GHR和IGF-2在9种组织中均有表达且在肝中的表达量最高(P<0.05);除肝脏之外,GHR在脑、肌肉、性腺和心脏中的表达量均显著高于其他4种组织;而IGF-2在肌肉中的表达量相对较高,在性腺和脑中的表达量其次,在其他组织的表达量相对较低(图5)。
分析河川沙塘鳢GHR、IGF-2基因在胚胎到仔鱼不同发育时期的表达模式,由图6可知,GHR基因在胚胎发育的各个时期均有表达,表达量呈先上升后下降的趋势,在原肠胚时期达到最大值,极显著的高于其他发育阶段(P<0.01)。仔鱼阶段表达量迅速升高,其表达量是受精卵阶段的4倍。相较于GHR基因,IGF-2在胚胎及仔鱼时期表达量一直呈升高趋势,与GHR基因相似,IGF-2基因在胚胎时期同样在原肠胚时期表达量显著高于其他时期(P<0.05)。
2.4 GHR、IGF-2基因的雌雄表达差异
如图7所示,雄鱼GHR和IGF-2基因在肝中的表达量显著高于雌鱼,GHR基因表达呈上升趋势,IGF-2则先下降再上升。而在脑和肌肉中仅IGF-2基因在210 d的脑和150、210 d的肌肉中具有显著性雌雄差异,其他时期无显著性差异。
3 讨论
鱼类的生长与哺乳动物相类似,受到GHR/IGF轴的调控。GH主要在垂体产生,一方面可与肝脏等靶器官GHR作用,产生IGFs,通过IGFs调节动物生长发育;另一方面可直接与肌肉等靶器官上GHR结合,通过JAKSTAT途径启动信号转导直接影响细胞营养物质分泌及代谢[3]。本研究首次克隆了河川沙塘鳢IGF-2和GHR基因的全长序列,序列分析表明河川沙塘鳢IGF-2和GHR基因的氨基酸序列与其他脊椎动物的相应基因表现出高度的同一性和相似性,表明这些基因在鱼类和哺乳动物中可能具有相似的功能。

图1 河川沙塘鳢GHR(A)和IGF-2(B)cDNA序列及推导的氨基酸序列Fig.1 Nucleotide and deduced am ino acid sequences of O.potamophila GHR(A)and IGF-2(B)cDNA

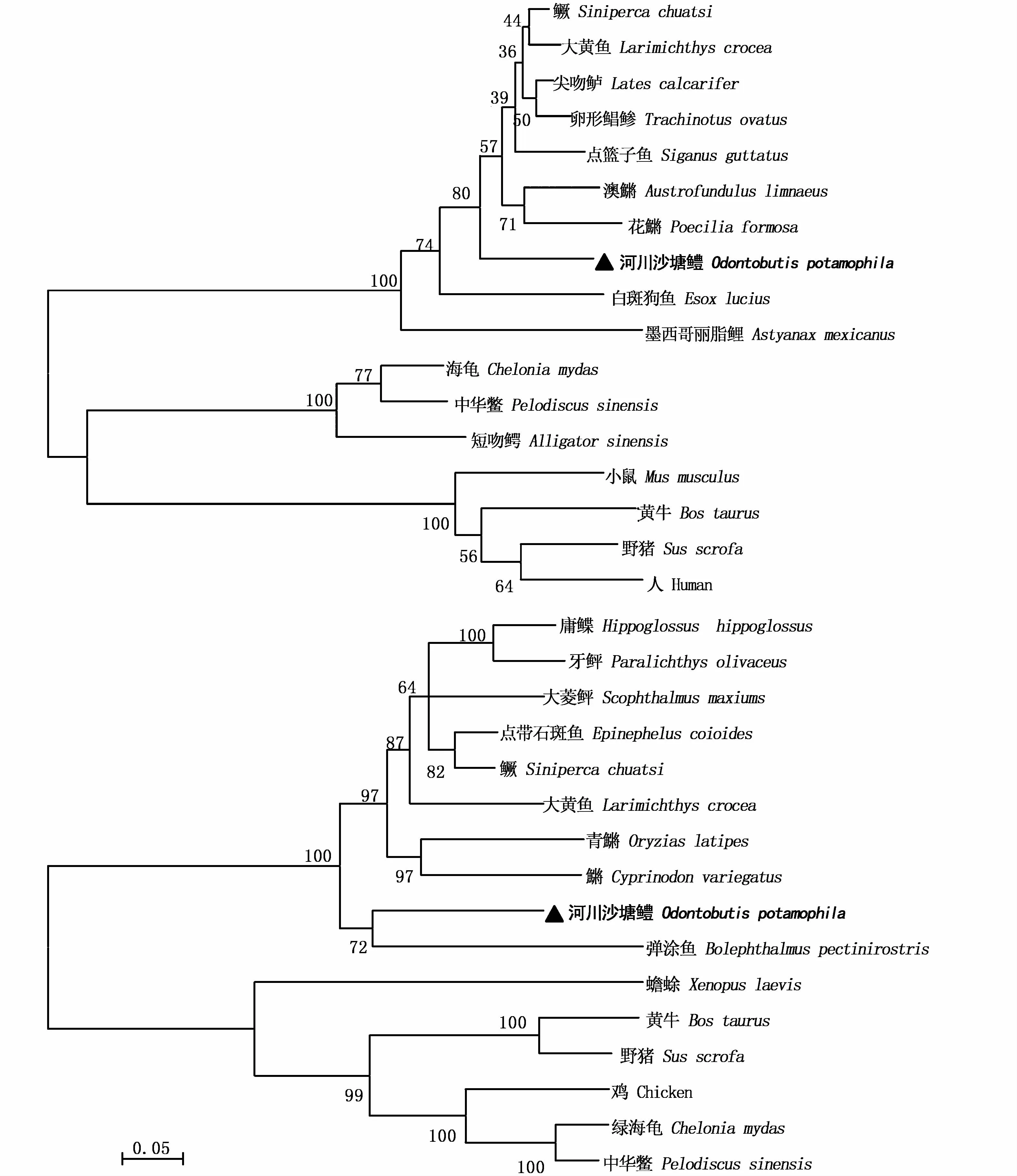
图2 河川沙塘鳢与其他物种的GHR和IGF-2基因系统进化树Fig.2 Phylogenetic tree of GHR and IGF-2 gene of O.potamophila and other vertebrates

图3 河川沙塘鳢GHR氨基酸序列与其他物种同源序列对比Fig.3 M ultiple alignment of O.potamophila GHR polypeptide sequences w ith other known orthologs

图4 河川沙塘鳢IGF-2氨基酸序列与其他物种同源序列对比Fig.4 Multiple alignment of O.potamophila IGF-2 polypeptide sequences w ith other known orthologs
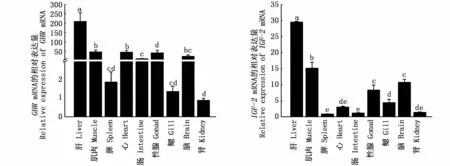
图5 GHR和IGF-2在河川沙塘鳢不同组织中的表达Fig.5 GHR and IGF-2 gene expressions in various tissues of O.potamophila
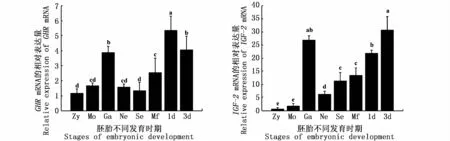
图6 GHR和IGF-2在河川沙塘鳢胚胎和仔鱼发育过程中的表达Fig.6 GHR and IGF-2 gene expressions during the embryonic and larval development of O.potamophila
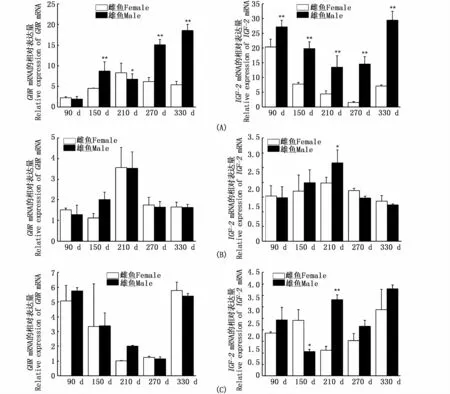
图7 河川沙塘鳢不同生长阶段GHR和IGF-2在肝(A)、脑(B)、肌肉(C)中表达量的雌雄对比Fig.7 Expression differences of GHR and IGF-2 in O.potamophila liver(A),brain(B)and muscle(C)between themale and fem ale
和大多数硬骨鱼的GHR一样,河川沙塘鳢GHR的胞外区有7个保守的半胱氨酸残基和1个FGEFSmotif,其中半胱氨酸残基可形成3个内部二硫键,未配对的半胱氨酸可能在GH诱导的GH受体二聚化过程中形成二硫键[19]。此外,FGDFSmotif靠近跨膜区,其在GH与GHR结合过程中起稳定空间构象的作用,能保证配体与受体的正常结合以及进一步的信号转导过程,并参与GHR的二聚化[3],这是已知鱼类GHR的共性之一。GHR胞内含有特征结构高度保守的BOX1、BOX2基序,BOX1区域是JAK2结合的位点,而BOX2区域参与受体的增殖反应,推测这两个区域在河川沙塘鳢GH所介导的信号转导过程中发挥重要作用。与哺乳动物相比BOX1中的保守序列PPVPVP在河川沙塘鳢的GHR基因中为PPIPAP,这种微小的改变也在其他鱼中被发现[20-21],这种改变可能是GHR基因适应不同物种信号转导机制的结果。自从PALAMARCHU等[15]在大麻哈鱼中首次克隆出鱼类的IGF-2基因,许多学者开始了对其生物学的研究。IGF-2前体蛋白由N端至 C端的信号肽、B、C、A、D、E区构成,切除信号肽和 E区导致转变为成熟肽[22]。在本实验中,河川沙塘鳢IGF-2基因全长1 586 bp,编码212个氨基酸,成熟肽为71个氨基酸。系统进化树分析表明,河川沙塘鳢GHR先与大弹涂鱼(Boleophthalmus pectinirostris)聚为一支,再与青鳉(Oryzias latipes)、杂色鳉(Cyprinodon variegatus)聚为一支。而IGF-2则自己聚为一支,后与亚马逊花鳉(Poecilia formosa)等聚为一支。聚类分析产生的进化树基本上与各参考物种的分类进化地位相吻合,由此可以在一定程度上推测河川沙塘鳢的系统进化地位。
许多硬骨鱼类GHR和IGF-2基因都具有广泛表达的特性,如在暗纹东方鲀(Takifugu obscurus)、半滑舌鳎(Cynoglossus semilaevis)、金头雕 (Sparus aurata)、多 耙 牙 鲆 (Paralichthys adspersus)中[20,23-24],在本 研 究 中 河 川 沙塘 鳢GHR基因在9个组织中均有表达,这与之前的研究是相一致的。GHR在多种组织中都有组织表达的模式支持了鱼类GHR具有多种生理功能的观点。TSE等[26]对鲫的研究表明IGF-2广泛分布于脑、鳃、心脏、头肾、肝脏、脾脏、肠,其中在肝脏中的表达量最高,这与已研究物种莫桑比克罗非鱼(Oreochromismossambicus)的IGF-2在肝中的表达量最高相一致[16]。在本实验中,也发现河川沙塘鳢GHR、IGF-2基因在检测的9个组织中肝脏的表达量最高,表明GHR、IGF-2主要在肝中产生;其次,肝脏是GHR与GH结合和信号转导最重要的组织,也是鱼类和其他哺乳类IGFs转录的主要位点,这也可能是GHR、IGF-2基因在肝脏中高丰度表达的原因。鱼类未受精卵中存在来自于母源保存和传递的 IGF-1和IGF-2 mRNA,对于进行体外受精和发育的硬骨鱼类来说,这些母源传递的mRNA对于胚胎发育具有重要作用[27]。在很多硬骨鱼 类中如 虹鳟[28]、斑马鱼[29]、金头鲷[27]、半滑舌鳎[23]中 IGF-2和 GHR基因在胚胎发育过程中均持续表达。EIVERS等[30]在斑马鱼的研究中发现 IGF-2和 IGF-1 mRNA在胚胎发育的原肠期存在表达,表明IGF-2对早期胚体发育模式的建立具有重要作用。WHITE[31]在斑马鱼的研究中发现GHR在原肠胚期表达量最高,作为介导GH通路的重要组件,在胚胎发育中发挥重要作用。然而在IGF-2基因敲除实验中,IGF-2 mRNA在囊胚期及原肠期高表达,而敲除IGF-2基因后并未对原肠期胚胎发育产生影响,提示IGF-2 mRNA尽管在原肠期高表达,但其翻译成多肽实际发挥作用的时间可能要在原肠期之后[30]。河川沙塘鳢IGF-2和GHR基因在胚胎发育过程中均有表达,且在囊胚到原肠胚期表达量相对较高,这表明IGF-2和GHR基因在胚胎发育过程中扮演重要角色。
动物的生长轴基因在控制机体生长、发育、代谢的过程中发挥着不可替代的作用,其生长轴基因的表达存在雌雄二态性,是导致雌雄生长速度具有显著差异性的原因之一,在鱼类中这种两性生长差异更加明显,例如黄颡鱼(Pseudobagrus vachelli)雄性个体生长明显快于雌性个体,而鳜(Siniperca chuatsi)雌鱼生长速度快于其雄鱼[32-33]。河川沙塘鳢在生长方面也具有明显的性别二态性,雄性河川沙塘鳢比雌性同期生长速度快30%以上。针对这一问题本研究检测了河川沙塘鳢生长相关基因GHR和IGF-2在雌、雄鱼不同生长阶段的相关组织脑、肝、肌肉中的表达情况,结果表明在河川沙塘鳢快速生长期雄鱼肝中GHR、IGF-2基因表达量均显著高于雌鱼,这与黄颡鱼的研究结果一致[32],说明河川沙塘鳢的生长与GHR、IGF-2的调控作用是密切相关的。国内外大量研究表明,GHR可以通过GH/IGF生长内分泌轴促进动物组织细胞的分化与生长,例如MA等[23]对比了半滑舌鳎不同发育时期雌、雄鱼肝脏中GHR基因的表达变化,发现不同发育阶段在雄鱼中的表达量均高于雌鱼。大麻哈鱼[24]、斑点叉尾鮰[34]、尼罗罗非鱼[17]禁食后肝 GHR mRNA表达量均下降,降低了GH对鱼的促生长作用,使鱼类的生长变慢。在鲤(Cyprinus carpio)中注射GH后,脑、胰脏和肝中IGFs的表达量均显著上升[26]。CHEN等[17]对尼罗罗非鱼的研究表明,每周注射IGF1和IGF2,到第5周时尼罗罗非鱼体长和体质量都明显升高。在河川沙塘鳢中GHR基因在不同发育时期肝组织中的表达量有很大的差异,IGF-2在肝中的表达量也存在明显的雌、雄二态性,说明IGFs在肝脏中的高表达与肝脏在产生IGFs和发挥IGFs生理功能方面起关键作用是一致的。GHR和IGF-2基因在河川沙塘鳢脑和肌肉中的大多数发育阶段没有显著性差异,因此笔者推测肝中GHR和IGF-2基因表达的雌、雄差异可能是导致河川沙塘鳢生长性别二态性的主要原因。本文为研究河川沙塘鳢生长提供了分子生物学依据,也为进一步研究鱼类生长基因的调控机制奠定了一定的基础。
