PHB1对人肝癌细胞增殖的影响及其作用机制
2019-09-02石娟娟张欣吴凤萍王沐淇李亚萍王文俊高宁党双锁
石娟娟 张欣 吴凤萍 王沐淇 李亚萍 王文俊 高宁 党双锁
PHB1是一种进化上保守的膜蛋白,主要参与抑制细胞增殖、调控细胞周期、诱导细胞凋亡、维持细胞内稳态等诸多细胞生命活动[1-3]。越来越多的研究证实PHB1是肝脏疾病发生发展过程中的异常表达蛋白之一,其与慢性丙型肝炎、酒精性肝病、肝肿瘤等疾病的发生发展密切相关[4-7]。前期研究发现,与正常肝细胞比较,PHB1在三个不同的人肝肿瘤细胞株Huh7、HepG2和SMMC-7721中低表达,在肝癌组织及癌旁组织中表达也显著下调[7]。本研究通过检测PHB1异常表达对人肝癌细胞增殖的影响,初步阐明PHB1影响HCC细胞增殖的作用机制。
材料与方法
一、主要试剂

二、细胞转染
人肝癌细胞株HepG2和SMMC-7721常规培养于含有10%胎牛血清的DMEM高糖培养液中,置于37℃、体积分数为0.05的CO2培养箱中培养。将对数生长期细胞以2×105个/孔浓度接种于六孔板,培养24 h,使细胞融合达70%~80%。根据PHB1的表达不同,实验分为PHB1高表达组和PHB1低表达组。其中,PHB1高表达组又分为pEGFP-PHB1转染组、pEGFP-N1空载转染组(vector)和未转染空白对照组(control);PHB1低表达组分为shRNA-PHB1转染组、shRNA-control空载转染组和未转染空白对照组(control)。参照InvitrogentTM DMRIE-C Reagent说明书进行细胞转染,每500 μL Opti-MEM培养基分别稀释10 μL DMRIE-C转染试剂和2 μg DNA,分别将两者吹打混匀,放置于室温30 min,以形成DNA/DMRIE-C转染复合物。根据实验分组分别将DNA/DMRIE-C复合物加入六孔板中,轻轻吹打混匀,培养箱孵育4 h,更换为DMEM完全培养基。继续培养24、48和72 h。同时设置未转染空白对照组,仅不加DNA/DMRIE-C复合物,其余步骤均与上述相同。引物设计依照Genbank中PHB1(NM_002634.2)为模板,上游引物:5′-TGGGAGGTC-TATATAAGCAGAG-3′,下游引物:5′-CGTCGCC-GTCCAGCTCGACCAG-3′,产物长度819 bp。shRNA-PHB1质粒靶点序列为5′-GTAGCAAAGA-TTTACAGAA-3′;shRNA-control质粒靶点序列为5′-GTTCTCCGAACGTGTCACGT-3′。荧光显微镜观察转染效果,鉴定pEGFP-PHB1和shRNA-PHB1质粒是否转染成功。
三、细胞增殖实验(MTT法)
取生长旺盛和呈对数生长的HepG2和SMMC-7721细胞,将细胞重悬液以6×103个细胞/孔密度接种于96孔培养板中,按照上述实验分组和转染方法处理细胞,其中每孔加DNA 100 ng和DMRIE-C转染试剂0.5 μL。继续分别培养24、48和72 h后弃上清,每孔加入20 μL MTT溶液(5 mg/mL),培养4 h后每孔中加入150 μL DMSO,在酶标仪570 nm处测定各孔的吸光度值(A)。存活率(%)=(A实验组/A对照组)×100%。
四、流式细胞仪检测PHB1对人肝癌细胞周期的影响
取对数期的HepG2和SMMC-7721细胞以6×105个细胞/孔接种于6孔板中,培养24 h。根据MTT实验结果,选择质粒转染细胞48 h后收集细胞并制成单细胞悬液,用冷PBS溶液洗两遍,弃去上清液,缓慢加入70%冰乙醇4℃固定过夜,冷PBS溶液清洗细胞去除乙醇,再加入含1% RNase A的Tris-HCl缓冲液(10 mmol Tris-HCl,pH 7.5)共同孵育15 min,PI染色15 min,流式细胞仪检测,并用ModFit LT2.0 软件分析细胞周期分布。以上实验重复3次,取平均值。
五、荧光定量PCR
质粒转染细胞48h后收集细胞,提取总RNA,反转录合成第一链cDNA,冰上配制反应体系25 μL [SYBR Premix ExTaqTM Ⅱ(2×) 12.5 μL、正向引物 (20 μmol) 1 μL、反向引物 (20 μmol) 1 μL、cDNA模板2 μL、灭菌ddH2O 8.5 μL];实时PCR条件:95℃预变性30 s;95℃变性5 s,60℃退火60 s,72℃延伸60 s,共40个循环。实验重复6次。反应结果由Sequence Detector System软件分析,实时PCR扩增的结果以Ct值表示。目的基因mRNA表达量的统计学分析经过内参GAPDH校正以及数据的线性转换,相比对照组的表达倍数为2-△△Ct。引物设计见表1。
六、免疫印迹分析
质粒转染细胞48 h后收集细胞,RIPA裂解液提取细胞总蛋白;BCA法测定总蛋白含量;根据蛋白分子量大小选择合适的浓度的SDS-PAGE凝胶电泳;电转至PVDF膜;采用5%胎牛血清封闭1 h;然后加入一抗4 ℃孵育过夜;TBST洗涤5 min,重复3次;再加二抗室温孵育1 h;TBST洗涤5 min,重复6次;ECL发光显影,放置G:BOX机器中5 min后,进行照相。
七、统计学分析
结 果
一、PHB1高表达和低表达人肝癌细胞株
PHB1高表达(pEGFP-PHB1)和低表达质粒(shRNA-PHB1)分别转染HepG2和SMMC-7721细胞48 h后,pEGFP-PHB1/N1及shRNA-PHB1/control转染组细胞中均可见明亮的绿色荧光,且pEGFP-PHB1和shRNA-PHB1转染组的绿色荧光强度分别稍高于对照组pEGFP- N1和shRNA-control转染组,而空白对照组未见绿色荧光,提示成功构建PHB1高表达和低表达人肝癌细胞株。见图1。
二、PHB1对人肝癌细胞增殖的影响
pEGFP-PHB1质粒分别转染HepG2和SMMC-7721细胞,PHB1转染组分别与vector转染组、control组比较,对细胞的生长均有不同程度的抑制作用,并呈时间依赖性(P<0.01);而vector组与control组比较,差异无统计学意义(P>0.05)。见表2。
shRNA-PHB1质粒分别转染HepG2和SMMC-7721细胞,shRNA-PHB1转染组分别与shRNA-control转染组、control组比较,对细胞的生长均有不同程度的促进作用,并呈时间依赖性(P<0.01);而shRNA-control组与control组比较,差异无统计学意义(P>0.05)。见表2。根据MTT实验结果,选择pEGFP-PHB1和shRNA-PHB1质粒分别转染HepG2和SMMC-7721细胞48 h进行后续研究。
三、PHB1对人肝癌细胞周期的影响
pEGFP-PHB1质粒分别转染HepG2和SMMC-7721细胞,PHB1转染组分别与vector转染组、control组比较,G0/G1期细胞比例升高(P<0.01),S期细胞比例下降(P<0.01),而vector组与control组比较,差异无统计学意义(P>0.05);即高表达PHB1可阻滞细胞于G0/G1期,使S期比例下降,抑制细胞增殖。见表3。
shRNA-PHB1质粒分别转染HepG2和SMMC-7721细胞,shRNA-PHB1转染组分别与shRNA-control转染组、control组比较,G0/G1期细胞比例下降(P<0.01),S期细胞比例升高(P<0.01),而shRNA-control组与control组比较,差异无统计学意义(P>0.05);即低表达PHB1可促使细胞趋于S期,促进细胞增殖。见表3。

表1 实时PCR引物序列
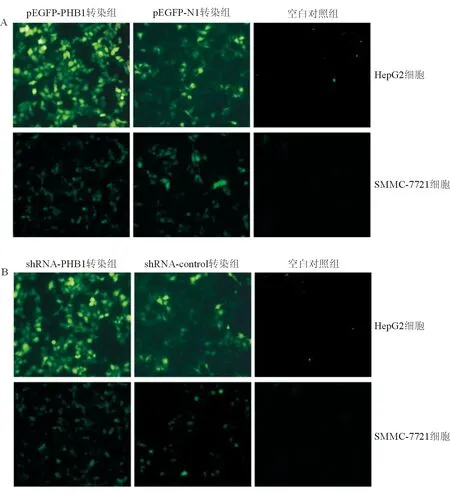
图1 质粒转染细胞48 h后荧光显微镜鉴定结果(×100)
组别HepG224 h48 h72 hSMMC-772124 h48 h72 hPHB1高表达 control98.82±1.0597.78±1.6994.62±2.2398.63±1.9597.22±3.3693.76±2.96 vector97.77±1.4596.20±2.1293.70±2.5796.98±2.0895.87±2.5792.62±4.03 PHB174.05±4.8753.30±3.4647.80±3.1371.67±2.3252.77±3.2250.25±5.62 t1/P11.44/0.181.43/0.180.66/0.521.42/0.190.78/0.450.56/0.59 t2/P212.17/0.0028.31/0.0029.84/0.0021.77/0.0023.38/0.0016.78/0.00 t3/P311.42/0.0025.89/0.0027.78/0.0019.45/0.0025.61/0.0015.00/0.00PHB1低表达 control98.80±1.7297.30±2.6997.51±2.9598.73±2.1197.68±2.8396.88±2.37 shRNA-control97.55±2.2896.90±0.9696.32±3.0199.12±2.1296.41±2.0494.78±2.53 shRNA-PHB1104.68±6.03121.43±5.10129.90±6.08105.27±5.82123.25±5.03131.50±5.20 t4/P41.07/0.310.34/0.740.70/0.500.31/0.760.89/0.401.48/0.17 t5/P52.30/0.0410.25/0.0011.74/0.002.59/0.0310.86/0.0014.84/0.00 t6/P62.71/0.0211.58/0.0012.13/0.002.43/0.0412.11/0.0015.55/0.00
注:t1/P1:control组与vector组比较;t2/P2:PHB1组与control组比较;t3/P3:PHB1组与vector组比较。t4/P4:control组与shRNA-control组比较;t5/P5:shRNA-PHB1组与control组比较;t6/P6:shRNA-PHB1组与shRNA-control组比较

表3 PHB1异常表达对人肝癌细胞周期影响(±s,%)
注:t1/P1:control组与vector组比较;t2/P2:PHB1组与control组比较;t3/P3:PHB1组与vector组比较。t4/P4:control组与shRNA-control组比较;t5/P5:shRNA-PHB1组与control组比较;t6/P6:shRNA-PHB1组与shRNA-control组比较
四、PHB1对细胞周期相关分子的影响
pEGFP-PHB1质粒转染HepG2细胞,PHB1转染组分别与vector转染组、control组比较,周期调控相关分子p53和p21CIP1 mRNA表达水平显著性升高(t=19.93、25.55,P<0.01;t=12.70、14.93,P<0.01),Cyclin A2、Cyclin E1和CDK2 mRNA表达水平显著性降低(t=8.79、10.53,P<0.01;t=9.32、16.01,P<0.01;t=12.70、20.17,P<0.01);而vector组和control组之间差异无统计学意义(P>0.05),见图2A。其蛋白质表达水平与mRNA表达水平相一致,见图2B。pEGFP-PHB1质粒转染SMMC-7721细胞所得实验结果与转染HepG2细胞相似,见图2。

图2 PHB1高表达对人肝癌细胞周期相关分子的影响
shRNA-PHB1质粒转染HepG2细胞,shRNA-PHB1转染组分别与shRNA-control转染组、control组比较,周期调控相关分子p53和p21CIP1 mRNA表达水平显著性降低(t=6.23、11.32,P<0.01;t=4.41、6.70,P<0.01),而Cyclin A2、Cyclin E1和CDK2 mRNA表达水平显著性升高(t= 11.50、11.60,P<0.01;t=9.77、9.79,P<0.01;t=7.29、7.40,P<0.01);而vector组和control组之间差异无统计学意义(P>0.05),见图3A。其蛋白质表达水平与mRNA表达水平相一致,见图3B。pEGFP-PHB1质粒转染SMMC-7721细胞所得实验结果与转染HepG2细胞相似,见图3。
讨 论
目前,肝癌发生发展的分子机制研究主要集中于信号通路、非编码RNA、异常表达蛋白、表观遗传修饰和染色质重塑等领域[8-9],而寻找异常表达蛋白并研究其功能是探索肝癌发病机制的难点和热点。
近年来,越来越多的研究证实,PHB1与肿瘤的发生发展密切相关。研究显示,PHB1蛋白在Mat1a基因敲除的肝脏特异性Phb1 KO老鼠模型呈现出高表达,若将PHB1沉默后可引起显著的肝脏损伤、肝纤维化和肝细胞癌[10]。在高转移人肝癌细胞MHCC97-H中,高表达的PHB1可以抑制细胞增殖并且促进细胞的迁徙[11]。PHB1可以作为WNT信号传导的负调节因子,通过激活WNT-β-连环蛋白信号通路诱导HCC的发生[12]。本实验结果提示,高表达PHB1可以抑制细胞增殖,而低表达PHB1则可以促进细胞增殖,并呈时间依赖性。高表达的PHB1可阻滞细胞于G0/G1期,使S期比例下降,抑制细胞增殖;低表达PHB1则得出相反的结果,可促使细胞趋于S期,促进细胞增殖。研究显示,在人乳腺癌细胞MCF-7中,PHB1基因沉默后可以促进细胞增殖,使G0/G1期细胞比例降低,S期细胞比例升高[13]。本实验结果与上述研究结果相似,说明高表达的PHB1可以显著抑制细胞增殖,并与调控细胞周期有关。
为了进一步明确PHB1抑制肝癌细胞增殖的具体作用机制,本研究对细胞周期相关的关键调控因素进行了分析,结果显示,pEGFP-PHB1质粒转染HepG2和SMMC-7721细胞48 h后,PHB1转染组分别与vector组、control组比较,周期调控相关分子p53、p21CIP1 mRNA和蛋白水平均显著升高,而Cyclin A2、Cyclin E1、CDK2 mRNA和蛋白水平均显著降低;提示高表达PHB1可以提高p53和p21CIP1的表达水平,降低Cyclin A2、Cyclin E1、CDK2的表达水平。然而,低表达的PHB1则得出相反的结果。研究证实,p53的活化不仅是预防肿瘤转化的关键,而且也是有效根除肿瘤的治疗靶点。活化的p53可以进一步阻滞细胞周期和诱导细胞凋亡,从而抑制肿瘤细胞生长[14]。p53引起的细胞周期阻滞需要p21CIP1的转录,p21CIP1可将细胞周期阻滞于G0/G1期[14-15]。已往研究显示,抗肿瘤药物rocaglamide(是一种中药单体成份)可以选择性的结合PHB1,并且进一步下调cyclin D、Cyclin E1、CDK2、CDK4和CDK5的表达水平,这些均是G0/G1期的调控蛋白,最终将细胞阻滞于G0/G1期[16],与本研究结果相似。
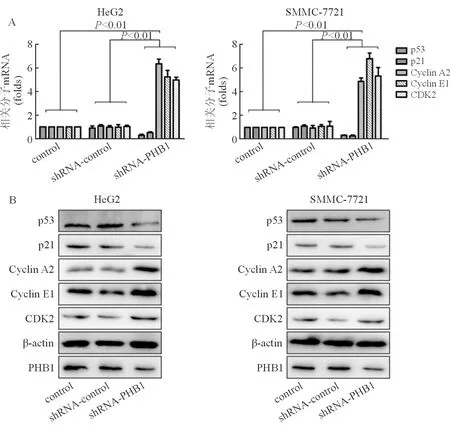
图3 PHB1低表达对人肝癌细胞周期相关分子的影响
本研究初步证实了PHB1抗HCC细胞增殖作用可能与调控细胞周期有关,其作用机制可能是PHB1选择性结合p53,进而使p21CIP1表达水平升高,Cyclin A2、Cyclin E1、CDK2表达水平降低,最终达到调控细胞周期的目的。虽然本研究为PHB1抗增殖作用提供了一定的实验基础和依据。但是,PHB1干扰HCC细胞周期更为确切的作用机制有待于进一步深入研究。
